芋艿分离蛋白的制备及工艺条件优化
2017-04-12黄友如王教飞李昕蓓徐田甜
黄友如,王教飞,李昕蓓,徐田甜
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
芋艿分离蛋白的制备及工艺条件优化
黄友如,王教飞,李昕蓓,徐田甜
(常熟理工学院生物与食品工程学院,江苏 常熟 215500)
利用响应面法对芋艿分离蛋白的制备工艺进行优化.在单因素试验基础上,以芋艿分离蛋白得率和纯度为响应值,进行四因素三水平Box-Behnken响应面优化设计.通过各个因素的显著性和交互作用分析,得到芋艿分离蛋白制备的最佳工艺条件为:浸提体系pH值为10.00,温度40℃,料液比1∶6,酸沉pH值为4.90,此工艺条件下制备的芋艿分离蛋白得率为1.33±0.020%,纯度为84.67±0.011%.
芋艿分离蛋白;制备;响应面
芋艿分离蛋白是以芋艿地下球茎为原料提取的,蛋白质含量≥90%以上.据报道[1],芋艿球茎蛋白组分中有一种黏液蛋白,有解毒作用,可提高机体的免疫力.芋艿蛋白中必需氨基酸占氨基酸总量的百分比和化学评分值接近或超过酪蛋白[2].王教飞[3]和孙啊敏等人[4]通过碱溶酸沉法制备芋艿分离蛋白,分别研究了不同pH值环境条件下芋艿分离蛋白的流变特性,以及金属离子对芋艿分离蛋白功能性质的影响.目前,有关芋艿分离蛋白提取、纯化及工艺优化方面的研究甚少,常银子等[5]曾研究了酶法提取芋艿蛋白质工艺,在最佳提取工艺下蛋白质提取率为10.20%,除此之外,迄今为止尚无芋艿分离蛋白提取工艺优化的研究报道.本文在前期实验室芋艿分离蛋白研究的基础上,以芋艿分离蛋白得率和纯度为响应值,通过单因素试验,采用响应面法设计优化芋艿分离蛋白提取工艺,为芋艿蛋白质商业化生产提供一定的依据.
1 材料和方法
1.1 材料、试剂与设备
芋艿:产自常熟地区;氢氧化钠、盐酸等均为分析纯,国药集团化学试剂有限公司.
LXY-II型离心沉淀机,上海医用分析仪器厂;FE20实验室pH计,梅特勒-托利多(上海)公司;Freezone 6冷冻干燥机,美国Labeonco公司.
1.2 方法
1.2.1 单因素实验
优化实验均以芋艿分离蛋白得率及纯度为响应值评价因素水平的优劣.以浸提时的碱溶pH值、温度、料液比及等电点沉淀蛋白时的酸沉pH值为优化对象进行优化.如探讨碱溶pH值的影响,可准确称取10 g芋艿干粉于100 mL烧杯中,加入60 mL,0.1 mol/L的磷酸盐缓冲溶液(pH值分别为6.0,7.0,8.0,9.0,10.0,11.0,12.0),低速搅拌30 min,以10 000 r/min离心30 min,得上清液.调上清液pH值为5.0进行酸沉,静置30 min,以10 000 r/min离心30 min,得沉淀.将沉淀回调pH值至7.0,用分子量为3 000的透析袋流水透析24 h,然后用去离子水透析24 h,每4 h换一次水,将透析后样品冷冻干燥得分离蛋白粉,称重及纯度分析.其他单因素实验(3次平行)分别设定温度(25,30,35,40,45,50,55℃),料液比(1∶2,1∶4,1∶6,1∶8 m/v),酸沉pH值(1.0,2.0,3.0,4.0,5.0,6.0,7.0).各水平重复3次.

蛋白质纯度即芋艿分离蛋白制品的蛋白含量,采用凯氏定氮法(N取6.25)测定.
1.2.2 响应面优化试验
根据单因素试验结果,以温度、碱溶pH值、料液比和酸沉pH值为关键工艺参数,设计四因素三水平Box–Behnken响应面.根据实验设计的因素水平,以芋艿分离蛋白得率和纯度为相应指标,共设计5个中心点和29个不同组合的实验,实验因素水平如表1所示.
1.2.3 统计分析
试验数据通过PASW statistics 18软件进行分析,ANOVA程序用于方差分析,当P<0.05时认为平均值间有显著性差异.最小显著差异法(LSD)用于数据多重比较分析.数据以3次独立样品测定结果的平均值±标准差表示.

表1 响应面实验的因素水平及编码
2 结果与分析
2.1 单因素试验
2.1.1 碱溶pH值
研究表明,芋艿蛋白质得率和纯度主要受温度、碱溶pH值、料液比、酸沉pH值等因素的影响[3-4].碱溶pH值对芋艿分离蛋白提取率及纯度影响见图1.由图1可知,pH值在6.0~12.0范围内,芋艿分离蛋白得率随着pH值的升高而增加.本实验室前期的实验结果表明,芋艿分离蛋白各组分的等电点pI主要集中在6.73和5.21两个条带,分别占分离蛋白总量的16.36%和27.30%.由于浸提pH值大于芋艿蛋白的等电点,在芋艿蛋白的浸提过程中随着pH值的增加,蛋白质自身带负电荷,同种电荷的蛋白质之间相互排斥、展开和解离,阻止了蛋白质的聚集和沉淀,提高了它们的溶解度及得率.但是当pH值超过10.0时,蛋白质的得率变化不大,纯度也降低,pH值过高会导致脱氨、脱羧及水解反应,产生色泽和异味,影响产品品质和功能特性[6-7].综合考虑,浸提体系的pH值宜选择在10.0左右.
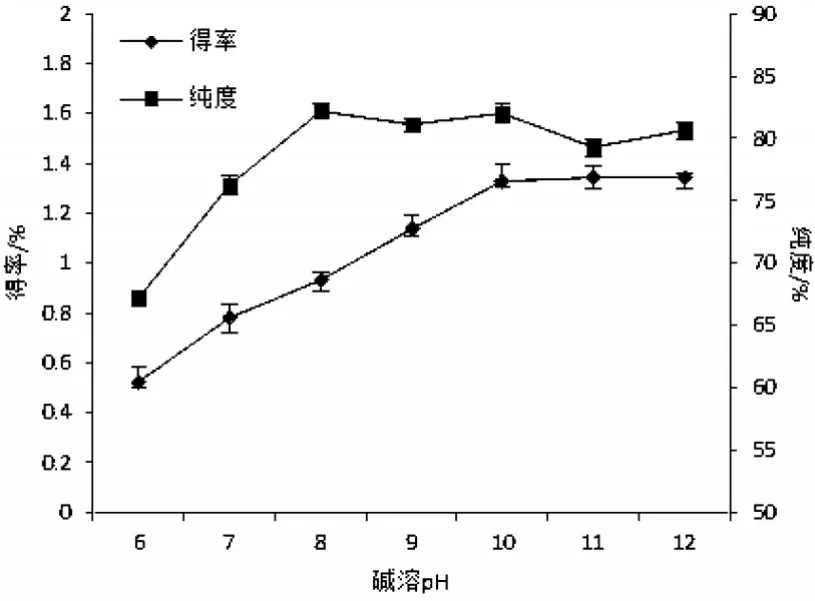
图1 碱溶pH值对芋艿分离蛋白得率与纯度的影响

图2 酸沉pH值对芋艿分离蛋白得率与纯度的影响
2.1.2 酸沉pH值
图2为酸沉pH值对芋艿分离蛋白得率及纯度的影响,可见pH值在4.0~6.0范围内,芋艿蛋白质得率和纯度较高.这是因为当pH值接近于芋艿蛋白质等电点时,芋艿蛋白因聚集而沉淀.当pH值小于4.0或者大于6.0时,具有同种电荷的芋艿蛋白相互排斥、解离和展开,抑制了蛋白质的聚结沉淀,使其溶解度增加,导致芋艿分离蛋白得率降低,纯度下降.酸沉pH值降低会使终产品芋艿分离蛋白的盐份增加,另外过低的pH值还将引发水解与脱酰胺化,产生色泽和异味,影响产品品质和功能特性[6-7].综合考虑,酸沉pH值控制在5.0左右.
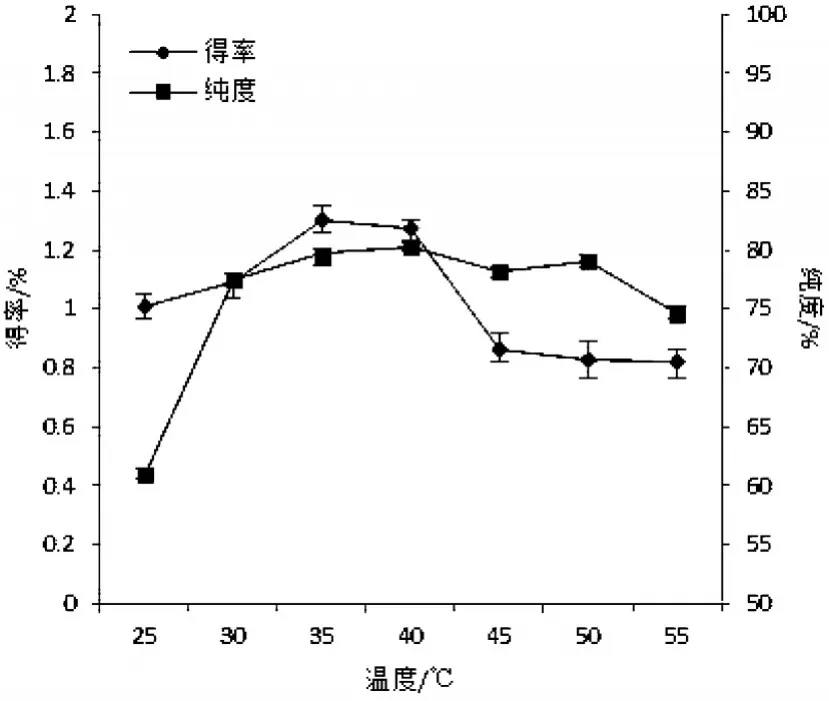
图3 浸提温度对芋艿分离蛋白得率与纯度的影响
2.1.3 浸提温度
温度对芋艿分离蛋白提取得率及纯度的影响结果见图3.由图3可知,在一定范围内,提取温度的升高有助于蛋白质溶解度的增加,从而提高蛋白质得率.在25~35℃之间,随着温度的升高,芋艿分离蛋白质的得率随之提高,但提取温度超过40℃时,蛋白质得率下降.这是因为升高温度,有利于蛋白质的疏水相互作用,蛋白质分子聚集,溶解度降低,蛋白质得率下降[8].温度对纯度的影响在25~30℃之间增加显著,30℃后其纯度无明显变化.综合考虑,浸提温度宜控制在35℃左右.
2.1.4 料液比
图4为料液比对芋艿分离蛋白得率与纯度的影响.从图4可以看出,料液比从1∶2增加到1∶4时,蛋白质得率提高了6.37%;料液比从1∶4增加到1∶6时,蛋白质得率提高了8.52%.但当料液比再继续增大时,蛋白质得率增加很小.料液比从1∶2到1∶4之间,蛋白质纯度增加,但料液比继续增加纯度没有明显变化.因此要提高芋艿分离蛋白得率和纯度,减少浸提过程中的乳清排放,料液比宜控制在1∶6左右.
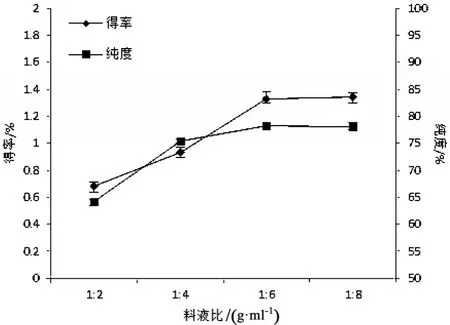
图4 料液比对芋艿分离蛋白得率与纯度的影响
2.2 响应曲面法优化提取工艺条件
2.2.1 Box-Behnken试验设计和响应值
根据单因素试验结果,综合相关分析,确定以浸提温度、料液比、碱溶pH值和酸沉pH值为自变量,以芋艿分离蛋白得率和纯度为响应值,进行四因素三水平Box-Behnken响应面优化设计,实验因素水平见表1.在29个试验组合条件下,试验设计方案及数据处理结果如表2所示.

表2 Box-Behnken试验设计及其响应值

接表2
2.2.2 模型的建立及显著性分析
基于参数评估,运用Design-Expert V 6.0软件可得出响应值和被检变量之间的逻辑关系.对这些实验数据进行二次多元回归拟合,获得编码应变量(芋艿蛋白得率Y1和纯度Y2)对编码自变量的关系为:
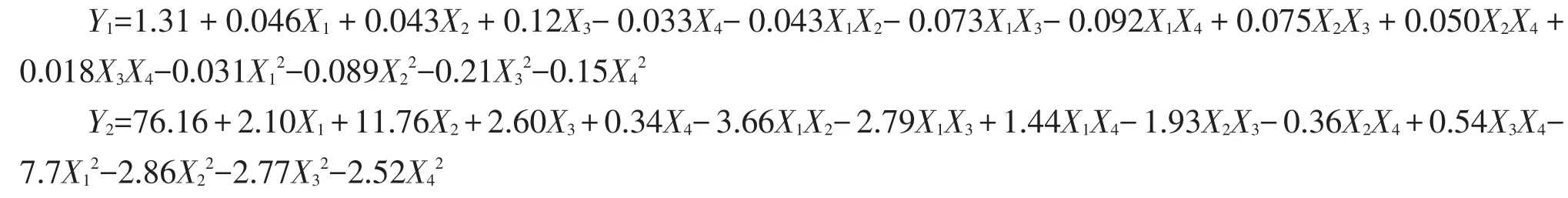
为检验方程有效性,利用分析软件进一步对其进行分析,其中芋艿分离蛋白得率和纯度的系数显著性结果见表3,多元回归模型的方差分析结果见表4.
由表3可知,方程的一次项中X1,X3,交互项X1X4和二次项中X22,X32,X42对响应值Y1(芋艿分离蛋白得率)的影响极显著(P<0.01),一次项中X2,X4,交互项X2X3对响应值Y1的影响显著(P<0.05).交互项X1X2,X1X3,X2X4,X3X4和二次项X12对响应值Y1影响不显著(P>0.05).而方程的一次项中X2和二次项中X12对响应值Y2(芋艿分离蛋白纯度)的影响极显著(P<0.01),一次项X1,X3,交互项X1X2和二次项中X22,对响应值Y2的影响显著(P<0.05).一次项X4,交互项X1X3,X1X4,X2X4,X2X3,X3X4和二次项X32,X42对响应值Y2的影响不显著(P>0.05).可见,各试验因素对响应值Y1和Y2的影响不是简单的线性关系.
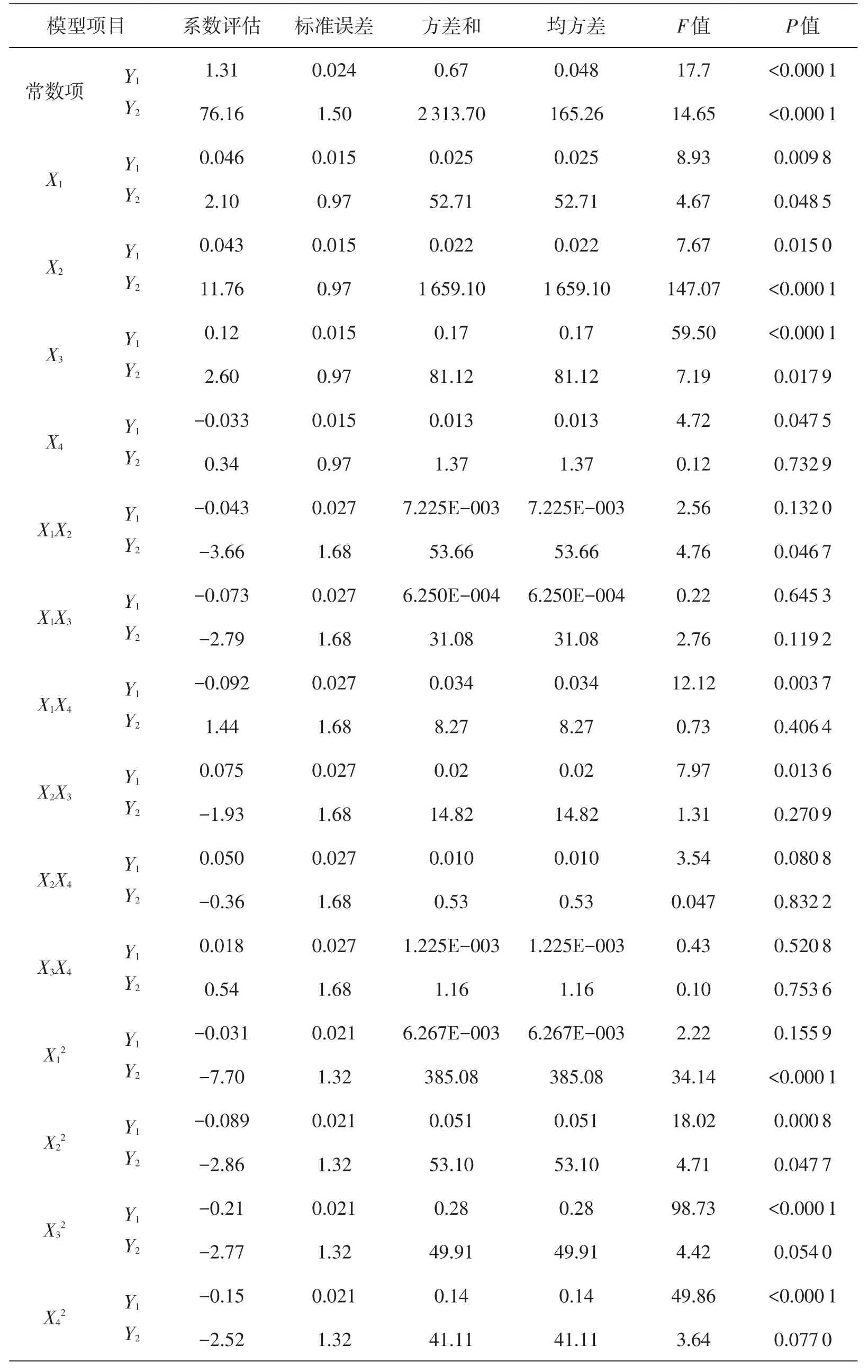
表3 芋艿分离蛋白得率和纯度拟合多元二次方程模型的方差分析
由表4可知,经显著性检验,回归模型高度显著,响应值Y1和Y2的相关系数R2分别为0.944 7和0.936 1,说明模型的拟合度好,表明芋艿分离蛋白得率和纯度的实验值和预测值有极高的一致性;校正决定系数adj-R2分别为0.889 3和0.8722,说明芋艿分离蛋白得率和纯度模型分别能够解释88.93%和87.22%,仅分别有11.07%和12.78%不能用这两个回归模型表示.本试验中Y1和Y2模型失拟项的P值分别为0.256 5和0.7001都大于0.05,模型失拟项不显著,进一步说明此模型的拟合度良好.变异系数(CV%)表示试验的精确度,数值越大,表明试验的可靠性越差[9],本试验中Y1和Y2模型的CV%值分别为4.78%和4.83%,说明模型方程能够较好地反映真实值.综上所述,回归模型拟合程度良好,实验误差小,能够准确地分析和预测芋艿分离蛋白的得率和纯度.可用回归线性方程替代实验对结果进行实验分析.
2.2.3 响应面交互作用分析
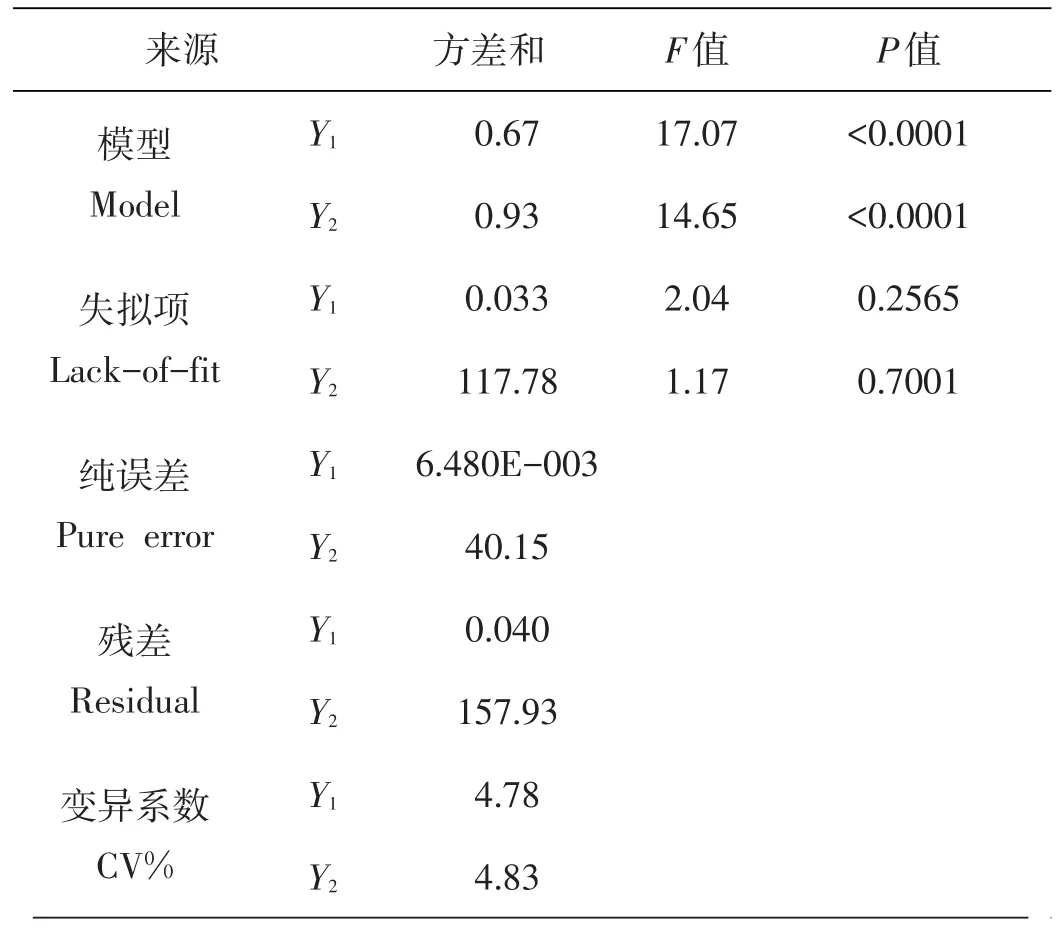
表4 多元回归模型方差分析表
运用Design-Expert软件所获得的三维响应曲面图如图5和图6所示.通过试验发现,在提取过程中参数变化对芋艿分离蛋白得率和纯度会产生不同的影响.图5和图6中显示温度和料液比对芋艿分离蛋白得率(Y1)影响的交互作用不明显,对纯度(Y2)交互作用也不显著;料液比和碱溶pH值对芋艿分离蛋白得率(Y1)存在交互作用,随着料液比和碱溶pH值的增加,芋艿分离蛋白的得率逐渐升高,但当提取料液比和碱溶pH值增加到一定值后,芋艿分离蛋白的得率却随着提取料液比和碱溶pH值的增加而降低.但料液比和碱溶pH值对Y2的相应曲面图的影响则较为平缓,说明料液比和碱溶pH值对Y2交互作用不显著.同理,由图可以看出,碱溶pH值和酸沉pH值、料液比和酸沉pH值对Y1的相应曲面图坡度陡峭,等高线排列紧密且趋于椭圆形,表明提取料液比与酸沉pH值、碱溶pH值与酸沉pH值对芋艿分离蛋白得率的交互影响相对较大,而温度与酸沉pH值、温度与碱溶pH值对Y1的响应曲面和温度与酸沉pH值、温度与碱溶pH值、料液比与酸沉pH值、碱溶pH值与酸沉pH值对Y2的相应曲面图坡度相对平缓,等高线排列稀疏,表明温度与碱溶pH值、温度与酸沉pH值对芋艿分离蛋白得率,以及提取温度与酸沉pH值、温度与碱溶pH值、料液比与酸沉pH值、碱溶pH值与酸沉pH值对芋艿分离蛋白纯度的交互影响相对较弱.
2.2.4 提取参数优化及模型验证

图5 提取条件对芋艿分离蛋白得率影响的响应曲面图
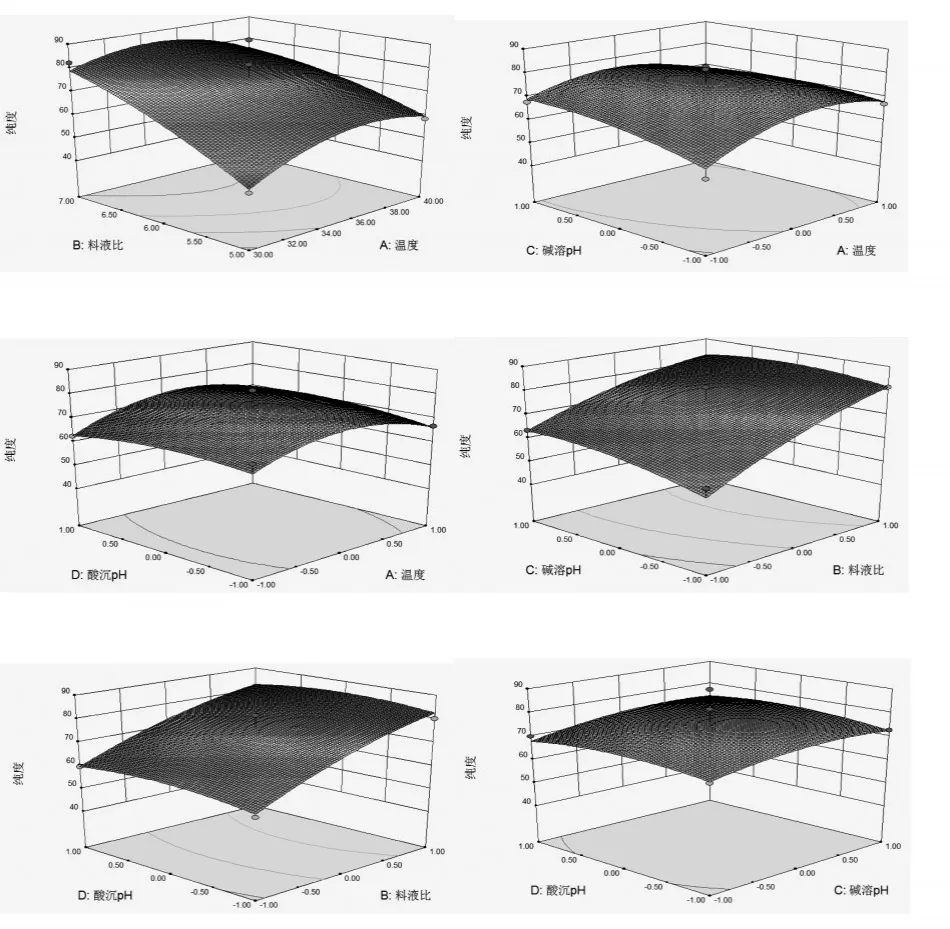
图6 提取条件对芋艿分离蛋白纯度影响的响应曲面图
通过最优化分析,得到被检变量的最优值,即浸提温度为40℃、料液比为1∶5.84、碱溶pH值为10.05、酸沉pH值为4.92,是模型最优提取工艺.此条件下,芋艿蛋白得率为1.36%,纯度为85.23%.考虑到操作的局限性,最优提取参数调整为提取温度40℃、料液比1∶6、碱溶pH值10.00、酸沉pH值4.90.在此条件下提取芋艿分离蛋白,3次平行试验得出芋艿分离蛋白实际得率为1.33±0.020%,实际纯度为84.67±0.011%,与理论值非常接近,证实了该方程的准确性和实用性.因此,该多元二次回归方程能够准确且适合于对芋艿分离蛋白得率和纯度的预测.与常银子等[5]酶法提取芋艿蛋白质工艺相比,碱溶酸沉法结合响应面优化工艺使蛋白得率提高了1.5倍.
2.2.5 优化后的芋艿分离蛋白制备工艺流程见图7.

图7 优化后的芋艿分离蛋白制备工艺流程
3 结论
以单因素试验为基础,首次采用响应面法建立了芋艿分离蛋白提取工艺参数的二次多项式数学模型,通过验证实验所得实际值接近模型预测值,能较好地预测芋艿蛋白的得率与纯度.该模型分析认为芋艿分离蛋白的最佳提取工艺条件为:提取温度40℃、料液比1∶6、碱溶pH值10.00、酸沉pH值4.90.经3次重复试验,证明应用响应面优化法提取芋艿分离蛋白是准确可行的,回归模型具有良好的预测性,能用于指导芋艿分离蛋白的提取,为芋艿蛋白质商业化生产提供一定的依据.
[1]高瑞莲.芋艿营养价值剖析[J].食品科学,2000(2):19-21.
[2]藤咸,柳琪,黎秀卿,等.芋头蛋白质含量及氨基酸组分的分析与营养评价[J].莱阳农学院学报,1992,9(4):313-314.
[3]王教飞,黄友如,钱雅萍,等.芋艿分离蛋白质流变特性研究[J].食品科学,2015,36(9):17-21.
[4]孙啊敏,王教飞,黄友如,等.金属离子对芋艿分离蛋白食品功能特性的影响[J].安徽农业科学,2015,43(15):235-239.
[5]常银子,王丽霞,仲山民,等.酶法提取芋艿蛋白质工艺[J].食品研究与开发,2011,32(3):19-22.
[6]石彦国,任莉.大豆制品工艺学[M].北京:中国轻工业出版社,1993:371-377.
[7]李正明,王兰君.植物蛋白生产工艺与配方[M].北京:中国轻工业出版社,1998:105-106.
[8]王璋,许时婴,汤坚.食品化学[M].北京:中国轻工业出版社,2011:156-157.
[9]刘军海,黄宝旭,蒋德超.响应面分析法优化艾叶多糖提取工艺研究[J].食品科学,2009,30(2):114-118.
Preparation and Process Condition Optimization of Taro Protein Isolates
HUANG Youru,WANG Jiaofei,LI Xinbei,XU Tiantian
(School of Biology and Food Engineering,Changshu Institute of Technology,Changshu 215500,China)
Based on single factor tests,the optimum preparation conditions of taro protein isolates were obtained through Box-Benhnken central combination design and RSM.The results showed that the optimum preparation conditions of taro protein isolates were as follows:extraction pH was 10.00,extraction temperature was 40℃, the ratio of material to solvent was 1∶6,and acid precipitation pH was 4.90.Under such conditions,the yield of taro protein isolates was 1.33±0.020%,and the purity was 84.67±0.011%.
taro protein isolates;preparation;response surface methodology
TS201.2+1;TQ645.9+9
A
1008-2794(2017)02-0097-07
2016-03-11
“十二五”农村领域国家科技计划项目“大宗低值蛋白增值加工关键技术研究与示范”(2012BAD34B04-1);“高生物利用度蛋白制备关键技术研究与开发”(2013AA102203-03)
黄友如,副教授,博士,研究方向:粮食、油脂及植物蛋白工程,E-mail:huangyouru@aliyun.com.
