肢体缺血后处理联合乌司他丁对大鼠脑缺血再灌注脑水肿的缓解作用研究Δ
2017-04-11周洪彬黄焕森何荣芝邓玉萍王晓俏吴钿生
周洪彬,黄焕森,何荣芝,邓玉萍,王晓俏,吴钿生
(广州医科大学附属第二医院麻醉科,广东 广州 510260)
肢体缺血后处理联合乌司他丁对大鼠脑缺血再灌注脑水肿的缓解作用研究Δ
周洪彬*,黄焕森,何荣芝,邓玉萍,王晓俏,吴钿生
(广州医科大学附属第二医院麻醉科,广东 广州 510260)
目的:探讨肢体缺血后处理联合乌司他丁对大鼠脑缺血再灌注脑水肿的缓解作用。方法:选取健康雄性成年SD大鼠300只作为研究对象,随机分为假手术组(Sham)、缺血再灌注组(IR)、乌司他丁组(Ul)、肢体缺血后处理组(Lp)、肢体缺血后处理联合乌司他丁组(LpUl)。采用线栓闭塞大脑中动脉法建立大鼠局灶性脑缺血再灌注模型;乌司他丁于脑缺血2 h后再灌注即刻尾静脉注射给药;肢体缺血后处理在脑缺血1.5 h后进行,即结扎5 min,再灌注5 min,重复3次。测定五组大鼠神经功能缺损评分、脑梗死体积分数、脑水肿程度、脑组织水通道蛋白4的表达、脑组织细胞凋亡等指标。结果:IR、Ul、Lp和LpUl组大鼠的神经功能缺损评分、脑梗死体积分数均依次减少,且两两比较,差异均有统计学意义(P<0.05)。与Sham组大鼠比较,IR、Ul、Lp和LpUl组大鼠缺血侧脑含水量均明显增加,差异均有统计学意义(P<0.05);IR、Ul、Lp和LpUl组大鼠组内脑缺血2 h后再灌注6、12、24 h时缺血侧脑含水量的差异均有统计学意义(P<0.05)。与Sham组大鼠比较,IR、Ul、Lp和LpUl组大鼠缺血侧脑组织水通道蛋白4的表达均明显增加,差异均有统计学意义(P<0.05)。与IR组大鼠比较,Ul、Lp、LpUl组大鼠的凋亡细胞阳性率均明显降低,差异均有统计学意义(P<0.05)。结论:肢体缺血后处理联合乌司他丁治疗,可减轻大鼠脑缺血再灌注脑水肿。
乌司他丁; 肢体缺血后处理; 脑缺血再灌注; 脑水肿; 水通道蛋白4; 大鼠
乌司他丁是一种糖蛋白,可从尿液中分离纯化得到,对多种Kunitz型蛋白酶和脂水解酶均有抑制作用[1]。相关研究结果表明,乌司他丁对手术刺激产生的器官损伤具有明显的保护作用,可改善微循环状态,调节患者术后凝血功能。理论上,肢体缺血后处理联合乌司他丁治疗可减轻脑缺血再灌注损伤[2-3],但目前尚无明确报道。本研究通过建立大鼠大脑中动脉缺血再灌注模型,观察肢体缺血后处理联合乌司他丁对脑缺血再灌注大鼠脑水肿的缓解作用,及对大鼠脑组织水通道蛋白4(AQP4)表达水平的影响[4],为围术期脑缺血再灌注损伤后脑水肿的防治提供理论依据。
1 材料
1.1 药品与试剂
乌司他丁注射液(广东天普生化医药公司);鼠抗AQP4(Abcam公司);鼠抗β肌动蛋白(Abcam公司);辣根过氧化物酶标记的羊抗鼠IgG(Abcam公司);BCA蛋白浓度测定试剂盒(Sigma公司);TUNEL细胞凋亡检测试验盒(上海ROCHE公司);2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)和二氨基联苯胺或联苯二胺(DAB)显色试剂盒(博士德生物工程公司);AR-2140型电子天平(梅特勒-托利多仪器有限公司);5427R型低温高速离心机(Eppendorf中国有限公司);多功能酶标仪(Sigma中国有限公司);-80 ℃超低温冰柜(Haier公司);微量移液枪德(Eppendorf公司);Western Blotting电泳设备(通用电气公司)。
1.2 实验动物
300只健康雄性成年SD大鼠(清洁级),体质量235~250 g,自南方医科大学实验动物中心购入。
2 方法
2.1 动物分组
将所有大鼠随机分为假手术组(Sham)、缺血再灌注组(IR)、乌司他丁组(Ul)、肢体缺血后处理组(Lp)、肢体缺血后处理联合乌司他丁组(LpUl)等五组,每组60只。根据缺血2 h后再灌注时间,将每组大鼠随机分为三个亚组(分别为再灌注6、12、24 h),每组20只。
2.2 动物模型的建立
Sham组大鼠只分离颈总动脉与颈外动脉,即不做栓塞,仅暴露右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),然后逐层缝合。IR、Ul、Lp、LpUl组大鼠参照Zea-Longa等线栓法建立大鼠大脑中动脉缺血再灌注模型:给予大鼠水合氯醛腹腔注射麻醉,于颅骨中线旁右侧处钻取直径1 mm小孔,深度3 mm,探头插入至皮层表面,采用激光多普勒血流灌注成像系统监测血流;将大鼠仰卧固定于操作台,于颈正中切口,分离前颈部肌肉组织,暴露右侧CCA、ECA和ICA,分离CCA周边神经丛,CCA预留单股手术缝线,分离ICA颅外分支,用微动脉夹夹闭;再用微动脉夹夹闭CCA和ICA,将4—0号尼龙外科手术缝合线由ECA切口处插入ICA,用缝线结扎ECA防止出血,松开微动脉夹,将尼龙线送入颅内后,松开CCA和翼腭突动脉上动脉夹,至监测到皮层脑血流量骤降,完成局部脑缺血模型构建[5-6]。Ul组大鼠于脑缺血2 h再灌注即刻尾静脉注射乌司他丁10万U/kg(采用0.9%氯化钠溶液稀释);Lp组大鼠行肢体缺血后处理,即脑缺血1.5 h后,用弹性止血带于双后肢中、上1/3部位结扎双后肢,以后肢远端表面皮肤温度降低、颜色呈绛紫色为标准判断后肢缺血成功,每次结扎5 min,再灌注5 min,重复3次;LpUl组大鼠在肢体缺血后处理的基础上,于脑缺血2 h再灌注即刻尾静脉注射乌司他丁10万U/kg(采用0.9%氯化钠溶液稀释)。
2.3 观察指标与疗效评定标准
对大鼠进行神经功能缺损评分、脑水肿程度检测、脑梗死体积检测、AQP4蛋白质表达Western Blotting印迹法检测和TUNEL细胞凋亡检测。
2.3.1 神经功能缺损评分:大鼠缺血2 h开始再灌注后且已经清醒,参考Longa评分法对大鼠进行神经功能缺损评价。0分,无神经损伤症状;1分,不能完全伸展对侧前爪;2分,向对侧转圈;3分,向对侧倾倒;4分,不能自发行走、意识丧失;1—3分为造模成功。大鼠未达到上述标准、麻醉未醒、经解剖发现存在脑蛛网膜下腔出血均视为模型建立失败。
2.3.2 脑梗死体积检测:完成脑缺血2 h再灌注后,每个亚组随机取5只大鼠,通过TTC染色法进行脑梗死体积检测。大鼠过度麻醉处死后,快速取出脑组织,除去大脑外部分(嗅球、小脑、低位脑干等),低温冷藏10 min,将脑组织置于切片槽中,以2 mm间隔行冠状连续切片;将脑切片置于10 g/L(约2%)的TTC溶液中,经37 ℃避光恒温温育30 min,取出后,给予40 g/L的多聚甲醛固定1 h后,梗死灶区呈白色,正常组织呈红色。拍照后,采用Auto CAD图象处理软件计算脑梗死相关数值[7],得到不同组大鼠缺血侧梗死区域的体积及梗死区域占大脑半球的百分比(脑梗死体积分数)。
2.3.3 脑水肿程度测定:采用干湿质量法于大鼠脑缺血再灌注损伤后不同时间点测定大脑半球不同区域(皮质区、皮质下区)的水肿程度。每个亚组随机取5只大鼠,开颅后取损伤侧大脑半球,准确称取记录湿质量,经24 h烘箱(100~110 ℃)干燥至质量恒定,称取记录干质量,以Sham组为对照,比较IR、Ul、Lp、LpUl组大鼠脑水肿程度的变化。公式为脑水肿程度(%)=(湿质量-干质量)/湿质量×100%[8],计算大鼠脑各部分的水肿程度,以每100 g湿质量脑组织中所含水的质量(g)表示,即脑含水量。
2.3.4 脑内AQP4表达水平检测:采用蛋白免疫印迹法(Western Blot,WB)半定量检测大鼠脑组织AQP4表达水平:每个亚组随机取5只大鼠,取各组大鼠梗死侧脑皮质,在超低温度下(-80 ℃)保存4 h,取出冻存后组织,研磨脑组织后将组织匀浆加入细胞裂解液中,在4 ℃、10 000 r/min转速下离心6 min,取上清液待用;根据BCA蛋白浓度测定试剂盒说明书操作,使用酶标仪测定AQP4浓度[9]。计算出WB反应体系加样量,保证各体系上样等量的样品蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,转膜,逐步孵育第一抗体及对应第二抗体并进行免疫反应,转移至暗室内操作,采用电化学发光试剂盒发光,X线片经过特定时间显影定影,晾干相应X线底片后(或凝胶成像仪)分析。根据之前测定的蛋白浓度及β肌动蛋白参考得出AQP4蛋白的相对表达水平[10]。
2.3.5 脑细胞凋亡数检测:脑缺血2 h再灌注后,每个亚组随机取5只大鼠,按上述步骤制成脑组织切片后采用DNA原位末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)检测细胞凋亡数:(1)厚度5 μm的脑切片经二甲苯润洗2次,每次约10 min,然后经梯度磷酸盐缓冲溶液(PBS)-乙醇冲洗2次,每次2 min;(2)室温(25 ℃)下,玻片标本经蛋白酶K(20 μg/ml)消化处理45 min;(3)玻片标本经PBS缓冲液冲洗3次,每次3 min,后加入TUNEL反应混合液50 μl(阴性对照组加50 μl荧光标记dUTP),37 ℃下湿盒避光反应1 h;(4)PBS缓冲液冲洗,玻片干燥后加POD转化剂50 μl于标本上,37 ℃下湿盒避光孵育30 min;(5)PBS缓冲液冲洗后,在玻片标本上加DAB反应底物50 μl,37 ℃下反应30 min,采用苏木精复染;(6)进行脱水、透明、封片、光镜观察。细胞核中出现的棕黄染色颗粒代表TUNEL阳性细胞数。对单张切片标本进行5次单独的油镜视野观察计数(×400),得出单张切片样本的阳性细胞平均数。最终TUNEL阳性率即为TUNEL阳性细胞数占总细胞数的百分比。
2.4 统计学方法

3 结果
3.1 五组大鼠神经功能缺损评分及脑梗死体积比较
Sham组大鼠无神经功能缺损及脑梗死出现。IR、Ul、Lp和LpUl组大鼠的神经功能缺损评分、脑梗死体积分数依次减少,两两比较,差异均有统计学意义(P<0.05),见表1。


组别神经功能缺损评分/分脑梗死体积分数/%Sham组(n=5)00IR组(n=5)2.62±0.3943.21±2.86Ul组(n=5)2.34±0.3536.83±2.37Lp组(n=5)1.36±0.2228.76±1.54LpUl组(n=5)1.19±0.1427.53±1.38
3.2 五组大鼠脑水肿程度比较
与Sham组大鼠比较,IR、Ul、Lp和LpUl组大鼠缺血侧脑含水量均明显增加,差异均有统计学意义(P<0.05);IR、Ul、Lp和LpUl组大鼠组内脑缺血2 h后再灌注6、12、24 h时缺血侧脑含水量的差异均有统计学意义(P<0.05),见表2;而其健康侧脑含水量的差异均无统计学意义(P>0.05)。IR、Ul、Lp和LpUl组大鼠缺血侧脑含水量随再灌注时间增加而呈上升趋势。


组别再灌注时间皮质区皮质下区水肿程度/%BBB通透率/(μg/g)水肿程度/%BBB通透率/(μg/g)Sham组(n=5)无76.53±1.256.94±0.2978.41±1.787.55±0.49IR组(n=5)6h83.26±2.2526.26±0.7586.38±2.2630.32±0.8112h85.83±2.4339.68±0.9190.03±1.9442.17±1.4624h89.32±2.7259.36±1.2793.24±2.1365.72±2.43Ul组(n=5)6h80.37±1.9621.42±0.9384.27±1.5626.11±0.6212h82.63±1.7336.55±1.1387.12±1.4941.83±1.2524h85.93±1.8655.81±1.3890.75±2.0560.84±2.17Lp组(n=5)6h79.14±1.5718.74±1.0480.92±1.2122.36±1.3412h80.72±1.8531.60±0.8382.45±1.6238.02±1.5124h82.66±1.5750.37±1.2585.35±1.8656.34±1.86LpUl组(n=5)6h77.56±1.6215.17±0.8578.84±1.2418.71±1.3412h78.87±1.4829.06±1.1380.13±1.1334.25±1.2624h79.67±1.8245.25±1.4681.62±1.5251.37±1.72
3.3 五组大鼠AQP4表达量比较
IR、Ul、Lp和LpUl组大鼠在脑缺血2 h后再灌注6、12、24 h时,缺血侧脑组织中AQP4的表达量均较Sham组明显增加,差异均有统计学意义(P<0.05),见图1、表3;五组大鼠健康侧脑组织AQP4表达水平的差异均无统计学意义(P>0.05)。IR、Ul、Lp和LpUl组大鼠缺血侧脑组织中AQP4表达水平随再灌注时间的增加而呈上升趋势,与缺血侧脑含水量的变化趋势一致,对缺血侧脑组织中AQP4表达水平、缺血侧脑含水量的数据进行Spearman相关性分析,结果显示,脑含水量和AQP4表达水平呈正相关性(P=0.037),相关性显著。
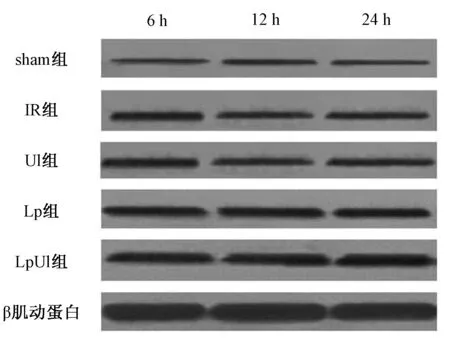
图1 五组大鼠灌注后缺血侧脑组织AQP4蛋白表达比较Fig 1 Comparison of AQP4 expression after cerebral ischemia reperfusion in the ischemic brain between five groups


组别6h12h24hSham组(n=5)0.038±0.0170.038±0.0150.039±0.017IR组(n=5)0.098±0.0230.115±0.0350.135±0.041Ul组(n=5)0.083±0.0250.095±0.0320.112±0.038Lp组(n=5)0.057±0.0190.064±0.0260.078±0.017LpUl组(n=5)0.052±0.0120.059±0.0160.071±0.020
3.4 五组大鼠脑细胞凋亡情况比较
Sham组大鼠可见到极少量的凋亡细胞,IR、Ul、Lp和LpUl组大鼠凋亡细胞阳性率分别为(26.98±2.25)%、(23.59±1.78)%、(18.25±1.83)%、(17.23+2.02)%,均明显高于Sham组,差异均有统计学意义(P<0.05)。IR组大鼠凋亡细胞阳性率明显高于Ul、Lp、LpUl组,差异有统计学意义(P<0.05);与Sham组大鼠比较,Lp、LpUl组大鼠凋亡细胞阳性率均明显降低,差异均有统计学意义(P<0.05),见图2。

A.假手术组;B.肢体缺血后处理组;C.肢体缺血后处理联合乌司他丁组A.sham operation group(sham), B. limb ischemia postconditioning group(Lp), D. limb ischemia postconditioning combined with ulinastatin group(LpUl)图2 大鼠脑组织细胞凋亡情况比较Fig 2 Comparison of cells apoptosis in rats brain tissues
4 讨论
本研究采用成熟的线栓法制备SD大鼠大脑中动脉局灶性脑缺血再灌注模型,探讨了单次尾静脉注射低剂量乌司他丁联合肢体缺血后处理对脑缺血再灌注损伤的协同抵抗作用。根据临床上乌司他丁体表面积用药剂量换算,乌司他丁注射剂量选择10万U/kg。乌司他丁的作用机制可能与其抑制炎症因子释放、抑制部分凝血因子功能、保护血管内皮细胞而间接调节渗透压,从而减轻脑水肿发生程度等有关。
本研究结果显示,乌司他丁静脉注射、肢体缺血后处理均可在一定程度上改善脑缺血再灌注大鼠神经功能缺陷评分,减轻脑水肿发生程度,缩小脑梗死面积,降低脑组织中水通道蛋白AQP4表达量,减少脑细胞凋亡,而两者联合应用时,上述指标均可明显改善[11]。肢体缺血后处理联合乌司他丁的作用机制可能是通过抑制炎症反应而减轻脑缺血再灌注损伤,其中乌司他丁可通过抑制炎症因子释放间接刺激机体应激保护,减少炎症因子的表达及炎性级联反应,减轻组织炎性损伤[12-13];而肢体缺血后处理则通过诱导内源性κ阿片受体激动剂释放,激活线粒体ATP敏感性钾通道,减轻线粒体内钙超载,抑制线粒体渗透性转换孔发生渗透性转换,从而发挥神经保护作用,还能促进脑缺血区热休克蛋白70的表达,抑制脑缺血再灌注大鼠脑皮层神经元凋亡[14-15]。
综上所述,肢体缺血后处理联合乌司他丁治疗,可有效减轻脑缺血再灌注大鼠脑水肿程度,改善神经功能缺陷,缩小脑梗死面积。
[1]Nishiyama T,Yokoyama T,Yamashita K.Effects of a protease inhibitor ulinastatin on coagulation and fibrinolysis in abdominal surgery[J].J Anesth,2006,20(3):179-182.
[2]朱椰凡,张启瑜,周蒙滔,等.区域动脉灌注乌司他丁治疗犬急性出血坏死性胰腺炎的机制[J].实用医学杂志,2010,26(9):1524-1527.
[3]涂献坤,石松生,杨卫忠,等.齐留通通过激活ERK1/2信号通路减轻大鼠脑缺血炎症反应和缺血性脑损伤[J].中国药理学通报,2014,30(10):1441-1444.
[4]鲁宏,孙善全.水通道蛋白-4在早期缺血性脑水肿中的表达[J].解剖学杂志,2003,26(4):347-349.
[5]Memezawa H,Minamisawa H,Smith ML,et al.Ischemic penumbra in a model of reversible middie cerebral artery occlusion in the rat[J].Exp Brain Res,1992,89(1):67-68.
[6]张成英,赵旭东.栓线法制作大鼠局灶性脑缺血模型插线部位的选择[J].四川解剖学杂志,2004,12(2):110-111.
[7]许淑红,尹茂山,吴玉林.吡拉格雷钠对氧糖剥夺复氧后星形胶质细胞水肿及AQP4表达的影响[J].中国药理学通报,2015,31(12):1661-1667.
[8]Liang D,Bhatta S,Gerzanich V,et al.Cytotoxic edema: mechanisms of pathological cell swelling[J].Neurosurg Focus,2007,22(5):E2.
[9]赵薇,王树,李方江.大黄酚对小鼠脑缺血/再灌注脑组织抗氧化应激和AQP4的影响[J].中国药理学通报,2015,31(10):1477-1478.
[10] 缪睿,李昌煜.水通道蛋白-依赖性细胞迁移的研究进展[J].中国药理学通报,2011,27(5):601-605.
[11] Ren C,Yan Z,Wei D,et al.Limb remote ischemic postconditioning protects against focal ischemia in rats[J].Brain Res,2009,1288:88-94.
[12] Murphy PG,Myers DS,Davies MJ,et al.The antioxidant potential of propofol (2,6-diisopropylphenol)[J].Br J Anaesth,1992,68(6):613-618.
[13] Chen HI,Hsieh NK,Kao SJ,et al.Protective effects of propofol on acute lung injury induced by oleic acid in conscious rats[J].Crit Care Med,2008,36(4):1214-1221.
[14] 许淑红,康辰,陈美灵,等.大鼠脑缺血再灌注后早期AQP4的动态表达及其与脑水肿关系的研究[J].中国药理学通报,2016,32(10):1433-1441.
[15] Gwak YS,Kang J,Unabia GC,et al.Spatial and temporal activation of spinal glial cells: role of gliopathy in central neuropathic pain following spinal cord injury in rats[J].Exp Neurol,2012,234(2):362-372.
Study on Remission Effects of Limb Ischemia Postconditioning Combined with Ulinastatin on Brain Water Content Induced by Cerebral Ischemia/Reperfusion Injury in RatsΔ
ZHOU Hongbin, HUANG Huansen,HE Rongzhi,DENG Yuping,WANG Xiaoqiao,WU Diansheng
(Dept.of Anesthesiology, the Second Affiliated Hospital of Guangzhou Medical University, Guangdong Guangzhou 510260, China)
OBJECTIVE:To probe into the remission effects of limb ischemia postconditioning combined with ulinastatin on brain water content induced by cerebral ischemia/reperfusion injury in rats. METHODS: 300 healthy male SD rats were randomly selected to be divided into sham operation group(sham), ischemia reperfusion group(IR), ulinastatin group(Ul), limb ischemia postconditioning group(Lp) and limb ischemia postconditioning combined with ulinastatin group(LpUl). The focal cerebral ischemia/reperfusion rat model was set up by using the middle cerebral artery occlusion method. After cerebral ischemia of 2 h, ulinastatin was administrated by instillation in tail vein injection; the ischemic postconditioning was conducted after ischemia of 1.5 h, namely, ligation of 5 min with instillation of 5 min, for repetition of three times. The neurological deficit score, cerebral infarction volume, brain water content, Aquaporin-4(AQP4) expression and neuron apoptosis were detected. RESULTS: The neurological deficit score, cerebral infarction volume decreased gradually in IR, Ul, Lp and LpUl group, with statistically significant difference between two groups(P<0.05). Compared with Sham group, the ischemic side of brain water content in IR, Ul, Lp and LpUl group increased significantly, with statistically significant difference(P<0.05). There was statistically significant difference among IR, Ul, Lp and LpUl group in ischemic side of brain water content with instillation of 6 h, 12 h and 24 h after ischemia of 2 h(P<0.05). Compared with Sham group, the AQP4 expression in IR, Ul, Lp and LpUl group increased significantly, with statistically significant difference(P<0.05). Compared with IR group, the positive rate of apoptosis cells in IR, Ul, Lp and LpUl group decreased significantly, with statistically significant difference(P<0.05). CONCLUSIONS: Limb ischemia postconditioning combined with ulinastatin can relieve the cerebral injury induced by cerebral ischemia reperfusion.
Ulinastatin; Limb ischemia postconditioning; Cerebral ischemia reperfusion; Brain water content; Aquaporin-4; Rats
广州市医药卫生科技一般引导项目(No:20151A010095)
R965
A
1672-2124(2017)03-0314-04
2016-11-17)
*主治医师。研究方向:麻醉与组织器官保护。E-mail:maxiahongbin@163.com
DOI 10.14009/j.issn.1672-2124.2017.03.009
