免疫系统与卵巢及卵巢生殖干细胞相关性的研究进展①
2017-04-10李小燕郑月慧
梁 夏 李小燕 毛 自 曹 璇 郑月慧
(衢州职业技术学院,衢州324000)
免疫系统与卵巢及卵巢生殖干细胞相关性的研究进展①
梁 夏 李小燕②毛 自②曹 璇②郑月慧②
(衢州职业技术学院,衢州324000)
免疫系统作为机体最重要的保卫系统,其功能的维持有赖于免疫细胞及免疫相关分子发挥相应的效能,这其中任何一个成分缺失或功能不全都可导致机体免疫功能障碍,并由此引发疾病。科学家已证实,生殖系统疾病与免疫系统相关细胞的功能异常存在着紧密联系,如子宫内膜异位症的发生与T细胞、自然杀伤细胞和单核/巨噬细胞介导的细胞免疫功能障碍具有相关性[1]。现有观点认为,机体各组织功能的建立和调控是依赖以免疫系统为主的组织控制系统(Tissue control system,TCS)来完成的[2]。TCS的功能在个体发育的早期即被建立[3-5],大约在孕中期末发育完全,由免疫系统相关组分、血管内皮细胞和自主神经组成,其中单核细胞衍生细胞(Monocyte-derived cells,MDCs)、T细胞和B细胞等免疫细胞在调控组织功能中具有举足轻重的地位[2]。该理论认为TCS发育完全后,作为其重要组成部分的MDCs能够适时地发出“停止效应(stop effect)”,使组织细胞的分化停止并保存在某一合适的分化状态,“停止效应”的实质就是避免组织细胞过度分化,机体功能的维持依赖于MDCs发出适当的“停止效应”。随着年龄的增长,机体免疫系统发生退化,MDCs发出“停止效应”的功能随之减退,从而引起机体各个组织(如卵巢)功能的下降[6]。
1 免疫系统与卵巢功能密切相关
1.1 免疫系统影响卵巢功能 二十世纪七十年代,关于免疫系统与卵巢功能的研究就已取得很大的进展:Nishizuka等[7]对2~4 d的新生小鼠行胸腺摘除术后发现,在后续培养中该类小鼠体内出现卵巢发育不全的现象;Russell等[8]利用正常雌鼠的胸腺细胞成功抑制了小鼠体内经环磷酰胺和X线诱导的超排卵现象;1979年,Bukovsky[9]首先提出免疫系统在调节卵巢功能中发挥重要作用。近年来随着研究的进一步深入,新的成果不断涌现:科学家给予新生裸鼠肌肉注射胸腺素,该类裸鼠发育到成年期,血清中的卵泡刺激素(Follicle stimulating hormone,FSH)和黄体生成素(Luteinizing hormone,LH)可维持稳定水平,并且能够有效抑制裸鼠卵巢发育不全地发生[10];此外,研究者还发现,随着年龄的增长,机体免疫系统不可避免地发生退化,这种退化首先表现为胸腺功能受损,其次就是卵巢功能的衰退[5]。众多成果表明,机体免疫系统与卵巢功能之间存在着密切联系。
1.2 免疫系统与卵巢内分泌系统的相互作用 众所周知,下丘脑-垂体系统通过其与卵巢之间的相互作用调控着卵巢的功能。垂体在下丘脑所产生的激素控制下分泌FSH和LH,二者直接控制卵巢的周期性生理变化。而免疫系统相关细胞和分子存在于下丘脑-垂体-卵巢轴的各个水平,故推测免疫系统也可调控卵巢的发育和衰退。早在二十世纪八、九十年代,免疫系统与卵巢的关系就已被发现,免疫细胞及其产生的细胞因子与下丘脑-垂体-卵巢轴的激素水平相互作用,参与卵巢组织分化、发育的全过程。
研究发现,细胞因子是卵泡发育及排卵过程中必不可少的因素[11]。排卵前的卵泡中存在着较多具有双相活性的肿瘤坏死因子-α(Tumor necrosis factor α,TNF-α),即FSH刺激颗粒细胞产生TNF-α,从而起到抑制前列腺素F2α(Prostaglandin F2α,PGF2α)产生的作用,同时TNF-α又能在排卵前刺激PGF2α暂时性提高,从而有利于排卵发生[12]。通过对小鼠卵巢的研究发现,TNF-α对FSH诱导的芳香酶活性及其后的孕激素水平提高均有抑制作用,因而进一步促进排卵发生[12]。白细胞介素-1(Interleukin-1,IL-1),能够减少颗粒细胞中LH受体的产生,从而降低孕激素分泌。此外,IL-1还参与排卵及卵母细胞发育过程[13]。对大鼠卵巢的体外研究发现,转化生长因子-β(Transforming growth factor-β,TGF-β)能够抑制卵泡的发育,同时TGF-β在维持原始卵泡的数量中发挥重要生理作用[14]。
月经周期中的黄体是哺乳动物体内寿命最短的组织,若卵子未受精,则黄体在两周内就会萎缩成为白体。研究者已在多种实验动物的黄体组织中发现了巨噬细胞,并提出巨噬细胞及其分泌的细胞因子如TNF等参与黄体的发育和退化[15]。在幼稚黄体和发育黄体中,TNF可刺激血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)的分泌,促进新生血管发生,从而有利于黄体的发育和成熟[15]。而在不断探索黄体生理机制的过程中发现,TNF等细胞因子在退化黄体中存在更多,幼稚黄体中的TNF促进黄体的生长,而退化黄体中较高浓度的TNF却参与细胞凋亡和黄体衰退,其中的机制尚不清楚[16]。
2 免疫系统参与卵巢生殖干细胞的增殖和分化
在成年哺乳动物的卵巢中,原始卵泡和卵母细胞的起源已经争论了近百年。2004年,Johnson等[17]首次发现成年小鼠卵巢中存在具有有丝分裂活性的生殖细胞,并认为雌性小鼠卵巢从出生后到成年都存在卵母细胞的更新。这一观点的提出打破了传统的“固定卵泡池”理论。自此,卵巢生殖干细胞(Ovarian germline stem cells,OGSCs)的研究受到广泛关注。
OGSCs是覆盖在卵巢表面的上皮细胞。现已在多种哺乳动物的卵巢表面上皮(Ovarian surface epithelium,OSE)内检测到成体干细胞和减数分裂相关基因的特征性标志物,如Oct-4(生殖干细胞特异性的转录因子)、 vasa(生殖细胞特异性基因)、scp3(联会复合体3,减数分裂标志基因)和端粒酶(仅在生殖干细胞中有表达,随细胞分化后表达丧失)等[18-21],因此OGSCs又有“生殖上皮”之称。
随着研究的进一步深入,2009年,Zou等[22]将绿色荧光蛋白(GFP)标记的小鼠OGSCs植入不孕小鼠体内,使不孕小鼠成功产下带有GFP标记的子代。2012年,White等[23]从功能正常的成人卵巢中提取生殖干细胞,并将其分别植入到人类的卵巢组织和免疫衰竭的小鼠体内,均观察到新的原始卵泡的形成。尽管有关OGSCs的研究取得了很大进展,在生殖医学领域关于OGSCs存在与否仍然具有很大争议:一些学者认为,我们所谓的OGSCs在小鼠卵巢内仅以少数存在,并且这些干细胞在体内不具有分裂增殖活性,因此无法补充原始卵泡池的耗竭[24,25]。此外,OGSCs的体外培养存在数量少、增殖缓慢等问题,因而探索OGSCs的增殖分化机制尤为重要和紧迫。本实验室工作人员也已经成功分离培养了OGSCs,并致力于研究该细胞的体内外调控机制[26,27]。
2.1 免疫系统参与卵巢生殖干细胞巢(OGSCs Niche)的组成 OGSCs是来自于卵巢皮层的双潜能干细胞,能够分化为卵巢生殖细胞和原始颗粒细胞[26],这一过程是通过卵巢生殖干细胞巢(OGSCs Niche)来调控的。Bukovsky[28]提出,OGSCs的周围存在着调控其功能的Niche,而免疫系统相关细胞和分子是OGSCs Niche的重要组成部分。OGSCs Niche在胎儿发育的早期就已建立,在胎儿时期由卵巢定型的MDCs和T细胞、血管内皮细胞等组成,而在成人则由初级MDCs(CD14+MDCs)、活化的MDCs([HLA-DR]+ MDCs)及T细胞等组成,免疫系统作为其重要组成部分很可能参与调控OGSCs的增殖和分化。
Bukovsky等[6]研究发现,免疫系统相关细胞和分子通过OGSCs Niche参与OGSCs的不对称分裂,促进生殖细胞的产生、分裂增殖和迁移,参与生成新的颗粒细胞及胎儿和成人的原始卵泡,并促进原始卵泡的生长以及优势卵泡的形成,从而维持卵巢的正常功能。此结论基于以下现象:①在研究人类胚胎和胎儿OGSCs形成卵泡的机制时发现,卵泡的发育通常始于卵巢皮质的最内层,靠近卵巢网,卵巢网是卵泡发育所必需的[29,30]。而卵巢网通道中含有免疫系统相关的细胞如初级MDCs,它们能够分化成大量活化的MDCs移行于网状通道中,并与固有的MDCs相互作用。此外,抑制性T细胞(CD3+T细胞)和细胞毒性T细胞(CD8+T细胞)也存在于网状通道内。②OGSCs在转化成生殖细胞时,需要接受来自于卵巢定型的骨髓细胞(Ovary-committed bone marrow cells,OCMT),如MDCs和T细胞的刺激[31]。OGSCs通过不对称分裂产生一个定向分化的生殖细胞和一个子代OGSC,该生殖细胞进一步分化为卵母细胞,并移行到邻近的上皮层和皮层血管内。在随血液循环的过程中,生殖细胞体积增大并与上皮颗粒细胞巢结合形成原始卵泡[32]。生殖细胞产生和移行的过程始终伴随着免疫系统相关细胞的参与,如初级 MDCs参与OGSCs的不对称分裂;CD8+T细胞伴随生殖细胞的对称分裂,这一过程也涉及初级MDCs的参与,除此之外初级MDCs还参与生殖细胞进入上皮层的过程;活化的MDCs则与生殖细胞的移行密切相关。
2.2 免疫系统建立的“卵巢记忆” Bukovsky[28]认为,OGSCs Niche中存在许多未定型的MDC和T细胞(Uncommitted MDC and T cells,UMT),并且这些细胞具有识别和记忆OGSCs的功能。2012年,Bukovsky等[5]正式提出关于“卵巢记忆”的假设:当原始生殖细胞植入未分化的性腺后,卵巢网就会刺激次级生殖细胞分化成卵母细胞。在发育的免疫适应期内,卵巢网中存在许多UMT,一部分UMT能够在卵巢网通道内分化成“面纱”细胞(veiled cells),并将卵巢网内卵母细胞的信息传递给发育中的淋巴组织,此时这些“面纱”细胞就被称为卵巢“记忆细胞(Ovarian memory cells,OMC)”,它们能够将卵巢网通道内其余的UMT转换成OCMT。这些OCMT移行到卵巢上皮层并产生细胞信号以触发OGSCs的不对称和对称分裂,进而分化成次级生殖细胞。次级生殖细胞的产生也依赖于hCG和雌二醇等提供合适的激素环境。该假设认为,发育中的免疫系统会建立起“卵巢记忆”,以支持成人期内依赖OCMT而完成的卵泡更新[33]。在35到40岁之间,免疫系统表现出明显的功能减退,卵泡更新也随之停止(图1)。
免疫适应期结束以后,随之而来的是胎儿卵巢网退化、卵子发生停止,这可能归咎于激素信号的减少(胎儿hCG屏障)[34]。此时,淋巴组织中OMC的数量也确定下来,形成卵巢记忆细胞池。在近月经初潮及最佳生殖期内,激素信号和OCMT通过刺激OGSCs重新参与周期性的卵子发生,持续的卵泡更新需要OCMT的循环供应,这一过程将最终导致记忆细胞池的耗竭。一旦可用的OMC被耗尽,即使激素信号仍然存在,卵子发生和卵泡的更新依然会终止。从这个观点来看,随着年龄增长而发生的免疫系统退行性变化可能是卵子发生和卵泡更新停止最根本的原因。该假设是科学家结合众多实验成果和理论依据提出的,揭示了哺乳动物免疫系统和生殖系统之间可能存在的内在联系,是对免疫系统调控OGSCs增殖、分化的大胆推测。
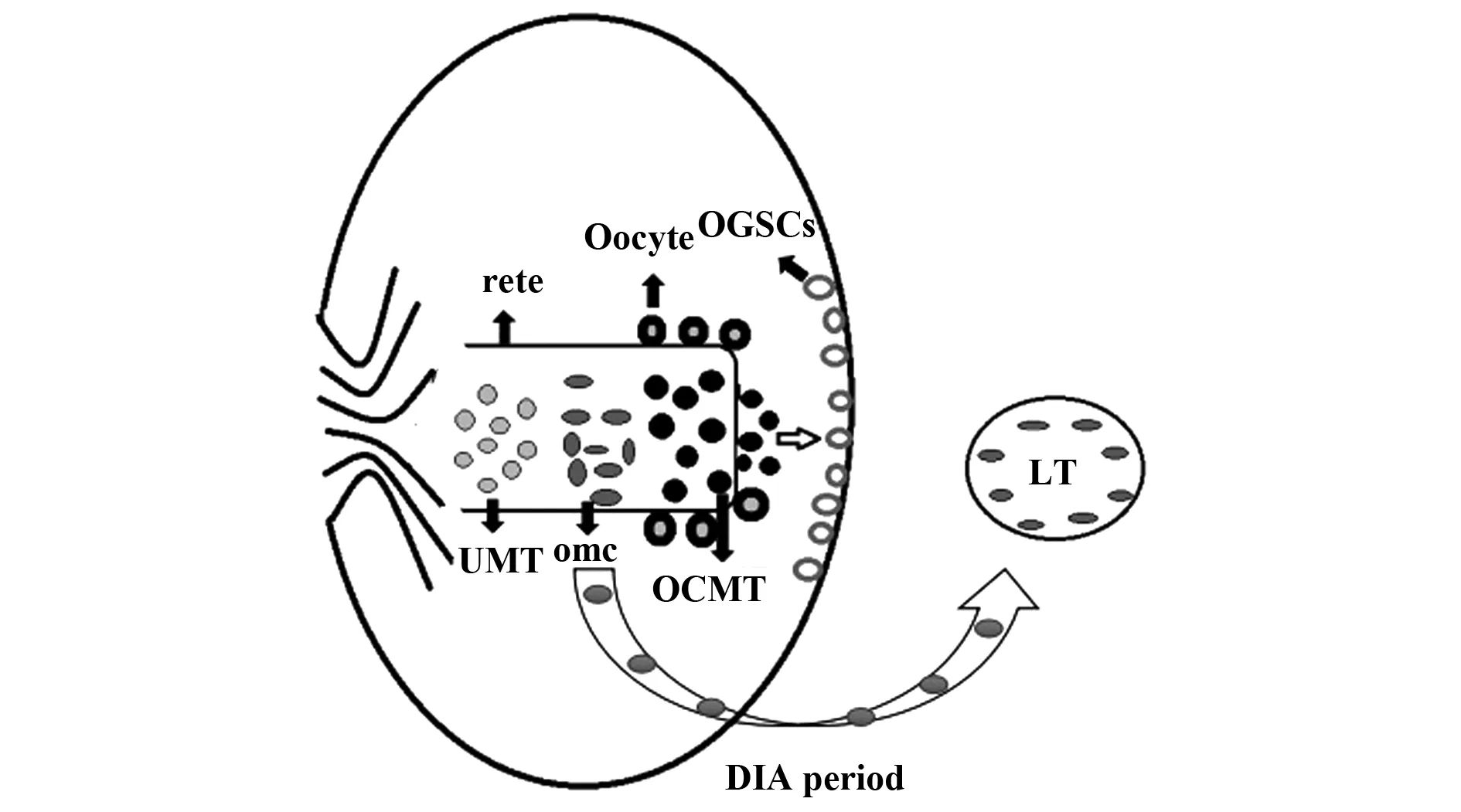
图1 免疫适应期内卵巢“记忆细胞”的产生Fig.1 Generation of ovarian memory cells during developmental immune adaptationNote: UMT.Uncommitted MDC and T cells;OCMT.Ovary-committed bone marrow cells;omc.Ovarian memory cells;OGSCs.Ovarian germline stem cells;LT.Lymphoid tissue;DIA.Developmental immune adaptation.
3 结语
OGSCs的提出打破了生殖医学的传统观点,作为胎儿和成人卵巢内生殖细胞的补给细胞,OGSCs能够维持卵巢的生殖功能,因此对其体内外调控机制的研究将给卵巢早衰以及卵巢不孕症等的临床治疗提供更广阔的前景,对提高女性受孕率和延缓女性衰老具有重要意义!近年来,从OGSCs的体外建系到植入OGSCs的不孕小鼠成功产下后代,科学家对OGSCs的探索取得了很大进展,但关于其调控机理的研究尚不充足。
在机体组织功能方面,免疫系统相关细胞和分子参与生殖细胞的对称分裂和迁移、促进颗粒细胞及胎儿和成人原始卵泡的生成,从而维持卵巢的正常功能。而在哺乳动物OGSCs的增殖分化过程中,免疫系统同样发挥着不可忽视的重要作用:OGSCs发生不对称分裂产生新的生殖细胞的过程需要接受MDCs和T细胞的刺激;免疫系统通过OGSCs Niche调控OGSCs的增殖分化。众多实验结果证明,免疫系统与哺乳动物雌性生殖系统的种种联系并非偶然,卵巢的功能甚至OGSCs的生理进程都很可能受到机体免疫系统的调控。然而,目前OGSCs存在与否仍然争议不断,OGSCs的分离纯化尚处于体外研究阶段,临床应用上仍然存在很大困难,因此探索OGSCs的增殖、分化机制必将成为研究者们共同面临的难题。科学家们在免疫和生殖领域所取得的研究成果,为我们探索OGSCs的体内外调控机制指引了新的方向,同时也将为女性不孕症等的临床治疗提供新的思路!
[1] Ahn SH,Monsanto SP,Miller C,etal.Pathophysiology and immune dysfunction in endometriosis [J].Biomed Res Int,2015,2015:795-976.
[2] Bukovsky A.Immune maintenance of self in morphostasis of distinct tissues,tumour growth and regenerative medicine [J].Scand J Immunol,2011,73(3):159-189.
[3] Li Y,Zhao LD,Tong LS,etal.Aberrant CD200/CD200R1 expression and function in systemic lupus erythematosus contributes to abnormal T-cell responsiveness and dendritic cell activity [J].Arthritis Res Ther,2012,14(3):R123.
[4] Bukovsky A.From cellular to chemical approach for acute neural and alternative options for age-induced functional diseases [J].World J Stem Cells,2015,7(8):1109-1117.
[5] Bukovsky A,Caudle MR.Immunoregulation of follicular renewal,selection,POF,and menopause in vivo,vs.neo-oogenesis in vitro,POF and ovarian infertility treatment,and a clinical trial [J].Reprod Biol Endocrinol,2012,10:97.
[6] Bukovsky A.Cell commitment by asymmetric division and immune system involvement [J].Prog Mol Subcell Biol,2007,45:179-204.
[7] Sakakura T,Nishizuka Y.Thymic control mechanism in ovarian development:reconstitution of ovarian dysgenesis in thymectomized mice by replacement with thymic and other lymphoid tissues [J].Endocrinology,1972,90(2):431-437.
[8] Russell WR,Walpole AL,Labhsetwar AP.Cyclophosphamide:induction of superovulation in rats [J].Nature,1973,241(5385):129-130.
[9] Bukovsky A,Presl J.Ovarian function and the immune system [J].Med Hypotheses,1979,5(4):415-436.
[10] Reggiani PC,Barbeito CG,Zuccolilli GO,etal.Neonatal thymulin gene therapy prevents ovarian dysgenesis and attenuates reproductive derangements in nude female mice [J].Endocrinology,2012,153(8):3922-3928.
[11] Crespo D,Bonnet E,Roher N,etal.Cellular and molecular evidence for a role of tumor necrosis factor alpha in the ovulatory mechanism of trout [J].Reprod Biol Endocrinol,2010,8:34.
[12] Nakao K,Kishi H,Imai F,etal.TNF-alpha suppressed FSH-induced LH receptor expression through transcriptional regulation in rat granulosa cells [J].Endocrinology,2015,156(9):3192-3202.
[13] Uri-Belapolsky S,Shaish A,Eliyahu E,etal.Interleukin-1 deficiency prolongs ovarian lifespan in mice [J].Proc Natl Acad Sci U S A,2014,111(34):12492-12497.
[14] Wang ZP,Mu XY,Guo M,etal.Transforming growth factor-beta signaling participates in the maintenance of the primordial follicle pool in the mouse ovary [J].J Biol Chem,2014,289(12):8299-8311.
[15] Galvao AM,Ferreira-Dias G,Skarzynski DJ.Cytokines and angiogenesis in the corpus luteum [J].Mediators Inflamm,2013,2013:420186.
[16] Galvao AM,Szostek AZ,Skarzynski DJ,etal.Role of tumor necrosis factor-alpha,interferon-gamma and Fas-ligand on in vitro nitric oxide activity in the corpus luteum [J].Cytokine,2013,64(1):18-21.
[17] Johnson J,Canning J,Kaneko T,etal.Germline stem cells and follicular renewal in the postnatal mammalian ovary [J].Nature,2004,428(6979):145-150.
[18] Virant-Klun I.Postnatal oogenesis in humans:a review of recent findings [J].Stem Cells Cloning,2015,8:49-60.
[19] Bhartiya D,Sriraman K,Parte S,etal.Ovarian stem cells:absence of evidence is not evidence of absence [J].J Ovarian Res,2013,6(1):65.
[20] Gheorghisan-Galateanu AA,Hinescu ME,Enciu AM.Ovarian adult stem cells:hope or pitfall? [J].J Ovarian Res,2014,7:71.
[21] Parvari S,Abbasi M,Abbasi N,etal.Stem cell isolation by a morphology-based selection method in postnatal mouse ovary [J].Arch Med Sci,2015,11(3):670-678.
[22] Zou K,Yuan Z,Yang Z,etal.Production of offspring from a germline stem cell line derived from neonatal ovaries [J].Nat Cell Biol,2009,11(5):631-636.
[23] White YA,Woods DC,Takai Y,etal.Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women [J].Nat Med,2012,18(3):413-421.
[24] Zhang H,Liu L,Li X,etal.Life-long in vivo cell-lineage tracing shows that no oogenesis originates from putative germline stem cells in adult mice [J].Proc Natl Acad Sci U S A,2014,111(50):17983-17988.
[25] Grive KJ,Freiman RN.The developmental origins of the mammalian ovarian reserve [J].Development,2015,142(15):2554-2563.
[26] Li J,Zhou F,Zheng T,etal.Ovarian germline stem cells (OGSCs) and the hippo signaling pathway association with physiological and pathological ovarian aging in mice [J].Cell Physiol Biochem,2015,36(5):1712-1724.
[27] Pan Z,Sun M,Li J,etal.The expression of markers related to ovarian germline stem cells in the mouse ovarian surface epithelium and the correlation with notch signaling pathway [J].Cell Physiol Biochem,2015,37(6):2311-2322.
[28] Bukovsky A.Ovarian stem cell niche and follicular renewal in mammals [J].Anat Rec (Hoboken),2011,294(8):1284-1306.
[29] Hummitzsch K,Anderson RA,Wilhelm D,etal.Stem cells,progenitor cells,and lineage decisions in the ovary [J].Endocr Rev,2015,36(1):65-91.
[30] Lee SH,Ichii O,Otsuka S,etal.Identifying a new locus that regulates the development of rete ovarian cysts in MRL/MpJ mice [J].Jpn J Vet Res,2011,59(2-3):79-88.
[31] Bukovsky A.Novel methods of treating ovarian infertility in older and POF women,testicular infertility,and other human functional diseases [J].Reprod Biol Endocrinol,2015,13:10.
[32] Kossowska-Tomaszczuk K,De Geyter C.Cells with stem cell characteristics in somatic compartments of the ovary [J].Biomed Res Int,2013,2013:310859.
[33] Bukovsky A,Copas P,Virant-Klun I.Potential new strategies for the treatment of ovarian infertility and degenerative diseases with autologous ovarian stem cells [J].Expert Opin Biol Ther,2006,6(4):341-365.
[34] Bukovsky A,Caudle MR,Svetlikova M,etal.Oogenesis in adult mammals,including humans:a review [J].Endocrine,2005,26(3):301-316.
[收稿2016-05-05 修回2016-08-22]
(编辑 张晓舟)
10.3969/j.issn.1000-484X.2017.03.033
①本文为国家自然科学基金(No.81160081,81360100)和衢州市科技计划项目(2016Y016)。
梁 夏(1989年-),女,在读硕士,主要从事哺乳动物雌性生殖干细胞的体内外调控机制方面的研究,E-mail:751052182@qq.com。
R392
A
1000-484X(2017)03-0468-04
及指导教师:郑月慧(1964年-),女,博士,教授,博士生导师,主要从事生殖内分泌和计划生育研究工作,E-mail:yuehuizheng@163.com。
②南昌大学医学院,江西省生殖生理与病理重点实验室,南昌330031。
