精氨酸单糖苷(AF)对免疫抑制小鼠免疫功能的影响①
2017-04-10宋明铭王佳奇黄宝亮高铭彤李婧毓丁传波郑毅男刘文丛徐晓华
宋明铭 王佳奇 黄宝亮 高铭彤 李婧毓 丁传波 郑毅男 刘文丛 徐晓华
(吉林农业大学,长春130118)
精氨酸单糖苷(AF)对免疫抑制小鼠免疫功能的影响①
宋明铭 王佳奇 黄宝亮 高铭彤 李婧毓 丁传波 郑毅男 刘文丛 徐晓华
(吉林农业大学,长春130118)
目的:研究精氨酸单糖苷(Arginyl-fructose,AF)对环磷酰胺(CTX)诱导的免疫抑制小鼠免疫功能的影响。方法: ICR小鼠100只,随机分成5组,即正常对照组(N),免疫抑制模型组(M),免疫抑制AF低、中、高剂量组(M-L、M-M、M-H)。试验组连续给药28 d。免疫抑制组,每周前3天,腹腔注射80 mg/kg环磷酰胺,形成免疫抑制。末次给药12 h解剖后,测定免疫器官指数,AF对脾淋巴细胞转化及增殖、巨噬细胞吞噬功能、特异性IgG抗体、血清中TNF-α 、IL-2含量的影响。并通过实时荧光定量PCR检测TNF-α 、IL-2 基因表达的差异。结果:AF能够显著提高小鼠的胸腺指数和脾脏指数,促进脾淋巴细胞的自然转化与增殖,增强巨噬细胞吞噬功能,显著提高小鼠血清中特异性IgG抗体含量,可显著提高小鼠血清中TNF-α、IL-2含量,实时荧光定量PCR检测结果显示,TNF-α、IL-2 mRNA能够良好表达。结论:AF能拮抗CTX免疫功能低下小鼠的免疫抑制作用。
精氨酸单糖苷;ICR小鼠;免疫;荧光定量PCR
精氨酸单糖苷(Arginyl-fructose,AF),是郑毅男等[1]首次从鲜参加工成红参的过程中获得,为美拉德反应中间产物的非褐变部分,是精氨酸与葡萄糖羟醛脱水缩合的产物[2,3],分子量为337.3。AF纯品为白色粉末,极易溶于水,不溶于甲醇等有机溶剂。实验研究表明,AF具有抗氧化[4,5]、抗肿瘤[6]、促进微循环等功能[7],而且具有抑制葡萄糖苷酶、抗糖尿病等作用[8]。
李敏珍等[9]报道,红参类药物有增强机体免疫功能作用。Yool等[10]报道,红参能够平衡体内免疫系统,调节免疫机能,抵抗疾病侵袭。AF在红参中含量丰富,所以通过此次试验,探讨AF是否在红参的免疫活性中发挥作用。
1 材料与方法
1.1 仪器、材料、试剂 万分之一电子天平[梅特勒-托利多仪器(上海)有限公司];冷冻干燥机(北京博医康实验仪器有限公司);LC-2010A高效液相色谱仪(日本岛津公司);荧光定量PCR仪电泳仪(北京六一);MX3000 RT-PCR仪(美国 Stratagene);PCR仪(美国SBP公司);琼脂糖凝胶电泳和紫外分光光度计;TGL-20B高速台式离心机(上海安亭科学仪器厂);凝胶成像仪(美国BIORAD公司);MK3型酶标仪(美国Thermo Electron公司)。
IL-2和TNF-α试剂盒(美国R&D公司,长春百金生物科技公司分装)。高纯总RNA快速提取试剂盒、2×Power Taq PCR Master Mix、Bio Take super RT Kit、2×SYBP Real-time PCR premixture(北京百泰克生物技术有限公司)。
精氨酸单糖苷AF,自制,纯度大于95%,临用时用纯净水配制成低、中、高剂量所需浓度;4周龄ICR小鼠,SPF级(18~22 g),购自吉林省亿斯实验动物中心。
1.2 方法
1.2.1 动物分组与剂量 100只ICR小鼠,适应性饲养1周后,随机分成5组,每组20只,即正常对照组(N),免疫抑制模型组(M),免疫抑制 AF低剂量组(M-L,20 mg/kg),免疫抑制AF中剂量组(M-M,40 mg/kg),免疫抑制 AF 高剂量组(M-H,80 mg/kg)。各组每日按10 ml/kg体重给小鼠灌胃给药,每天给药1次,连续给药28 d。M、M-L、M-M及M-H组,每周前3 d,腹腔注射环磷酰胺(CTX,80 mg/kg),形成免疫抑制。
1.2.2 小鼠免疫器官脏器指数测定 末次给药12 h后,眼球取血,离心机4 500 r/min分离血清,处理后的血清保存在-20℃冰箱,待用。将小鼠处死后进行系统的解剖,取出脾脏和胸腺,用9%生理盐水进行漂洗,滤纸吸干后称重,计算脾指数及胸腺指数。脏器指数=脏器重量(g)× 100/体重(g)。
1.2.3 脾淋巴细胞转化试验 给药第21天后,每组随机抽取10只小鼠,脱臼处死,置75%酒精中浸泡5 min,无菌取脾脏,加入RPMI1640,300目钢网研磨,吸取脾细胞悬液于1.5 ml离心管中,离心10 min(1 500 r/min,4℃),弃上清液。于上述离心管中加入ACK Lysis Buffer,再次离心10 min(1 500 r/min,4℃),弃上清液。再加入RPMI1640,细胞计数,配成2×106ml-1脾细胞悬液。试验分为3组,第1组为对照组即脾淋巴自然转化组;第2组加入ConA(5 μg/ml,100 μl),刺激T细胞转化;第3组加入LPS(10 μg/ml,100 μl),刺激B细胞转化。将各组细胞依次加到 96 孔板中,每孔加入100 μl脾细胞悬液,每孔设立3个复孔。细胞培养条件为:5%CO2培养箱,37℃,48 h。培养48 h后,每孔内加入MTT(5 mg/ml)20 μl,继续培养4 h后,离心(2 000 r/min,10 min),吸取上清液,加入150 μl的DMSO充分溶解结晶,酶标仪490nm条件下,测定各孔OD值。
1.2.4 体外脾淋巴细胞增殖试验 ICR小鼠,脱臼处死,取脾方法如1.2.3所述。试验分为空白组、阴性对照组、阳性对照组及AF加药组(浓度分别为:1、2、4、6、8、10 μg/ml)。每组设立3个复孔,空白组加入培养基100 μl,其他组别加入细胞悬液100 μl于96孔板中。培养1 h后,于空白及阴性对照组各加入培养基100 μl,阳性对照组加入ConA(50 μg/ml,10 μl),加药组加入相应浓度AF。培养条件与其余步骤,如1.2.3所述。
1.2.5 腹腔巨噬细胞吞噬功能的检测 ICR小鼠,脱臼处死,置75 %酒精中浸泡5 min,无菌条件下剪开腹部,使腹膜壁暴露,用75 %乙醇冲洗腹壁。之后无菌抽取1 ml消毒空气及4 ml冷PBS注入腹腔,最后抽取腹腔悬液,离心2次(1 500 r/min 4℃,10 min),每次离心后弃去上清液,用PBS洗涤。末次洗涤后,再加入RPMI1640,细胞计数,配成2×106ml-1脾细胞悬液。吸取100 μl细胞悬液于96孔板的各孔,5%CO2培养箱培养(37℃、2 h),贴壁细胞即为巨噬细胞,未贴壁用37℃PBS洗去。
试验设置AF加药组(浓度分别为:1、2、4、6、8、10 μg/ml)与空白对照组。每组设立3个复孔,空白对照组加入培养基200 μl,其他分别加入不同浓度的AF 200 μl于96孔板中。5%CO2培养箱培养(37℃、24 h),弃去上清液,用37℃ PBS 200 μl/孔洗3遍,加入0.075%中性红溶液200 μl/孔,培养箱中培养30 min弃去上清液,用37℃ PBS 200 μl/孔洗3遍,每孔加200 μl细胞裂解液(1 mol/L醋酸∶无水乙醇=1∶1)培养1 h,540nm测其吸光度值。吞噬中性红增加率(%)=(A给药-A对照)/A对照×100%。
1.2.6 血清TNF-α、IL-2含量测定 取分装好的小鼠血清,常温解冻,严格按照ELISA说明书操作,点入96孔板,酶标仪测定后,进行数据处理分析。
1.2.7 特异性IgG抗体的检测 取分装好的小鼠血清,常温解冻,ELISA法测定小鼠特异性IgG抗体水平。
1.2.8 荧光定量RT-PCR测定
1.2.8.1 组织中RNA提取 ①取出各组小鼠保存在液氮中的脾脏组织,在DEPC水处理后的研钵中充分研磨至粉末状。②1 ml Trizol于1.5 ml离心管中,再加入少许脾脏粉末,振荡器充分混匀后,静置5 min;③加200 μl氯仿于上述离心管中,盖紧,用手颠倒混匀后,室温放置10 min,12 000 r/min离心15 min 4℃;④吸出上清液于新的1.5 ml离心管中,加500 μl异丙醇,混匀,室温静置10 min后,12 000 r/min 4℃离心10 min,保留沉淀。⑤加75%冷乙醇1 ml于上述沉淀离心管中,充分洗涤沉淀,7 500 r/min 4℃离心5 min,弃上清;⑥室温干燥RNA至半透明状;⑦向离心管中加20 μl DNase/RNase-Free Deionized Water溶解沉淀,-80℃冻存。RNA提取图,见图1。
1.2.8.2 反转录合成cDNA TNF-α、IL-2的基因序列从数据库NCBI获得,参照查询的基因序列使用Primer5.0软件设计TNF-α 、IL-2定量引物,反转录引物使用试剂盒中的随机引物,荧光定量引物序列见表1。
按照东洋纺试剂盒说明书步骤,进行反转录试验,得到cDNA产物,于-80℃保存。反转录加样体系见表2。
1.2.8.3 实时荧光定量反应 以GAPDH为内参引物,采用荧光染料SYBR-GreenⅠ检测TNF-α 、 IL-2在小鼠脾脏组织中相对表达量,每个样品3个重复。扩增反应条件如下:95℃预变性5 min;95℃反应10 s,60℃反应30 s,40个循环。反应结束后,记录溶解曲线和扩增曲线,每孔样本的Ct值,使用2-ΔΔCt方法计算。反应体系见表3。


图1 RNA提取图Fig.1 Picture of RNA extraction
表1 荧光定量引物序列
Tab.1 Sequences of fluorescence quantitative primers
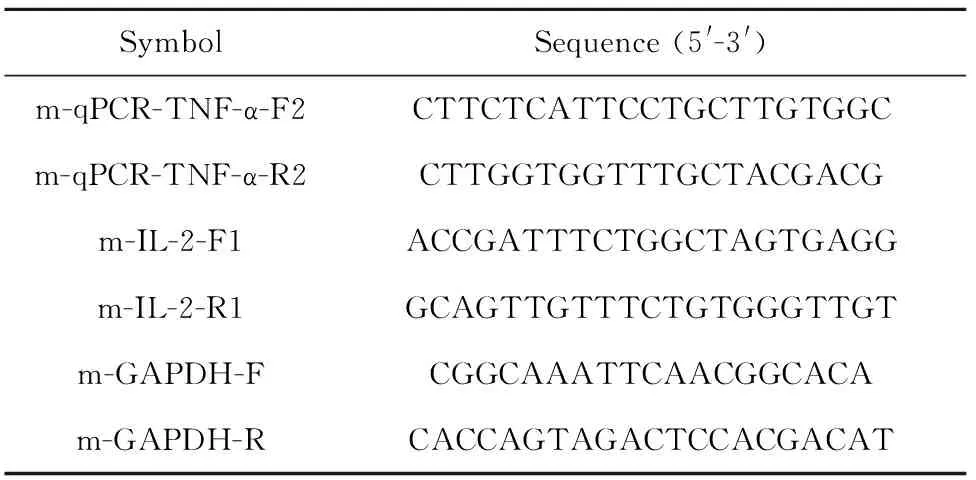
SymbolSequence(5'-3')m-qPCR-TNF-α-F2CTTCTCATTCCTGCTTGTGGCm-qPCR-TNF-α-R2CTTGGTGGTTTGCTACGACGm-IL-2-F1ACCGATTTCTGGCTAGTGAGGm-IL-2-R1GCAGTTGTTTCTGTGGGTTGTm-GAPDH-FCGGCAAATTCAACGGCACAm-GAPDH-RCACCAGTAGACTCCACGACAT
2 结果
2.1 AF对小鼠免疫器官脏器指数的影响 与M组比较,N、M-L、M-M组胸腺指数、脾脏指数均存在显著统计学意义(P<0.01),M-H组无明显变化,见表4。
2.2 AF对脾淋巴细胞转化的影响 从图2可知,T淋巴细胞转化刺激剂为ConA,与M组比较,M-L组具有极显著统计学意义(P<0.01),M-M组存在显著统计学意义(P<0.05),M-H组与M组无明显统计学意义。B淋巴细胞转化的刺激剂为LPS,与M组比较,M-L组具有显著统计学意义(P<0.01),M-M组存在显著统计学意义(P<0.05),M-H组与M组差异无明显统计学意义。
2.3 AF对体外脾淋巴细胞增殖的影响 不同浓度AF对小鼠脾淋巴细胞增殖活性的影响,如图3所示。随着AF浓度的增加,脾淋巴细胞的增殖活性逐渐增强。与阴性对照组比较,AF浓度为6、8、10 μg/ml时,呈现极显著性(P<0.01)。
2.4 AF对小鼠腹腔巨噬细胞吞噬功能的影响 如表5所示,AF能显著促进小鼠腹腔巨噬细胞吞噬中性红。与对照组比较,AF浓度为6、8、10 μg/ml时,呈现极显著性(P<0.01)。AF浓度为4 μg/ml时,存在显著性(P<0.05)。
2.5 AF对小鼠血清中细胞因子TNF-α、IL-2的影响 如图4所示,与M组比较,N组血清中TNF-α含量显著上升(P<0.01),呈极显著性,M-L、M-M组血清中TNF-α含量升高(P<0.05),M-H组TNF-α含量与M组差异无统计学意义。与M组相比,M、M-L组血清中IL-2含量明显升高(P<0.05),M-M组IL-2含量升高(P<0.05),M-H组IL-2 含量与M组差异无统计学意义。
2.6 AF对小鼠特异性IgG抗体的影响 结果显示,M、M-L、M-M组小鼠获得的免疫应答良好,与M组小鼠比较,抗体水平极显著性提高(P<0.01),M-H组无明显变化,见图5。
表2 反转录加样体系
Tab.2 Reverse transcription reaction system

ReagentSampleadditionTotalRNA7.0μlPrimermix0.5μlRTenzymemix0.5μl5×RTbuffer2.0μlTotal10.0μl
表3 RT-PCR反应体系
Tab.3 Real-time PCR reaction system

ReagentSampleadditionSYBRgreenmix12.5μlH2O9.5μlF0.5μlR0.5μlTotal25.0μl
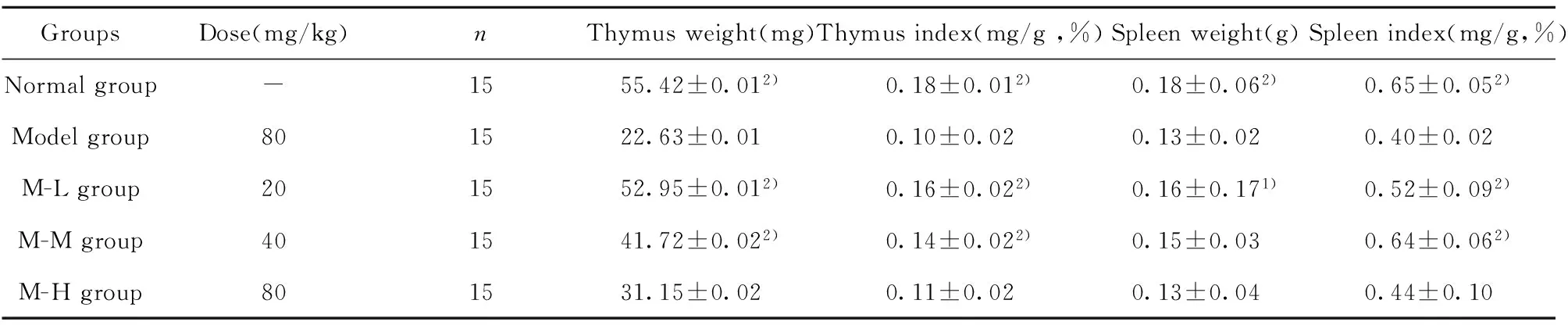
GroupsDose(mg/kg)nThymusweight(mg)Thymusindex(mg/g,%)Spleenweight(g)Spleenindex(mg/g,%)Normalgroup-1555.42±0.012)0.18±0.012)0.18±0.062)0.65±0.052)Modelgroup801522.63±0.010.10±0.020.13±0.020.40±0.02M-Lgroup201552.95±0.012)0.16±0.022)0.16±0.171)0.52±0.092)M-Mgroup401541.72±0.022)0.14±0.022)0.15±0.030.64±0.062)M-Hgroup801531.15±0.020.11±0.020.13±0.040.44±0.10
Note:1)P<0.05,2)P<0.01,compared with model.

图2 AF对小鼠脾淋巴细胞转化的影响Fig.2 Effect of AF on transformation of mouse spleen cellsNote: *.P<0.05,**.P<0.01,compared with model.

图4 AF对小鼠血清中细胞因子TNF-α 、IL-2的影响Fig.4 Effects of AF on serum TNF-α and IL-2 in miceNote: *.P<0.05,**.P<0.01,compared with model.



GroupsDosage(μg/ml)A540Increasingrate(%)Control-0.343±0.02-AF10.343±0.020.087AF20.343±0.030.117AF40.349±0.031)1.672AF60.405±0.052)18.17AF80.435±0.022)26.82AF100.472±0.032)37.52
Note:1)P<0.05,2)P<0.01,compared with normal.
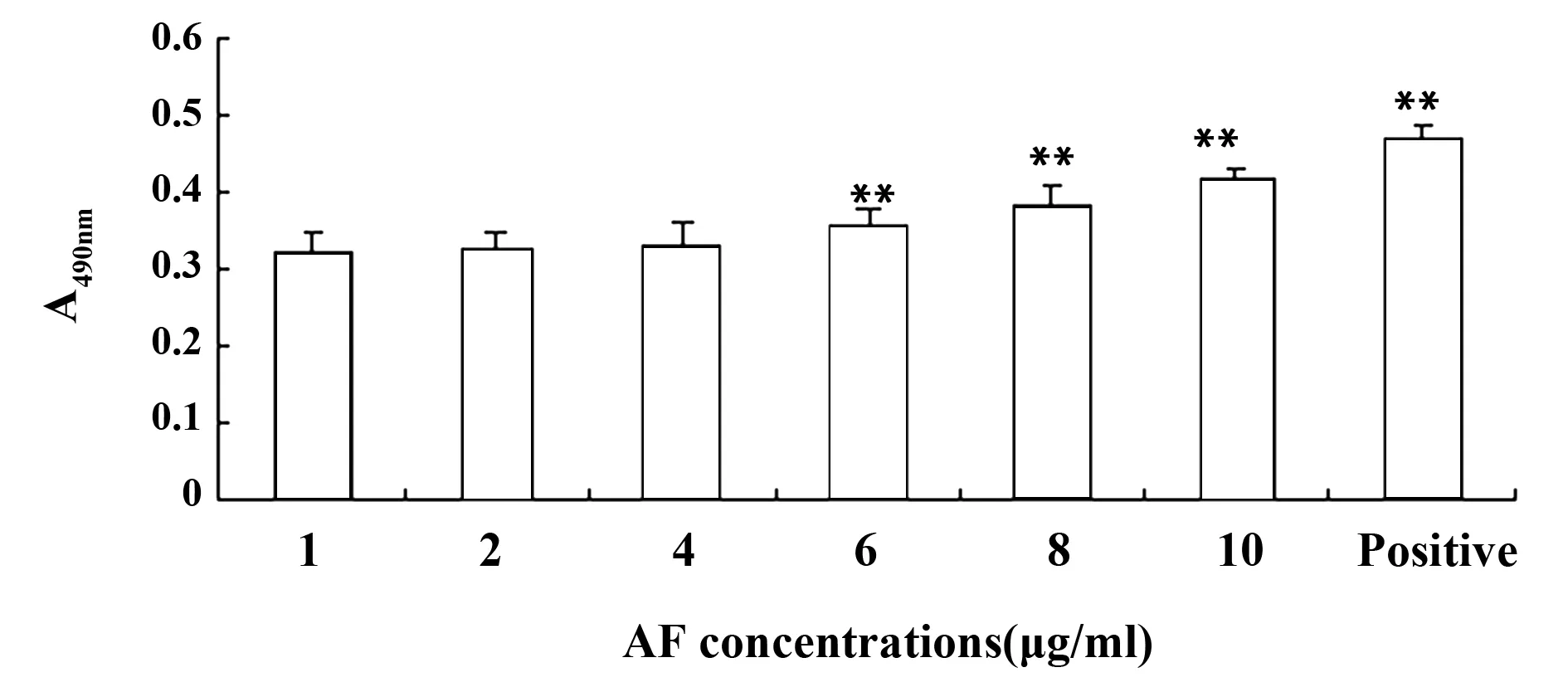
图3 AF对小鼠脾淋巴细胞增殖的影响Fig.3 Effect of AF on proliferation of mouse spleen cellsNote: **.P<0.01,compared with normal.

图5 AF对小鼠特异性IgG抗体的影响Fig.5 Effects of AF on serum IgG in miceNote: *.P<0.05,**.P<0.01,compared with model.
2.7 AF对小鼠脾脏组织中TNF-α、IL-2 mRNA表达的影响 荧光定量PCR结果显示,TNF-α、IL-2熔解曲线为单一峰,扩增曲线均为典型S型,基线平整。M-L组TNF-α、IL-2 mRNA表达分别为(7.73±0.16)、(10.63±0.34),M-M组TNF-α、IL-2 mRNA表达分别为(2.6±0.03),(5.43±0.23),显著高于M组[(1.83±0.72)、(2.45±0.02)](P<0.01、P<0.05),如图6。
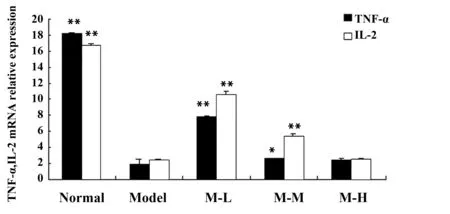
图6 AF对小鼠脾脏组织中TNF-α 、IL-2 mRNA表达的影响Fig.6 Effects of AF on TNF-α,IL-2 mRNA expression in miceNote: *.P<0.05,**.P<0.01,compared with model.
3 讨论
本研究显示,ICR小鼠给药28 d后,显著提高了免疫抑制小鼠脾脏及胸腺指数;M-L组显著促进脾淋巴细胞转化,体外脾淋巴细胞增殖,显著促进小鼠腹腔巨噬细胞吞噬功能;M-L、M-M组小鼠特异性IgG抗体明显高于M组;免疫抑制小鼠血清中,肿瘤坏死因子TNF-α及IL-2的含量显著提高。且通过实时荧光定量PCR检测,TNF-α及IL-2 mRNA水平明显增高。
本试验以体内给药研究方式结合实时荧光定量PCR等体外试验进行研究,结果表明,AF可减轻CTX造成的免疫器官萎缩现象。从免疫应答来看,本试验中免疫抑制AF低剂量组、免疫抑制AF中剂量组小鼠特异性IgG抗体水平明显高于免疫抑制模型组小鼠,Guy等[11]研究表明,特异性IgG抗体是血清主要的抗体成分,可清除有害补体片段,抑制炎症反应在机体免疫中起保护作用。本研究的IgG水平表明,AF能提高免疫抑制小鼠免疫应答能力。刘佳[12]和赵定亮[13]报道,IL-2能促进T、B淋巴细胞的增殖与分化,可诱导杀伤细胞(LAK)的产生。可以增强机体免疫监视功能。谭兵[14]和李卫[15]报道,TNF-α能够抵抗微生物入侵和调节机体免疫的功能。此次试验,用ELISA试剂法,检测出AF免疫抑制组小鼠血清中IL-2、TNF-α含量显著提高。同时,采用荧光定量PCR,检测TNF-α及IL-2 mRNA水平。以上试验结果表明,AF具有较强的免疫增强能力,能拮抗CTX免疫功能低下小鼠的免疫抑制作用。但本次试验,只是免疫研究中的一部分,应进一步探讨研究,以充分证实试验结果。
[1] 郑毅男,松浦幸永,韩立坤,等.红参中新化合物-精氨酸衍生物的分离与结构鉴定[J].药学学报,1996,31(3):191-195.
[2] Takaku T,Han LK,Kameda K,etal.Production of arginyl-frictosyl glucose during proce-ssing of red ginseng Tradit[J].Med,1996,13:118-123.
[3] Suzuki Y,Choi KJ,Uchida K,etal.Arginyl-fructosyl-glucose and arginyl-fructose compo-unds related to browning reaction in the model system of steaming and heat-drying processes for the preparation of red ginseng[J].J Ginseng Res,2004,28,143-148.
[4] Cho EJ,Piao XL,Jang MH,etal.The effect of steaming on the free amino acid contents and antioxidant activity of Panax ginseng[J].Food Chem,2008,107:876-882.
[5] Kim GN,Lee JS,Song JH,etal.In vitro and cellular antioxidant activity of arginyl-fructose and arginyl-fructosyl-glucose[J].Food Sci Biotechnol,2009,18(6),1505-1510.
[6] Keum YS,Park KK,Lee JM,etal.Antioxidant and anti-tumor promoting activities of the methanol extract of heat-processed ginseng[J].Cancer Lett,2000,150,41-48.
[7] 郑毅男,张 晶,奥田拓道,等.精氨酸衍生物对微循环的作用[J].吉林农业大学学报,1998, 20(4):45-47.
[8] Kwang-Hyoung L,Kyoung-Soo H,Sung-Hoon J,etal.Effect of long-term dietary arginyl-fructose (AF) on hyperglycemia and HbA1c in diabetic db/db mice[J].Mol Sci,2014,15,8352-8359.
[9] 李敏珍,何晓帆,曹治金,等.高丽参、西洋参、红参对小鼠免疫功能的影响比较[J].广西中医药,1989,12(5):52-55.
[10] Yool BC,Park GH,Okuda H,etal.Inhibitory effect of arginine-derivatives from ginseng extract and basic amino acids on protein-arginine N-methyltransferase[J].Amino Acids,1999,17:391-400.
[11] Guy B,Hessler C,Fourage S,etal.Systemic immunization with urease protects mice against Helicobacter pylori infection[J].Vaccine,1998,16(8):850-856.
[12] 刘 佳,单安山,孙进华.白细胞介素-2的研究进展与应用[J].黑龙江畜牧兽医,2009,21:57-61.
[13] 赵定亮,单风平.细胞介素-2最新研究进展[J].微生物学杂志,2013,33(4):77-79.
[14] 谭 兵,李瑜元,聂玉强.肿瘤坏死因子-α的研究进展[J].国际内科学杂志,2007,5(3):129-133.
[15] 李 卫,刘 佳,白家媛.α肿瘤坏死因子的研究进展[J].动物医学进展,2010,31(12):12-14.
[收稿2016-02-23 修回2016-04-25]
(编辑 许四平)
Protective effect of Aginyl-fructose immunosuppression in mice
SONGMing-Ming,WANGJia-Qi,HUANGBao-Liang,GAOMing-Tong,LIJing-Yu,DINGChuan-Bo,ZHENGYi-Nan,LIUWen-Cong,XUXiao-Hua.
JilinAgriculturalUniversity,Changchun130118,China
Objective:To study the effect of AF on mice induced by cyclophosphamide.Methods: 100 ICR mice were divided into 5 groups randomly,the normal contral group(N),immunosuppressive model group(M),AF low-dose group(M-L,20 mg/kg),AF middle-dose group(M-M,40 mg/kg),AF high-dose group(M-H,80 mg/kg).Drugs were chronically administered to mice for 28 days,dosage of administration was 10 ml/kg of the mice′s weight.The groups of M,M-L,M-M,M-H received an injection of cyclophosphamide (CTX,80 mg/kg) three times a week to cause immunosuppressive.Organ idex,splenic lymphocyte transformation,phagocytic function,IgG,IL-2,TNF-α were conducted 12 hours after the last administration in mice of each group.Results: AF could improve the thymus index and spleen index in mice significantly,promoting the natural transformation and proliferation of splenic lymph-ocytes,adding phagocytic function,AF could improve the content of IgG,IL-2,TNF-α in serum significantly.The result of Real-time fluorescence quantitative PCR show that TNF-α mRNA,IL-2 could be well expressed.Conclusion: AF can inhibit hypoimmunologic mice induced by CTX.
Arginyl-fructosyl;ICR mice;Immune;Fluorogenic quantitative PCR
10.3969/j.issn.1000-484X.2017.03.006
①本文受吉林省自然科学基金(20160101017JC)、吉林大学生创业资金项目(20160521011HJ)和延边州科技发展计划项目(2015JH01)资助。
宋明铭(1991年-),女,硕士,主要从事为中药新药研究与开发方面的研究,E-mail:15144090081@163.com。
及指导教师:刘文丛(1968年-),男,博士,教授,主要从事中药新药研究与开发方面的研究,E-mail:jwlw6803@126.com。 徐晓华(1968年-),女,副主治医师,主要从事糖尿病肾病方面的研究,E-mail:xuxiaohua681002@qq.com。
R151.3
A
1000-484X(2017)03-0347-05
