壳聚糖的纳米载体应用于口服蛋白类药物/疫苗递送的研究❋
2017-04-10夏桂雪包子娴程晓杰陈西广
高 萍, 夏桂雪, 包子娴, 刘 雅, 程晓杰, 孔 明, 冯 超, 陈西广
(中国海洋大学海洋生命学院,山东 青岛 266003 )
壳聚糖的纳米载体应用于口服蛋白类药物/疫苗递送的研究❋
高 萍, 夏桂雪, 包子娴, 刘 雅, 程晓杰, 孔 明, 冯 超, 陈西广❋❋
(中国海洋大学海洋生命学院,山东 青岛 266003 )
近年来,细菌性和病毒性的传染性疾病已成为制约水产鱼类养殖业发展的瓶颈。口服免疫因其对鱼体操作方便、无损失、不受时间地点及鱼体大小的限制近年来得到了广泛的关注。然而口服免疫因疫苗在通过鱼的胃肠道时易被消化酶降解,导致免疫效率低下。因此,随着纳米技术的迅速发展,基于壳聚糖的纳米载体与水产疫苗的有效结合在鱼类口服免疫领域越来越受到重视。本文利用离子交联法和聚电解质凝聚法分别合成了壳聚糖纳米粒(CS-NPs)和壳聚糖/羧甲基壳聚糖复合纳米粒(CS/CMCS-NPs),其平均粒径分别为(178 ± 6.27)和(255 ± 7.54 )nm,zeta电位分别为(+16.4 ± 0.51)和(+15.9 ± 0.37 )mV。纳米粒对模式蛋白药物牛血清白蛋白(BSA)的包封率分别为(42.9 ± 1.2)% 和(59.4 ± 3.2)%。红细胞溶血试验及MTT试验表明相较于CS-NPs,CS/CMCS-NPs具有更好的生物相容性。以荧光染料Cy5.5对纳米载体进行了荧光标记来评价Caco-2细胞对荧光纳米载体的摄取,结果表明,在一定浓度和时间范围内,Caco-2细胞对纳米粒的摄取存在一定的浓度依赖性和时间依赖性。为了研究纳米载体所包载的蛋白类药物在大菱鲆体内的分布情况,以FITC对BSA进行荧光标记,口服灌胃大菱鲆36 h后,对于FITC-BSA:CS-NPs组,荧光药物主要分布在肝脏和前肠中;对于FITC-BSA:CS/CMCS-NPs组,荧光药物主要分布在后肠、肝脏和脾脏中;作为对照组的FITC-BSA组,在肝脏中的荧光分布最强,由此可见,CS/CMCS-NPs能够更有效的保护药物到达大菱鲆的后肠,有望成为一种安全有效的口服蛋白疫苗运送载体。
壳聚糖纳米载体;口服免疫;牛血清白蛋白;大菱鲆
中国是世界最大的水产鱼类养殖国,其养殖产量占世界的61.7%。然而,随着水产养殖环境的急剧恶化,细菌性和病毒性的传染性疾病已成为制约水产养殖业发展的瓶颈。疫苗免疫可以诱导鱼体内产生特异性免疫反应,进而增强鱼体抵抗疾病的能力。因此,通过疫苗免疫的方法获得持久性的预防性免疫保护已获得了广泛的关注。与传统的疫苗相比,新型疫苗具有安全性更好、免疫效率更高等优点[1]。其主要类型有亚单位疫苗、基因工程疫苗、合成肽疫苗和DNA疫苗等。蛋白类抗原因其具有较强的免疫原性进而诱导特异性免疫反应而受到研究者的极大关注[2-3]。
目前,鱼类的接种方法主要有3种,分别为注射、口服和浸浴。根据鱼类自身的特点,口服免疫因其对鱼体操作方便、无损失、不受时间地点及鱼体大小的限制及减少对环境的污染等优点得到了广泛的关注[4]。但口服免疫也有一些缺点,其免疫效率相对较低。原因为疫苗在通过鱼的消化道时会被胃中的消化酶降解,失去免疫原性,因此导致疫苗的免疫效率低下。为了保护疫苗免遭破坏,可用于口服的安全有效的载体包载抗原是一种有效的方法[5]。在过去的几十年,纳米技术被广泛的用于药物和疫苗学[6-7],呈现指数增长的模式,应运产生了纳米疫苗(Nanovaccinology)[8]。纳米载体可以有效的保护抗原以防止在胃肠道中被降解、延长抗原在胃肠道中的停留时间以及增强抗原被肠道相关淋巴组织的摄取等。甲壳素是自然界中天然存在的含量仅次于纤维素的第二大类多糖,壳聚糖是甲壳素脱N-乙酰基后的一种阳离子聚合物[9]。壳聚糖纳米载体因其良好的生物可降解性、生物相容性和无毒性而在医药领域得到了广泛的应用[10-12]。据报道,鱼类胃中的pH环境可达2.0,前肠的pH为4.5左右,后肠的pH可达8.5~9.0[13]。而研究表明鱼类后肠部位分布有更多与免疫相关的淋巴细胞,因此纳米载体如何有效的保护抗原达到鱼类的后肠是开发新载体首先要考虑的重要因素。
本文以壳聚糖(CS)及其水溶性的羧甲基壳聚糖(CMCS)为原料,制备了壳聚糖/羧甲基壳聚糖纳米载体(CS/CMCS-NPs)用于口服疫苗的递送,评价了纳米粒的生物相容性及细胞摄取率,并以牛血清白蛋白(BSA)作为模式蛋白进行了载药纳米粒相关性质的研究及药物在大菱鲆体内的分布,以探讨该纳米载体作为蛋白类疫苗口服输送载体的可行性。
1 材料与方法
1.1 纳米载体的制备
1.1.1 CS纳米载体(CS-NPs)的制备 采用离子交联的方法制备了CS-NPs。三聚磷酸钠(TPP)作为交联剂。将壳聚糖(分子量MW: 150 kDa, 脱乙酰度DD: 92%)溶于0.1 mol/L醋酸溶液中得到CS浓度为1 mg/mL,调节CS溶液至pH=5.0。在室温和磁力搅拌的条件下,将浓度为 1 mg/mL TPP溶液缓慢逐滴加入到CS溶液(V∶V = 6∶1)中,直至出现白色乳光,在滴加过程中不断的搅拌,反应进行2 h,得到CS-NPs。
1.1.2 CS与CMCS复合纳米载体(CS/CMCS-NPs)的制备 采用聚电解质凝聚的方法制备CS/CMCS-NPs[14]。将1 mL TPP溶液逐滴滴入5 mL CS溶液中,边滴加边搅拌1 h,在室温和磁力搅拌的条件下,将浓度为0.5 mg/mL的4 mL CMCS溶液(分子量为170 kDa,羧甲基取代度DS 92%)滴加入上述混合溶液中,得到CS/CMCS-NPs。
1.2 纳米载体的表征
1.2.1 平均粒径和zeta电位 利用动态光散射的方法通过激光粒度仪测定了BSA:CS-NPs和BSA:CS/CMCS-NPs的平均粒径和zeta电位。检测波长633 nm,检测角为90°,每个样品测三次重复。
1.2.2 透射电镜(TEM)观察 通过透射电镜观察BSA:CS-NPs和BSA:CS/CMCS-NPs的形态。分别将两种纳米悬液滴加至铜网上,滤纸吸干表面液体,干燥,于透射电镜下观察纳米粒的形态。
1.3 包载BSA的纳米粒的制备及包封率的计算
1.3.1 包载BSA的纳米粒的合成 BSA:CS-NPs的制备参照CS-NPs的合成方法。CS溶液与BSA溶液(1 mg/mL)的体积比6∶4。BSA:CS/CMCS-NPs的合成方法参照CS/CMCS-NPs的合成法。将4 mL 1 mg/mL的BSA溶液与4 mL CMCS溶液混合均匀,后将CS醋酸溶液缓慢逐滴加入上述溶液中,在室温和磁力搅拌的条件下,逐滴加入TPP,继续搅拌2 h。
1.3.2 包封率的计算 纳米粒对BSA的包封率和载药量进行了测定,方法如下:取新制备的包载BSA的纳米粒悬液2 mL于离心管中,18 000 r/s,4 ℃离心30 min,取上清液,用BCA试剂盒(北京索莱宝科技有限公司)检测其中的BSA的含量。按照以下公式计算纳米颗粒载BSA的包封率(Encapsulation efficiency,EE)和载药量(Loading content,LC)。
EE(%)=

1.4 纳米载体的生物相容性检测
1.4.1 血液相容性 大菱鲆(50~60g,青岛忠海水产有限公司)采用尾椎静脉取血的方法,采集得到的血液收集于抗凝管中,加入等体积的0.9% 生理盐水混匀,于4 ℃ 1 000r/s离心10min,弃上清液,加入0.9% 生理盐水配制红细胞悬液至终浓度为0.5 % (V/V) 。分别取新制备的100μL红细胞悬液加入到不同浓度的(1mg/mL,2mg/mL)CS和CS/CMCS纳米悬液中,于37 ℃恒温振荡器震荡1h后,1 000r/s离心10min。取上清液于545nm波长测定吸光值(OD)。溶血率(Hemolysisrate,HR%)计算公式如下:
其中:ODP为阳性对照组吸光度值;ODN为阴性对照组吸光度值;ODs为材料组吸光度值。
1.4.2 细胞相容性 噻唑蓝比色法(MTT法)是目前应用最广泛的检测细胞生长和增殖的方法,常被用于材料对细胞的毒性检测等。利用MTT法(美国Sigma公司)评价了不同浓度(0.125、0.25、0.5 和1mg/mL)的CS-NPs和CS/CMCS-NPs对结肠癌细胞(Caco-2,青岛大学医学院附属医院中心实验室提供)的细胞毒性。
1.5 荧光纳米载体的细胞摄取
以分子药物荧光标记为代表的荧光标记技术,为示踪细胞对纳米载体的摄取及定量研究提供了便利。以荧光染料Cy5.5(北京泛博生物化学有限公司)对CS进行了标记。成功制备了Cy5.5-CS和Cy5.5-CS/CMCS纳米颗粒。
1.5.1Caco-2细胞对荧光纳米载体摄取的激光共聚焦显微镜观察 细胞对纳米粒摄取的定量检测参照Khin等[15]的方法。将细胞密度约为 5×104/mL的Caco-2细胞接种于无菌激光共聚焦专用培养皿中培养24h,加入2mL新鲜配制的Cy5.5-CS和Cy5.5-CS/CMCS纳米悬液(0.5mg/mL,D-Hank’s缓冲液作为溶剂),分别培养1、2、4h。到预设的时间,用D-Hank’s缓冲液(Hyclone公司)轻微冲洗细胞单层3次,加入DAPI工作液(北京索莱宝科技有限公司)继续孵育15min后用D-Hank’s缓冲液洗涤细胞3次,每个培养皿中加入1mLD-Hank’s缓冲液,通过激光共聚焦扫描显微镜(德国Zeiss公司)观察对荧光纳米粒的吞噬。
1.5.2Caco-2细胞对荧光纳米粒摄取的定量测定 将细胞接种于96孔细胞培养板中,培养细胞24h后,加入新配制的D-Hank’s缓冲液梯度稀释Cy5.5-CS和Cy5.5-CS/CMCS纳米悬液(浓度分别为50、100、200μg/mL),每个浓度设置5个复孔,每孔200μL。分别培养1、2和4h后,用荧光酶标仪(Ex/Em= 673/692nm)检测细胞的荧光强度。根据以下公式计算细胞对荧光纳米颗粒的细胞摄取率:
其中:Wsample为细胞摄取的Cy5.5的含量;Wtotal为96孔板中所加入的Cy5.5的总含量。
1.6 荧光药物在组织中的分布
为了探究CS/CMCS-NPs作为口服蛋白抗原载体的可行性,以FITC(美国Sigma公司)对模式蛋白药物BSA进行了荧光标记,合成了FITC-BSA:CS-NPs和FITC-BSA:CS/CMCS-NPs。将健康的大菱鲆随机分为3组,分别用无菌灌喂针灌喂大菱鲆500μLFITC-BSA:CS纳米悬液(15μgFITC-BSA/ 每克鱼)和FITC-BSA:CS/CMCS-纳米悬液(15μgFITC-BSA/ 每克鱼)。对照组灌喂500μLFITC-BSA。对大菱鲆进行口服灌喂36h后,将其置于冰上5min,用解剖剪解剖大菱鲆,分离出心脏、肝脏、脾脏、肠和肾脏等器官,利用小动物活体成像系统观察各器官中的荧光强度。另一部分离体的心脏、肝脏、脾脏、前肠、后肠和肾脏等器官吸干表面的血迹后,称重,将组织置于5mL离心管中,加入2mL含0.1mol/LTris-HCl,2mmol/LEDTA和0.1 %TritonX-100的缓冲液(pH=7.4)中研磨均匀,静置10min使组织充分裂解。将组织匀浆于 5 000r/s匀浆15min,取上清用荧光酶标仪(Ex/Em= 475/525nm)测定各组织中的荧光强度。
2 结果与分析
2.1 纳米载体的制备与表征
CS-NPs和CS/CMCS-NPs的平均粒径、zeta电位及粒径分布系数见表1所示。CS/CMCS-NPs的粒径大于CS-NPs的粒径,表明CMCS的引入使得纳米粒的粒径增大。与CS-NPs相比,CS/CMCS-NPs具有更小的多分散系数,zeta电位的绝对值更高,表明CS/CMCS-NPs的分散性更加均一,结构更稳定。纳米粒的透射电镜图(见图1)也证明此观点。透射电镜如图1所示。

表1 CS-NPs 和 CS/CMCS-NPs的平均粒径、多分散系数和zeta电位Table 1 Mean particle size, polydispersity index (PDI) and zeta potential of CS-NPs and CS/CMCS-NPs
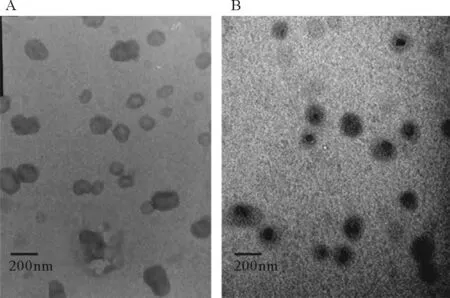
图1 CS-NPs (A)和CS/CMCS-NPs (B)的透射电镜图
2.2 载药纳米粒的性质研究及包封率的计算
BSA:CS-NPs和BSA:CS/CMCS-NPs的平均粒径,PDI和zeta电位及包封率如表2所示。可以看出,CMCS的加入增大了BSA:CS/CMCS-NPs平均粒径,BSA:CS-NPs和BSA:CS/CMCS-NPs两种纳米粒的zeta电位的绝对值均大于15,表明纳米粒具有相对稳定的结构。BSA:CS-NPs对BSA的包封率和包载量分别为42.9%和12.8%,而BSA:CS/CMCS对BSA的包封率和包载量分别为59.4% 和18.5%,均高于CS-NPs的包封率和载药量,可见CMCS的加入,提高了纳米载体对药物的包封率和载药量。

表2 BSA:CS-NPs 和 BSA:CS/CMCS-NPs的平均粒径、多分散系数和zeta电位、包封率和包载量
2.3 纳米载体的生物相容性检测
2.3.1 血液相容性检测 溶血是指红细胞破裂溶解的现象。导致溶血的因素有很多。纳米颗粒进入机体后,与血液中的红细胞或血浆蛋白相互作用,可能导致溶血现象的发生。国际对安全的生物材料在溶血率方面的要求为溶血率低于5%[16]。不同浓度的CS-NPs和CS/CMCS-NPs对红细胞的溶血情况见表3所示。低浓度组(1mg/mL)的CS-NPs和CS/CMCS-NPs与红细胞作用1h后的溶血率分别为(1.96 ± 0.07)% 和(1.55 ± 0.08)%,低于高浓度(2mg/mL)CS-NPs和CS/CMCS-NPs的红细胞溶血率(3.29 ± 0.08)% 和(2.53 ± 0.06)% 。同时,对于相同的浓度组,CS-NPs对红细胞的溶血率高于CS/CMCS-NPs的溶血率,表明CS/CMCS-NPs具有更好的血液相容性。但2种纳米粒对红细胞的溶血率仍低于5 %,符合对生物材料的安全标准。

表3 CS-NPs 和 CS/CMCS-NPs的溶血率
2.3.2 细胞相容性检测 不同浓度(0.125、0.25、0.5、1mg/mL)的CS-NPs和CS/CMCS-NPs在24、48和72h对细胞的毒性影响如图2所示。CS/CMCS-NPs实验组细胞的增长率高于90%,CS-NPs处理组细胞的增值率高于80%,相对于CS-NPs,经CS/CMCS-NPs处理的实验组对细胞的增殖影响更小。根据ISO10993-5 手册中关于MTT细胞毒性检验中的规定,当材料与细胞共孵育24h后,经材料处理的细胞增殖率低于70%, 则认为该材料具有潜在的细胞毒性[17]。因此,CS-NPs(见图2A) 和CS/CMCS-NPs(见图2B)对Caco-2均没有细胞毒性,相较于CS-NPs,CS/CMCS-NPs具有更好的细胞相容性。

图2 CS-NPs(A)和 CS/CMCS-NPs(B)对Caco-2细胞的细胞毒性Fig.2 In vitro cytotoxicity of CS-NPs(A)and CS/CMCS-NPs in Caco-2 cells
2.4Caco-2细胞对荧光纳米载体的摄取
2.4.1Caco-2 细胞对荧光纳米粒摄取的激光共聚焦显微镜观察 为了模拟肠道细胞对纳米粒的摄取,以Caco-2 细胞为模型,分别将200μg/mL的Cy5.5-CS-NPs(见图3A) 和Cy5.5-CS/CMCS-NPs(见图3B)与细胞共孵育1、2、4h,用激光共聚焦显微镜观察纳米粒在细胞内的分布,如图3所示。图中蓝色的荧光为DAPI,所染部位为细胞核,红色荧光为Cy5.5所标记的纳米粒,2种纳米粒处理组中细胞中均可观察到红色的荧光,随时间的延长,红色荧光逐渐的由细胞的表面扩散至细胞质中,且荧光强度随着时间的延长而增强,表明随时间的延长,有更多的纳米颗粒被细胞吞噬,是一个时间依赖性的过程。
2.4.2Caco-2 细胞对荧光纳米粒摄取的定量测定
2.4.2.1 纳米粒的浓度对细胞摄取的影响 测定了不同浓度(50、100、200μg/mL)的Cy5.5-CS-NPs和Cy5.5-CS/CMCS-NPs在与Caco-2细胞共孵育4h后的细胞摄取率,如图4所示。图中可以看出,在相同的时间内,随着纳米粒浓度的增大,Caco-2对纳米粒的摄取率逐渐的增大。共孵育4h后,低浓度组(50μg/mL)的Cy5.5-CS-NPs和Cy5.5-CS/CMCS-NPs的细胞摄取率分布为1.25% 和1.20%,而高浓度组的细胞吞噬率分别为4.08% 和4.78%,说明Cy5.5-CSNPs和Cy5.5-CS/CMCSNPs的细胞摄取率有一定的浓度依赖性。
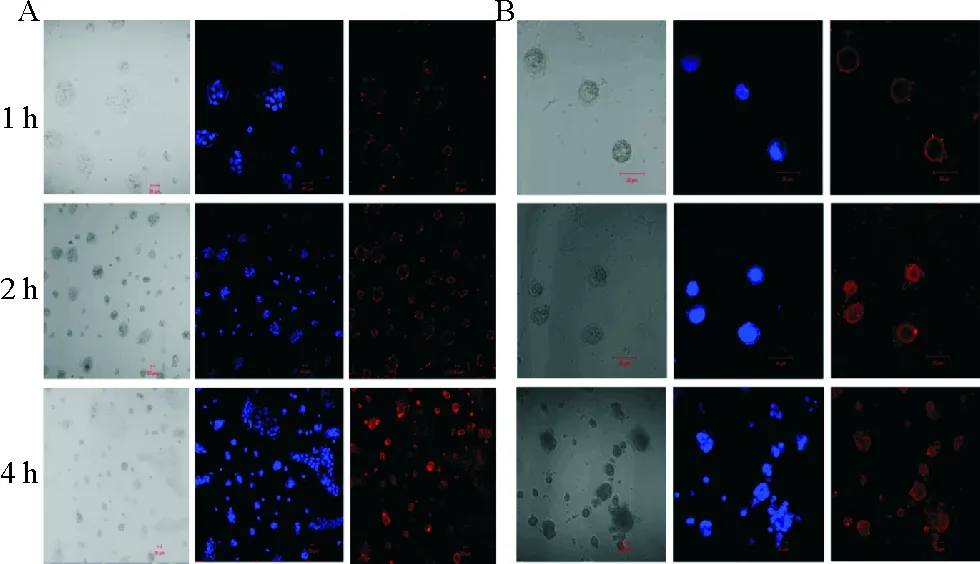
图3 Caco-2细胞在不同时间内(1 、2 、4 h)对浓度为200 μg/mL 的Cy5.5-CS-NPs(A)和Cy5.5-CS/CMCS-NPs(B)的摄取(37 ℃)

图4 Caco-2 细胞对不同浓度的Cy5.5-CS-NPs 和Cy5.5-CS/CMCS-NPs的摄取率
2.4.2.2 培养时间对细胞摄取的影响 在纳米粒与Caco-2细胞共孵育1、2、4h后,细胞对浓度为200μg/mL的Cy5.5-CS-NPs和Cy5.5-CS/CMCS-NPs的摄取情况如图5所示。可见,在一定的浓度范围内,随着时间的延长,Caco-2细胞对2种纳米粒的摄取率逐渐的增大。

图5 Caco-2细胞与纳米粒共孵育时间(1、2、4 h)对细胞摄取率的影响
2.5 口服载药荧光纳米颗粒在大菱鲆体内的组织分布
为了示踪蛋白药物在大菱鲆肠道内的分布,以FITC-BSA为模式蛋白,利用小动物活体成像系统实时监测了FITC-BSA在大菱鲆体内的分布情况。如图6所示,在口服灌胃12h后,FITC-BSA在胃肠道中均有分布,随着时间的延长,36h后,大菱鲆胃肠中的荧光信号减弱。

图6 口服FITC-BSA溶液36 h后在大菱鲆体内的分布
2.5.1 载药荧光纳米粒的组织分布的定性检测 为了检测载药荧光纳米粒在机体内的渗透效果,对大菱鲆口服灌胃FITC-BSA:CS和FITC-BSA:CS/CMCS纳米悬液36h后处死大菱鲆,取心脏、肝脏、脾脏、肠和肾脏在小动物活体成像系统观察FITC-BSA在大菱鲆体内的分布情况,结果如图7所示。图中可以看出,PBS对照组没有检测到明显的荧光信号,FITC-BSA:CS/CMCS-NPs组在后肠中检测到明显的荧光信号,FITC-BSA:CS-NPs组检测到相对较弱的荧光信号,而FITC-BSA实验组在肠道无明显的荧光信号。

图7 体内荧光成像观察FITC-BSA在大菱鲆组织中的分布
2.5.2 载药荧光纳米粒的组织分布的定量检测 口服灌胃FITC-BSA:CS和FITC-BSA:CS/CMCS纳米悬液36 h后,将大菱鲆处死,取出心脏、肝脏、脾脏、前肠、后肠和肾脏,称重后进行组织匀浆,离心取上清液,用荧光酶标仪检测各组织上清液中的荧光强度(见图8)。对于FITC-BSA:CS-NPs和FITC-BSA:CS/CMCS-NPs组,口服纳米颗粒36 h后,荧光纳米颗粒主要分布在肠道、肝脏,而对于没有载体包载的FITC-BSA组,荧光纳米颗粒主要分布肝脏等。原因为纳米颗粒经口服进入大菱鲆的机体,由于壳聚糖的纳米颗粒具有一定的黏膜粘附性,36 h后大菱鲆肠道中仍然分布着较高剂量的纳米颗粒。对于FITC-BSA:CS-NPs组,载药荧光纳米粒主要分布在肝脏和前肠中,其分布含量由大到小的顺序为肝脏>前肠>脾脏>肾脏>后肠。而对于FITC-BSA:CS/CMCS-NPs组,荧光纳米粒主要分布在后肠、肝脏和脾脏中,其分布顺序为后肠>肝脏>脾脏>肾脏。作为对照组的FITC-BSA组,在肝脏中的荧光强度最强,其顺序为肝脏>心脏>肾脏。
3 讨论
近年来,在水产鱼类病害防治领域,口服免疫因其操作简单并且可以诱导粘膜免疫和系统免疫等优点而引起了广泛的关注。然而高效的蛋白类、多肽类的疫苗在口服接种的过程中由于恶劣的胃肠环境易导致疫苗的失活或降解,限制了口服免疫的应用范围。随着纳米技术在药物及免疫学领域的应用,纳米输送载体成为该领域的研究热点。纳米载体具有一些良好的性质,使其在口服免疫方面具有一定的优越性,例如对药物或疫苗的可控性缓释,可以延长药物或疫苗的作用时间;有效的保护药物或疫苗防止被降解或破坏,提高疫苗的稳定性。研究表明鱼类的后肠相较于前肠分布有更多与免疫相关的淋巴组织[13, 18-19],因此选择一种功能化的纳米载体对疫苗进行有效包载保护其到达鱼类的后肠并且增强疫苗透黏膜的能力是增强免疫反应的重要因素。

图8 口服纳米颗粒后大菱鲆各组织中荧光药物的分布
通过离子交联法和聚电解质凝聚法分别制备了纳米载体CS-NPs和CS/CMCS-NPs,该方法制备工艺简单,反应条件温和。CS是一种天然的阳离子聚合物,在酸性环境中,分子中的-NH2基团发生质子化作用带正电,可以与带负电的TPP交联成纳米球。CMCS分子链上有大量的羧甲基基团,其解离常数pKa为2.0~4.0,在pH=5.0的环境中带负电荷,可以与带正电的CS发生静电作用而成纳米粒。同时,交联剂TPP的加入使得CS/CMCS复合纳米粒的结构更稳定。研究表明,pH 对包载药物的纳米粒的平均粒径具有重要的影响,本研究中,当溶液pH 接近5时,具有最小的平均粒径。原因可能为BSA的等电点为4.7左右,在接近或超过BSA的等电点时,TPP和BSA表面带有较多的负电荷,更易于和带正电的壳聚糖进行交联,因此,形成更紧实的纳米颗粒,粒径更小。同时,颗粒的形状是影响抗原呈递细胞如树突细胞对抗原吞噬效率的重要因素。原因为树突细胞对颗粒的吞噬效率与两者接触面的固有形态密切相关。与蠕虫状颗粒相比,球形的颗粒具有更强的细胞吞噬效率[20]。图中CS/CMCS-NPs复合纳米粒具有更好的球形形态,分散良好。
利用溶血试验和MTT试验分别评价了CS-NPs和CS/CMCS-NPs的生物相容性,溶血试验表明对于相同的浓度组,CS-NPs对红细胞的溶血率高于CS/CMCS-NPs的溶血率,但溶血率仍低于5%。MTT毒性实验检测不同浓度的纳米粒对Caco-2细胞的增值率的影响,纳米粒在0.125~1 mg/mL的范围内,对细胞的增值率没有显著的影响,但相对于CS-NPs,CS/CMCS-NPs具有更好的细胞相容性。结合溶血试验,表明CS/CMCS-NPs具有良好的生物相容性。
纳米粒的浓度对细胞摄取的影响表明,在一定浓度范围内,纳米粒的浓度与细胞的摄取率存在正比例关系。研究表明,细胞对壳聚糖的纳米粒的摄取主要是通过纳米粒子表面的正电荷与细胞膜表面的负电荷的静电作用非特异性的被细胞摄取[21]。而这种非特异性的内吞作用取决于纳米粒子表面的电荷密度与细胞膜上的负电荷的密度,当纳米粒在低浓度与细胞作用时,细胞的摄取量与纳米粒浓度成正比;当纳米粒浓度增大到一定程度后,其相对摄取率减小,原因可能为细胞对纳米粒的摄取量逐渐达到饱和状态。时间对细胞摄取的影响表明,在一定的浓度范围内,随着时间的延长,Caco-2细胞对两种纳米粒的摄取率逐渐的增大。细胞在最初的2 h内对纳米颗粒的摄取速度最快,随时间的延长,摄取速度逐渐的减慢,共孵育6 h后,摄取速度基本不变。原因可能为细胞对纳米颗粒的摄取与外排达到了动态平衡的状态,而本研究中,Caco-2细胞与纳米颗粒共孵育4 h内,细胞对纳米粒的摄取率与培养时间存在一定的正比例关系,说明细胞对纳米粒的摄取还未达到饱和。
载药荧光纳米粒的组织分布的定性检测表明,口服灌喂大菱鲆36 h后,不同的实验组荧光药物的分布差异较大。相对于CS-NPs载体,CS/CMCS-NPs载体在肠道中具有更广泛的pH响应性,因此在后肠碱性环境中具有更强的稳定性,可以保护FITC-BSA到达大菱鲆的后肠,防止在前肠中被上皮细胞吞噬。而后肠中分布着的大量的与免疫反应密切相关的淋巴细胞。在后肠中,随着pH的增大,具有pH响应的CS/CMCS 纳米粒结构逐渐崩解,逐渐释放出FITC-BSA,但是由于后肠中的蛋白酶比前肠相对少,松散的纳米粒被吸附到后肠表面,通过淋巴循环到达脾和肾等主要的免疫器官,因此在脾脏和肾脏中分布有较多的荧光药物。对于CS-NPs组,由于其在碱性环境中的不稳定,在前肠中对FITC-BSA释放的较快。而对于无载体包载的FITC-BSA,容易被前肠中的酶降解为氨基酸,进入血液中,而没有进入淋巴循环。因此,最多量的荧光药物分布在肝脏中,原因为肝脏是解毒和代谢的器官,而在脾脏和肾脏免疫器官中的分布极微量。
综上,本研究表明了制备的纳米粒的球形完整,分布较均一,并且CS/CMCS-NPs具有良好的生物相容性。纳米载体CS/CMCS-NPs对BSA具有较高的包封率,并且可以保护所包载的药物到达鱼类的后肠,因此,该纳米颗粒有望成为一种安全有效的口服疫苗运送载体。本研究中,以BSA作为模式蛋白药物对纳米载体进行了相关的评价,然而,蛋白类及多肽类疫苗的分子量更大、结构更复杂,我们将在以后的研究中进一步探讨。
[1] Leong J, Anderson E, Bootland L, et al. Fish vaccine antigens produced or delivered by recombinant DNA technologies[J]. Developments in Biological Standardization, 1996, 90: 267-277.
[2] Jiang T, Singh B, Li HS, et al. Targeted oral delivery of BmpB vaccine using porous PLGA microparticles coated with M cell homing peptide-coupled chitosan[J]. Biomaterials, 2014, 35(7): 2365-2373.
[3] Zhang L, Zeng Z, Hu C, et al. Controlled and targeted release of antigens by intelligent shell for improving applicability of oral vaccines[J]. Biomaterials, 2016, 77: 307-319.
[4] Duff D. The oral immunization of trout againstBacteriumsalmonicida[J]. Journal of Immunology, 1942, 44(1): 87-94.
[5] Liu Y, Cheng XJ, Dang QF, et al. Preparation and evaluation of oleoyl-carboxymethy-chitosan (OCMCS) nanoparticles as oral protein carriers[J]. J Mater Sci Mater Med, 2012, 23(2): 375-384.
[6] Wu M, Dong H, Guo K, et al. Self-assemblied nanocomplexes based on biomimetic amphiphilic chitosan derivatives for protein delivery[J]. Carbohydrate Polymers, 2015, 121: 115-121.
[7] Li N, Peng L-H, Chen X, et al. Antigen-loaded nanocarriers enhance the migration of stimulated Langerhans cells to draining lymph nodes and induce effective transcutaneous immunization[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2014, 10(1): 215-223.
[8] Mamo T, Poland GA. Nanovaccinology: The next generation of vaccines meets 21st century materials science and engineering[J]. Vaccine, 2012, 30(47): 6609-6611.
[9] Jollès P, Muzzarelli RA. Chitin and Chitinases [M]. Birkhäuser Verlag AG, 1999.
[10] Liu Y, Kong M, Feng C, et al. Biocompatibility, cellular uptake and biodistribution of the polymeric amphiphilic nanoparticles as oral drug carriers[J]. Colloids and Surfaces B: Biointerfaces, 2013, 103: 345-353.
[11] Feng C, Sun G, Wang Z, et al. Transport mechanism of doxorubicin loaded chitosan based nanogels across intestinal epithelium[J]. Eur JPharm Biopharm, 2014, 87(1): 197-207.
[12] Muzzarelli RA. Chitins and chitosans as immunoadjuvants and non-allergenic drug carriers[J]. Marine Drugs, 2010, 8(2): 292-312.
[13] Rodrigues A P, Hirseh D, Figueiredo H C P, et al. Production and characterisation of alginate microparticles incorporating Aeromonas hydrophila designed for fish oral vaccination[J]. Process Biochemistry, 2006, 41(3): 638-643.
[14] Feng C, Wang Z, Jiang C, et al. Chitosan/o-carboxymethyl chitosan nanoparticles for efficient and safe oral anticancer drug delivery: In vitro and in vivo evaluation[J]. Int J Pharm, 2013, 457(1): 158-167.
[15] Win K Y, Feng S S. Effects of particle size and surface coating on cellular uptake of polymeric nanoparticles for oral delivery of anticancer drugs[J]. Biomaterials, 2005, 26(15): 2713-2722.
[16] Avadi M R, Sadeghi A M, Mohammadpour N, et al. Preparation and characterization of insulin nanoparticles using chitosan and Arabic gum with ionic gelation method[J]. Nanomedicine, 2010, 6(1): 58-63.
[17] Bonferoni M, Rossi S, Ferrari F, et al. A modified Franz diffusion cell for simultaneous assessment of drug release and washability of mucoadhesive gels[J]. Pharmaceutical Development and Technology, 1999, 4(1): 45-53.
[18] Zhang L, Zeng Z, Hu C, et al. Controlled and targeted release of antigens by intelligent shell for improving applicability of oral vaccines[J]. Biomaterials, 2016, 77: 307-319.
[19] Pirarat N, Pinpimai K, Rodkhum C, et al. Viability and morphological evaluation of alginate-encapsulated Lactobacillus rhamnosus GG under simulated tilapia gastrointestinal conditions and its effect on growth performance, intestinal morphology and protection against Streptococcus agalactiae[J]. Animal Feed Science and Technology, 2015, 207: 93-103.
[20] Champion J A, Mitragotri S. Shape induced inhibition of phagocytosis of polymer particles[J]. Pharm Res, 2009, 26(1): 244-249.
[21] Kircheis R, Wightman L, Wagner E. Design and gene delivery activity of modified polyethylenimines[J]. Advanced Drug Delivery Reviews, 2001, 53(3): 341-358.
责任编辑 高 蓓
The Application of Chitosan-Based Nanocarrier for Oral Protein Drug/Vaccine Delivery
GAO Ping, XIA Gui-Xue, BAO Zi-Xian, LIU Ya, CHENG Xiao-Jie,KONG Ming, FENG Chao, CHEN Xi-Guang
(College of Marine Life Science, Ocean University of China, Qingdao 266003, China)
In recent years, infectious bacterial and viral diseases have restricted the development of fish aquaculture. Oral immunization of fish has caused extensive attention because of its convenient operation with no restricted time, place, the sizes and no injury to fish. But oral vaccine may be degraded by digestive enzymes in the gastrointestinal tract (GI), which lead to the low immune efficiency. Therefore, with the rapid development of nanotechnology, the potent combination of chitosan (CS) based-nanocarriers with aquatic vaccines has caused much attention in the field of fish oral vaccination. Chitosan-nanoparticles (CS-NPs) and chitosan/carboxymethyl chitosan-nanoparticles (CS/CMCS-NPs) were prepared by ionic gelation and polyelectrolyte complexation method, respectively. Their average particle sizes were (178 ± 6.27)and (255 ± 7.54) nm, respectively. The zeta potential was (+15.9 ± 0.37) and (+16.4 ± 0.51) mV, respectively. The model protein of bovine serum albumin (BSA) was encapsulated in nanoparticles with the encapsulation efficiency (EE) of (42.9 ± 1.2)% and (59.4 ± 3.2)%, respectively. The hemolysis and MTT assay showed that CS/CMCS-NPs exhibited better biocompatibility compared with CS-NPs. In order to evaluate cellular uptake efficiency of nanoparticles by Caco-2 cells, the nanocarriers were labeled with Cy5.5. The results showed that the cellular uptake efficiency revealed concentration-dependence and time-dependence in the certain range of concentration and time. For the sake of tracing the biodistribution of BSA encapsulated in nanoparticles, BSA was labeled with FITC. After oral administration in turbot with nanoparticles 36 hours later, the fluorescent proteins were mainly distributed in liver and foregut with the group of FITC-BSA:CS-NPs, while in hindgut, liver and spleen with the group of FITC-BSA:CS/CMCS-NPs. As for the control group, there were mainly distributed in liver. Thus, CS/CMCS-NPs could effectively protect the protein to reach the hindgut of turbot and had great potential to be applied as safe and effective oral vaccine delivery.
chitosan nanocarrier;oral vaccination;bovine serum albumin;turbot
国家自然科学基金项目(31500807);中国博士后基金项目(2014M560579);青岛市科技发展计划项目(15-9-1-73-jch)资助 Supported by the National Natural Science Foundation of China (31500807); The National Science Foundation for Post-doctor (2014M560579); Applied Basic Research Plan of Qingdao (15-9-1-73-jch)
2015-06-07;
2015-07-15
高 萍(1985-),女,博士生,主要从事海洋生物材料研究。E-mail:gaoping1221@163.com
❋❋ 通讯作者:E-mail: xgchen@ouc.edu.cn
R944.1;Q819
A
1672-5174(2017)05-072-08
10.16441/j.cnki.hdxb.20160213
高萍, 夏桂雪, 包子娴, 等. 壳聚糖的纳米载体应用于口服蛋白类药物/疫苗递送的研究[J]. 中国海洋大学学报(自然科学版), 2017, 47(5): 72-79.
GAO Ping, XIA Gui-Xue, BAO Zi-Xian, et al. The application of chitosan-based nanocarrier for oral protein drug/vaccine delivery[J]. Periodical of Ocean University of China, 2017, 47(5): 72-79.
