RNA干扰UGP基因表达对三角褐指藻碳流分配的影响❋
2017-04-10朱葆华常雅青何文栋杨官品潘克厚
朱葆华,常雅青,何文栋,杨官品,李 赟,潘克厚,3❋❋
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2.中国海洋大学海洋生命学院,山东 青岛 266003;3.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
RNA干扰UGP基因表达对三角褐指藻碳流分配的影响❋
朱葆华1,常雅青1,何文栋1,杨官品2,李 赟1,潘克厚1,3❋❋
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2.中国海洋大学海洋生命学院,山东 青岛 266003;3.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
为深入研究RNA干扰尿苷二磷酸葡萄糖焦磷酸化酶(UGPase)基因的表达对三角褐指藻(PhaeodactylumtricornutumBohlin)碳流分配的影响,本研究以RNA干扰UGP表达的三角褐指藻为对象,测定了野生和转基因藻株的叶绿素荧光参数和生物量,分析了它们的脂肪酸组成和金藻昆布多糖、总脂及蛋白质的含量。研究显示,转基因藻株的最大光能转化效率(Fv/Fm)从指数生长后期开始显著低于野生型,但野生和转基因藻株的终生物量无明显差别。转基因藻株(AS、IR)的C16与C18之和分别占总脂肪酸含量的66.90%和68.89%,比野生藻株分别提高了19.40%和22.97%,说明抑制UGP表达改变了三角褐指藻的脂肪酸组成。转基因藻株的金藻昆布多糖、总脂及蛋白质含量与野生型藻株差别明显:藻株AS的金藻昆布多糖含量降低25.70%,蛋白质含量上升3.80%,总脂含量提高了13.2%;藻株IR的金藻昆布多糖含量降低40.70%,蛋白质含量上升8.30%,总脂含量增加了25.20%。研究结果表明,RNA干扰UGP的表达改变了三角褐指藻的脂肪酸组成,使得在最终生物量无明显减少的情况下,光合作用固定的碳更多转向油脂合成。本研究进一步明确了RNA干扰UGP的表达对三角褐指藻碳流分配的影响机制,为通过基因工程改造藻种提高微藻的生物柴油生产潜力提供了新思路。
三角褐指藻;生物柴油;RNA干扰;UGPase;脂肪酸;碳流分配
生物柴油作为一种可再生、绿色环保的清洁能源日益受到关注,有望成为化石燃料的重要替代,缓解能源危机[1]。硅藻(Diatom)是一类单细胞、光合自养的真核微藻,在海洋生态系统及全球碳循环中发挥重要作用,它们固定的碳主要以脂质和金藻昆布多糖存储在藻细胞中。利用基因工程手段调控金藻昆布多糖的合成,不但有助于深入了解金藻昆布多糖的合成路径,也是培育优良能源微藻藻种的有效方法[2]。
三角褐指藻(PhaeodactylumtricornutumBohlin)是一种真核海洋单细胞硅藻,能够大量合成并积累多不饱和脂肪酸(PUFAs),特别是EPA,其含量可达总脂肪酸含量的30%以上,有望成为工业化生产EPA的原料[3]。此外,三角褐指藻具有适应性强、繁殖快和培养方便等优点,其油脂含量较高,可作为规模化生产生物柴油的优良候选藻种[4]。
尿苷二磷酸葡萄糖焦磷酸化酶(Uridine diphosphoglucosepyrophosphorylase,简称UGPase), 催化葡萄糖-1-磷酸(Glc-1-P)和尿苷三磷酸(UTP)生成尿苷二磷酸葡萄糖(UDPG)和焦磷酸(PPi)的可逆反应,即Glc-1-P+ UTP←→UDPG+ PPi。UGPase在生物中普遍存在,在高等植物糖类代谢和细胞壁的生物合成中发挥重要作用[5-6]。关于UGPase在硅藻中的功能,我们前面的研究初步证明了该酶在三角褐指藻的碳流分配中发挥重要作用,但UGPase在碳流分配中如何发挥作用等需要进一步深入研究[2]。
本文以RNA干扰UGP表达的三角褐指藻为对象,测定其生长、脂肪酸组成和金藻昆布多糖、总脂和蛋白质含量,试图回答以下问题:(1)UGPase对金藻昆布多糖合成的影响,碳流分配有几个去向?(2)碳流分配中有多大比例转向脂类,多大比重转向蛋白? 以便深入探究三角褐指藻UGPase影响碳流分配的机制。
1 材料与方法
1.1 藻种来源及培养
野生型三角揭指藻(PhaeodactylumtricornutumBohlin)从中国海洋大学微藻种质库获得,转基因三角褐指藻为RNA干扰UGP表达藻株,编号分别为AS和IR。AS代表转化了反义干扰载体的藻株,IR代表转化了反向重复干扰载体的藻株,WT代表野生型藻株。
在(20±2)℃、光照强度为27.5~37.5 μmol photons·m-2·s-1(光照周期12D∶12D)条件下用f/2培养基不通气培养,每种藻株设置3个平行。接种时的细胞密度相同,均为25×104/mL,培养液的体积为350 mL,置于500 mL的三角瓶中培养,每日随机调换三角瓶并摇晃2~3次,每隔1天定时取样,进行细胞密度、叶绿素荧光各项参数的测定,培养至指数生长末期,收集藻液。
1.2 转基因藻株的鉴定
1.2.1 PCR鉴定 用CTAB法[7]分别提取野生型和转基因三角褐指藻的基因组DNA,根据遗传转化体系中的抗Shble基因序列用Primer5软件设计引物、进行PCR扩增,对保存的转基因藻株进行鉴定,引物见表1。
PCR反应条件:95 ℃预变性5 min,95 ℃变性30 s,63 ℃退火40 s,72 ℃延伸45 s,30个循环后,72 ℃延伸5 min。
1.2.2 实时荧光定量PCR 实时荧光定量采用相对定量的方法,以编码组蛋白的H4基因(Histone H4)为内参[8], 本研究所用引物见表1。离心(4 000g,5 min)收集指数生长末期的藻细胞,灭菌双蒸水洗涤2次,用于提取RNA。总RNA的提取使用OMEGATotal RNA Kit I试剂盒,按照说明书操作。RNA反转录使用全式金的TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒,用Roche Applied Science的LightCycler 480 Real-Time PCR System 进行实时荧光定量PCR检测。最后采用2-ΔΔCT算法[9]计算UGP的相对转录量。

表1 引物信息
1.3 生长曲线绘制及生物量测定
每隔10 d,在显微镜下用血球计数板对3组藻进行计数,绘制生长曲线。
离心收集指数生长末期的藻液各260 mL,通过Christ真空冷冻干燥机(ALPHA 1-4 LD,Germany)进行冷冻干燥,称量藻粉质量,计算生物量。
1.4 叶绿素荧光参数的测定
利用Water-PAM水样叶绿素荧光仪(Walz, Germany)测定叶绿素荧光参数。测定前对待测藻液进行暗适应15 min。叶绿素荧光参数PSⅡ的最大光能转化效率Fv/Fm,PSⅡ的实际光能转化效率Yield,光化学淬灭qP和非光化学淬灭NPQ可由自带程序直接读出,其中Fv/Fm=(Fm-F0)/Fm,F0为基础荧光,Fm为饱和脉冲(4 000 μmol·m-2·s-1,持续时间为0.8 s)激发获得的最大荧光。
1.5 叶绿素和类胡萝卜素含量测定
取指数生长末期的藻液2 mL,离心收集(2 000g,4 ℃,8 min)藻细胞,用灭菌双蒸水洗涤2次,加入2 mL无水甲醇,用涡旋仪震荡15 s使藻细胞悬浮,黑暗条件下室温放置24 h,离心(3 000g,10 min),取上清液于470和666 nm测定OD值[10]。
叶绿素a和类胡萝卜素质量浓度(μg/mL),按照下面的公式计算[11,12]:
CChla=15.65A666;
CCaro=(1 000A470—4.476A666)/221。
其中:A470和A666分别表示叶绿素溶液在波长470和666 nm处的吸光度;CChla和CCaro分别表示叶绿素a和类胡萝卜素的浓度。
1.6 UGPase活性测定
UGPase活性测定使用GENMED植物尿苷二磷酸葡萄糖焦磷酸化酶活性光谱法定量检测试剂盒(Genmed Scientifics Inc., Shanghai, China)。蛋白质浓度测定使用GENMEDBradford蛋白浓度定量试剂盒(Genmed Scientifics Inc., Shanghai, China)。酶活性通过SynergyScie多功能酶标仪(Bio-Tek,USA)监测37 ℃,0与30 min时波长340 nm处的吸光值进行测定。UGPase单位活性定义为:在37 ℃,pH=7.5条件下,每分钟还原1 μmol的NADP+所需的酶量。
1.7 气相色谱法测定脂肪酸组成
参照文献[13]的方法进行:取30 mg藻粉于15 mL试管中,加入1 mL 2 mol/L的KOH-CH3OH溶液,涡旋混匀,75 ℃水浴皂化30 min;冷却至室温,加入2 mL 3 mol/L的HCL-CH3OH溶液,75 ℃水浴中甲酯化15 min;冷却至室温,加入1 mL正己烷,振荡后加入2 mL蒸馏水萃取;取上层正己烷层于EP管中,离心(1 000g,4 ℃,10 min)。气相色谱(GC)分析采用AgiLent 6890 Series GC Systerm (US10251016,USA);氢火焰离子化检测器(FID);实验参数:气化室温度250 ℃,空气流量450 mL/min,分流比10∶1,程序升温170 ℃(1 min)升至210 ℃(25 min),每分钟3 ℃,每个样品取5,每进行GC分析。
1.8 金藻昆布多糖、总脂和蛋白质含量测定
金藻昆布多糖含量测定:按照Granum 和Myklestad[14]的方法萃取金藻昆布多糖,用苯酚-硫酸法测定其含量[15]。称取约2 mg藻粉,置于10 mL螺口玻璃管中,加入5 mL 0.05 mol/L H2SO4,旋紧管盖,快速涡旋混匀。60 ℃水浴10 min;反应液用Whatman的GF/C膜过滤至螺口管中,取2 mL滤液依次加入0.5 mL 3%的液化苯酚和5 mL的浓H2SO4。快速涡旋混匀,静至30 min后用流水冷却。用分光光度计(U-3310)测定其485 nm处的吸光值。
总脂含量测定:采用氯仿-甲醇法[16-17]。取50 mg藻粉,悬浮于氯仿∶甲醇(2∶1,V/V)中,震荡萃取15 min,离心(条件)取上清,将下层(沉淀物)进行第二次抽提。2次抽提的上清混合,加入0.9%的NaCl,形成氯仿∶甲醇∶水(2∶1∶0.6,V/V/V)的萃取体系,抽出下层(氯仿层)转移到螺口玻璃管中。65 ℃水浴挥发掉氯仿,放入烘箱中80 ℃烘干并称重。
蛋白质含量测定[18]:称取10 mg藻粉于1.5 mL离心管中,加入100 μL 1 mol/L NaOH混匀,80 ℃水浴10 min,加入900 μL蒸馏水混匀,离心(4 ℃,9 000g,30 min),取上清于5mL离心管中,重复上述抽提步骤2次,合并所有上清。利用Bradford蛋白浓度测定试剂盒测定样品蛋白浓度。
1.9 数据分析
采用SPSS软件进行单因子方差分析,以P<0.05作为差异显著性水平。
2 结果
2.1 转基因三角褐指藻的鉴定
2.1.1 PCR鉴定 由图1可以看出,以转基因三角褐指藻基因组DNA为模板得到了长度约为400bp的扩增产物,说明本实验使用的转基因藻株确实为含有RNA干扰载体的三角褐指藻。
2.1.2 UGP相对表达量及酶活测定 由图2可以看出,转基因藻株AS和IR的UGP相对表达量明显低于野生藻株WT,由图3可以看出,转基因藻株AS对应的UGPase活性下降22%,转基因藻株IR对应的UGPase活性下降59%,说明转基因藻株中UGP的表达受到不同程度的抑制,与野生藻株相比差异显著。

(1.DNA MarkerDL2000;2.转基因藻株AS;3.转基因藻株IR;4.野生藻株WT。Lane 1.DNA Marker DL2000;lane 2.transgenic AS;lane 3.transgenic IR;lane 4.wild type WT.)

(WT:野生藻株;AS:转基因株AS;IR:转基因株IR。WT:Wild type;AS:Transgenic AS;IR:Transgenic IR.)
2.2 转基因与野生型三角褐指藻生长曲线
由图4可以看出,转基因和野生藻株的细胞密度均随培养时间的延长逐渐增加,在培养周期内最大细胞密度分别为670×104/mL(IR),600×104/mL (AS),550×104/mL (WT),差异显著性分析表明三者之间没有显著性差异,说明转基因没有影响三角褐指藻的生长。

(WT:野生藻株;AS:转基因株AS;IR:转基因株IR。WT:Wild type;AS:Transgenic AS;IR:Transgenic IR.)
2.3 叶绿素荧光参数
由图5可以看出,在培养周期内,野生与转基因藻株的最大光能转化效率Fv/Fm、实际量子产量Yield在第8天之前差别不大,但第8天之后野生藻株显著高于转基因藻株。野生与转基因藻株的光化学淬灭qP没有显著差异,而非光化学淬灭NPQ转基因藻株在第4~9天显著低于野生藻株,但第10天开始恢复与野生藻株没有显著差别。总体来讲,在培养周期内,转基因藻株的光合作用能力与野生藻株并没有显著差别(P>0.05)。

图4 转基因和野生型三角褐指藻生长曲线Fig.4 Comparisons of growth curves of the transgenic Phaeodactylum tricornutum and the wild type

(A:最大光能转化效率(Fv/Fm);B:PSⅡ的实际光能转化效率Yield;C:光化学淬灭qP;D:非光化学淬灭NPQ。A:Photochemical efficiency(Fv/Fm);B:Actual photochemical efficiency of PSⅡYield;C:Photochemical quenching qP;D:Non-photochemical quenching NPQ.)
2.4 叶绿素和类胡萝卜素含量
由图6和7可以看出,转基因藻株的叶绿素a和类胡萝卜素含量均显著高于野生藻株,说明转基因改变了三角褐指藻的色素含量。
2.5 脂肪酸组成分析
由表2可以看出,3株藻的脂肪酸组成和含量差异显著,转基因藻株的C14∶0和C16∶3相对含量显著低于野生藻株, 而C16∶0、C16∶1相对含量显著高于野生藻株。其中,转基因藻株AS和 IR的C16与C18之和分别占到了总脂肪酸的66.9%和68.89%,较对照组分别提高了19.4%和22.97%,说明转基因改变了三角褐指藻的脂肪酸组成。

图6 转基因和野生型三角褐指藻叶绿素a相对含量Fig.6 Chlorophylla contents in the transgenic Phaeodactylum tricornutum and the wild type

图7 转基因和野生型三角褐指藻类胡萝卜素相对含量Fig.7 Carotenoids contents in the transgenic Phaeodactylum tricornutum and the wild type

表2 RNA干扰对三角褐指藻脂肪酸组成的影响 /%Table 2 The influence of RNA interference on the fatty acid composition of Phaeodactylum tricornutum
注:a、b、c分别表示方差分析差异程度,同一列中有相同字母的组之间差异不显著(P>0.05)。NT:未检测到;Others:其他未标定的脂肪酸。
Note:Values in the same row with the same superscripts are not significantly different(P>0.05). NT:Not detected. Others:Other fatty acids without calibration.
2.6 金藻昆布多糖,蛋白质,总脂含量和生物量
由表3可以看出,转基因和野生藻株的金藻昆布多糖,蛋白质,总脂含量有显著的差异,而生物量并没有明显差别。
3 讨论
金藻昆布多糖是硅藻的主要能量储存性多糖,其生化合成路径目前仍没有被阐明[19]。我们前面的研究表明,UGPase是三角褐指藻金藻昆布多糖合成的限速酶,在其生物合成及碳流分配中发挥重要作用[2],但碳流如何分配,碳流分配的去向等并没有深入研究。本文以RNA干扰UGP表达的三角褐指藻为对象,研究表明,UGPase在金藻昆布多糖合成中发挥非常重要的作用,在碳流分配中主要引导碳流转向脂类合成,还有一部分碳流合成了蛋白和色素,同时,脂肪酸的组成也发生了明显改变。
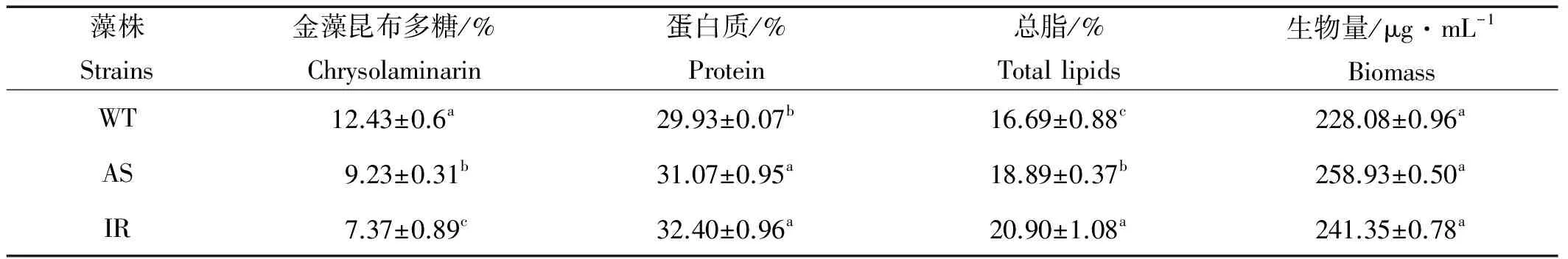
表3 转基因和野生藻株的金藻昆布多糖、蛋白质、总脂含量和生物量Table 3 Chrysolaminarin,protein,total lipids and biomass in the transformantsand the wild type
注:a、b、c分别表示方差分析差异程度,同一列中有相同字母的组之间差异不显著(P>0.05)。
Note: Values in the same row with the same superscripts are not significantly different(P>0.05).
由图2和3可以看出,转基因藻株(AS和IR)UGP相对表达量降低伴随着UGPase活性下降,酶活性下降伴随着金藻昆布多糖合成的减少,而且,酶活性下降的越多,金藻昆布多糖合成越少,二者呈明显的正相关(见表2)。上述结果进一步表明,UGPase是三角褐指藻金藻昆布多糖合成的限速酶,在其生物合成中发挥非常重要的作用,这与我们前面的研究结果是一致的[2]。
到目前为止,微藻和油料作物针对提高甘油三酯(TAG)的基因工程,主要集中在调控脂类合成路径中的关键酶基因,很少见到通过改变碳流分配提高油脂合成能力的相关研究。Li等[20]报道,由于抑制了莱茵衣藻(Chlamydomonas)淀粉合成缺陷突变体腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)的活性,导致TAG的合成量较野生藻株提高了10倍,这说明为了提高油脂含量,将碳流由淀粉引向脂类合成是比直接调控脂类合成路径更加有效的策略。本研究中,由于抑制了UGPase的活性,藻株AS金藻昆布多糖含量下降25.7%,总脂含量上升13.2%;藻株IR金藻昆布多糖含量下降40.7%,总脂含量上升25.2%,进一步说明调控三角褐指藻金藻昆布多糖合成是提高油脂含量的有效方法,这与我们前面的研究也是一致的[2]。
微藻的脂肪酸组成是衡量生物柴油质量的重要指标,C16与C18之和已经用来评价生物柴油的质量[21]。本研究中,由于抑制了UGPase的活性,不但油脂含量明显提高,也改变了脂肪酸的组成和含量,特别需要指出的是,转基因藻株AS和IR的C16与C18之和分别占到了总脂肪酸含量的66.9%和68.89%,较对照组分别提高了19.4%和22.97%,而EPA的含量却显著降低(见表3),因此,抑制UGP表达的转基因藻株的脂肪酸组成更适合生物柴油的生产。本文首次报道,抑制UGP表达改变了三角褐指藻的脂肪酸组成,可能是由于碳流转向脂类合成,刺激了脂肪酸合成相关酶的活性,但具体的机制还需要进一步研究。
UGPase是否在碳流分配中发挥作用,一些研究者在不同物种中进行了相关研究。Coleman等[22]报道,在小黑杨(Hybridpoplar)中过表达UGP,改变了淀粉和纤维素之间的碳流分配;Wang等[23]在拟南芥(Arabidopsisthaliana)中表达了来自棉花的UGP,发现UGPase在碳流分配,特别是在纤维素的生物合成过程中发挥重要作用;Weselake等[24]提出,有关油脂积累的实验,应考虑碳流分配对蛋白质合成的影响;我们前面的研究也表明,UGPase在三角褐指藻的碳流分配中发挥重要作用[2]。但是,碳流如何分配,碳流分配的去向等上述研究并没有涉及。本研究中,抑制UGP的表达,金藻昆布多糖的合成显著降低,碳流转向脂类、蛋白及色素的合成(见表3,图6和7),藻株AS金藻昆布多糖含量降低25.70%,蛋白质含量上升3.80%,总脂含量提高了13.2%;藻株IR的金藻昆布多糖含量降低40.70%,蛋白质含量上升8.30%,总脂含量增加了25.20%,这些结果表明,在终生物量没有明显减少的情况下,抑制UGP的表达,导致三角褐指藻光合作用固定的碳更多转向油脂的合成,其次是蛋白和色素。由于在藻类中,色素种类很多,本研究只测定了叶绿素a和类胡萝卜素的含量变化,因此,碳流到底有多大比重转向色素的合成还需要进行系统研究。
叶绿素荧光是光合作用的良好指标和探针,通过对各种荧光参数的分析,可以得到有关光能利用的信息[25]。为了检测转基因对藻细胞生长及光合作用的影响,本研究测定了各项叶绿素荧光参数和终生物量。由图5可以看出,最大光能转化效率(Fv/Fm)、实际量子产量(Yield)在第8天之前没有显著差别,但第8天之后野生藻株显著高于转基因藻株;qP(光化学淬灭,反映光合活性高低)没有显著差别,转基因藻株的NPQ(非光化学淬灭,反映植物的光保护能力)在第4至第9天显著低于野生藻株,但第10天开始恢复与野生藻株没有显著差别。总体来讲,在培养周期内,转基因藻株的光合作用能力与野生藻株并没有显著差别,体现在生长方面,它们之间的细胞密度和终生物量也没有显著差别(见图4,表3),说明金藻昆布多糖合成减少没有影响三角褐指藻的生长,这与一些学者的报道不同,他们认为转基因影响生长,生长速率降低[20,26],但到目前为止,具体的机制还有待深入研究。
4 结语
本研究进一步阐明了UGPase在三角褐指藻金藻昆布多糖合成中的重要作用,在光合固碳没有明显减少的情况下,抑制UGP的表达,三角褐指藻光合作用固定的碳更多转向油脂的合成,其次是蛋白和色素,为通过基因工程提高油脂含量提供了一条新的思路。
[1] Dismukes G C, Carrieri, D. Bennette,N. et al. Aquatic phototrophs: Efficient alternatives to land-based crops for biofuels[J]. Current Opinion in Biotechnology, 2008, 19: 235-240.
[2] Zhu B H, Shi H P, Yang G P, et al. Silencing UDP-glucose pyrophosphorylase gene inPhaeodactylumtricornutumaffects carbon allocation[J].New Biotechnology, 2016, 33: 237-244.
[3] Harwood J L, Guschina I A. The versatility of algae and their lipid metabolism[J]. Biochimie, 2009, 91(6): 679-684.
[4] Dillschneider R, Steinweg C, Rosello-Sastre R, et al. Biofuels from microalgae: photoconversion efficiency during lipid accumulation[J].Bioresource Technology, 2013, 142: 647-654.
[5] Kleczkowski L A, Kunz S, Wilczynska M. Mechanisms of UDP-glucose synthesis in plants[J]. Critical Reviews in Plant Sciences, 2010, 29(4):191-203.
[6] Kawano Y,Sekine M,Ihara M. Identification and characterization of UDP-glucosepyrophosphorylasein cyanobacteriaAnabaenasp. PCC 7120[J]. Journal of Bioscience and Bioengineering, 2013, 117(5): 531-538.
[7] 张桂和,徐碧玉,王裙.几种海洋微藻基因组DNA的分离提取及PCR检测[J].热带海洋学报, 2007, 26(1): 68-71. Zhang G H, Xu B Y, Wang Q. Genomic DNA extraction from several marine microalgae species and their examination by polymerase chain reaction(PCR)[J]. Journal of Tropical Marine, 2007, 26(1): 68-71.
[8] Siaut M, Heijde M, Mangogna M, et al. Molecular toolbox for studying diatom biology inPhaeodactylumtricornutum[J]. Gene, 2007, 406: 23-35.
[9] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25: 402-408.
[10] Lichtenthaler H K,Wellburn A R. Determination of total carotenoids and chlorophylls a and b of leaf extracts in different solvents[J]. Biochemical Society Transactions, London, 1983,11:591-603.
[11] Henriques M, Silvaand A , Rocha J. Extraction and quantification of pigments from a marine microalga: A simple and reproducible method[J]. Applied Microbiology, 2007: 586-593
[12] Wellburn A R.The spectral determination of chlorophyll a and chlorophyll b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution[J].Journal Plant Physiology, 1994, 144(3): 307-313.
[13] Lepage G, Roy C. Improved recovery of fatty acid through direct transesterification without prior extraction or purification[J]. Journal of Lipid Research, 1984, 25: 1391-1396.
[14] Granum E, Myklestad S M. A simple combined method for determination of β-1, 3-glucan and cell wall polysaccharides in diatoms[J]. Hydrobiologia, 2002,477:155-161.
[15] Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances[J]. Anal Chem, 1956, 28: 350-356.
[16] Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Can J Biochem Physiol, 1959, 37: 911-917.
[17] Axelsson M, Gentili F. A Single-Step method for rapid extraction of total lipids from green microalgae[J]. PloS One, 2014, 9: 1-6.
[18] Eze J M O, Dumbroff E B .A comparison of the bradford and lowry methods for the analysis ofprotein in chlorophyllous tissue [J]. Canadian Journal of Botany,1982,60(7):1046-1049.
[19] Kroth P G, Chiovitti A, Gruber A, et al. A model for carbohydrate metabolism in the diatomPhaeodactylumtricornutumdeduced from comparative whole genome analysis[J]. PloS One, 2008,1:1426-1439.
[20] Li Y, Han D, Hu G, et al.Chlamydomonasstarchless mutant defective in ADP-glucose pyrophosphorylase hyper-accumulates triacylglycerol[J]. Metab Eng, 2010,12:387-391.
[21] Tang D, Han W, Li P, et al. CO2biofixation and fatty acid composition ofScenedesmusobliquusandChlorellapyrenoidosain response to different CO2levels [J]. Bioresour Technol, 2011,102:3071-3076.
[22] Coleman H D, Canam T, Kang K Y, et al. Over-expression of UDP-glucose pyrophosphorylase in hybrid poplar affects carbon allocation[J]. Exp Bot, 2009, 58: 4257-4268.
[23] Wang Q, Zhang X, Li F, et al. Identification of a UDP-glucose pyrophosphorylase from cotton (GossypiumhirsutumL.) involved in cellulose biosynthesis inArabidopsisthaliana[J]. Plant Cell Rep, 2011,30:1303-1312.
[24] Weselake R J, Taylor D C, Rahman M H,et al. Increasing the flow of carbon into seed oil[J]. Biotechnol Adv, 2009,27:866-878.
[25] 梁英, 陈书秀, 田传远, 等. 温度对三角褐指藻叶绿素荧光特性及生长的影响[J]. 中国海洋大学学报(自然科学版), 2008, 38(3): 377-383. Liang Y, Chen S X, Tian C Y, et al. Effects of Temperature on the ChlorophyⅡFluorescence Parameters and Growth ofPhaeodactylumtricornutum[J]. Periodical of Ocean University of China, 2008, 38(3): 377-383.
[26] Radakovits R, Eduafo P M, Posewitz M C. Genetic engineering of fatty acid chain length inPhaeodactylumtricornutum[J].Metab Eng, 2011,13: 89-95.
责任编辑 朱宝象
Effectof RNA Interference ofUGP-Glucose Pyrophosphorylase Gene Expression Oncarbon Allocation inPhaeodactylumtricornutum
ZHU Bao-Hua1, CHANG Ya-Qing1, HE Wen-Dong1, YANG Guan-Pin2, LI Yun1, PAN Ke-Hou1,3
(1.Key Laboratory of Mariculture (Ocean University of China), Ministry of Education, Qingdao 266003, China;2.College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China;3.Laboratory for Marine Fisheries and Aquaculture,Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China)
Diatom are unicellular, photosynthetic and eukaryotic microalgae, which are responsible for around 40% of the total carbon fixation in oceans. Chrysolaminaran is the main energy storage polysaccharide of diatom. To date, the biosynthetic pathway of chrysolaminaran has not been fully elucidated inPhaeodactylumtricornutum. This species has a fully sequenced genome and a perfect transgenic platform, making it feasible to exogenously trigger RNA-mediated silencing in this alga. UDP-glucose pyrophosphorylase (UGPase) catalyzes the reversible production of UDP-glucose and pyrophosphate (PPi) from glucose-1-phosphate (G-1-P) and UTP. It is a key enzyme in carbohydrate metabolism, playing an important role in carbon partitioning. In order to study the mechanism of UGPase in regulating carbon partitioning, the contents of chrysolaminarin, protein and total lipid were measured in transgenicP.tricornutumwith the expression UGP genesuppressed, and compared with those of the wild. The measured and compared included also chlorophyll fluorescence parameter and fatty acid composition. Our results showed that maximal photochemical efficiency (Fv/Fm) of transgenicP.tricornutumwas significantly lower than that of the wild after the eighth day of cultivation, but their biomass was not significantly different. The C16 and C18 series contents of the two transgenic strains (AS and IR) accounted for 66.9% and 68.89% of the total, increased by 19.40% and 22.97% in comparison with those of the wild, respectively. Our findings indicated that suppression of UGP gene changed the fatty acid metabolism ofP.tricornutum.Chrysolaminarin, protein and total lipid of transgenic strains (AS and IR) were significantly different from those of the wild. The content of chrysolaminarin decreased by 25.70%, and the contents of protein and total lipid increased by 3.80% and 13.20% in transgenic strain AS. Nevertheless, the content of chrysolaminarin decreased by 40.70%, the contents of protein and total lipid increased by 8.30% and 25.2% in IR. The results of the study showed that RNA interference on UGPgene expression had altered carbon allocation and fatty acid composition ofP.tricornutum.Biomass changed little; however more carbon captured during photosynthesis had turned to lipid synthesis. This study has further revealed the carbon allocation mechanism of RNA interference on UGP gene expression inP.tricornutum, which will provide a novel avenue for improving the total lipid in microalgal cellsand lay the foundation for a complete understanding of the chrysolaminarin biosynthesis pathway.
P.tricornutum; biodiesel; RNA interference; UGPase; fatty acid; carbon allocation
国家高技术研究发展计划项目(2013AA065801;2014AA022001)资助 Supported by National High Technology Research and Development Projects (2013AA065801;2014AA022001)
2016-09-09;
2016-11-23
朱葆华(1971-),男,副教授,主要从事微藻生理、生化与分子生物学方面的研究。E-mail:zhubaohua@ouc.edu.cn
❋❋ 通讯作者:E-mail:qdkhpan@126.com
Q756;S917
A
1672-5174(2017)05-042-08
10.16441/j.cnki.hdxb.20160316
朱葆华,常雅青,何文栋,等.RNA干扰UGP基因表达对三角褐指藻碳流分配的影响[J].中国海洋大学学报(自然科学版),2017, 47(5): 42-49.
ZHU Bao-Hua, CHANG Ya-Qing, HE Wen-Dong, et al.Effectof RNA interference ofUGP-glucose pyrophosphorylase gene expression oncarbon allocation inPhaeodactylumtricornutum[J].Periodical of Ocean University of China, 2017, 47(5): 42-49.
