花鲈初孵仔鱼饥饿不可逆点的确定及摄食节律研究❋
2017-04-10王晓龙温海深张美昭李吉方张凯强常志成
王晓龙, 温海深, 张美昭, 李吉方, 张凯强,王 伟, 刘 阳, 田 源, 常志成
(海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003)
花鲈初孵仔鱼饥饿不可逆点的确定及摄食节律研究❋
王晓龙, 温海深❋❋, 张美昭, 李吉方, 张凯强,王 伟, 刘 阳, 田 源, 常志成
(海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003)
为确定花鲈仔鱼初次摄食的不可逆点(PNR),通过人工催产、孵化获得花鲈仔鱼,在水温(21±1)℃、盐度26条件下,开展了初孵仔鱼的饥饿实验,研究了在饥饿状态下花鲈仔鱼的不可逆点(PNR)及投喂状态下仔鱼期的摄食节律。研究表明,花鲈仔鱼孵化后,4日龄开始摄食外源食物,进入混合营养期,6日龄卵黄囊消失,进入外源营养期,混合营养期仅2d。饥饿组仔鱼生长呈现先增长后下降的趋势,部分仔鱼身体出现畸形。白天为室内自然光照(500~800 lx),夜间为人工光源(200~250 lx),在此条件下,早期仔鱼(5日龄)在14:00和20:00摄食率高于50%;晚期仔鱼(11日龄)在08:00、14:00和20:00摄食率均高于50%,属于典型的白天摄食类型,且随着仔鱼的生长发育,摄食高峰期逐渐延长。研究结果表明,在(21±1)℃的水温条件下,花鲈仔鱼的最佳投喂时机在4日龄,9日龄至10日龄抵达不可逆点,仔鱼的主要摄食时间为午后到傍晚,夜间弱光照条件下也会进行摄食。
花鲈;仔鱼;饥饿;不可逆点;摄食节律
饥饿是仔鱼初次摄食期死亡的主要原因之一,Blaxter和Hempel[1]于1963年首次提出初次摄食饥饿不可逆点(Point of no return,PNR),不可逆点是仔鱼耐受饥饿的临界点,当仔鱼饥饿至该点时,仔鱼个体虽能仍能存活一段时间,但已不能恢复摄食能力,直至死亡。目前,已有一些学者对鱼类仔鱼耐受饥饿的时间临界点做了研究报道,如大泷六线鱼(Hexagrammosotakii)、黄鳝(Monopterusalbus)、斑鳜(Sinipercascherzeri)、泥鳅 (Misgurnusanguillicaudatus)、美洲西鲱(Alosasapidissima)、金鲫(CarassiusauratusRed variety)等[2-7],但有关花鲈(Lateolabraxmaculatus)仔鱼的相关研究尚未见报道。
花鲈(Lateolabraxmaculatus)俗称海鲈、鲈鱼等,属鲈形目(Perciformes)鮨科(Serranidae)花鲈属(Lateolabrax)[8]。其主要分布在中国、朝鲜及日本沿海,是一种广温、广盐的浅海内湾凶猛肉食性鱼类,近年来,由于南方地区花鲈人工育苗的规模化生产,使得花鲈的人工养殖发展迅速,已成为我国海水网箱养殖和河口地区池塘养殖的重要经济鱼类之一[9]。目前国内外有关花鲈的受精卵孵化、胚胎发育、苗种培育、早期形态发育、耐盐性、饥饿及补偿生长等方面已有一些报道[10-11],而有关花鲈早期发育阶段摄食特性的研究鲜有报道。本实验通过对花鲈早期发育阶段开口摄食时间、饥饿不可逆点(PNR)及摄食节律等方面的研究,旨在阐述花鲈早期发育过程中的发育规律和特点,以期丰富花鲈生物学和生理学研究内容,人工孵化后的花鲈仔鱼由内源性营养转化为外源性营养的临界期是个危险时期,即将开口的仔鱼会因不能及时摄取到适口饵料而出现批量死亡,故本实验想通过探究花鲈仔鱼的初次摄食率和确定不可逆点(PNR),为提高花鲈仔鱼存活率及花鲈的人工育苗提供必要的基础资料,同时,在实践上为花鲈人工育苗技术的完善提供科学依据。
1 材料与方法
1.1 材料
实验于2015年12月在东营市利津县双瀛水产苗种有限责任公司鱼苗繁育基地进行。实验用的花鲈仔鱼为北方花鲈亲鱼群体经人工催产、孵化所得的同批次初孵仔鱼。
1.2 方法
1.2.1 仔鱼的饥饿实验 随机选取孵化后的花鲈仔鱼4 000尾,平均分为2组,其中一组为饥饿组,一组为正常饲喂对照组,放置在相同规格的有效水体为60 L的聚乙烯塑料桶中(半径25 cm,高46 cm)。根据温度对花鲈受精卵孵化和前期仔鱼发育温度的实验[12],为降低畸形率和保证存活率,适宜水温为13~22 ℃,适宜盐度为19~28,在考虑到实际情况的条件下,实验期间水体温度控制在(21±1)℃,盐度为26,每日换等温水1/4量,不间断微充气,白天为室内自然光照(500~800 lx),夜晚控制光照在200~250 lx。实验用水为经过沉淀砂滤的自然海水经充分曝气后,再经过25#浮游生物网(250目筛绢网)过滤,保证水中没有适合仔鱼摄食的生物饵料。饥饿组不投喂,直至全部死亡,正常饲喂对照组,投喂经小球藻强化过的褶皱臂尾轮虫。从0日龄开始,每天从饥饿组和对照组中各取30尾仔鱼,通过体视镜连接计算机上图像处理软件,测量仔鱼体长、卵黄囊长径、短径,油球长径、短径,精确到0.01 mm。计算卵黄囊体积参照公式:卵黄囊体积= 4/3π(r/2)2R/2,式中r为卵黄囊短径,R为卵黄囊长径。油球体积公式同卵黄囊体积公式。
1.2.2 初次摄食率 从0日龄开始,每天下午14:00从饥饿组随机选取仔鱼30尾,设3个平行组,置于35 cm×15 cm×10 cm的透明聚乙烯塑料缸中,投喂经小球藻强化的褶皱臂尾轮虫(投喂量为培育水体中8~10个/mL)。室内自然光照(500~800 lx)下4 h后取出仔鱼,经MS222麻醉,在光学显微镜和解剖镜下进行观察,逐一观察仔鱼的摄食情况,记录摄食轮虫数量,得出初次摄食率和消化道饱满度,同时测量仔鱼全长。同样,从对照组中随机选取仔鱼30尾,设3个平行组,测量上述指标。仔鱼初次摄食率=摄食轮虫仔鱼的个体数量/所观察摄食情况的仔鱼个体总数×100%。
1.2.3 不可逆点(PNR)的确定 不可逆点即仔鱼在饥饿状态下,饥饿到该点时,仍可存活一段时间不会立即死亡,但大部分个体已经已不能恢复摄食的能力。PNR的测定采用Blaxter、殷名称等[1,13]采用的方法,通过测定饥饿组仔鱼的初次摄食率,得到初次摄食率中的最高值,当测定的摄食率低于最高初次摄食率的50%时,即为不可逆点的时间,以出膜后日龄表示。
1.2.4 摄食节律 仔鱼前期、后期阶段的划分根据Houde[14]和兰俊全等[15]的方法,将仔鱼期分为早期仔鱼和晚期仔鱼,即从受精卵孵化到卵黄囊完全消失为早期仔鱼,从卵黄囊消失开始到奇鳍膜即将分化为后期仔鱼。所选取的仔鱼来自车间养殖池(5 m×5 m),水深1m,水温19~22 ℃,盐度为25~30,放养密度为1~3万尾/m3,饵料序列为轮虫—卤虫无节幼体(枝角类和桡足类)—鱼、虾肉糜(微型颗粒饲料),每天2次投喂(07:00和16:00各一次),本实验中白天为室内自然光照(500~800 lx),夜晚采用人工光源(200~250 lx),从养殖池中选取了5日龄早期仔鱼、11日龄晚期仔鱼,每6 h取样一次,自上午8:00到次日上午8:00,共设5个时间组:8:00、14:00、20:00、次日2:00、次日8:00,每次随机取样30尾(每个平行组10尾),经MS222麻醉,测量全长和体质量。在光学显微镜和解剖镜下测定花鲈仔鱼消化道饱满程度,采用0~4级法[16],共5级标准:消化道内无饵料为 “0”级,消化道内饵料不足消化道容量的1/2为“1”级,消化道内饵料超过消化道容量的1/2但未充满为“2”级,消化道内饵料充满但未膨胀为“3”级,消化道内饵料充满且膨胀为“4”级。饱满度3级和4级为摄食饱满。
1.3 数据分析
用Spss19.0计算数据平均值和标准差,用Excel进行作图。用平均值±标准差来表示形态统计值。
2 结果
2.1 饥饿组和对照组仔鱼形态与组织结构变化
花鲈对照组仔鱼全长和卵黄囊、油球大小的变化结果见表1,初孵仔鱼卵黄囊体积为(2.157 4±0.105 9)mm3,油球体积为(0.031 3±0.007 3) mm3,刚开始完全为内源性营养,卵黄囊和油球逐渐被吸收,体积减小,至4日龄时开始从外界获取营养物质,进入混合营养期,6日龄时卵黄囊、油球吸收完毕,进入外源营养期。
饥饿组和对照组仔鱼全长变化见图1,花鲈初孵仔鱼全长((4.0±0.06) mm),在3日龄前,仔鱼全长平稳增长,日增长率为 3.76%;在4至6日龄(混合营养期),对照组全长增长加快,日增长率达4.24%,饥饿组增长缓慢,日增长率为3.42%,达到最大体长4.63 mm;7~11日龄(外源营养期),仔鱼从外界获取营养物质,对照组保持稳定增长,日增长率为4.63%,饥饿组体长出现负增长,日减少率为1.74%。
2.2 初次摄食率及不可逆点
花鲈仔鱼饥饿组初次摄食率变化见图2,实验结果表明,在水温为(21±1)℃的培养条件下,仔鱼从4日龄,开始摄食且摄食率比较低,仅为10.00%;5~7日龄,大部分仔鱼开始摄取外源营养物质,初次摄食率逐步升高;8日龄,摄食强度最高,最高初次摄食率为86.67%;10日龄,仔鱼初次摄食率降为40.00%;11日龄,仔鱼身体发生弯曲变形,沉在水体底部,已失去正常摄食能力,大部分已死亡;12日龄,仔鱼全部死亡。综上所述,花鲈仔鱼耐受饥饿的临界点在9~10日龄之间,PNR期的时间为2 d。

表1 花鲈仔鱼对照组仔鱼全长和卵黄囊、油球的变化
注:“—”表示卵黄囊、油球消失,不作测量。
Note: “—”denoted the yolk sac and oil globule was absorbed completely and was not measured.
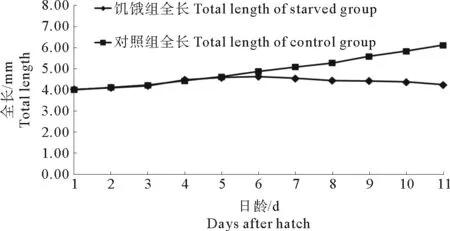
图1 花鲈仔鱼饥饿组和对照组全长变化对比
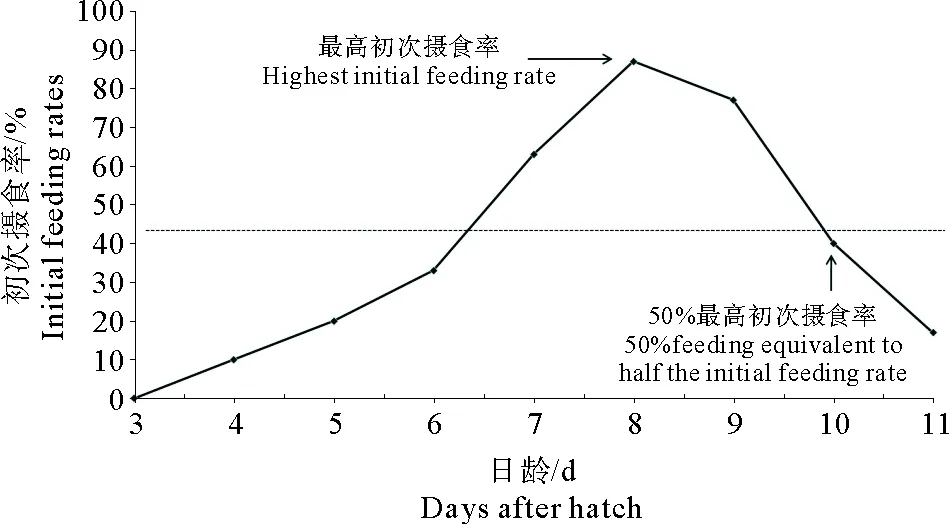
图2 花鲈仔鱼的初次摄食率
2.3 仔鱼摄食节律
仔鱼昼夜摄食节律见图3与4,早期仔鱼(5日龄)各时间点摄食率均不高,仅在14:00和20:00摄食率超过50%,分别为70.0%和66.7%,消化道饱满度较高,少数个体4级、多数个体2级、3级;晚期仔鱼(11日龄)在各时间段均维持较高的摄食率,14:00和20:00摄食率超过80.0%,最高摄食率为86.7%,但仍未达到100%,仅在2:00摄食率低于50.0%,为46.7%,在各时间段消化道饱满度均较高,均能发现达到4级的个体。
3 讨论
3.1 饥饿对仔鱼生长、形态的影响
仔鱼期是鱼类生活史中最为关键的阶段,当仔鱼期的卵黄囊耗尽,必须尽快使仔鱼获取外源营养物质,早期仔鱼在饥饿状态下无自身物质可供消耗,既要保证基础生存,又需进行各器官的发育、完善,使得仔鱼因饥饿而受到的损伤难以修复,影响仔鱼后期的成活率[17-18]。仔鱼在饥饿状态下缺乏能量来源,鱼体内消化器官组织结构、消化酶活力、血液组分都会有适应性变化[19-20]。本实验中,饥饿组部分花鲈仔鱼肠道变窄、变短,肌肉萎缩,头颈部逐渐弯曲,身体逐渐变黑、消瘦,呈现出头大、身体小的佝偻状(见图5),大部分个体静伏于水体底部,受到惊吓后能够做短时间的不规则运动,少部分个体悬浮在水体中部,部分个体浮于水体表面。

图3 花鲈仔鱼5日龄摄食节律及饱满度

图4 花鲈仔鱼11日龄摄食节律及饱满度
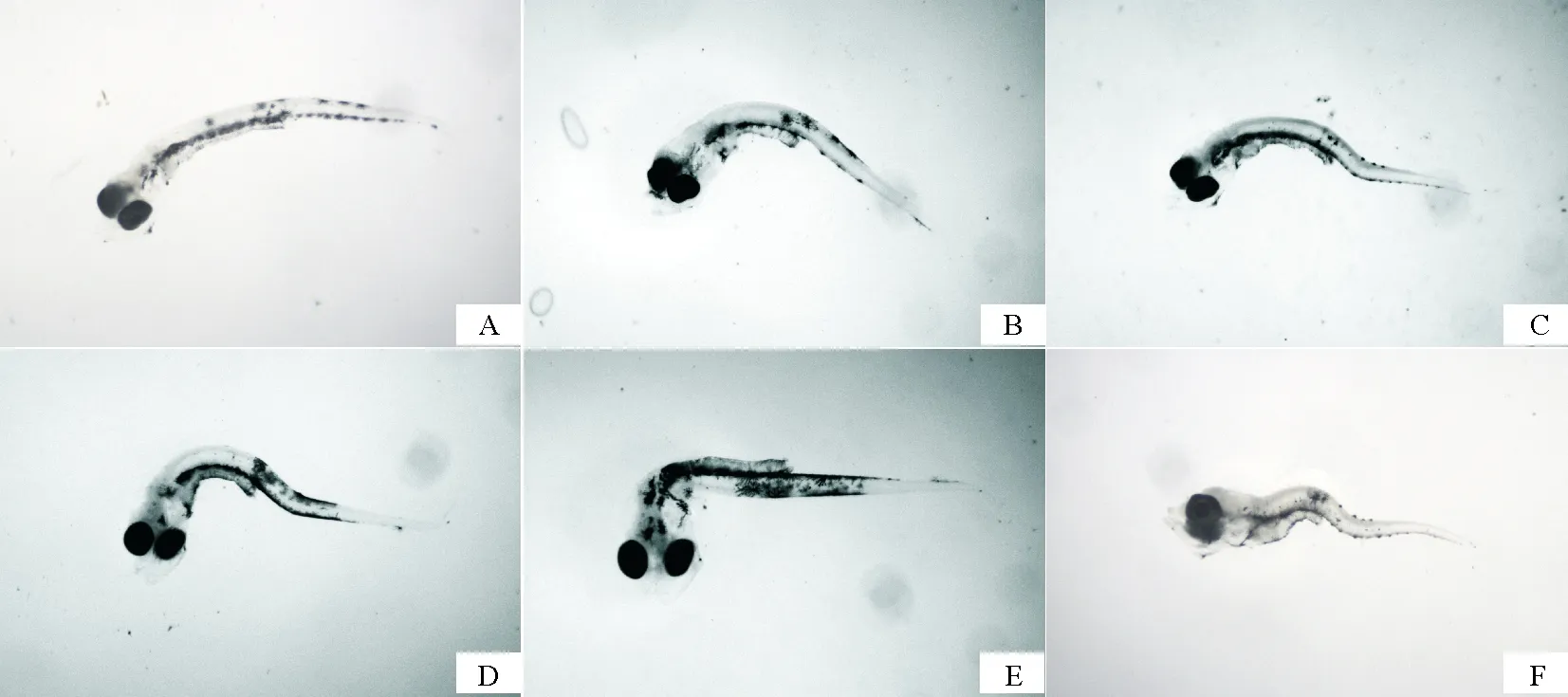
图5 花鲈仔鱼饥饿状态下形态变化图
根据Farris[21]和钱周兴[22]等指出,初孵仔鱼的生长经过3个阶段:全卵黄营养的快速生长阶段;卵黄殆尽、四处觅食的慢速生长阶段;卵黄耗尽、不能建立外源营养摄食的负生长阶段。本实验温度为(21±1)℃,饥饿组初始体长为4.02 mm,以3.70%的增速迅速生长,在混合营养期以3.42%的速度保持慢速增长,并在6日龄达到最大全长4.63 mm,6日龄后,仔鱼既无卵黄囊营养,也没有外源性营养,开始以1.74%的负增长率进入负增长阶段。花鲈仔鱼全长与杂交鳢[23]仔鱼全长变化趋势基本一致,仔鱼全长在卵黄囊期后逐渐减小。饥饿会刺激仔鱼提高摄食能力,加强其游动水平以寻求食饵,而这种耗能会以仔鱼生长和发育为代价。在培育期间要在混合营养期加强投喂,以减少仔鱼生长发育发生不可逆变化的概率,影响仔鱼成活率。
3.2 仔鱼的开口时间
培育水温的高低是影响仔鱼开口时间的重要因素,温度直接影响仔鱼代谢速率、生长发育等。据研究,在水温8.0~13 ℃条件下,花鲈仔鱼14日龄开口摄食[24];水温15.5~16.5 ℃条件下,花鲈仔鱼孵出约6d开口摄食[25]。水温18.5~19.0 ℃条件下,花鲈仔鱼5日龄开口摄食[26]。本研究中,仔鱼期的培育水温为(21±1) ℃,4日龄开口摄食。说明在一定适宜范围内,随着培育水温的提升,仔鱼开口时间不断提前,与马旭洲[27]等对瓦氏黄颡鱼(Pelteobagrusvachelli)的研究结果一致。
初次摄食时间与鱼的种类、培育水温、开口饵料种类等有关,开口时间是多种因素综合作用的结果。在本实验中,(21±1) ℃条件下,仔鱼在孵化后的第4天开口摄食,比张雅芝对花鲈[25](6日龄,水温15.5~16.5 ℃)的研究提早2d,比兰俊全[26](5日龄,水温18.5~19.0 ℃)的研究提早1 d。
3.3 初次摄食率与不可逆点
在饥饿条件下,花鲈仔鱼的初次摄食率同大多数种类仔鱼一致,从较低的初始值到峰值,再下降到0。花鲈仔鱼初次摄食率较低,与多数卵生硬骨鱼类仔鱼情况相近[28],摄食率较低可能是由于仔鱼的摄食效率较低,鱼类仔鱼期摄食效率与饵料密度、仔鱼和食饵对象的游速、光照等相关[29]。本研究中仔鱼初次摄食率为10%明显高于鮸(Miichthysmiimy)的2.3%[30],与哲罗鱼(Huchotaimen)的10%相持平[31]。通常用仔鱼初摄食率的高低来衡量其摄食能力的强弱,花鲈仔鱼最高初次摄食率出现在第8日龄,为87%,并持续了1d时间。高于大泷六线鱼[4](Hexagrammosotakii)的65%持续1d、杂交鳢[23](Channamaculata♀ ×C.argus♂)的70%持续1d,而低于美洲西鲱[5](Alosasapidissima)的89%持续1d、唐鱼[28](Tanichthysalbonubes)的100%持续1d,这说明花鲈仔鱼的摄食能力要强于大泷六线鱼和杂交鳢,弱于美洲西鲱和唐鱼。
不可逆点最早由Blaxter和Hempel[1]于1963年首次提出,指仔鱼在饥饿状态下失去摄食能力的临界点,仔鱼过了该点时,虽然还能生存一段时间,但已不具备摄食能力,亦称“不可逆转饥饿”或“生态死亡”。本研究中,花鲈仔鱼3日龄以开始形成鳔,4日龄已经充气,开始摄食,5日龄部分仔鱼已建立巡游模式。4日龄初次摄食率为10.0%,8日龄达到最高初次摄食率86.7%,卵黄囊已耗尽,大部分仔鱼完成了从内源性营养至外源性营养的转换,混合营养期(4~5日龄)仅为2 d,9和10日龄,初次摄食率为76.7%和40%,说明花鲈仔鱼的不可逆点时间点在9和10日龄之间。花鲈仔鱼从开口摄食到不可逆点仅5~6 d,混合营养期仅2 d,说明在此温度下花鲈仔鱼生长发育较快,培育过程中要及时进行投喂,避免延迟投喂所造成的严重影响。
3.4 临界期与巡游模式
临界期是指仔鱼从内源性营养转向外源性营养时,仔鱼发生大量死亡的危险期,Hjort[32]首先将这一概念用于海水鱼类种群丰富度的变动,临界期是一个内在的危险期。本研究中在(21±1) ℃条件下,花鲈仔鱼4日龄初次摄食率10%,进入混合营养期,6日龄卵黄囊已耗尽,进入外源营养期,摄食率在2 d的混合营养期内以83%的日均增长率迅速提高,仔鱼混合营养期较短,较低的初次摄食率说明大部分仔鱼刚开口时难以从外界获得营养源,对仔鱼生长发育及存活有一定影响,而较高的日增长率说明,已开口摄食的的仔鱼能够正常摄食生物饵料,同时大部分仔鱼能在卵黄囊耗尽前成功过渡到外源营养期。
花鲈初孵仔鱼的游泳模式类似于鲱(Clupeaharengus)、鳕(Gadousmacrocephaius)等一般小型海洋鱼类卵黄囊期仔鱼的早期游泳模式[33-34],由阵发性快速游泳并伴随相对较长时间的间歇期组成。卵黄囊的吸收伴随着视觉和运动器官的发育完善,仔鱼的巡游模式亦逐步完善,巡游模式的建立是仔鱼开始获得外源性营养的先决条件[33],由此可见本研究中花鲈仔鱼初次摄食率较低可能是由于巡游模式并未建立完善,仔鱼在饥饿条件下会加速卵黄囊的吸收,完善各视觉、运动器官,从外界寻求能量来源,这也符合本研究中在临界期摄食率迅速提升的现象。
3.5 早、晚期仔鱼的昼夜摄食节律
不同鱼类有各自的摄食节律,同一种鱼在不同环境和发育阶段,其摄食节律也有一定差异。Hemifan[35]将鱼类的摄食分为晨昏摄食、白天摄食、夜间摄食和无明显摄食节律4种;Azzaydi[36]等以欧洲海鲈(Dicentrarchuslabrax)为对象,分别在08:00~09:00、16:00~17:00、00:00~01:00 3个时间点进行投喂,发现海鲈的摄食节律根据水温和光周期进行变化,午后的摄食活动最明显,摄食率最高,光照减弱,摄食活动亦减弱;视觉器官是发育最早的感觉器官 (与摄食相关的),王小平[37]等以10日龄花鲈仔鱼为对象,在10 lx条件下,发现实验组仔鱼以“S”形姿态摄食轮虫(身体弯成字母“S”形,然后向食物进攻),无轮虫组仔鱼散乱活动,没有表现任何向性,证明视觉在仔鱼早期的摄食中起了关键作用;兰俊全[24]等研究得出40日龄前花鲈仔鱼,摄食高峰在午后到傍晚这段时间,其中18:00前后消化道饱满度最高。本研究中,由于考虑到生产培育中夜间会使用人工光源,故将夜间光照控制在200~250 lx,研究发现,早期仔鱼(5日龄)在14:00和20:00摄食率较高,消化道饱满度多为2、3级,同时也仅在这2个时间点发现了饱满度达4级的个体;晚期仔鱼(11日龄)在各时间点均有较高摄食率与摄食量,白天(14:00)的摄食率(86.7%)明显高于夜晚(2:00)的摄食率(46.7%),同时在各时间点均能发现饱满度达4级的个体,说明晚期仔鱼较早期仔鱼摄食活动明显增强,摄食量增加。结果表明花鲈仔鱼摄食活动主要在白天进行,特别是午后到傍晚阶段,在夜间弱光照下也会进行低强度的摄食活动,对生产中加快花鲈仔鱼培育进程有参考意义。
4 结语
在(21±1)℃水温条件下,花鲈仔鱼4日龄开口摄食,混合营养期仅为2 d,需及时进行投喂;6日龄仔鱼能够完全适应外界营养;9和10日龄之间抵达不可逆点。花鲈仔鱼摄食活动在午后到傍晚阶段最为活跃,夜间人工光照下也会进行低强度的摄食活动。进入不可逆期的仔鱼肥满度与摄食活动明显低于正常仔鱼,这为判断仔鱼饥饿程度提供了新依据,完善了人工花鲈苗培育的理论基础。
[1] Blaxter J H S, Hempel G. The Influence of Egg Size on Herring Larvae (Clupea harengus L.)[J]. Ices Journal of Marine Science, 1963, 28(2):211-240.
[2] 夏连军,施兆鸿,陆建学.黄鲷仔鱼饥饿试验及不可逆点的确定[J]. 海洋渔业, 2004(4): 286-290. Xia L J, Shi Z H, Lu J X. Experimental starvation onDentextumifronslarvae and definition of the point of no return[J]. Marine Fisheries, 2004(4): 286-290.
[3] 王有基, 宋立民, 姚荣荣, 等. 泥鳅仔鱼发育、摄食与不可逆点的确立[J]. 水利渔业, 2007(6): 17-20. Wang Y J, Song L M, Yao R R, et al. The definition of point of no return of larvae and feeding characteristics and development ofMisgurnusanguillicaudatuslarvae[J]. Reservoir Fisheries, 2007(6): 17-20.
[4] 菅玉霞,房慧,张少春,等. 大泷六线鱼仔鱼饥饿试验及不可逆点的研究[J]. 海洋科学, 2014(3):111-115. Jian Y X, Fang H, Zhang S C, et al.Starvation and no return point study ofHexagrammosotakiiJordan et Starks larvae[J]. Marine Sciences, 2014(3): 111-115.
[5] 高小强,洪磊,刘志峰,等. 美洲西鲱仔鱼不可逆点及仔、稚鱼摄食特性研究[J]. 水产学报, 2015(3): 392-400. Gao X Q, Hong L, Liu Z F, et al. The definition of point of no return of larvae and feeding characteristics ofAlosasapidissimalarvae and juveniles[J]. Journal of Fisheries of China, 2015(3): 392-400.
[6] 许郑超,王国成,刘青,等. 金鲫仔鱼的饥饿实验和不可逆点研究[J]. 水产养殖, 2015(4): 14-19. Xu D C, Wang G C, Liu Q, et al. Experimental starvation on Gold Crucian Carp larvae and determination of the point of no return[J]. Aquaculture, 2015(4): 14-19.
[7] 王茂元. 斑鳜仔鱼饥饿试验及不可逆点的确定[J]. 广东海洋大学学报, 2015(4): 99-103. Wang M Y. Starvation test on Siniperca scherzeri larvae and acertaining the point of no return[J]. Journal of Guangdong Ocean University, 2015(4): 99-103.
[8] 成庆泰, 郑葆珊. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987: 327-332. Cheng Q T, Zheng B S. Fish system retrieval of China[M]. Beijing: Science Press,1987:327-332.
[9] 谢凤才,温海深,张美昭. 我国海产花鲈繁养现状及淡化养殖技术[J]. 现代农业科技,2012,19:267-269. Xie F C, Wen H S, Zhang M Z. Breeding status and freshwater culture technology ofLateolabraxjaponicusin China[J]. Modern Agricultural Science and Technology,2012,19:267-269.
[10] 张美昭,高天翔,阮树会,等. 花鲈人工育苗技术的研究[J]. 青岛海洋大学学报(自然科学版), 2001(3): 339-344. Zhang M Z, Gao T X, Ruan S H, et al. Study on the technique of artificial seeding production ofLateolabraxjaponicus[J]. Periodical of Ocean University of Qingdao, 2001(3): 339-344.
[11] 朱艺峰,林霞,关文静,等. 花鲈在短期周期性饥饿下的补偿生长[J]. 水产科学, 2007(11): 597-600. Zhu Y F, Lin X, Guan W J, et al. Compensatory growth in Japanese Sea PerchLateolabraxjaponicusduring short period starvation[J]. Fisheries Science, 2007(11): 597-600.
[12] 王永新,陈建国,孙帼英. 温度和盐度对花鲈胚胎及前期仔鱼发育影响的初步报告[J]. 水产科技情报, 1995(2): 54-57. Wang Y X, Chen J G, Sun G Y. Effects of temperature and salinity on embryo and early larvae development in common sea bass,Lateolabraxjaponicus[J]. Fisheries Science & Technology Information, 1995(2): 54-57.
[13] 殷名称. 鱼类早期生活史研究与其进展[J]. 水产学报, 1991(4):348-358. Yin M C. Advances and studies on early life history of fish[J]. Journal of Fisheries of China ,1991(4):348-358.
[14] Houde E. Fish early Life dynamics and recruitment variability[J]. Am Fish Soc Symp, 1987(2):17-29.
[15] 竺俊全,李明云,邵全利,等. 花鲈仔稚幼鱼的形态特征及其生态习性的研究[J]. 海洋科学,2000, 12:38-42. Zhu J Q, Li M Y, Shao Q L, et al. Studies on the morphological characteristics and the ecology ofLateolabraxjaponicuslarval, juvenile fish[J]. Marine Sciences, 2000, 12:38-42.
[16] 苏锦祥. 鱼类学与海水鱼类养殖[M]. 北京:中国农业出版社, 2000: 292-302. Su J X. Fish science and marine fish culture[M]. Beijing: China Agriculture Press, 2000: 292-302.
[17] Mehner T, Wieser W. Energetics and metabolic correlates of starvation in juvenile perch (Percafluviatilis)[J]. Journal of Fish Biology, 1994, 45(45):325-333.
[18] Preez H H D, Mclachlan A, Marais J F K. Oxygen consumption of a shallow water teleost, the spotted grunter,Pomadasyscommersonni(Lacépéde, 1802)[J]. Comparative Biochemistry & Physiology Part A Physiology, 1986, 84(1):61-70.
[19] 胡麟,吴天星. 饥饿对鱼类生理生化的影响[J]. 水利渔业, 2007(1): 7-9. Hu L, Wu T X. Effects of starvation on hematological and blood biochemical indices of fish[J]. Reservoir Fisheries, 2007(1): 7-9.
[20] Wen X, Chen L, Ku Y, et al. Effect of feeding and lack of food on the growth, gross biochemical and fatty acid composition of juvenile crab, Eriocheir sinensis[J]. Aquaculture, 2006, 252(s2-4):598-607.
[21] FARRIS, David A. A Change in the Early Growth Rates of Four Larval Marine Fishes1[J]. Limnology & Oceanography, 1959, 4(1):29-36.
[22] 钱周兴,徐永清,方一峰. 饥饿对鱼类的影响[J]. 生物学通报, 2006(6): 9-11. Qian Z X, Xu Y Q, Fang Y F. Effects of starvation on fish[J]. Bulletin of Biology, 2006(6): 9-11.
[23] 马建波,茅沈丽,梁桂洪,等. 杂交鳢仔鱼饥饿试验及不可逆点的确定[J]. 水生态学杂志, 2012(3):90-95. Ma J B, Mao S L, Liang G H, et al. Starvation and point of no return in Hybrid Snakehead larvae[J]. Journal of Hydroecology, 2012(3):90-95.
[24] 胡先成,曹双俊,周忠良,等. 花鲈的胚胎发育和仔鱼发育[J]. 水产科技情报, 1995(5): 195-198. Hu X C, Cao S J, Zhou Z L, et al. Embryonic and larval development ofLateolabraxjaponicus[J]. Fisheries Science & Technology Information, 1995(5): 195-198.
[25] 张雅芝,郑金宝,谢仰杰,等. 花鲈仔、稚、幼鱼摄食习性与生长的研究[J]. 海洋学报(中文版), 1999(5): 110-119. Zhang Y Z, Zheng J B, Xie Y J, et al. The feeding habits and growth of larval, juvenile and youngLateolabraxjaponicus[J]. Periodical of Ocean University of China, 1999(5): 110-119.
[26] 竺俊全,李明云,吴锡科. 花鲈仔稚鱼的生长发育与摄食节律研究[J]. 浙江海洋学院学报(自然科学版), 2002(3):210-215. Zhu J Q, Li M Y, Wu X K. Study on the growth and feeding rhythm of larval and juvenile ofLateolabraxjaponicus[J]. Journal of Zhejiang Ocean University (Natural Science), 2002(3): 210-215.
[27] 马旭洲,王武,甘炼,等. 延迟投饵对瓦氏黄颡鱼仔鱼存活、摄食和生长的影响[J]. 水产学报, 2006(3): 323-328. Ma X Z, Wang W, Gan L, et al. Effects of delayed feeding on survival , feeding and growth ofPelteobagrusvachellilarvae[J]. Journal of Fisheries of China, 2006(3): 323-328.
[28] 陈国柱,方展强. 饥饿对唐鱼仔鱼摄食和生长的影响[J]. 动物学杂志, 2007(5): 49-61. Chen G Z, Fang Z Q. Effects of Starvation on Feeding and Growth of the Larvae ofTanichthysalbonubes[J]. Chinese Journal of Zoology, 2007(5): 49-61.
[29] 殷名称. 鱼类仔鱼期的摄食和生长[J]. 水产学报, 1995(4): 335-342. Yin M C. Feeding and growth of the larva stage of fish[J]. Journal of Fisheries of China, 1995(4): 335-342.
[30] 彭志兰,柳敏海,傅荣兵,等. 早繁鮸鱼仔鱼饥饿试验及不可逆点的确定[J]. 海洋渔业, 2007(4): 325-330. Peng Z L, Liu M H, Fu R B, et al. Experiment on the starvation and determination of the point of no return for the ahead of schedule breeding larvae ofMiichthysmiiuyBasilewsky[J]. Marine Fisheries, 2007(4): 325-330.
[31] 张永泉,尹家胜,杜佳,等. 哲罗鱼仔鱼饥饿实验及不可逆生长点的确定[J]. 水生生物学报, 2009(5): 945-950. Zhang Y Q, Yin J S, Du J, et al. Experimental starvation onhuchotaimenand definition of the point of no return[J]. Acta Hydrobiologica Sinica, 2009(5): 945-950.
[32] Hjort J. Fluctuations in the great fisheries of Northern Europe viewed in the light of biological research[J]. Rapp. P.-V. RPuti. Cons. Inr. E, 1914, 20(1): 228.
[33] 殷名称, Blaxter J H S. 海洋鱼类仔鱼在早期发育和饥饿期的巡游速度[J]. 海洋与湖沼,1989(1): 1-9. Yin M C, Blaxter J H S. Cruising speeds during early development and starvation of marine fish larvae[J]. Oceanologia et Limnologia Sinica,1989(1): 1-9.
[34] Hunter J R,1981, Feeding ecology and predation of marine fish larvae[M]∥ Lasker R. Marine Fish Larvae. Seattle and London: University of Washington: 33-77.
[35] Helfman G S. Fish Behaviour by Day, Night and Twilight[M]∥ Behaviour of Teleost Fishes. US: Springer, 1993: 366-387.
[36] Azzaydi M, Madrid J A, Zamora S, et al. Effect of three feeding strategies (automatic, ad libitum demand-feeding and time-restricted demand-feeding) on feeding rhythms and growth in European sea bass (DicentrarchuslabraxL.)[J]. Aquaculture, 1998, 163(s3-4):285-296.
[37] 王小平,单保党,洪万树,等. 花鲈视觉发育与摄食行为的关系[J]. 厦门大学学报(自然科学版), 1999(2):171-175. Wang X P, Shan B D, Hong W S, et al.The relation between feeding behaviour and vision development ofLateolabraxjaponicus[J]. Journal of Xiamen University(Natural Science), 1999(2):171-175.
责任编辑 朱宝象
Determination of Irreversible Starvation Point and Feeding Rhythm ofLateolabraxmaculatusLarvae
WANG Xiao-Long, WEN Hai-Shen, ZHANG Mei-Zhao, LI Ji-Fang, ZHANG Kai-Qiang, WANG Wei, LIU Yang, TIAN Yuan, CHANG Zhi-Cheng
(Key Laboratory of Mariculture (Ocean University of China), Ministry of Education, Qingdao 266003, China)
Abstract: In order to determine the irreversible point and feeding rhythm ofLateolabraxmaculatuslarvae,L.maculatuslarvae were obtained by artificially induced spawning and hatching at (21±1)℃ and salinity 26. The results showed that the larvae opened mouth in 4 days after hatching, mixed nourishment in only 2 days, with yolk sac completely absorbed in 6 days after hatching. The total length of the larvae of starvation group increased first and decreased then with some larvae exhibited a physical abnormality. Under sunlight (500~800 lx) in daytime and lamplight (200~250 lx) in night, the feeding rate of early-stage larvae (5 days after hatching) was higher than 50% at 14:00 and 20:00, and the feeding rate of late-stage larvae (11 days after hatching) was higher than 50% at 8:00, 14:00 and 20:00. Therefore,L.maculatustypically fed only in daytime, and the feeing peak period gradually prolonged with growth. At (21±1)℃, the best feeding time was on day 4 after hatching, the irreversible starvation point arrived on days 9~10 after hatching, and the feeding period sustained from afternoon to evening.
Lateolabraxmaculatus; larva; starvation; irreversible starvation point; feeding rhythm
国家“十二五”国家科技支撑计划项目(2011BAD13B03);东营市渔业科技项目(20150217)资助 Supported by the Plan in the Nation Science & Technology Pillar Program during the Twelfth Five-year Plan Period(2011BAD13B03) and Fishery science and technology project of Dongying City(20150217)
2016-03-30;
2016-10-12
王晓龙(1994-),男,硕士生,研究方向:鱼类生理学。E-mail:sheldon89898899@163.com
❋❋ 通讯作者:E-mail: wenhaishen@ouc.edu.cn
S917.4
A
1672-5174(2017)05-057-08
10.16441/j.cnki.hdxb.20160100
王晓龙,温海深,张美昭,等. 花鲈初孵仔鱼饥饿不可逆点的确定及摄食节律研究比[J].中国海洋大学学报(自然科学版),2017, 47(5): 57-64.
WANG Xiao-Long, WEN Hai-Shen, ZHANG Mei-Zhao, et al. Determination of irreversible starvation point and feeding rhythm ofLateolabraxmaculatusLarvae [J].Periodical of Ocean University of China, 2017, 47(5): 57-64.
