姜黄素联合热疗对人黑素瘤A375细胞毒性的实验研究
2017-04-09郝慧霞李桂梅
郝慧霞,李桂梅,莎 娜
黑素瘤[1](melanoma)是由黑素细胞异常过度增殖引发的肿瘤,多为恶性,称为恶性黑素瘤(malignant melanoma),多发生于皮肤及皮肤-黏膜交界处、眼脉络膜和软脑膜。大部分转移性恶性黑素瘤对多种化疗药物抵抗[2],因此,治疗恶性黑素瘤是亟待攻克的难题。黑素瘤在中国的发病率并不是很高,约占全部恶性肿瘤的1%[3]。研究表明[4],从传统中药姜黄中提取的姜黄素,对黑素瘤、乳腺癌、肺癌、宫颈癌、前列腺癌、肝癌等恶性肿瘤有较好的疗效,且没有明显的不良反应。
姜黄素是从草本植物姜黄的根茎中提取出来的一种酚类色素,具有抗炎、抗氧化及抗肿瘤等作用[5],而热疗可以提高化疗药物的敏感性[6]。本研究诣从细胞水平上探讨姜黄素联合热疗对人恶性黑素瘤A375细胞毒性是否存在协同效应,为临床上姜黄素联合热疗治疗皮肤恶性黑素瘤提供理论依据。
1 材料与方法
1.1 细胞及主要试剂
人恶性黑素瘤细胞株A375(北京协和细胞资源中心),噻唑蓝(MTT)及姜黄素试剂(美国Sigma公司),DMEM(高糖)培养基(Thermo公司),胎牛血清(天津市灏洋生物制品科技有限公司)。
1.2 方法
1.2.1 细胞培养 取人恶性黑素瘤A375细胞,培养于含10%胎牛血清、青霉素和链霉素各100 μg/ml的DMEM培养基,置于37 ℃、5%CO2饱和湿度环境的培养箱中常规传代培养,待生长至对数生长期,用0.25%胰酶消化,机械吹打成细胞悬液,调细胞浓度为2×105/ml,接种于96孔细胞培养板,每孔100 μl,在37 ℃、5%CO2孵箱中培养24 h待细胞贴壁后备用;调浓度为4×105/ml人恶性黑素瘤A375细胞接种于25 ml培养瓶,在37 ℃、5%CO2孵箱中培养24 h待细胞贴壁后备用。
1.2.2 试剂配置 取姜黄素0.1842 g,用100 μl 二甲基亚砜溶解后,再用无水乙醇定容至100 ml,此即为5×103μmol/L姜黄素母液。取5×103μmol/L姜黄素母液2 ml,用培养基定容至100 ml,此姜黄素浓度为100 μmol/L,0.22 μm滤器过滤,分装每管10 ml、-20℃避光冻存、备用。
1.2.3 细胞活性比较 取备用细胞板随机作为30 μmol/L姜黄素组、单纯热疗组(43℃恒温水浴箱60 min)、30 μmol/L姜黄素联合热疗组(加完姜黄素后,放到43℃恒温水浴箱60 min)和对照组(加相同剂量的培养液),各组移入37 ℃、5%CO2孵箱中继续培养24 h,收获细胞前4 h,每孔分别加入20 μl MTT,37 ℃、5%CO2饱和湿度条件下再培养4 h,终止培养,吸去孔内培养液,每孔加入150 μl二甲基亚砜振荡10 min,于波长570 nm处测定吸光度(A值)。细胞增殖抑制率[7]=(对照组A值-对照组A值)×100%/对照组A值。
1.2.4 剂量反应关系 取备用细胞板随机作为0、10、20、30、40、50 μmol/L的姜黄素联合热疗组,在37 ℃、5%CO2孵箱中继续培养24 h后,重复1.2.3实验步骤。
1.2.5 流式细胞仪检测细胞凋亡(Annexin V-PI双染法)
取备用细胞瓶作对照组、30 μmol/L姜黄素联合热疗组、50 μmol/L姜黄素联合热疗组,在37℃、5%CO2孵箱中继续培养48 h后,收集细胞,调整细胞浓度1×106/ml,磷酸盐缓冲液(PBS)洗2次,70%冷乙醇固定,上机前过40目网调细胞数1×106/ml,碘化丙啶(PI)染色,流式细胞仪检测,Cell Quest软件收集细胞,Modi fi t软件分析处理数据。
1.3 统计学方法
利用SPSS 22.0软件进行统计学分析,资料描述均采用x¯±s表示;多组均数的比较采用单因素方差分析;多组率的比较采用非参数H检验;剂量反应关系采用Spearman秩相关分析,P<0.05为差异有统计学意义。
2 实验结果
2.1 基本情况
倒置显微镜下观察人恶性黑素瘤A375细胞(图1),镜下可见其贴壁生长,呈梭形或不规则多角形,形态饱满,中央有核,核较圆。常规胰酶消化后,细胞逐渐变圆。随着姜黄素浓度的升高,细胞变圆脱壁,坏死、漂浮细胞增多,经Giemsa染色,随着姜黄素浓度的升高,显微镜下可见大量A375细胞核固缩、细胞核边缘化、核膜裂解、出现无核细胞、空泡细胞(图2-图4)。

图1 正常A375细胞对照组(×10倍)

图2 30 μmol/L姜黄素+热疗(×10倍)
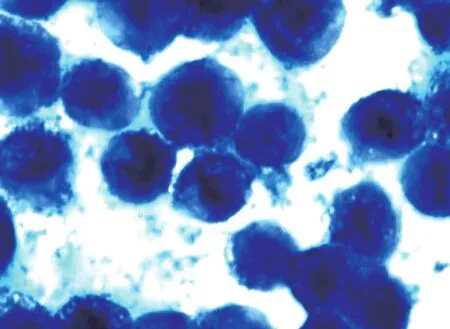
图3 30 μmol/L姜黄素+热疗(Giemsa染色×100倍)
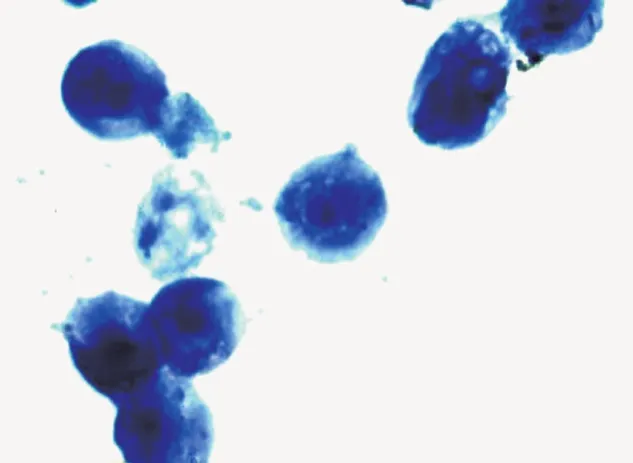
图4 50 μmol/L姜黄素+热疗(Giemsa染色×100倍)
2.2 细胞活性比较
与对照组相比,30 μmol/L姜黄素组、单纯热疗组、联合组的细胞活性均有不同程度的抑制,以联合组的细胞抑制率最高(45.95%),差异具有统计学意义(F=5.47,P<0.01)。联合组的细胞抑制率显著高于30 μmol/L姜黄素组和热疗组(P<0.01),30 μmol/L姜黄素组细胞抑制率高于热疗组11.71%,且差异有统计学意义(P<0.01)(表1)。
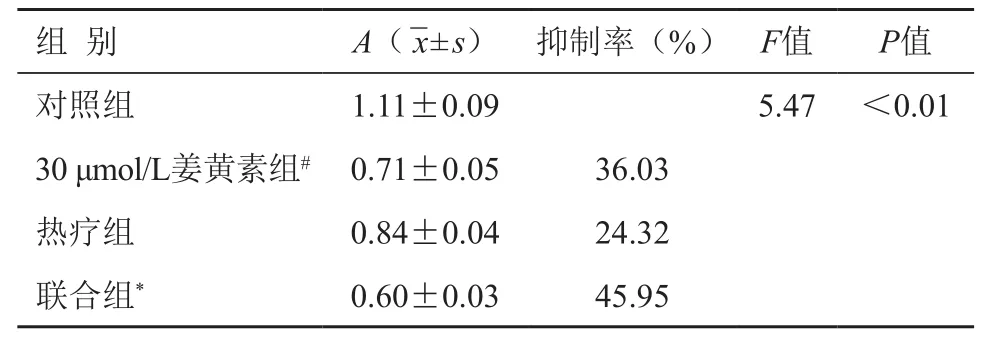
表1 不同处理因素对A375细胞增殖活性的影响
2.3 剂量反应关系
A375细胞经10、20、30、40、50 μmol/L的姜黄素联合热疗处理后,随着姜黄素浓度的增加,A375细胞增殖抑制率也增加,并呈剂量依赖性,姜黄素浓度与A375细胞增殖抑制率存在正相关(rs=0.95)(表2)。
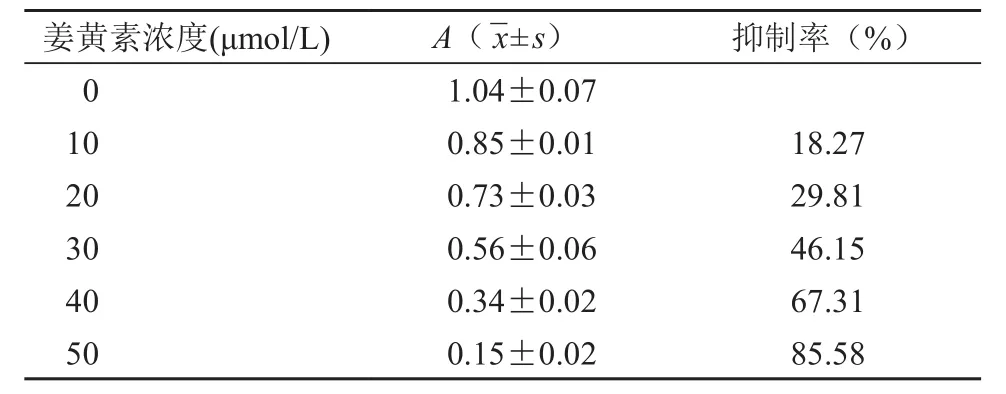
表2 不同浓度姜黄素联合热疗抑制A375细胞增殖剂量反应关系
2.4 流式细胞仪检测结果
不同处理因素诱导 A375细胞凋亡的毒性效应经流式细胞仪检测,与对照组相比,各处理因素组细胞早期凋亡率均增加。对照组、30 μmol/L姜黄素组、热疗组、30 μmol/L 姜黄素联合热疗组细胞早期凋亡率分别为4.27%、22.01%、17.14%和31.56%,差异具有统计学意义(H=15.37、P<0.01)。
3 讨论
黑素瘤是一种源于皮肤正常黑素细胞的高度恶性肿瘤,发展迅速,恶性程度高,预后较差,病死率高[8,9],其易复发和转移,预后较差,发生远处转移的5年生存率低于5%。
姜黄素[5,9](C21H20O6,分子量368.37)是从姜黄属植物如姜黄、莪术等的根或茎中提取的一种有效成分,中医认为有理气、清热和散结的功效,盛产于东南亚地区和澳大利亚及我国南部。热疗是一种治疗恶性肿瘤有效的辅助方法,其基本原理是利用物理方法将肿瘤区域或全身组织加热到42.5~43.5 ℃,并维持一定时间,达到能破坏肿瘤细胞又不损伤正常组织的目的。目前热疗已被认为继手术治疗、放疗、化疗和生物免疫治疗后出现的治疗肿瘤有效方法[10],成为肿瘤综合治疗有效的手段之一,同时因热疗不会对环境产生任何不良影响,因此被称为“绿色治疗”。
我们乘坐电梯并习以为常,殊不知,它也是一个默默付出不求回报的劳动者,小作者善于挖掘电梯不为人知的另一面,让诗歌变得新奇有深意。
本次研究结果显示,与对照组相比,30 μmol/L姜黄素组、单纯热疗组、30 μmol/L姜黄素联合热疗组的细胞活性均有不同程度的抑制,但以联合组的细胞抑制率最高,且差异具有统计学意义(P<0.01)。说明姜黄素联合热疗有明显抑制A375细胞生长、增殖的作用,这与文献报告基本一致。邱实和谭升顺[11]研究显示,姜黄素能抑制人恶性黑素瘤A375细胞的增殖活性,其对人恶性黑素瘤A375细胞的毒性与姜黄素浓度成正相关关系和明显剂量-效应关系。Weber等[12]研究认为姜黄素可以靶向性地抑制转录因子NF-kB的诱导活化作用,阻碍细胞株抗凋亡机制的运行,促使癌细胞凋亡。也有研究认为[13]姜黄素诱导肿瘤细胞凋亡是通过下调Bcl-2[14]及p53的表达,从而控制细胞凋亡。A375细胞增殖抑制率与姜黄素浓度存在正相关关系(rs=0.95),A375细胞增殖抑制率呈剂量依赖性,说明姜黄素联合热疗对恶性黑素瘤A375细胞的增殖抑制作用为协同相加作用,而不是拮抗作用。经流式细胞仪分析,不同处理因素诱导A375细胞凋亡的毒性效应,一方面显示30 μmol/L姜黄素联合热疗组细胞早期凋亡率分别高于30 μmol/L姜黄素组和热疗组9.6%和14.42%,这说明热疗具有增敏姜黄素的细胞毒性作用,姜黄素联合热疗对肿瘤细胞的毒性高于单纯姜黄素和热疗作用[15]。热疗对肿瘤细胞毒性机制较复杂,目前认为热疗一方面增强自然杀伤细胞活性,促进白细胞介素2和肿瘤坏死因子的生成,提高机体免疫功能,促进肿瘤细胞消除,另一方面刺激机体高表达热休克蛋白,它可参与特异性抗肿瘤免疫反应,抑制肿瘤生长和诱导肿瘤细胞凋亡[16]。
本次研究发现,姜黄素联合热疗对人恶性黑素瘤A375细胞的毒性起协同相加作用,热疗可加强姜黄素抑制A375细胞增殖的作用、提高姜黄素诱导A375细胞凋亡的敏感性和增敏姜黄素的细胞毒性。但细胞实验外用于临床治疗,还需要进一步的探索和研究。
【参 考 文 献】
[1] 张学军. 皮肤性病学 [M]. 6版. 北京, 人民卫生出版社,2004:203-204.
[2] Molife R, Hancock BW. Adjuvant therapy of malignant melanoma [J].Crit Rev Oncol Hematol,2002, 44(1):81,102.
[3] Li XY, Sun JF, Hu SQ, et al. Icariin induced B16 melanoma tumor cells apoptosis, suppressed tumor growth and metastasis [J]. Iran J Public Health, 2014, 43(6):847-848.
[4] Tan Q, Wu J, Li Y, et al. A supermolecular curcumin for enhanced antiproliferative and proapoptotic activities: molecular characteristics, computer modeling and in vivo pharmacokinetics [J].Nanotechnology, 2013, 24(3):035102.
[5] Fang J, Lu J, Holmgren A. Thioredoxin reductase is irreversibly modified by curcumin: a novel molecular mechanism for its anticaneeractivity [J]. J Bid Chem, 2005, 280(26):25284-25290.
[6] Blackham AU, Swett K, Eng C, et al. Perioperative systemic chemotherapy for appendiceal mucinous carcinoma peritonei treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy [J]. J Surg Oncol, 2014 ,109(7):740-745.
[7] 王芳, 林新瑜, 刘刚, 等. 白细胞介素-22对人表皮黑素细胞生物活性的影响 [J]. 实用皮肤病学杂志, 2014, 7(4):246-249.
[8] Naksuriya O, Okonogi S, Schiffelers RM, et al. Curcumin nanoformulations: a review of pharmaceutical properties and preclinical studies and clinical data related to cancer treatment [J].Biomaterials, 2014, 35(10):3365-3383.
[9] 余美荣, 蒋福升, 丁志山. 姜黄素的研究进展 [J]. 中草药, 2009,40(5):828-831.
[10] 蒋东, 郑世营, 陈锁成. 全身热疗与肿瘤细胞凋亡的研究进展 [J].医学综述, 2008, (1):50-52.
[11] 邱实, 谭升顺. 姜黄素对人黑素瘤A375细胞增殖及凋亡的影响 [J].中国皮肤性病学杂志, 2009, 23(11):7056-7070.
[12] Weber WM, Hunsaker LA, Roybal CN, et al. Curcumin(diferulo ylmethane) inhibts constitutive NF-κB activation, induces G1/S arrest, suppresses proliferation, and induces apoptosis in mantle cell lymphoma [J]. Bioorganic &Medicinal Chemistry, 2006, 14:2450.
[13] 田慧军, 王笛乐. 姜黄素诱导人结肠癌细胞株SW480 凋亡及其bcl-2 表达相关性研究 [J] . 肿瘤防治研究, 2006, 33 (3) :185-187.
[14] 卫艳萍, 史四季, 张如幸, 等. 槲皮素对人黑素瘤A375细胞增生和凋亡的影响 [J]. 实用皮肤病学杂志, 2016, 9(3):171-174.
[15] 李石伟, 刘跃明. 姜黄素联合热疗对Hep22 细胞凋亡及细胞周期的影响 [J]. 中国实验诊断学, 2009, 13(11):1616-1617.
[16] Morita M, Kuwano H, Araki K, et al. Prognostic significance of lymphocyte in fi ltration following preoperative chemo-radio therapy and hyperthermia for esophageal cancer [J]. Int J Radiat Oncol Biol Phys, 2001, 49(5):1259-1266.
