3种水产致病弧菌的生长速度对比研究
2017-04-06罗凯艾克特夏理海李由申张进雄
罗凯,艾克特,夏理海,李由申,张进雄
许巧情,郜卫华
3种水产致病弧菌的生长速度对比研究
罗凯,艾克特,夏理海,李由申,张进雄

采用LB液体培养基,按照1∶500的比例对鳗弧菌(Vibrioanguillarum)、溶藻弧菌(V.alginolyticus)和河流弧菌(V.fluvialis)进行扩大培养,并测定不同时间段细菌培养液光密度D600nm值和重量来间接反映其生长情况。结果显示,鳗弧菌在5.75h时D600nm为1.046,溶藻弧菌在4.5h时D600nm为1.064,河流弧菌在3.75h时D600nm为1.071。这表明河流弧菌生长速度最快,溶藻弧菌次之,鳗弧菌生长速度最慢。
鳗弧菌(Vibrioanguillarum);溶藻弧菌(V.alginolyticus);河流弧菌(V.fluvialis);生长速度
弧菌能够诱发多种养殖动物产生疾病,常引起疾病大面积爆发,不仅发病率较高,严重的甚至导致死亡。这在南美白对虾的养殖中最为突出,给南美白对虾的养殖带来巨大的经济损失。鉴于此,有关弧菌的致病原理、鉴定方法和防治措施等报道较多[1~4]。据有关资料显示,溶藻弧菌(Vibrioalginolyticus)、鳗弧菌(V.anguillarum)、河流弧菌(V.fluvialis)、霍乱弧菌(V.cholerae)、哈维氏弧菌(V.harveyi)、鱼肠道弧菌(V.ichthyoenteri)、灿烂弧菌(V.splendidus)、副溶血性弧菌(V.parahaemolyticus)、创伤弧菌(V.vulnificus)、杀鲑弧菌(V.salmonicida)、美人鱼弧菌(V.damsela)、奥氏弧菌(V.ordalii)、费氏弧菌(V.fischeri)、鲨鱼弧菌(V.carchariae)、海利斯顿氏弧菌(V.pelagius)及最小弧菌(V.mimicus)等多种弧菌可以引发相关鱼类爆发疾病[5~11],其中的一些种类甚至会导致其他动物和人类致病[12~16]。本研究通过生长试验比较了鳗弧菌、溶藻弧菌和河流弧菌的生长速度,以期为相应疾病的防治提供参考。
1 材料与方法
1.1 菌种来源及活化
菌种来源:鳗弧菌、溶藻弧菌和河流弧菌菌种均为上海海洋大学所赠。
菌种活化:将-80℃冰箱冻存的菌种置于37℃的水浴锅中解冻溶解,然后放入到新制备的 5mLLB液体培养基(1%胰蛋白胨、0.5%酵母提取物、1%氯化钠)中在37℃、220r/min的转速下培养12h。将培养培养12h的菌液采用细菌平板涂布的方法,接种到LB固体培养基(1%胰蛋白胨、0.5%酵母提取物、1%氯化钠、1.2%琼脂糖)中,在恒温培养箱中37℃培养12h,培养后的细菌放入到4℃冰箱保存待用。
1.2 试验方法
将上述鳗弧菌、溶藻弧菌和河流弧菌的固体培养基取出后放置于洁净工作台中,严格按照无菌操作的要求,分别挑取鳗弧菌、溶藻弧菌和河流弧菌的单个菌落放置于装有5mL新配制的LB 液体培养基的EP管中,在37℃、220r/min的转速下培养6h后,以LB 液体培养基作为基准,利用紫外分光光度计测定3种致病弧菌菌体悬浮培养液的D600nm值。每间隔10min测定1次,待D600nm达到1.0时,停止培养。再将D600nm达到1.0的3种弧菌培养液分别取出100μL,按照1∶500的比例加入到装有50mL新配制的LB液体培养基的培养瓶中进行扩大培养,每种弧菌扩大培养3组。
利用配制的LB液体培养基作为参照,测定每种弧菌在不同培养时间段的D600nm值,取其平均值并记录数据。同时分别取对应时间段的弧菌培养液1mL于已称其重量的EP管中,利用高速离心机12000r/min离心1min,使弧菌菌体沉淀于EP管底部,用移液枪尽可能取尽上清LB液体,称量并计算对应时间段菌体重量,取其平均值并记录数据。
2 结果与分析
2.1 鳗弧菌的生长速度
图1A为鳗弧菌菌液在不同培养时间的光密度D600nm,图1B为每毫升鳗弧菌菌液在不同培养时间的菌体重量。由图1可知,鳗弧菌在LB 液体培养基中37℃、220r/min的转速下培养,5.75h后D600nm为1.046,其在0~5.5h之间生长速度不断加快,而5.5~5.75h之间生长速度减慢。
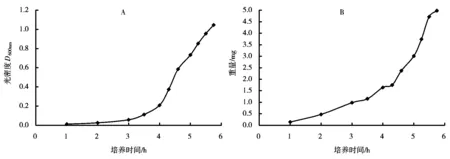
图1 不同培养时间的鳗弧菌菌液D600nm值(A)和菌体重量(B)
2.2 溶藻弧菌的生长速度
图2A为溶藻弧菌菌液在不同培养时间的光密度D600nm,图2B为每毫升溶藻弧菌菌液在不同培养时间的菌体重量。由图2可知,溶藻弧菌在LB 液体培养基中在37℃、220r/min的转速下培养,4.5h后D600nm为1.064,其在0~4.25h之间生长速度不断加快,在4.25~4.5h之间生长速度有放缓的趋势。
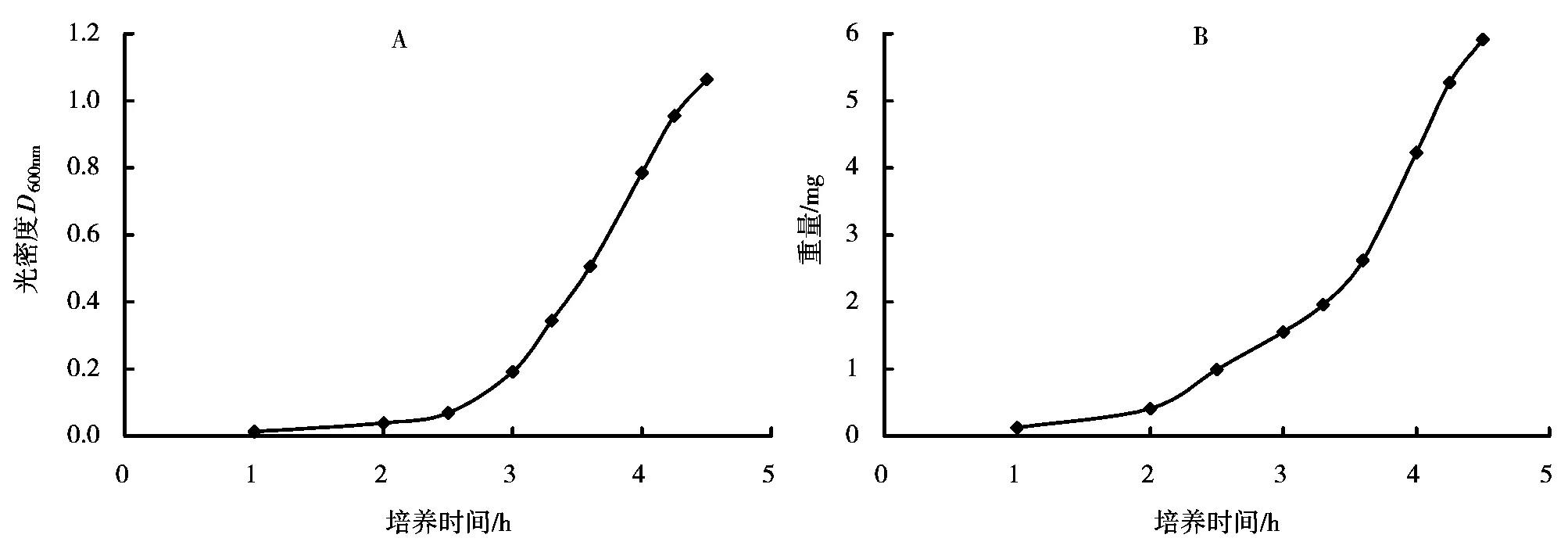
图2 不同培养时间的溶藻弧菌菌液D600nm值(A)和菌体重量(B)
2.3 河流弧菌生长速度结果
图3A为河流弧菌菌液在不同培养时间的光密度D600nm,图3B为每毫升河流弧菌菌液在不同培养时间的菌体重量。由图3可知,河流弧菌在LB液体培养基中在37℃、220r/min的转速下培养,3.75h后D600nm为1.071,其在0~3.5h之间生长速度不断加快,在3.5~3.75h之间生长速度稍有减慢。
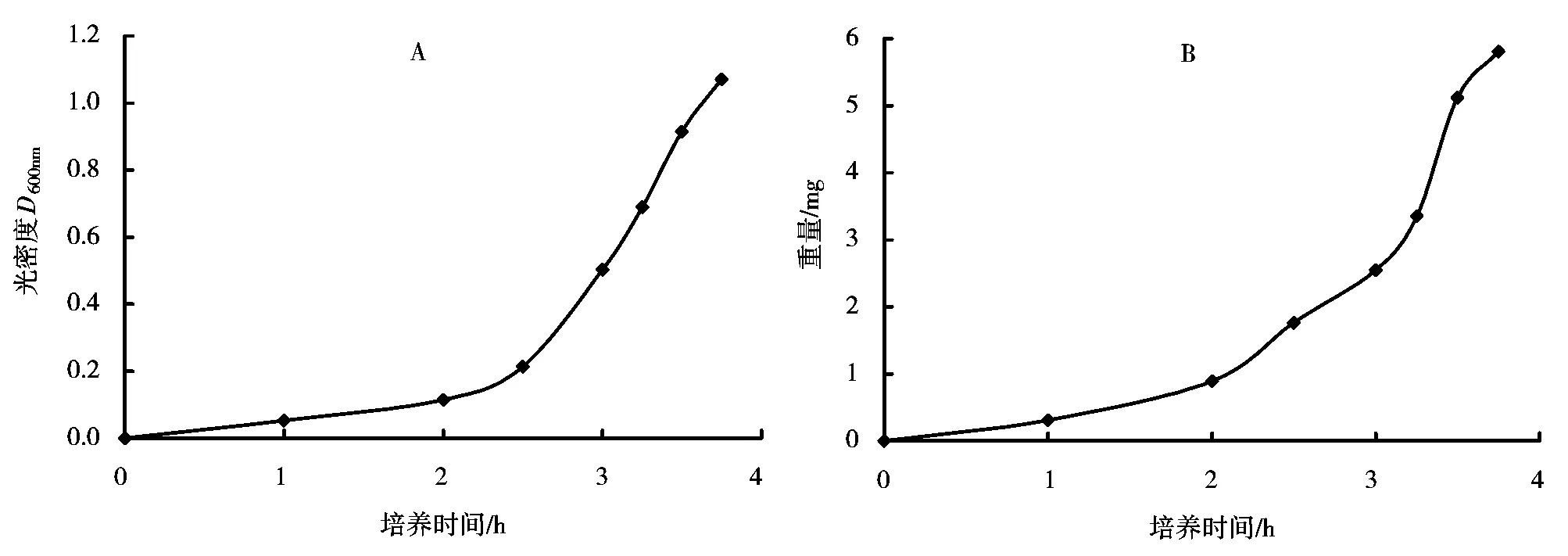
图3 不同培养时间的河流弧菌菌液D600nm值(A)和菌体重量(B)
3 讨论与小结
细菌最常见的生长繁殖方式是细胞壁沿着横向开始分裂开而形成2个子代细菌,结合细菌在培养基中生长的特点将细菌的生长分为4个主要阶段:适应阶段、对数生长阶段、稳定阶段和衰亡阶段[17]。适应阶段主要是细菌对环境的适应,数目基本保持不变,仅仅是细菌个体增大,极少细菌出现分裂;对数生长阶段细菌大量生长繁殖,呈对数增长;平衡阶段是受环境的限制,细菌数目维持在稳定状态;衰亡阶段细菌开始出现大量死亡,活菌数减少。通过细菌生长速度的研究,可以了解细菌的生长规律,对科研、生产等具有重要意义。
本研究比较了3种常见的水产致病弧菌(鳗弧菌、溶藻弧菌和河流弧菌)在LB培养基中的生长规律,间接反应其在水生动物中的致病能力。朱苏琴[18]在研究河流细菌突变株生长曲线时,利用1∶100的比例扩大培养,在条件为28℃、120r/min的转速下培养了23h,根据酶标仪测得的D550nm为0.7,并绘制出河流弧菌突变株的生长曲线。与本研究相比,虽然培养条件不同,但是细菌在波长为600 nm时有最大吸收峰,同时弧菌最佳培养温度在35℃附近[19,20],因此本研究测定的鳗弧菌在LB液体培养基中37℃、220r/min下培养,5.75h后D600nm为1.046,在0~5.5h生长速度加快,5.5~5.75h生长速度减慢的结果更符合细菌生长的一般规律。程海燕[21]将3种溶藻弧菌突变株(ΔtoxR、ΔacfA、C-acfA)分别接种到TSB培养基中,扩大培养前原菌液D600nm为0.5,然后按照1∶1的比例,在28℃、200r/min的条件下培养,在4~5h之间溶藻弧菌的D600nm达到1.0。本研究在LB液体培养基中37℃、220r/min下培养,4.5h后其菌液的D600nm为1.064,0~4.25h生长速度加快,4.25~4.5h生长速度减慢,但减慢趋势不明显,两者结果基本一致,但温度和扩大培养的倍数不同,有关温度、培养基种类和扩大培养倍数对结果的影响需要进一步探讨。有关鳗弧菌生长速度的研究较少,因此本研究发现其在LB液体培养基中37℃、220r/min下培养,5.75 h后D600nm为1.046,0~5.5h生长速度加快,5.5~5.75h生长速度减慢。测定这3种致病性弧菌的生长速度,在生产实践中具有重要的意义,可以间接反映致病性弧菌在侵袭动物科学宿主到爆发疾病,再到疾病传播的速度,可让生产者及时采取预防和治疗措施,减少经济损失。比较3种致病性弧菌的生长速度可以发现,在37℃的条件下,河流弧菌生长速度最快,因此河流弧菌在进入机体后能够快速地达到对数生长期,大量繁殖并产生细菌毒素,对鱼体能够造成快速损伤,所以当生产者发现河流弧菌感染时,应该尽早采取紧急治疗措施,减少经济损失;鳗弧菌生长速度最慢,而溶藻弧菌生长速度介于河流弧菌和鳗弧菌之间,说明溶藻弧菌和鳗弧菌侵入机体时,致病速度相对较慢,可以采取抗生素治疗的同时利用中草药制剂增加鱼体的抗病能力达到治愈的目的。但是疾病的发生与传播还受宿主生理条件、侵入的数量和种类、环境条件等因素影响,所以生产实践种应视具体情况采取适当预防措施。
[1]胡梦华,马立才,赵姝,等.一株致病性溶藻弧菌的多重耐药与毒力基因分子分析[J].海洋渔业,2015,37(6):557~563.
[2]张德福,樊晓琳,付绪磊,等.巢式PCR快速检测海产品中的副溶血弧菌[J].现代食品科技,2015,31(11):307~312.
[3]郭静,Liswaniso,郭安南,等.溶藻弧菌相关分离株的分子及VITEK 鉴定[J].水产学报,2012,36(3):383~390.
[4]程蝶,柴方超,蔡怡,等.环介导等温扩增联合横向流动试纸条可视化检测哈维氏弧菌的研究[J].生物技术通报,2016,32(6):60~68.
[5]Lai Y,Tao J,Sun C,etal.Biological characteristics and histopathological observation ofVibrioalginolyticusfrom diseased fish [J].Acta Microbiologica Sinica,2014,54:1378~1384.
[6]Zhang Z H,Wu H H,Xiao J F.etal.Immune responses of zebrafish (Daniorerio) induced by bath-vaccination with a live attenuatedVibrioanguillarumvaccine candidate[J].Fish and Shellfish Immunology,2012,33:36~41.
[7]朱苏琴,纪荣兴,苏永全,等.河流弧菌(Vibriofluvialis)对大黄鱼(Pseudosciaenacrocea)鳃粘液粘附特性研究[J].海洋与湖沼,2012,43(2):389~393.
[8]Mateo D R,Spurmanis A,Siah A,etal.Changes induced by two strains ofVibriosplendidusin haemocyte subpopulations ofMyaarenaria,detected by flow cytometry with Lyso Tracker[J].Diseases of Aquatic Organisms,2009,86:253~62.
[9]夏青,王宝杰,刘梅,等.哈维氏弧菌浸浴后凡纳滨对虾肠道组织病理变化及转录水平的免疫应答[J].水产学报,2015,39(10):1521~1529.
[10]闫茂仓,陈少波,单乐州,等.海水养殖动物致病弧菌的研究进展[J].水产科学,2009,28(8):475~481.
[11]段亚飞,梁俊平,李吉涛,等.鳗弧菌感染对脊尾白虾鳃组织抗氧化酶系统的影响[J].水产科学,2015,34(11):667~672.
[12]李艳,陈清,申洪.创伤弧菌攻击对人脐静脉内皮细胞系的影响[J].中国组织工程研究与临床康复,2010,14(15):2783~2786.
[13]芮浩鹏.从鱼到人:主要病原性弧菌的致病机理研究[D].上海:华东理工大学,2010.
[14]杨少丽,王印庚,董树刚.海水养殖鱼类弧菌病的研究进展[J].海洋水产研究,2005,26(4):75~83.
[15]张金金,扈庆华,李连青.副溶血弧菌的致病性及检测方法[J].分子诊断与治疗杂志,2014,6(4):274~278.
[16]吴后波,潘金培.病原弧菌的致病机理[J].水生生物学报,2003,27(4):422~426.
[17]孙斌.微生物生长曲线曲线方程讨论[J].辽阳石油化工高等专科学校学报,2002,18(3):4~6.
[18]朱苏琴.河流弧菌对大黄鱼粘液的粘附作用研究[D].厦门:集美大学,2012.
[19]Griffitt K J,Grimes D J.A novel agar formulation for isolationand direct enumeration ofVibriovulnificusfrom oyster tissue [J].Journal of Microbiological Methods,2013,94:98~102.
[20]陈春梅,陈锦春.水产品中创伤弧菌的选择性分离[J].检验检疫科学,2007,17(6):37~39.
[21]程海燕.溶藻弧菌毒力相关基因toxR、acfA的功能研究[D].湛江:广东海洋大学,2014.
[编辑] 余文斌
2016-09-29
湿地生态与农业利用教育部工程研究中心(长江大学)开放课题(KF201608)。
罗凯(1992-),男,硕士生,研究方向为名特水产养殖。通信作者:郜卫华,35507883@qq.com。
S917.1
A
1673-1409(2017)02-0025-04
[引著格式]罗凯,艾克特,夏理海,等.3种水产致病弧菌的生长速度对比研究[J].长江大学学报(自科版),2017,14(2):25~28.
