乌腺金丝桃醇溶物对二氢叶酸还原酶抑制的最佳条件及抑菌效果
2017-04-06胡竣航李臣军常桂英吉林农业科技学院生物工程学院吉林吉林132101
胡竣航,李臣军,常桂英 (吉林农业科技学院生物工程学院,吉林 吉林 132101)
乌腺金丝桃醇溶物对二氢叶酸还原酶抑制的最佳条件及抑菌效果
胡竣航,李臣军,常桂英
(吉林农业科技学院生物工程学院,吉林 吉林 132101)
为了进一步研究乌腺金丝桃(Hypericumattenuatum)的药理活性机理,为开发利用长白山特色资源提供依据,探讨了乌腺金丝桃醇溶物对二氢叶酸还原酶(DHFR)抑制的最佳条件。通过建立DHFR酶反应体系,采用分光光度法测定酶活力,分别研究了乌腺金丝桃的根、茎、叶、花的醇溶物对二氢叶酸还原酶的抑制作用。结果表明:4种醇溶物对二氢叶酸还原酶有不同程度的抑制作用,其中花的醇溶物抑制作用最为明显,抑制率为30%,最佳作用温度为40℃,最佳作用pH为7.5,添加的最适二氢叶酸底物浓度为20μL 1×10-4mol/L,最佳NADPH浓度为20μL 1×10-3mol/L,最佳巯基乙醇浓度为50μL 0.01mol/L,最佳酶用量为10μL。
乌腺金丝桃(Hypericumattenuatum);二氢叶酸还原酶;反应体系;酶抑制的最佳条件
全世界共有400余种金丝桃属(HypericumLinn)植物,我国有55种。金丝桃属植物在我国东北地区分布较少,作为药用植物的仅有2种,即长柱金丝桃[HypericumlongistylumOliv]和乌腺金丝桃[Hypericumattenuatum][1]。金丝桃属植物的化学成分研究结果表明,该属植物主要含有二蒽酮类、黄酮类、间苯三酚类和芳香酸类化合物等化学成分,具有抗菌消炎、收敛止血,以及治疗黄疸、肝炎及疮疖肿毒的作用,对心律失常、心肌缺血、心衰和增强免疫力具有较好的功效,同时还具有抗抑郁、抗肿瘤及抗病毒等活性[2]。
二氢叶酸还原酶(DHFR)可以将体内的二氢叶酸(FH2)还原为四氢叶酸(FH4),从而调节四氢叶酸的再生[3]。四氢叶酸是体内一碳单位转移酶系统中的辅酶,是由叶酸在维生素C和 NADH+存在下,经叶酸还原酶作用下生成二氢叶酸,然后由二氢叶酸还原酶催化生成四氢叶酸。四氢叶酸可传递一碳单位,参与嘌呤和嘧啶的合成,是 DNA合成所必须的,对正常血细胞的生成具有促进作用[4]。所以当叶酸缺乏或某些药物抑制叶酸还原酶,使叶酸不能转变为四氢叶酸,都可能影响血细胞的发育和成熟。同时,DHFR 的异常表达也是一些肿瘤发生、发展的原因。控制四氢叶酸的生成,成为治疗癌症药物的主要研究方向,二氢叶酸还原酶便成为抗癌药物的主要靶酶[5]。
目前已知抗肿瘤药物如氨甲蝶呤等均为DHFR抑制剂,但这些化学药物毒副作用极强。因而寻找和开发天然植物DHFR抑制剂成为抗肿瘤药物研究的重要方向[6]。乌腺金丝桃醇溶物具用明显的抗病毒、抗肿瘤活性,但从目前的研究现状来看,乌腺金丝桃主要化学成分作用机理的研究涉及的比较少,对代谢关键酶的研究还没见报道,探讨其对DHFR酶活力的影响将会对开发利用乌腺金丝桃植物资源起到积极的促进作用。
1 材料与方法
1.1 供试材料
乌腺金丝桃全草采自吉林农业科技学院乌腺金丝桃基地。巯基乙醇、磷酸钾缓冲液等生化试剂由吉林农业科技学院生物技术实验室提供。二氢叶酸和二氢叶酸还原酶为美国sigma公司产品,分析纯级。
1.2 试验仪器
摇摆式高速万能粉碎机DFY-500:江苏省江阴市万达药化机械有限公司产品;旋转蒸发仪EYELA和冷冻干燥机、真空冷冻抽滤机:日本东京理化公司产品;μ2700紫外可见分光光度计:日本岛津公司产品。
1.3 试验方法1.3.1 醇溶物的提取
采摘乌腺金丝桃全草,洗净,将其根、茎、叶、花分开,干燥后用药材量的20倍的80%乙醇浸提12h,收集醇溶液,使用旋转蒸发仪提取浸膏,冷冻干燥机干燥,再用真空冷冻抽滤机得到干燥的结晶物,置于-40℃下储存,备用。
1.3.2 DHFR反应体系的建立
用分光光度法测定DHFR酶活力,酶活力以测定NADPH特征性的340nm波长下光密度值下降速度来表示。
DHFR反应体系:于4mL比色皿中依次加入50μL二次蒸馏水,100L 50mmol/L磷酸钾缓冲溶液(pH7.5),50μL 0.01mol/L巯基乙醇,10μL 1×10-3mol/LNADPH溶液,20μL 1×10-4mol/L二氢叶酸,最后加10μL DHFR。快速混匀后分别在0、3、6、9、12、15、18min时测定340nm波长下的光密度值,建立底物与酶活力关系曲线。
酶活力定义为:每3min减少0.010个光密度为1个活力单位。
1.3.3 醇提物对DHFR酶活力的最小抑制浓度及最佳抑制条件试验
1)最小抑制浓度 准确称量乌腺金丝桃干燥结晶醇提物,配置成10、1、10-1、10-2、10-3、10-4、10-4、10-5、10-7mg/mL的溶液,分别加入反应体系,测定DHFR酶活力,确定醇提物对DHFR酶活力的最小抑制浓度。
2)最适温度 在DHFR反应体系中加入最小抑制浓度的乌腺金丝桃醇提物,在25、30、35、37、40、45、50℃下测DHFR酶活力变化,选择酶活力降低最大的温度为最适温度。
3)最适pH 在DHFR反应体系中加入最小抑制浓度的乌腺金丝桃醇提物,选择酶最适温度,在4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0 pH下测DHFR酶活力变化,选择酶活力降低最大的pH为最适pH。
4)最适二氢叶酸浓度 在DHFR反应体系中加入最小抑制浓度的乌腺金丝桃醇提物,选择最佳温度、pH,加入浓度分别为5、10、15、20、25μL 1×10-4mol/L二氢叶酸,测DHFR酶活力变化,选择酶活力降低最大的底物浓度为最适底物浓度。
5)最适NADPH浓度 在DHFR反应体系中加入最小抑制浓度的乌腺金丝桃醇提物,选择最佳温度、pH,加入浓度分别为5、10、15、20μL 1×10-3mol/L NADPH,测DHFR酶活力变化,选择酶活力降低最大的NADPH浓度为最适底物浓度。
6)最适巯基乙醇浓度 在DHFR反应体系中加入最小抑制浓度的乌腺金丝桃醇提物,选择最佳温度、pH,加入浓度分别为20、30、50、70μL 0.01mol/L巯基乙醇,测DHFR酶活力变化,选择酶活力降低最大的巯基乙醇浓度为最适添加浓度。
7)最适酶用量 在DHFR反应体系中加入最小抑制浓度的乌腺金丝桃醇提物,选择最佳温度、pH,加入浓度分别为5、10、15、20μL DHFR,测DHFR酶活力变化,选择酶活力降低最大的NADPH浓度为最适酶浓度。
8)正交试验 在上述7个试验结果后,设计7因素2水平正交试验(表1),筛选最小抑制浓度、温度、pH、二氢叶酸浓度、NADPH浓度、巯基乙醇浓度、酶浓度等的最优组合。
'

表1 正交试验因素水平表
1.3.4 抑菌试验
1)供试菌液的制备 LB培养基的配置与灭菌→细菌的活化(37℃下24h)→ 配置菌悬液备用。
2)滤纸片法抑菌效果测定 制备4种浓度分别为2、4、6、8mg/mL乌腺金丝桃醇溶物。采用滤纸片法,将直径为10mm的滤纸片灭菌后,分别浸泡于各浓度胞外粗提物溶液中2h,分别吸取0.4mL各供试菌悬液涂布于培养皿上,并且以无菌生理盐水组作对照。每个处理3个重复,置于37℃培养24h,测量各供试菌在不同浓度下的抑菌圈大小。
1.3.5 数据分析
采用SPSS 16.0对正交试验结果进行统计分析。
2 结果与分析
2.1 底物与酶活力关系曲线
利用紫外-可见分光光度计测得反应进程中NADPH在340nm处光密度的变化值,得到酶活力变化曲线(图1)。
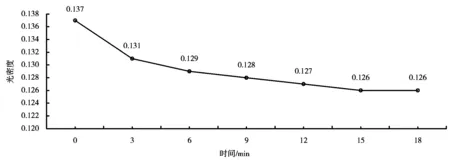
图1 酶活力变化曲线
2.2 醇提物对DHFR酶活力的最小抑制浓度
醇提物对DHFR酶活力的最小抑制浓度试验结果如图2所示。由图2可知,乌腺金丝桃4个不同器官的醇提物均表现抑制作用,其中花的抑制作用最好,花、叶、茎和根的抑制率分别为30%、26%、16%和15%,这与其主要有效成分在全草中的分布状况有关[7]。在受试浓度下,浓度越大,抑制效果越明显,选择10mg/mL为最佳抑制浓度,。
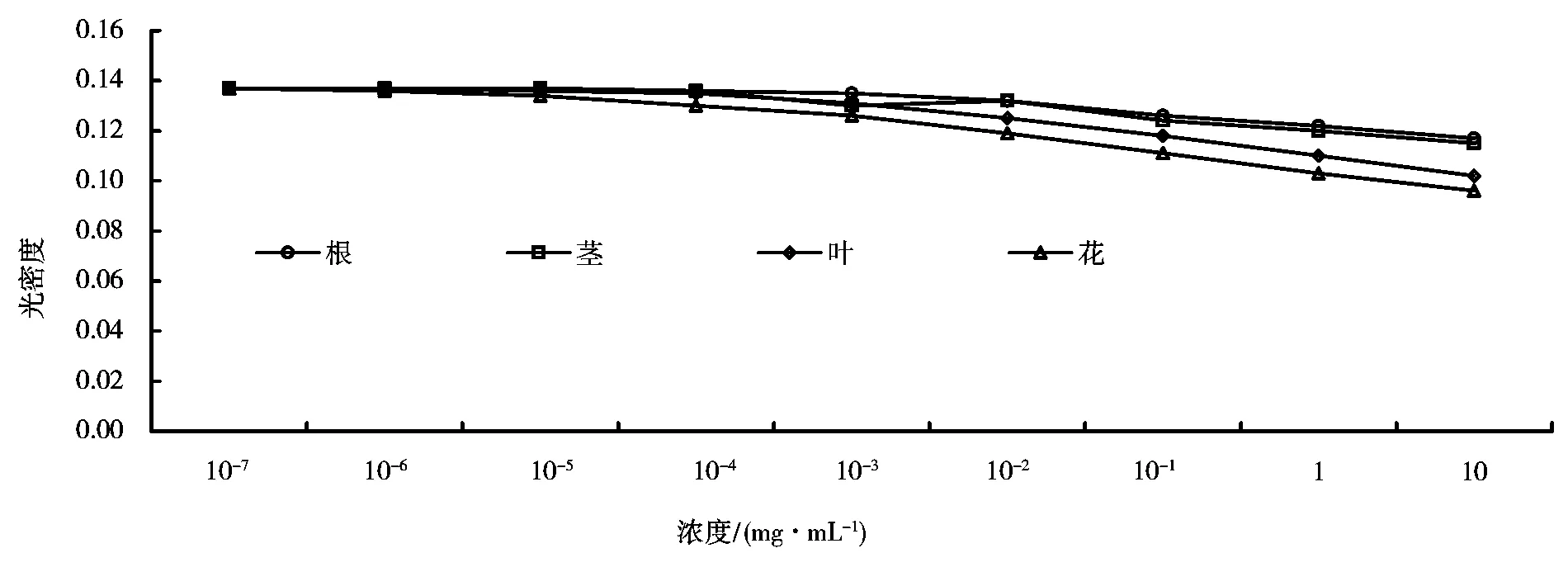
图2 醇提物对DHFR酶活力的最小抑制浓度
2.3 温度对DHFR酶活力的影响
不同温度下的DHFR酶活力测定结果如图3所示。温度变化主要是对酶的活性影响,过高过低的反应温度都会使酶活力下降,由图3可知,反应体系中酶的最佳活性温度为40℃左右。
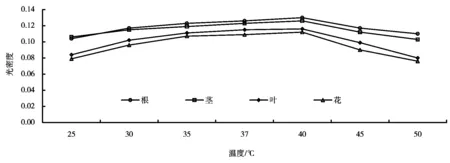
图3 不同温度下的DHFR酶活力
2.4 pH对DHFR酶活力的影响
不同pH下的酶活力测定结果如图4所示。pH对酶反应体系的影响也是对酶活性的影响,过酸或过碱会使酶活力下降,由图4可知,反应体系中酶的最佳pH为7.5。
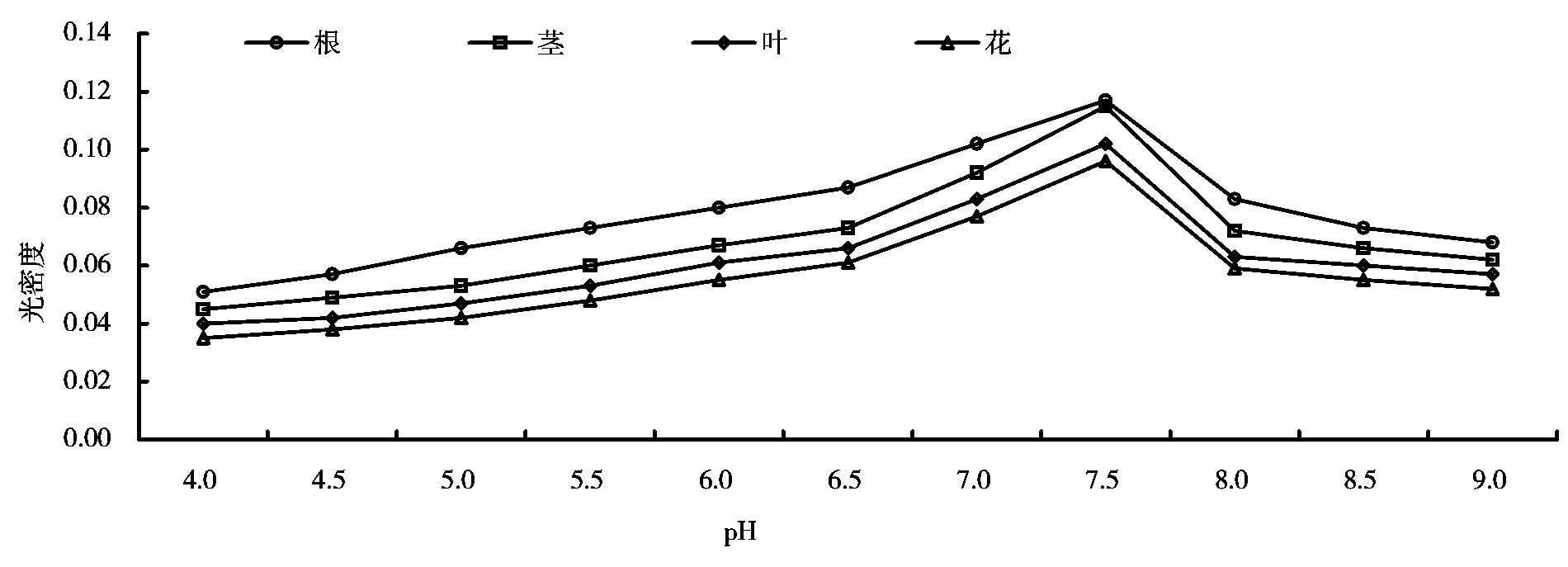
图4 不同pH下的DHFR酶活力
2.5 二氢叶酸浓度、NADPH浓度、巯基乙醇浓度以及二氢叶酸还原酶浓度对DHFR酶活力的影响
在不同二氢叶酸浓度、不同NADPH浓度、不同巯基乙醇浓度以及不同二氢叶酸还原酶浓度条件下的酶活力测定结果分别如图5~8所示。由图5~8可知,其最佳条件分别为:1×10-4mol/L的二氢叶酸加入量为20μL,1×10-3mol/L 的NADPH加入量为20μL,0.01mol/L的巯基乙醇加入量为50μL,酶的加入量为10μL。这与安会梅的研究结果相吻合[8]。
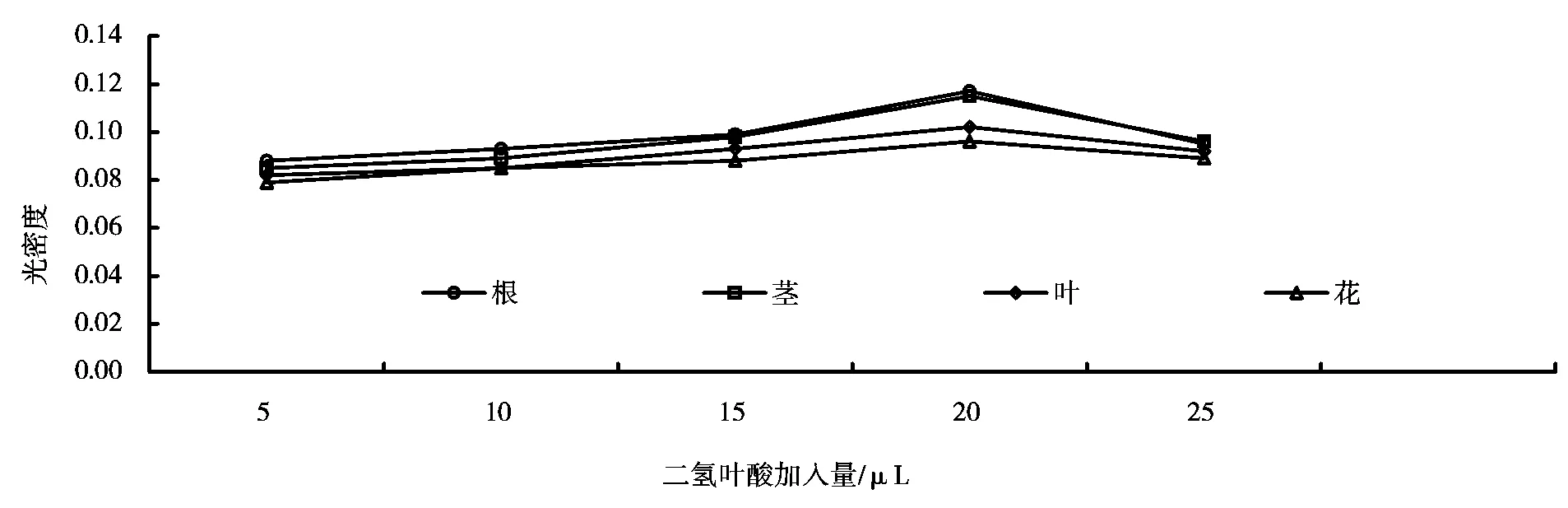
图5 不同浓度二氢叶酸下的DHFR酶活力

图6 不同浓度NADPH下的DHFR酶活力
图7 不同浓度巯基乙醇下的DHFR酶活力
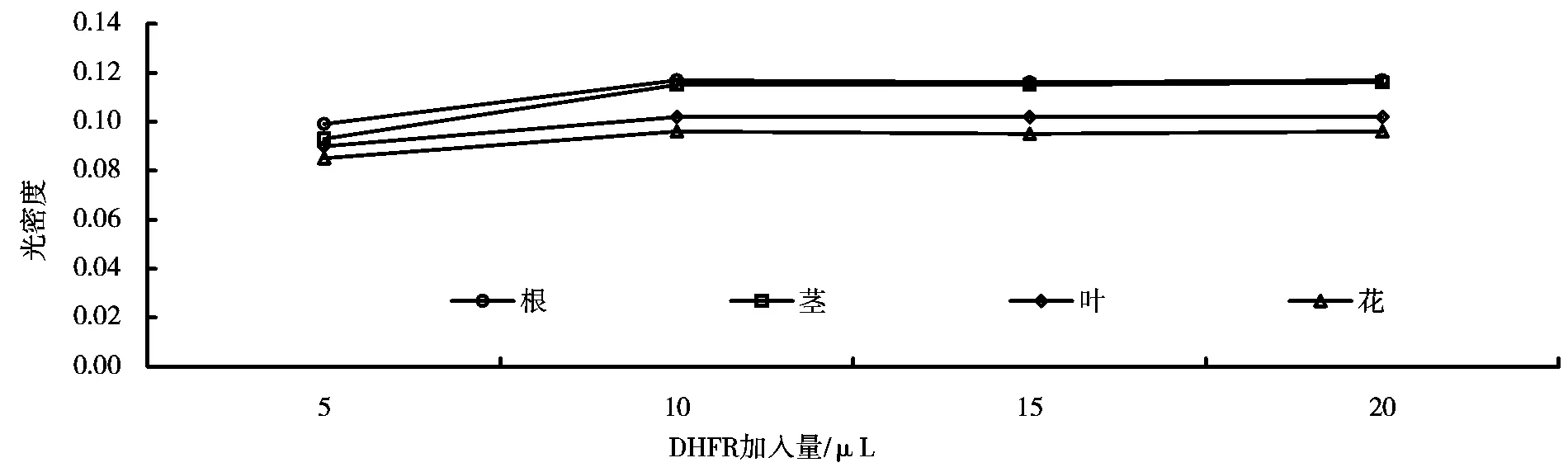
图8 不同酶浓度下的DHFR酶活力
2.6 醇提物对二氢叶酸还原酶抑制的最佳条件
正交试验结果见表2。由表2可知:影响DHFR酶活力大小的因素由大到小依次为温度、最小抑制浓度、DHFR的加入量、巯基乙醇的加入量、二氢叶酸的加入量、pH、NADPH的加入量。由极差分析可知,B因素(温度)对DHFR的活性影响最大,E因素(NADPH的加入量)的影响最小。由此可知:10mg/mL为醇提物的最佳抑制浓度,其中花的抑制作用最为明显,抑制率为30%。
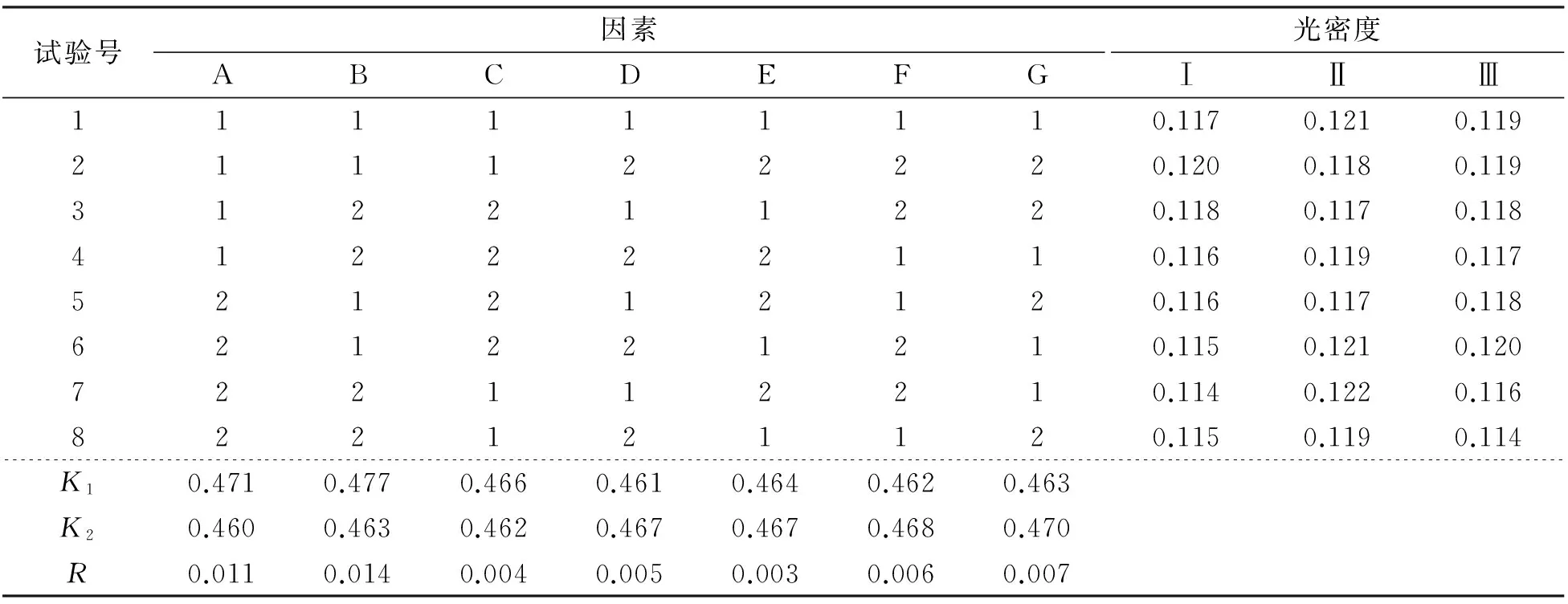
表2 正交试验结果
2.7 乌腺金丝桃醇溶物的抑菌作用
抑菌试验结果表明,乌腺金丝桃醇溶物的浓度越高,抑菌圈直径越大,胞外粗提物的浓度与抑菌效果呈正相关关系;同时,沙门氏菌、阪崎肠杆菌、大肠杆菌等革兰氏阴性菌的抑菌圈直径比较长,而四联球菌、蜡状芽孢杆菌、枯草芽孢杆菌等革兰氏阳性菌的抑菌圈直径相对较短(表3)。其原因可能是:革兰氏阳性菌能产生外毒素,在菌体开始生长的阶段,代谢旺盛,细胞增殖快,外毒素含量高,对乌腺金丝桃醇提物的活性破坏作用强,产生的抑菌效果不明显;革兰氏阴性菌能产生内毒素,在菌体生长阶段,代谢旺盛,细胞增殖快,也有少量衰亡、死亡的细胞会释放的内毒素,但其含量低,对乌腺金丝桃醇溶物的活性破坏作用弱,产生的抑菌效果明显。

表3 乌腺金丝桃醇溶物对各供试菌的抑菌效果
3 结论
本研究结果表明,乌腺金丝桃4个不同器官的醇提物对DHFR均表现抑制作用,其中花的抑制作用最强,花、叶、茎和根的抑制率分别为30%、26%、16%和15%。通过建立DHFR反应体系测定酶活力,结果表明:DHFR的最佳活性温度为40℃左右;最适pH为7.5;1×10-4mol/L的二氢叶酸最适加入量为20μL;1×10-3mol/L 的NADPH最适加入量为20μL; 1×10-2mol/L的巯基乙醇最适加入量为50μL;酶的最适加入量为10μL。抑菌试验结果表明:乌腺金丝桃醇溶物对细菌有抑制作用,并与醇溶物浓度成正相关,尤其对革兰氏阴性菌作用明显。
本研究结果表明乌腺金丝桃的醇溶物对二氢叶酸还原酶有一定的抑制作用,其结果可为以后提取工艺的优化、反应体系的优化、主要有效成分的提纯、抗肿瘤新药物的开发提供依据。
[1]张喜.乌腺金丝桃中金丝桃素的含量测定及提取纯化金丝桃素的工艺研究[D].长春:吉林大学,2011.
[2]王玲,索朗斯珠,马俊英,等.金丝桃素的提取分离及其药理活性研究现状[J].动物医学进展,2005,26(5):32~35.
[3]杨静.二氢叶酸还原酶(DHFR)与SμFμ相互作用调节Hedgehog信号通路[D].南昌:南昌大学,2013.
[4]吴嘉炜.酶的调控机制及动力学[D].北京:中国科学院生物物理研究所,1999.
[5]朱静.叶酸、核黄素缺乏及亚甲基四氢叶酸还原酶基因多态性对人类遗传物质稳定性的影响[D].昆明:云南师范大学,2006.
[6]李荣华,张增叶,崔海靖,等.抗肿瘤药物的研究进展及临床应用评价[J].中国医院用药评价与分析,2004,(1):16~19.
[7]邢桂珍.金丝桃素的提取与化学合成工艺的研究[D].兰州:中国农业科学院兰州畜牧与兽药研究所,2007.
[8]安会梅.荧光光度法二氢叶酸还原酶抑制剂筛选模型的建立和应用[D].北京:首都师范大学,2006.
[编辑] 余文斌
2016-05-29
吉林省大学生创新资助项目(2015[040]);长白山重点实验室项目(2014[s003])。
胡竣航(1994-),男,现从事生物化学与生物工程研究。通信作者:常桂英,cgy650607@126.com。
Q949.758.5
A
1673-1409(2017)02-0036-06
[引著格式]胡竣航,李臣军,常桂英.乌腺金丝桃醇溶物对二氢叶酸还原酶抑制的最佳条件及抑菌效果[J].长江大学学报(自科版),2017,14(2):36~41,45.
