紫薇茎段离体培养体系的优化
2017-04-06唐丽丹
刘 晓,李 卓,唐丽丹,王 献
(河南农业大学 林学院,河南 郑州 450002)
紫薇茎段离体培养体系的优化
刘 晓,李 卓,唐丽丹,王 献*
(河南农业大学 林学院,河南 郑州 450002)
以矮首领紫薇当年生半木质化带腋芽茎段、硬枝茎段以及叶片为外植体,从消毒时间、启动培养基、增殖培养基和生根培养基选择等方面进行离体培养体系的优化。结果表明,茎段为较好的外植体。最佳消毒时间:带腋芽茎段用0.1%升汞处理8 min,诱导率为66.67%;带水培芽茎段用0.1%升汞处理4 min,诱导率为65.55%;叶片用0.1%升汞处理4 min,诱导率为55.56%。带腋芽茎段最佳启动培养基为MS+6-BA 1.0 mg/L+NAA 0.10 mg/L,诱导率为83.33%。腋芽和水培芽的最佳增殖培养基均为MS+6-BA 2.0 mg/L+NAA 0.30 mg/L。腋芽增殖系数为2.42,芽长为3.2 cm;水培芽增殖系数为3.21,芽长为2.1 cm。腋芽最佳生根基本培养基为1/2MS,最佳生根培养基为1/2MS+IBA 0.5 mg/L,生根率为96.67%;水培芽最佳生根培养基为1/2MS+IBA 0.5 mg/L+活性炭(AC)0.1 g/L,生根率为81.25%。
矮首领紫薇; 茎段; 叶片; 组织培养
紫薇(Lagerstroemiaindica)为千屈菜科(Lythraceae)紫薇属(Lagerstroemia)落叶灌木或小乔木,别名百日红、满堂红、痒痒树,主要分布在亚洲东部、东南部以及南部的热带、亚热带地区[1]。在我国,紫薇主要分布在南部和东南地区[2]。其树姿优美,花开正值炎夏,花色艳丽,花期长,有较高的园林观赏价值,已成为部分城市的市花。矮首领紫薇(Lagerstroemiaindica‘Aishouling’)是从荷兰引进的矮化紫薇,具有矮生、株型紧凑、早花、多花、花期长、耐修剪和适应性强等优点,可用作道路绿化带、花坛的种植树种,也可作盆景供室内观花,应用价值极高,应用前景广阔。
紫薇传统的繁殖方式主要为播种和扦插。播种繁殖的后代易发生变异,不能保持母本的优良性状;扦插繁殖所得植株不会变异,繁殖速度快,但株型低矮的矮生型和匍匐型紫薇扦插成活率较低[3]。组织培养具有后代遗传稳定、繁殖速度快和繁殖系数高等特点。因此,以矮生型紫薇带芽茎段和叶片为外植体进行离体培养,分别筛选最佳消毒时间、启动培养基、增殖培养基和生根培养基,为其今后规模化生产提供科学依据和理论基础。
1 材料和方法
1.1 植物材料
试验材料为安阳农业科学院紫薇生产基地的矮首领紫薇,取其当年生半木质化带腋芽茎段、硬枝茎段和叶片为外植体。
1.2 外植体处理
5月份,选取生长健壮、无病虫害的当年生半木质化枝条和中上部叶片,分别在洗洁精溶液中清洗浸泡30 min,再用流水冲洗15 min。用纸擦干水分,将枝条在超净工作台上切成2~3 cm带1~2节的茎段。之后先用75%乙醇处理30 s,无菌水冲洗3次,再用0.1%升汞进行消毒处理。带腋芽茎段分别用0.1%升汞处理8、10、12 min,叶片分别用0.1%升汞处理4、6、8 min。无菌水冲洗5次,并用无菌滤纸吸干水分,然后分别接种到MS+6-BA 1.0 mg/L+NAA 0.1 mg/L的培养基中。每个处理接种45个外植体,每瓶接种3个,重复3次。培养20 d后,观察腋芽和叶片的生长状况,统计污染率、褐化率和诱导率。污染率=污染的外植体数/外植体总数×100%,褐化率=褐化的外植体数/外植体总数×100%,诱导率=芽萌发外植体数(诱导愈伤组织的叶片外植体数)/外植体总数×100%。
10月份,选取生长健壮、无病虫害的当年生硬枝茎段,粗度为1.5~2.0 cm,去除老叶,在洗洁精溶液中清洗浸泡30 min,再用流水冲洗15 min,放入装有清水的三角瓶中进行水培芽的培养。之后将水培芽茎段在超净工作台上切成2~3 cm带1~2节的茎段,用75%乙醇处理30 s,无菌水冲洗3次,再用0.1%升汞分别处理4、6、8 min。无菌水冲洗5次。用无菌滤纸吸干水分,分别接种到MS+6-BA 1.0 mg/L+NAA 0.1 mg/L的培养基中。每个处理接种45个外植体,每瓶接种3个,重复3次。培养10 d后,统计污染率、褐化率和诱导率。
1.3 启动培养
经灭菌处理后的叶片,后期出现褐化死亡的现象,愈伤组织诱导率较低,且几乎未分化出不定芽。因此,选用腋芽和水培芽进行启动培养。选择上述最佳的外植体处理方法进行消毒灭菌处理,然后将已灭菌的带腋芽茎段接种到以MS为基本培养基的启动培养基中进行腋芽诱导。其中,6-BA设0.5、1.0、2.0 mg/L 3个水平,NAA设0.05、0.10、0.20 mg/L 3个水平。以不添加植物生长调节剂的培养基作为对照。将水培芽茎段继续接种在MS+6-BA 1.0 mg/L+NAA 0.10 mg/L培养基中培养。培养20 d后,观察记录腋芽、水培芽的长势,统计芽长和诱导率。
1.4 增殖培养
经过启动培养,腋芽和水培芽整体上获得了较高的诱导率。待启动培养中腋芽长度为2~3 cm时,切取腋芽并转入以MS为基本培养基的增殖培养基中。增殖培养基中添加的植物生长调节剂采用两因素完全随机组合设计。其中,6-BA设0.5、1.0、2.0 mg/L 3个水平,NAA设0.05、0.10、0.20、0.30 mg/L 4个水平,共12个处理,每个处理接种30个外植体,每瓶接种3个,重复3次。将生长较好的水培芽分别接种到MS+6-BA 2.0 mg/L+NAA 0.30 mg/L、MS+6-BA 1.0 mg/L+NAA 0.10 mg/L+KT 1.0 mg/L、MS+6-BA 1.0 mg/L+NAA 0.10 mg/L+活性炭(AC)0.15 g/L培养基中进行增殖培养。每个处理接种30个外植体,每瓶接种3个,重复3次。培养30 d后观察不定芽的发生情况,统计芽长和增殖系数。增殖系数=培养30 d后总芽数/接种时总芽数×100%。
1.5 生根培养
1.5.1 基本培养基的筛选 选取长势较好、长度为2~3 cm的腋芽不定芽进行生根培养,分别接种到MS和1/2MS培养基中,均添加IBA 0.5 mg/L、NAA 0.2 mg/L。每个处理接种30个外植体,每瓶接种3个,重复3次。培养30 d后,观察根系生长状况,统计生根率和根长。生根率=生根的外植体数/外植体总数×100%。
1.5.2 腋芽不定芽的生根培养 在1/2MS培养基中分别添加不同质量浓度的IBA(0.2、0.5、1.0 mg/L)和NAA(0.2、0.5、1.0 mg/L),并设置IBA 0.5 mg/L+6-BA 0.1 mg/L和NAA 0.5 mg/L+6-BA 0.1 mg/L的2个组合处理,以不添加植物生长调节剂的培养基作为对照,共9个处理,每个处理接种30个外植体,每瓶接种3个,重复3次。40 d后统计生根率和根长。
1.5.3 水培芽不定芽的生根培养 将水培芽不定芽分别接种到1/2MS+IBA 0.5 mg/L和1/2MS+IBA 0.5 mg/L+AC 0.1 g/L的生根培养基中。每个处理接种30个外植体,每瓶接种3个,重复3次。40 d后统计生根率和根长。
1.6 培养条件
如无特殊说明,本试验中启动、增殖和生根培养基中均添加8.0 g/L琼脂、30 g/L蔗糖,pH值 5.8~6.0。培养室的温度为(23±2)℃,光照强度为1 000 lx,光照时间为12 h/d。
1.7 数据处理
试验数据采用Excel 2010进行统计,SPSS 19.0分析软件进行方差分析,邓肯式新复极差法进行比较(P<0.05)。
2 结果与分析
2.1 不同消毒时间对紫薇外植体生长的影响
不同升汞(0.1%)消毒时间对外植体褐化率、污染率和诱导率的影响不同(表1)。结果表明:0.1%升汞处理8 min,紫薇带腋芽茎段诱导率最高,达到66.67%,显著优于其他处理,褐化率最低,为33.33%,污染率相对较高;0.1%升汞处理12 min,诱导率最低,为31.11%,污染率最低,为5.56%,但褐化率最高,达68.89%。0.1%升汞处理4 min,紫薇带水培芽茎段诱导率最高,为65.55%,显著优于其他处理,褐化率最低,为34.45%,污染率最高;0.1%升汞处理8 min,诱导率最低,为36.67%,褐化率最高,达63.33%,但污染率最低,为8.89%。0.1%升汞处理4 min,紫薇叶片愈伤组织诱导率最高,为55.56%,显著优于其他处理,褐化率最低,为44.44%,污染率最高;0.1%升汞处理8 min,愈伤组织诱导率最低,为17.78%,污染率最低,为8.89%,但褐化率最高,达82.22%。综上所述,紫薇带腋芽茎段、带水培芽茎段、叶片用0.1%升汞消毒的最佳时间分别为8、4、4 min。
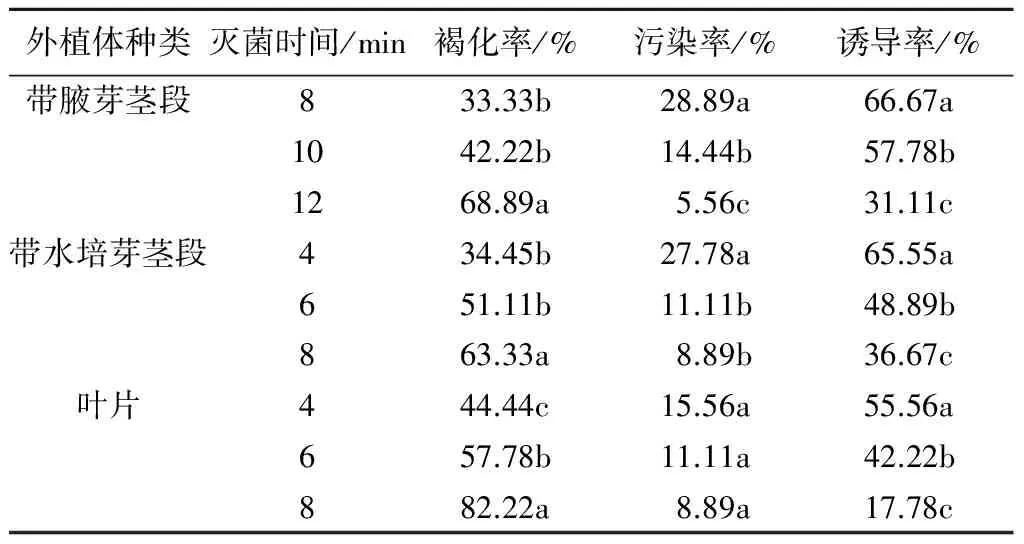
表1 不同消毒时间对紫薇外植体生长的影响
注:同种外植体处理不同小写字母表示在0.05水平差异显著。
2.2 不同质量浓度6-BA和NAA对紫薇外植体诱导的影响
启动培养20 d后,不同质量浓度6-BA和NAA对外植体诱导的影响不同(表2)。结果表明:对于紫薇带腋芽茎段,当6-BA质量浓度为0.5 mg/L时,诱导率随NAA质量浓度的升高而减少,芽长随NAA质量浓度的升高而增加;当6-BA质量浓度为1.0 mg/L时,诱导率随NAA质量浓度的升高先增加后减少,芽长在NAA质量浓度为0.20 mg/L时达到最大值;当6-BA质量浓度为2.0 mg/L时,诱导率随NAA 质量浓度的升高而减少,芽长在NAA质量浓度为0.10 mg/L时达到最大值;当不添加6-BA和NAA时,芽长最短,为2.3 cm。6-BA 2.0 mg/L+NAA 0.05 mg/L的处理组合诱导率最高,为90.00%,芽长为3.6 cm,但叶片出现黄绿色;6-BA 1.0 mg/L+NAA 0.10 mg/L和6-BA 2.0 mg/L+NAA 0.10 mg/L的处理组合诱导率次之,均为83.33%,但前者芽的长势更好,生长更健壮。综合分析,紫薇带腋芽茎段最佳启动培养基为MS+6-BA 1.0 mg/L+NAA 0.10 mg/L。对于紫薇带水培芽茎段,在MS+6-BA 1.0 mg/L+NAA 0.10 mg/L培养基中,其长势较好,叶片翠绿,诱导率为76.67%,芽长为1.8 cm。

表2 不同质量浓度6-BA和NAA对紫薇腋芽诱导的影响
注:同列不同小写字母表示在0.05水平差异显著,下表同。
2.3 不同培养基对紫薇不定芽增殖的影响
增殖培养30 d后,不同质量浓度6-BA和NAA对不定芽增殖的影响不同(表3和表4)。结果表明,当6-BA质量浓度为0.5 mg/L时,腋芽增殖系数较小,长势整体均不好,伴有黄叶;当6-BA质量浓度为1.0 mg/L时,与NAA质量浓度为0.30 mg/L的组合处理效果最好,芽长和增殖系数均较高,芽整体长势较好,芽多且叶片翠绿;当6-BA质量浓度为2.0 mg/L时,与NAA质量浓度为0.30 mg/L的组合处理效果最好,芽长和增殖系数最高,芽较多且生长健壮,叶色翠绿,较适合不定芽的增殖。

表3 不同质量浓度6-BA和NAA对紫薇腋芽不定芽增殖的影响

表4 不同培养基对紫薇水培芽不定芽增殖的影响
水培芽在1号培养基中长势最好,增殖系数最大,芽最长。3号培养基中加入AC有利于叶片的生长,但2号培养基加入KT效果不明显。以上结果表明,腋芽和水培芽的最佳增殖培养基均为MS+6-BA 2.0 mg/L+NAA 0.30 mg/L。
2.4 不同培养基对紫薇不定芽生根的影响
将腋芽增殖芽接种到不同的基本培养基(1/2MS和MS)上,培养30 d后,不定芽的生根状况差别较大(表5)。以1/2MS为基本培养基不定芽生根率较高,根系生长健壮,根长且粗,须根多。由此得出,紫薇不定芽生根最佳基本培养基为1/2MS。

表5 不同基本培养基对紫薇不定芽生根的影响
腋芽不定芽培养40 d后,不同生长调节剂种类及其质量浓度对不定芽生根有不同的影响(表6)。当只添加IBA时,随着质量浓度的升高,腋芽不定芽生根率和根长均先增加后减少,IBA质量浓度为0.5 mg/L时,生根率和根长均达到最大值,分别为96.67%和3.5 cm,根粗,叶色浓绿;当只添加NAA时,随着质量浓度的升高,腋芽不定芽生根率减少,根长先增加后减少,NAA质量浓度为0.5 mg/L时达1.6 cm。IBA 0.5 mg/L+6-BA 0.1 mg/L和NAA 0.5 mg/L+6-BA 0.1 mg/L的2个组合处理,和不添加6-BA的处理相比,并没有增加腋芽不定芽的生根率和根长,反而使之下降。
水培芽不定芽在2种培养基中的生根率、根长、长势差异不大(表7)。但加入AC的不定芽生根率更高,根更长,长势更好。综合不定芽的生根率、根长以及长势,紫薇腋芽不定芽最佳生根培养基为1/2MS+IBA 0.5 mg/L,紫薇水培芽不定芽最佳生根培养基为1/2MS+IBA 0.5 mg/L+AC 0.1 g/L。

表6 不同植物生长调节剂种类及其质量浓度对紫薇腋芽不定芽生根的影响

表7 不同培养基对紫薇水培芽不定芽生根的影响
3 结论与讨论
外植体的灭菌处理是进行植物组织培养的第1步。紫薇夏季取材的半木质化的带芽茎段应适当延长灭菌消毒的时间[4],但较长的灭菌时间可能使植物材料受到伤害,甚至造成外植体死亡。如硬枝水培芽灭菌时间过长易导致生长点出现黑点,萌发不良。叶片灭菌时间过长也易发黑。因此,唯有选择适宜的灭菌时间才能显著减少外植体的褐化和污染,有效地提高外植体的存活率[5]。而不同品种具体灭菌时间的不同,则可能是由于基因型存在差异。
在植物组培快繁的各个阶段,植物生长调节剂的种类和质量浓度配比起着至关重要的作用。木本植物的组织培养中,添加一定的细胞分裂素和少量的生长素即可诱导不定芽的形成[6]。在紫薇外植体的诱导分化培养中,6-BA和NAA的组合最有利于诱导不定芽的形成[7]。在矮首领紫薇带腋芽茎段启动培养的试验中,选用了6-BA和NAA的组合,通过不同质量浓度的对比试验,发现MS+6-BA 1.0 mg/L+NAA 0.10 mg/L为最佳启动培养基,芽的整体长势最好。但由于紫薇物种的特异性,植物诱导培养过程中对植物生长调节剂质量浓度的需求也不尽相同,如美国红叶紫薇在MS+6-BA 1.0 mg/L+IBA 0.05 mg/L的培养基上腋芽诱导率最高[8]。在矮首领紫薇叶片诱导培养的试验中,叶片诱导的愈伤组织较少且未分化出不定芽,这可能是因为叶片的分化程度高,不利于再分化。
在矮首领紫薇腋芽增殖培养阶段,6-BA和NAA质量浓度对不定芽的增殖效果影响很大,随着6-BA质量浓度的增加,芽长和增殖系数大体上呈增加趋势,当 NAA质量浓度较低时,试管苗出现了叶片发黄、落叶,甚至死苗等长势不良现象。当6-BA质量浓度为2.0 mg/L且NAA质量浓度大于0.10 mg/L时,紫薇腋芽生长不良的现象才有所缓解。这种现象与紫薇Pecos(Lagerstroemiaindica‘Pecos’)丛生芽增殖需要较低质量浓度6-BA 的研究结果不同,可能是由于紫薇Pecos比较敏感,过高的质量浓度不利于其增殖[7]。在硬枝水培芽增殖的过程中,加入AC的水培芽的长势较好,说明该AC浓度对水培芽的生长增殖有促进作用,但加入KT之后效果不明显,可能是其浓度不合适。在今后的研究过程中,有必要对AC和KT的浓度进行系列研究,筛选出硬枝水培芽增殖的最适浓度。
在生根阶段,本试验结果表明,矮首领紫薇腋芽不定芽最佳生根基本培养基为1/2MS,与桂花[9]、凤丹牡丹[10]和长寿花[11]等木本植物组培生根时常用的基本培养基相同。矮首领紫薇腋芽不定芽最佳生根培养基为1/2MS+IBA 0.5 mg/L,所得结果与绝大部分紫薇属植物生根报道结果相同,说明紫薇属不同品种间的生根差异较小[12]。矮首领紫薇水培芽不定芽最佳生根培养基为1/2MS+IBA 0.5 mg/L+AC 0.1 g/L,说明适宜浓度的活性炭有利于促进根的生长。
试管苗的驯化移栽是组织培养快繁的最后一个阶段,生根质量严重影响着试管苗驯化移栽的成活率。如何在保证高生根率的基础上提高生根的质量是今后研究的重点。同时,适宜移栽基质的种类及其体积比也需要深入研究。
[1] 陈俊愉.中国花卉品种分类学[M].北京:中国林业出版社,2001.
[2] 王献.我国紫薇种质资源及其亲缘关系的研究[D].北京:北京林业大学,2004.
[3] 唐婉.国内外紫薇资源在北京地区的越冬能力研究[D].北京:北京林业大学,2013.
[4] 李国瑞.紫薇快速繁殖及植株再生的研究[D].武汉:华中农业大学,2010.
[5] 段丽君,李国瑞,童俊,等.紫薇离体茎段快速繁殖体系研究[J].江西农业大学学报,2013,35(4):709-714.
[6] 陈正华.木本植物组织培养及其应用[M].北京:高等教育出版社,1986.
[7] 王晓娇.紫薇同源四倍体的获得及组培快繁技术研究[D].北京: 北京林业大学,2013.
[8] 陈怡佳,崔媛媛,张晓明,等.美国红叶紫薇的组织培养与快速繁殖[J].植物生理学报,2015,51(6): 882-886.
[9] 李林,韩远记,袁王俊,等.桂花组织培养快繁体系的建立[J].河南大学学报(自然科学版),2013,43(6): 667-671.
[10] 王新,成仿云,钟原,等.凤丹牡丹鳞芽离体培养与快繁技术[J].林业科学,2016,52(5):101-110.
[11] 范诸平,王立雪,杨东,等.重瓣长寿花组织培养再生体系的建立[J].东北林业大学学报,2016,44(7): 54-58.
[12] 王轲.四种紫薇属植物快繁与再生体系的建立[D].北京:北京林业大学,2015.
InVitroCulture System Optimization ofLagerstroemiaindicaStems
LIU Xiao,LI Zhuo,TANG Lidan,WANG Xian*
(College of Forestry,Henan Agricultural University,Zhengzhou 450002,China)
One-year-old half-lignified stems with axillary buds,hardwood stems with hydroponic buds and leaves ofLagerstroemiaindica‘Aishouling’ were used as explants forinvitroculture system optimization,including sterilization time,induction medium,proliferation medium and basic rooting medium.The results showed that the stems were the optimal explants.The optimal sterilization time of 0.1% HgCl2:stems with axillary buds was treated for 8 min,and the induced rate was 66.67%;stems with hydroponic buds was treated for 4 min,and the induced rate was 65.55%;leaves was treated for 4 min,and the induced rate was 55.56%.By taking the stems as explants,the best induction medium of stems with axillary buds was MS+6-BA 1.0 mg/L+NAA 0.10 mg/L,with the induction rate of 83.33%.The optimal proliferation media for axillary buds and hydroponic buds were both MS+6-BA 2.0 mg/L+NAA 0.30 mg/L.The proliferation coefficient of axillary buds was 2.42,and the shoot length was 3.2 cm;the proliferation coefficient of hydroponic buds was 3.21,and the shoot length was 2.1 cm.The best basic rooting medium for axillary buds was 1/2MS;the best rooting medium was 1/2MS+IBA 0.5 mg/L,and the rooting rate was 96.67%.The best rooting medium for hydroponic buds was 1/2MS+IBA 0.5 mg/L+AC 0.1 g/L,and the rooting rate was 81.25%.
Lagerstroemiaindica‘Aishouling’; stem; leaves; tissue culture
2016-09-21
河南省科技攻关(农业领域)项目(152102110052)
刘 晓(1992-),女,河南新郑人,在读硕士研究生,研究方向:园林植物与观赏园艺。 E-mail:2364599364@qq.com
*通讯作者:王 献(1970-),女,河南南召人,副教授,博士,主要从事园林植物栽培生理的研究。 E-mail:xianw888@sina.com
S685.99
A
1004-3268(2017)03-0112-06
