麻叶荨麻的化感作用研究
2017-04-06张翔宇汤界世胡云霞韩彩霞
刘 瑜,张翔宇,汤界世,胡云霞,韩彩霞,邵 华*
(1.石河子大学 生命科学学院,新疆 石河子 832000;2.中国科学院 新疆生态与地理研究所/干旱区生物地理与生物资源重点实验室,新疆 乌鲁木齐 830011;3.伊犁师范学院 化学与环境科学学院,新疆 伊宁 835000)
麻叶荨麻的化感作用研究
刘 瑜1,2,张翔宇1,2,汤界世1,2,胡云霞3,韩彩霞2,邵 华2*
(1.石河子大学 生命科学学院,新疆 石河子 832000;2.中国科学院 新疆生态与地理研究所/干旱区生物地理与生物资源重点实验室,新疆 乌鲁木齐 830011;3.伊犁师范学院 化学与环境科学学院,新疆 伊宁 835000)
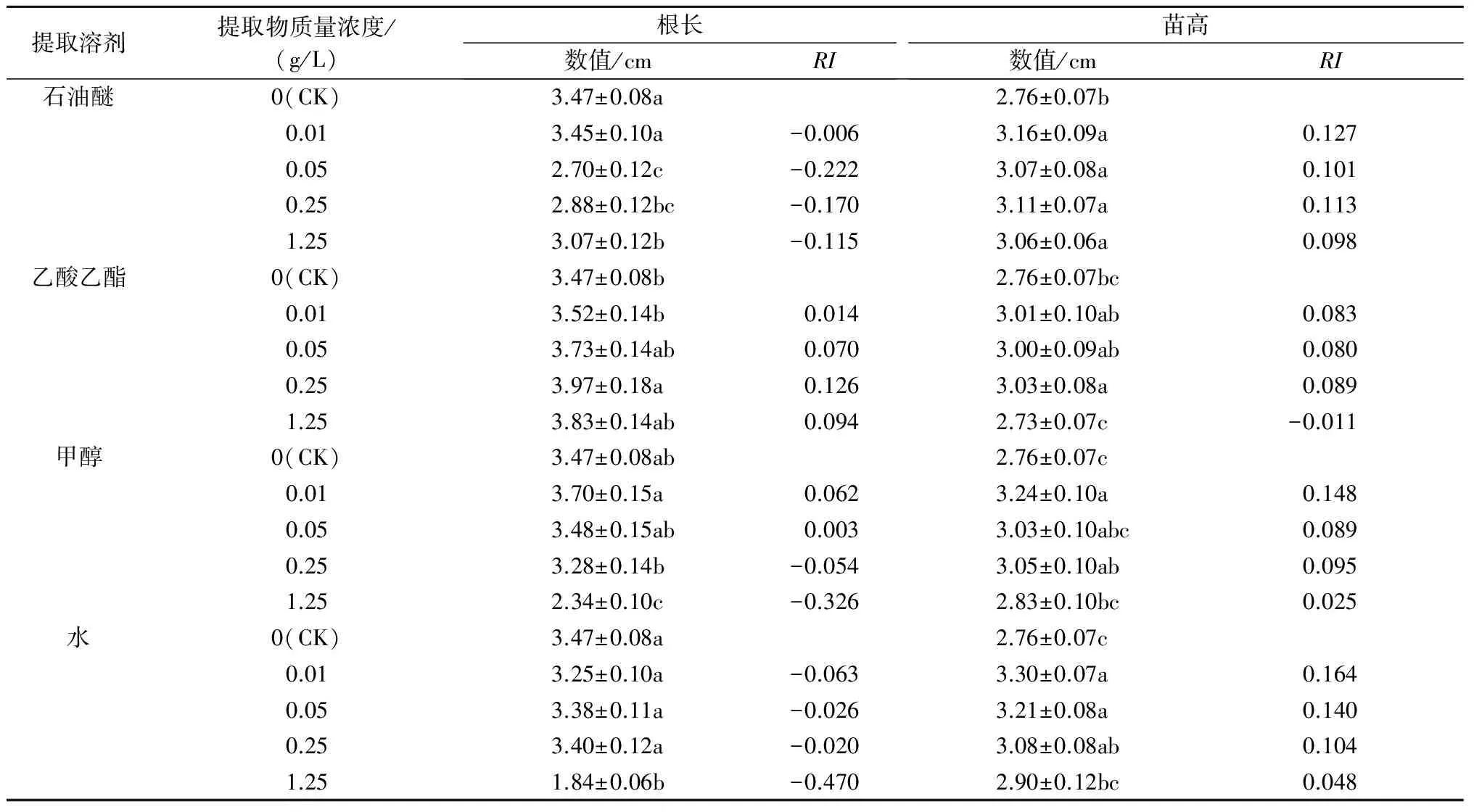
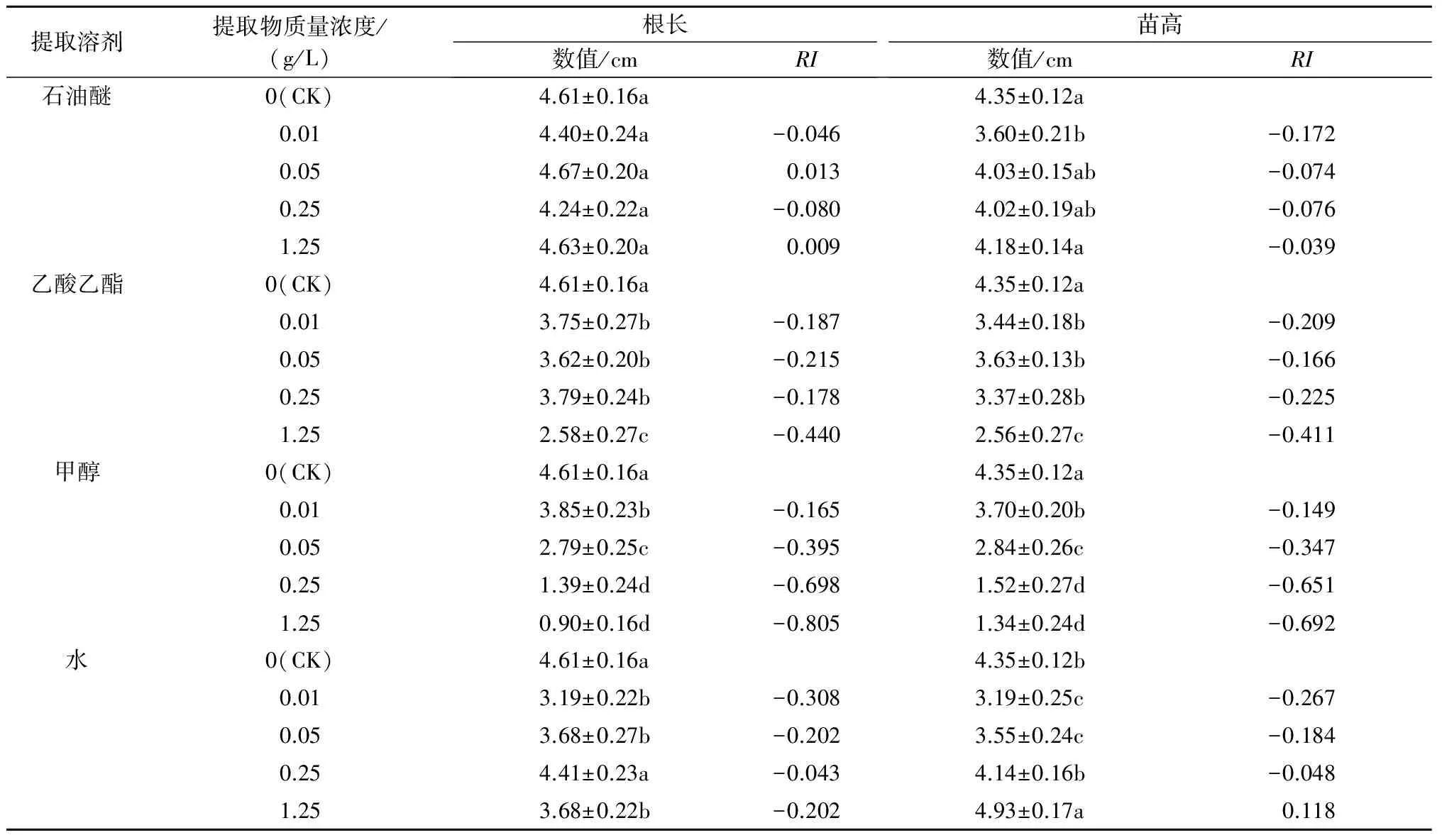
以双子叶植物紫花苜蓿和单子叶植物早熟禾为受试植物,通过培养皿滤纸法和盆栽法对麻叶荨麻的化感作用进行研究。结果表明,对麻叶荨麻叶分别用石油醚、乙酸乙酯、甲醇、水4种不同极性的溶剂以超声法进行提取,得率分别为0.66%、0.84%、2.70%、3.13%。麻叶荨麻叶的甲醇和水提取物对紫花苜蓿幼苗生长具有明显的化感抑制作用,在质量浓度为1.25 g/L时对根长的抑制率最高,分别达到了32.6%和47.0%;而石油醚和乙酸乙酯提取物对紫花苜蓿的生长影响较弱。石油醚和水提取物对早熟禾幼苗生长表现出较弱的化感抑制作用;而乙酸乙酯和甲醇提取物的化感作用很强,均在0.01 g/L的低质量浓度时即对幼苗生长产生显著抑制作用,当质量浓度达到1.25 g/L时,乙酸乙酯和甲醇提取物对早熟禾根长的抑制率分别达到了44.0%和80.5%,对苗高的抑制率分别达到了41.1%和69.2%。盆栽试验显示,麻叶荨麻根土对紫花苜蓿和早熟禾幼苗的生长有2.4%~5.0%的极轻微促进作用,并未达到统计学意义上的显著水平,提示麻叶荨麻植株中的化感物质在进入土壤之后,可能被微生物分解利用而失去生长抑制活性。
麻叶荨麻; 化感作用; 紫花苜蓿; 早熟禾
麻叶荨麻(UrticacannabinaL.),亦被称为焮麻、钱麻、红活麻、蝎麻等,为中国植物图谱数据库收录的有毒植物,其根、叶及刺毛均有毒,在我国的新疆、甘肃、四川、陕西、山西、河北、辽宁等地为常见杂草[1-4]。其分布地之一的新疆天山野果林主要位于伊犁谷地的新源、巩留、霍城、伊宁、塔城盆地及其低丘陵地带,它不仅具有调节气候、涵养水源、防风固沙等生态功能,而且是世界上重要的种质资源库,对植物物种的变迁演化及栽培果树起源研究具有极高的价值[5]。然而,由于过度放牧、气候变化等自然和人为因素的共同作用,近年来,天山野果林出现严重的退化现象[6]。与野果树大面积死亡同时出现的现象是,林下植被中麻叶荨麻的种群在不断壮大,其与野果林退化之间的关系值得关注。不仅如此,麻叶荨麻在野外也常排挤其他植物而成为优势物种。该植物是否通过向周围环境中释放有毒的化感物质而抑制伴生植物生长,值得进行深入地研究。
化感作用是指供体植物通过茎叶挥发、淋溶、凋落物分解、根系分泌等途径向环境中释放化学物质,从而影响周围植物的生长与发育[7-9]。化感作用可能对多种植物迅速占据生态优势起到了重要甚至是决定性的作用[10-14]。由于植物可通过根系向周围环境释放各种化学物质,从而影响其他植物的生长,且麻叶荨麻植株高大,含叶量很高,茎叶比接近1∶5,故选择麻叶荨麻的叶提取物进行化感作用研究,同时通过盆栽试验检测其根土对受试植物幼苗生长的影响,以期解析麻叶荨麻是否通过化感作用的方式辅助其生长优势的形成。
1 材料和方法
1.1 材料
麻叶荨麻植株及供试土壤于2016年7月采集于新疆新源县野果林。根土为麻叶荨麻的根周土壤,对照土壤为距离荨麻根系1 m以上、生长有其他伴生植物的同样土质的土壤,在试验样地随机选择5个点进行采样。植株在室内阴干后,分离茎叶,取叶称质量后进行试验;土壤直接用于栽培试验。受试植物紫花苜蓿(MedicagosativaL.)和早熟禾(PoaannuaL.)种子购自新疆克劳沃草业科技有限公司。
1.2 方法
1.2.1 麻叶荨麻叶提取物的制备 将晾干的麻叶荨麻叶粉碎后称取100 g,加入体积为1 L的锥形瓶中,加石油醚后在室温下超声提取30 min,过滤并收集滤出液,重复3次。合并滤出液,在旋转蒸发仪上旋蒸至干,称质量并计算得率。乙酸乙酯、甲醇、水提取物均以同样的方法进行制备。
1.2.2 麻叶荨麻叶提取物的化感活性测定 紫花苜蓿和早熟禾种子用2%次氯酸钠消毒10 min,再以无菌蒸馏水冲洗5~6遍,晾干后备用。将麻叶荨麻叶的石油醚、乙酸乙酯、甲醇提取物以甲醇配制成1.25 g/L,并依次进行梯度稀释后加入直径为9 cm并铺有1层滤纸的培养皿中,然后挥干甲醇,加入5 mL蒸馏水,使其终质量浓度分别为0.01、0.05、0.25、1.25 g/L。水提取物以蒸馏水直接配制成相应的质量浓度备用。在每个培养皿中分别加入紫花苜蓿和早熟禾种子各10粒,以蒸馏水处理为对照,每个处理设5个重复,在25 ℃下进行培养,5 d后测量根长和苗高并进行统计分析。
1.2.3 利用麻叶荨麻根土的盆栽试验 称取过筛后的麻叶荨麻根土和对照土壤各100 g,加入直径7 cm的培养杯中,每个杯中各放20粒受试植物种子,每个处理设5个重复,在25 ℃(昼)/16 ℃(夜)条件下培养2周后,测量植株的根长与苗高。
1.2.4 化感效应指数的计算 采用化感效应指数衡量化感作用强度:
RI=1-C/T(T≥C)
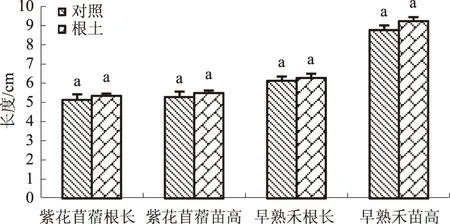
RI=T/C-1(T 式中,RI代表化感效应指数,C代表对照值,T代表处理值,RI>0表示促进作用,RI<0表示抑制作用,RI绝对值的大小与化感作用强度一致[10,14-15]。 1.2.5 数据统计与分析 试验所得数据首先经ANOVA分析其差异显著性,然后采用SPSS17.0进行Fisher’sLSD分析[16]。 2.1 麻叶荨麻叶提取物对紫花苜蓿幼苗生长的影响 麻叶荨麻叶的石油醚、乙酸乙酯、甲醇和水提取物的得率依次为0.66%、0.84%、2.70%、3.13%。麻叶荨麻叶各溶剂提取物对双子叶植物紫花苜蓿幼苗生长的影响如图1所示,其对根长和苗高影响的统计结果见表1。 2.1.1 根长 从表1可以看出,石油醚、甲醇和水提取物对紫花苜蓿根长都表现出一定的抑制作用,而各质量浓度的乙酸乙酯提取物则表现出轻微的促进作用。石油醚提取物对紫花苜蓿根长表现出较弱的抑制作用,抑制率为0.6%~22.2%;甲醇和水提取物的抑制作用总体上强于石油醚提取物,在质量浓度为1.25g/L时对根长的抑制率分别达到了32.6%和47.0%。 提取溶剂提取物质量浓度/(g/L)根长数值/cmRI苗高数值/cmRI石油醚0(CK)3.47±0.08a2.76±0.07b0.013.45±0.10a-0.0063.16±0.09a0.1270.052.70±0.12c-0.2223.07±0.08a0.1010.252.88±0.12bc-0.1703.11±0.07a0.1131.253.07±0.12b-0.1153.06±0.06a0.098乙酸乙酯0(CK)3.47±0.08b2.76±0.07bc0.013.52±0.14b0.0143.01±0.10ab0.0830.053.73±0.14ab0.0703.00±0.09ab0.0800.253.97±0.18a0.1263.03±0.08a0.0891.253.83±0.14ab0.0942.73±0.07c-0.011甲醇0(CK)3.47±0.08ab2.76±0.07c0.013.70±0.15a0.0623.24±0.10a0.1480.053.48±0.15ab0.0033.03±0.10abc0.0890.253.28±0.14b-0.0543.05±0.10ab0.0951.252.34±0.10c-0.3262.83±0.10bc0.025水0(CK)3.47±0.08a2.76±0.07c0.013.25±0.10a-0.0633.30±0.07a0.1640.053.38±0.11a-0.0263.21±0.08a0.1400.253.40±0.12a-0.0203.08±0.08ab0.1041.251.84±0.06b-0.4702.90±0.12bc0.048 注:同一溶剂提取物不同质量浓度处理数据后标不同字母表示在0.05水平上差异显著,下同。 2.1.2 苗高 从表1可以看出,除1.25 g/L乙酸乙酯提取物外,各溶剂提取物对紫花苜蓿的苗高均表现出一定的促进作用。但是,这种促进作用较为微弱,效果仅为2.5%~16.4%。 2.2 麻叶荨麻叶提取物对早熟禾幼苗生长的影响 麻叶荨麻叶各溶剂提取物对单子叶植物早熟禾幼苗生长的影响如图2所示,其对根长和苗高影响的统计结果见表2。 2.2.1 根长 从表2可以看出,石油醚和水提取物对早熟禾根长的化感抑制作用相对较弱,而乙酸乙酯和甲醇提取物表现出很强的化感作用。其中,乙酸乙酯提取物在最低质量浓度0.01 g/L时即对根长表现出显著的生长抑制作用(抑制率18.7%),并在质量浓度为1.25 g/L时抑制率达到了44.0%;甲醇提取物的抑制作用更为明显,在0.01、0.05、0.25、1.25 g/L时对早熟禾根长的抑制率分别达到16.5%、39.5%、69.8%、80.5%。总体上各提取物对早熟禾根长的化感抑制作用强度高低顺序为甲醇提取物>乙酸乙酯提取物>水提取物>石油醚提取物。 图2 麻叶荨麻叶提取物对早熟禾幼苗生长的影响 提取溶剂提取物质量浓度/(g/L)根长数值/cmRI苗高数值/cmRI石油醚0(CK)4.61±0.16a4.35±0.12a0.014.40±0.24a-0.0463.60±0.21b-0.1720.054.67±0.20a0.0134.03±0.15ab-0.0740.254.24±0.22a-0.0804.02±0.19ab-0.0761.254.63±0.20a0.0094.18±0.14a-0.039乙酸乙酯0(CK)4.61±0.16a4.35±0.12a0.013.75±0.27b-0.1873.44±0.18b-0.2090.053.62±0.20b-0.2153.63±0.13b-0.1660.253.79±0.24b-0.1783.37±0.28b-0.2251.252.58±0.27c-0.4402.56±0.27c-0.411甲醇0(CK)4.61±0.16a4.35±0.12a0.013.85±0.23b-0.1653.70±0.20b-0.1490.052.79±0.25c-0.3952.84±0.26c-0.3470.251.39±0.24d-0.6981.52±0.27d-0.6511.250.90±0.16d-0.8051.34±0.24d-0.692水0(CK)4.61±0.16a4.35±0.12b0.013.19±0.22b-0.3083.19±0.25c-0.2670.053.68±0.27b-0.2023.55±0.24c-0.1840.254.41±0.23a-0.0434.14±0.16b-0.0481.253.68±0.22b-0.2024.93±0.17a0.118 2.2.2 苗高 麻叶荨麻各溶剂提取物对早熟禾苗高的影响与对根长的影响趋势相同(表2)。其中,乙酸乙酯提取物在不同质量浓度下对苗高的抑制率在16.6%~41.1%,而甲醇提取物的抑制率则在14.9%~69.2%。总体上各溶剂提取物对早熟禾苗高的抑制率高低顺序与对根长的影响相同,即甲醇提取物>乙酸乙酯提取物>水提取物>石油醚提取物。 2.3 麻叶荨麻根土对紫花苜蓿和早熟禾幼苗生长的影响 麻叶荨麻根土对双子叶植物紫花苜蓿和单子叶植物早熟禾幼苗生长的影响如图3和图4所示。麻叶荨麻根土对2种植物幼苗的根长和苗高均表现出极其轻微的促进作用。其中,根土中生长的紫花苜蓿幼苗根长较对照提高3.9%,苗高较对照提高3.8%,而根土培养的早熟禾根长较对照提高2.4%,苗高较对照提高5.0%。但是,麻叶荨麻根土对紫花苜蓿和早熟禾的这种促进作用均未达到统计学意义上的显著水平。 A:紫花苜蓿(左为对照土,右为根土);B:早熟禾(左为对照土,右为根土) 相同字母表示处理间差异不显著(P>0.05) 从植物中寻找对其他植物具有生长抑制作用的植物毒素往往是研究某种植物是否具有化感作用的重要环节[17]。在化感作用研究中,由于生物测定试验中受试植物的种子萌发后,化感物质直接接触幼苗的根,而后再通过根影响到苗。因此,根长比苗高更能反映化感物质的作用强度。麻叶荨麻叶提取物的生物测定试验结果表明,该植物的叶中含有能够显著抑制受试植物生长的化学物质。其中,对紫花苜蓿具有化感作用的化学物质主要集中在甲醇和水提取物中,而对早熟禾具化感作用的化学物质则主要集中在乙酸乙酯和甲醇提取物中。然而需要指出的是,虽然人们习惯于将从植物体中分离出来的具有生长抑制作用的化学物质称为化感物质,但是严格地说,它们更适合被称作植物毒素,并不等同于化感物质。事实上,几乎每种植物都可以或多或少地产生一些有毒的次生代谢产物,它们未必就是人们寻找的化感物质[18]。要证明它们是否作为化感物质存在,还需要进一步验证,例如需要验证该物质是否在土壤(或空气中)存在,是否达到有效作用浓度和作用时间等[19]。盆栽试验结果表明,麻叶荨麻根土对2种植物幼苗的根长和苗高均表现出极其轻微的促进作用,未达到显著水平。据此可以推测,尽管麻叶荨麻植株中含有一些能明显抑制受试植物生长的化感物质,但是在进入土壤之后可能被土壤微生物分解利用,或者发生了土壤吸附、化学降解等反应,从而使化感物质失去毒性;而土壤微生物在分解化感物质的过程中也发生了种类和数量上的变化,进而改变了土壤理化性质,最终表现为对紫花苜蓿和早熟禾没有显著的化感作用。由此可见,仅仅对某种植物的提取物进行化感作用研究并不能如实地反映其作用过程,化感物质进入土壤之后发生的一系列复杂反应很有可能会引起质的变化[20]。 [1] 王文釆,陈家瑞.中国植物志(第23卷第2分册)[M].北京:科学出版社,1995. [2] 敖特根白音,李运起,韩艳华,等.国内外麻叶荨麻的研究进展[J].中国野生植物资源,2015,34(1):32-36. [3] 张洪涛.新疆麻叶荨麻(UrticacannabinaL.)内生菌的分离及棉花黄萎病等病菌拮抗菌的筛选与鉴定[D].乌鲁木齐:新疆大学,2007. [4] 张晓庆,金艳梅,李发弟,等.麻叶荨麻与玉米粉混贮对青贮品质的影响[J].草业学报,2015,24(1):190-195. [5] 刘爱华,张新平,温俊宝,等.天山野苹果林苹果小吉丁与苹果腐烂病复合危害研究[J].新疆农业科学,2014,51(12):2240-2244. [6] 成克武,周晓芳,臧润国,等.新疆野苹果资源保护对策探讨[J].干旱区研究,2008,25(6):760-765. [7] Rice E L.Allelopathy[M].2nd ed.Orlando,Florida:Academic Press,1984. [8] 王建花,陈婷,林文雄.植物化感作用类型及其在农业中的应用[J].中国生态农业学报,2013,10(21):1173-1183. [9] 林娟,殷全玉,杨丙钊,等.植物化感作用研究进展[J].中国农学通报,2007,23(1):68-72. [10] 沈玉聪,张红瑞,姚珊,等.5种酚酸类物质对小麦幼苗的化感作用研究[J].河南农业科学,2016,45(5):101-105. [11] 王晓英.高羊茅腐解物的自毒作用初探[J].河南农业科学,2015,44(5):107-110. [12] 马剑敏,马顷,苏秀燕,等.水绵对3种沉水植物的化感作用研究[J].河南农业科学,2011,40(9):70-73. [13] 赵丹,白丽荣,赵帅.黄顶菊提取液对旱稻种子的化感作用[J].河南农业科学,2013,42(7):80-83. [14] 刘明久,许桂芳,姜辉.入侵植物香丝草化感作用的生物测定[J].河南农业科学,2008(6):71-73. [15] 周先容,幸春渝,江波,等.茎瘤芥叶水浸提液对3种作物种子萌发的化感效应[J].河南农业科学,2015,44(10):117-121. [16] 辛雅芬,米士伟,张淑玲,等.球毛壳菌在黄瓜上的侵染定殖及其对黄瓜生长和产量的影响[J].吉林农业大学学报,2013,35(4):450-456. [17] Gibson D M,Krasnoff S B,Biazzo J,etal.Phytotoxicity of antofine from invasive swallow-worts[J].Journal of Chemical Ecology,2011,37:871-879. [18] Inderjit,Dakshini K M M.Allelopathic potential ofPluchealanceolata:Comparative study of cultivated fields[J].Weed Science,1996,44:393-396. [19] Inderjit,Weston L A.Are laboratory bioassays for allelopathy suitable for prediction of field responses?[J].Journal of Chemical Ecology,2000,26:2111-2118. [20] Inderjit.Soil microorganisms:An important determinant of allelopathic activity[J].Plant Soil,2005,274:227-236. The Allelopathic Potential ofUrticacannabinaL. LIU Yu1,2,ZHANG Xiangyu1,2,TANG Jieshi1,2,HU Yunxia3,HAN Caixia2,SHAO Hua2* (1.College of Life Science,Shihezi University,Shihezi 832000,China; 2.Key Laboratory of Biogeography and Bioresource in Arid Land/Xinjiang Institute of Ecology and Geography,Chinese Academy of Sciences,Urumqi 830011,China; 3.Chemistry and Environment Science School of Yili Normal University,Yining 835000,China) The allelopathic potential ofUrticacannabinaL.was evaluated via petri-dish and pot experiments using alfalfa(MedicagosativaL.) and bluegrass(PoaannuaL.) separately as dicotyledonous and monocotyledonous receiver plants.Petroleum ether,ethyl acetate,methanol and water were used to extract chemicals by ultrasound fromU.cannabinaleaves,and yielded 0.66%,0.84%,2.70%,3.13% extracts,respectively.The methanol and water extracts exhibited the most potent inhibitory activity onMedicagosativaseedlings,which resulted in 32.6% and 47.0% reduction in root length,respectively,when the mass concentration was 1.25 g/L,while petroleum ether and ethyl acetate extracts only showed weak activities.ForPoaannuaL.,petroleum ether and water extracts showed relatively weak effects,whereas ethyl acetate and methanol extracts exhibited very strong activities,which significantly suppressed seedling growth starting from the lowest mass concentration 0.01 g/L;when the mass concentration reached 1.25 g/L,ethyl acetate and methanol extracts inhibited root length of bluegrass by 44.0% and 80.5%,and shoot length by 41.1% and 69.2%,respectively.Pot experiment revealed that bulk soil ofU.cannabinaslightly promoted seedling growth of both alfalfa and bluegrass by 2.4%—5.0%,which was not statistically significant,implying that the toxic substances inU.cannabinaplant might have been degraded and utilized by soil microorganisms and hence lost their inhibitory activity. UrticacannabinaL.; allelopathy;MedicagosativaL.;PoaannuaL. 2016-08-16 科技部国家重点研发计划项目(2016YFC0501500);中国科学院特色研究所主要服务项目(TSS-2015-014-FW-4-2);新疆维吾尔自治区自然科学基金面上项目(2015211C291);国家自然科学基金面上项目(31460164) 刘 瑜(1995-),女,新疆奎屯人,在读本科生,研究方向:化感作用。E-mail:772729930@qq.com *通讯作者:邵 华(1969-),女,山东临沂人,副研究员,博士,主要从事外来入侵植物的化感作用及生物农药开发利用研究。E-mail:shaohua@ms.xjb.ac.cn Q948.12 A 1004-3268(2017)03-0095-062 结果与分析

3 结论与讨论
