河南地区NADC30-like PRRSV毒株的增殖特性与遗传进化分析
2017-04-06王林建郭振华乔松林陈鑫鑫张改平
王林建,郭振华,乔松林,陈鑫鑫*,张改平*
(1.河南农业大学 生命科学学院,河南 郑州 450002; 2.河南省农业科学院 河南省动物免疫学重点实验室/农业部动物免疫学重点开放实验室,河南 郑州450002)
河南地区NADC30-like PRRSV毒株的增殖特性与遗传进化分析
王林建1,2,郭振华2,乔松林2,陈鑫鑫2*,张改平1,2*
(1.河南农业大学 生命科学学院,河南 郑州 450002; 2.河南省农业科学院 河南省动物免疫学重点实验室/农业部动物免疫学重点开放实验室,河南 郑州450002)
为研究河南地区猪繁殖与呼吸综合征病毒(PRRSV)的流行特点和遗传变异情况,采集河南省滑县地区猪繁殖与呼吸综合征(PRRS)发病猪场中的病料,经研磨、稀释、离心处理后将悬液上清接种于原代猪肺泡巨噬细胞,进行病毒分离培养,结果显示,PAM出现典型细胞病变效应,将得到的分离株命名为HNhx。应用PRRSV N蛋白的特异抗体进行间接免疫荧光(IFA)试验,结果表明,接种HNhx分离株的PAM出现特异性荧光,证明该分离株为PRRSV。应用RT-PCR技术对Nsp2区进行扩增分析,根据扩增目的产物大小推测HNhx分离株为NADC30-like毒株。遗传分析发现,与其他参考毒株相比,HNhx毒株的ORF3、ORF4和ORF5基因与NADC30毒株的同源性最高。基于ORF3、ORF4和ORF5序列构建进化树,系统进化分析的结果表明,HNhx归于NADC30-like亚群。
猪繁殖与呼吸综合征病毒; 分离; 鉴定; 序列分析
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS),是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的以妊娠母猪流产和各年龄段猪呼吸障碍为主要特征的传染病。上世纪80年代,该病首先出现在美国和加拿大,然后在全球范围内传播,成为全球猪病控制上的一大难题[1-2]。自1995年我国首次报道PRRS以来,该病一直长期流行[3-9]。尤其是2006年,由高致病性PRRSV(highly pathogenic PRRSV,HP-PRRSV)引发的以高热、高发病率和高死亡率为特征的疫情,对生猪养殖业造成前所未有的打击[10]。
PRRSV按基因型分为以VR-2332株为代表的北美洲型和以LV株为代表的欧洲型。2种基因型毒株之间引发的PRRS临床症状相似,但是病毒的抗原性、基因组成及结构存在较大的差异。PRRSV是一种有囊膜的单股正链RNA病毒,属于动脉炎病毒科、动脉炎病毒属,其基因组全长约15 kb,除去头尾的5′UTR和3′UTR还包含10个开放阅读框。ORF1a和ORF1b分别编码pp1a和pp1ab 2种多聚蛋白,pp1a和pp1ab分别被酶切裂解为Nsp1α、Nsp1β、Nsp2—Nsp6、Nsp7α、Nsp7β、Nsp8,以及Nsp9—Nsp12。ORF2a、ORF2b、ORF3—ORF5、ORF5a、ORF6和ORF7分别编码病毒的结构蛋白GP2a、GP2b、GP3—GP5、GP5a、M和N[11-12]。由于缺少校正酶,PRRSV在病毒复制过程中极易引入突变,因此,PRRSV是变异率最高的病毒之一。其中,Nsp2是不同毒株基因组之间差异最大的区域。与经典毒株的非结构蛋白Nsp2相比,HP-PRRSV的Nsp2存在30个不连续的氨基酸缺失,而2008年美国分离株NADC30则存在131个不连续的氨基酸缺失。这些不同数目氨基酸的缺失可以作为区分不同亚型毒株的分子标志。
自2006年以来,HP-PRRSV毒株已成为国内主要的流行毒株,但PRRSV存在较大的遗传变异[13-14]。从2013年开始,多个省份相继报道在猪场发现了与美国NADC30毒株同源性很高的毒株,研究人员将其命名为NADC30-like毒株[15]。NADC30-like毒株Nsp2区存在131个氨基酸的不连续缺失。随后的分子流行病学调查研究也显示,NADC30-like毒株在我国多个地区逐渐呈流行态势[16-17]。当前,我国正在广泛使用的商业化疫苗是以HP-PRRSV为亲本的弱毒苗。有研究表明,这些疫苗不能提供有效的保护,免疫后的猪仍能被NADC30-like毒株感染。鉴于此,分离目前流行的NADC30-like毒株,并研究其致病性和进化情况,以期为研制预防NADC30-like毒株的疫苗和实现对PRRS的整体防控奠定基础。
1 材料和方法
1.1 细胞、病毒株与菌种
高致病性PRRSV毒株HN07-1、Marc-145细胞株均由河南省农业科学院动物免疫学重点实验室保存。原代猪肺泡巨噬细胞(PAM)取自6周龄左右大小的PRRSV阴性猪。将猪麻醉处死后,取出完整的肺部,无菌PBS缓冲液清洗肺部表面,用HBSS缓冲液经气管注入左右肺并且反复灌洗肺组织。收集灌洗液,400g离心15 min收集细胞,RPMI 1640培养液重悬洗涤2次,收集细胞用冻存液冻存,液氮保存。使用时复苏细胞铺于细胞培养板或者培养瓶中。JM109感受态细胞购自宝生物工程(大连)有限公司。
1.2 主要试剂
TRIzol试剂购自Invitrogen公司;RPMI 1640培养基、DMEM培养基、胰蛋白酶购自Solarbio公司;胎牛血清(FBS)购自Gibco公司;Q5超保真聚合酶和T4连接酶购自NEB公司;病毒基因组提取试剂盒、反转录试剂盒PrimeScript RT Master Mix、RACE 5′/3′试剂盒和pMD®19-T Simple载体购自宝生物工程(大连)有限公司;Cy3标记的羊抗鼠二抗购自Abbkine公司;PRRSV N蛋白抗体由河南省农业科学院动物免疫学重点实验室制备。
1.3 病毒的分离与增殖
疑似阳性的病料经研磨后按1︰10稀释于RPMI 1640培养基中,-80 ℃反复冻融3次,4 000g离心10 min,使用0.22 μm滤膜过滤后接种于PAM。37 ℃孵育1 h后,加入新鲜的含10%FBS和1%双抗的RPMI 1640培养基。在37 ℃二氧化碳培养箱中培养2~3 d,观察病变情况。若无病变,反复冻融后转接下一代直至出现病变。收集分离到的病毒,以不同的MOI的毒量接种于新的PAM,36 h后观察细胞病变情况。
(2)压缩机压缩液化过程:10 m3储罐内的BOG经阀门V2、2 m3储罐内的气体经阀门V3进入压缩机加压后,经阀门V5进入10 m3储罐液相空间;当2 m3储罐压力降低时(罐内气体基本被抽空时),关闭阀门V3,打开阀门V1,继续上述压缩液化过程。
1.4 HNhx毒株间接免疫荧光试验(IFA)
接种PRRSV培养24 h后,弃掉PAM细胞的培养基,PBST洗涤后,用含2%双氧水的甲醛溶液固定细胞。PBST洗涤3次后,加5%脱脂奶后于37 ℃封闭1 h,之后加入1︰2 000稀释的鼠源抗PRRSV的N蛋白抗体,于37 ℃温育1 h。PBST洗涤3次,加入1︰1 000稀释的Cy3标记的羊抗鼠二抗于37 ℃温育1 h。PBST洗涤3次后,置于荧光倒置显微镜下观察试验结果。
1.5 毒株鉴定
使用病毒基因组提取试剂盒提取病毒的总RNA,并按PrimeScript RT Master Mix操作步骤反转录得到cDNA。用Nsp2鉴定引物(表1)进行PCR扩增,所得产物进行琼脂糖凝胶电泳,观察扩增片段大小。并将目的片段克隆到pMD®19-T Simple载体,转化JM109感受态细胞。涂氨苄青霉素抗性的LB平板,于37 ℃培养箱过夜培养。菌液PCR筛选阳性克隆,并送至生工生物工程(上海)股份有限公司进行测序。

表1 所用引物序列及产物大小
1.6 HNhx毒株生长曲线绘制
将Marc-145细胞或者分离的原代PAM铺满6孔板,按MOI为0.1接种HNhx病毒。分别在接毒6、12、24、36、48、60、72、96 h后吸取100 μL培养上清,经10倍梯度稀释处理后,接种于培养单层PAM的96孔细胞培养板中。培养120 h后,观察CPE情况,按Reed-Mucnch法计算TCID50,并绘制生长曲线。
1.7 HNhx毒株ORF3、ORF4和ORF5扩增和测序
依据病毒基因组提取试剂盒使用说明书从培养液中提取病毒总RNA,并按PrimeScript RT Master Mix操作步骤反转录得到cDNA。使用6对特异引物(表1),以cDNA为模板,经Q5超保真聚合酶扩增,采用1%琼脂糖凝胶电泳并利用凝胶回收试剂盒回收得到目的片段。将目的片段连接到pMD®19-T Simple载体,转化JM109感受态细胞,涂布到氨苄青霉素抗性的LB平板中,过夜培养,然后进行菌液PCR筛选阳性克隆,并送至生工生物工程(上海)股份有限公司进行测序。
利用DNAMAN和DNAStar等软件对测序结果与CH-1R、JXA1、HB-1(sh)/2002、NADC30等参考毒株(表2)进行核酸和氨基酸相似性分析。并使用MEGA 6.06软件对分离毒株ORF3、ORF4和ORF5进行系统进化分析。

表2 PRRSV参考毒株背景信息
2 结果与分析
2.1 病毒分离与增殖结果
组织病料经研磨、反复冻融和过滤后接种于原代PAM。放置于37 ℃二氧化碳培养箱中培养2 d后转接下一代,直至第3代PAM开始裂解。PAM细胞病变达50%时,冻存于-80 ℃。反复冻融3次,过滤后保存病毒,并将其命名为HNhx毒株。使用PAM测定其病毒滴度为107.5TCID50/mL。以不同的MOI的毒量接种于新的PAM,36 h后可清楚观察到PAM出现裂解、皱缩、脱落等PRRSV感染的典型病变(图1)。
2.2 HNhx毒株IFA结果
以MOI为0.1的病毒量分别将HNhx与HN07-1毒株接种于PAM和Marc-145细胞,24 h后使用抗PRRSV N蛋白的特异性抗体进行间接免疫荧光试验。结果显示,HNhx毒株和HN07-1毒株感染的PAM和Marc-145细胞均出现特异红色荧光(图2),证明分离株HNhx确为PRRSV毒株。
2.3 HNhx毒株鉴定结果
从分离株培养液中提取总RNA,反转录生成cDNA。使用能区分经典毒株(C-PRRSV)、HP-PRRSV毒株和NADC30-like毒株的特异引物Nsp2F/R(表1)进行RT-PCR鉴定。琼脂糖凝胶电泳结果显示,HP-PRRSV、HN07-1毒株扩增得到的目的片段大小为950 bp左右,而分离毒株扩增得到目的片段约为647 bp,据此推测分离株可能为NADC30-like毒株(图3)。为了进一步确定毒株的分类,将目的片段进行测序,并对测序结果进行氨基酸序列比对分析。结果显示,分离毒株与NADC30-like毒株有相似的特征,即在非结构蛋白Nsp2区存在不连续的131个氨基酸的缺失。因此,可确定HNhx为NADC30-like毒株。
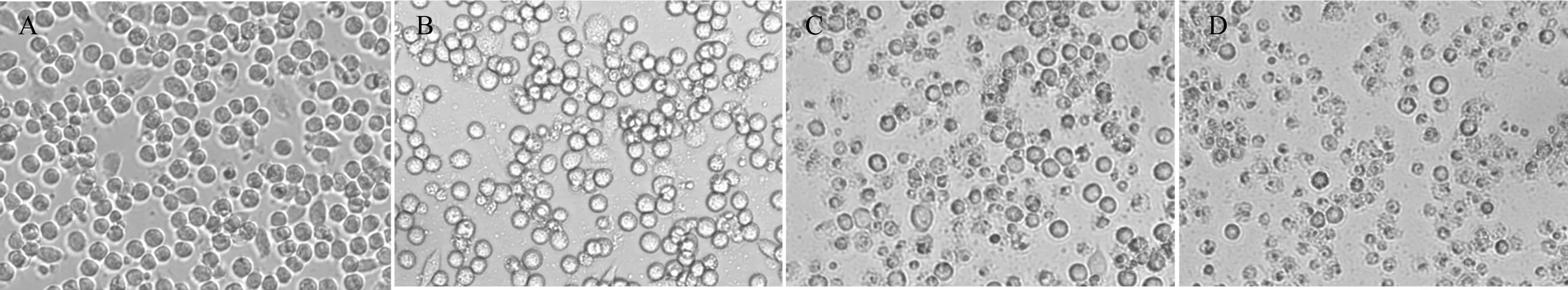
A.Mock;B.MOI=0.02;C.MOI=0.2;D.MOI=2

A.PAM;B.Marc-145
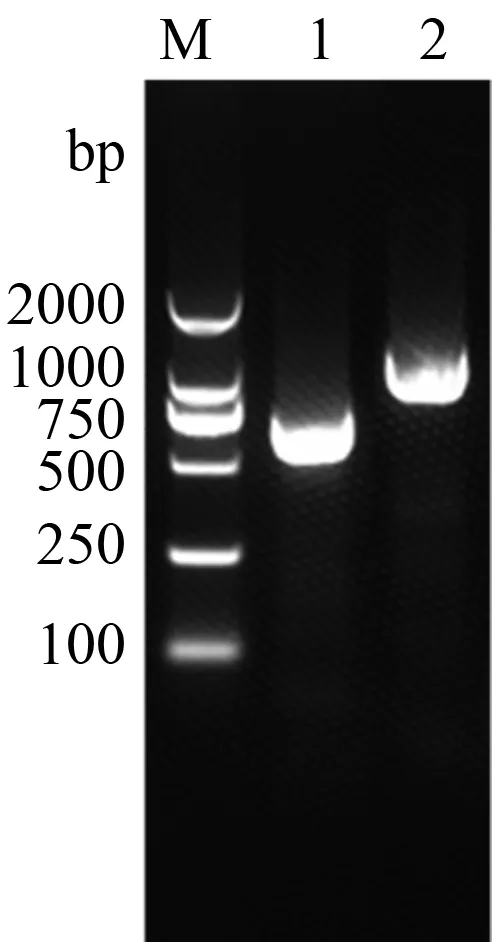
M.DL2000 DNA Marker;1.HNhx毒株Nsp2;2.HN07-1毒株Nsp2
2.4 HNhx毒株生长曲线
HNhx毒株生长曲线如图4所示,在感染PAM 36 h后病毒滴度达到顶峰,之后开始缓慢降低。而HNhx毒株感染Marc-145细胞后,滴度缓慢上升,96 h达到107.5TCID50/mL。结果表明,HNhx毒株在PAM上具有更好的增殖特性,PRRSV感染Marc-145后,滴度较低,但随着时间延长,滴度缓慢升高。因此,推测HNhx经多次繁殖后也可在Marc-145上适应。

图4 HNhx毒株生长曲线
2.5 HNhx毒株ORF3、ORF4和ORF5基因扩增结果
从分离株培养液中提取总RNA,反转录生成cDNA。使用表1中引物扩增HNhx毒株的ORF3、ORF4和ORF5基因。扩增产物琼脂糖凝胶电泳结果如图5所示,ORF3、ORF4、ORF5基因大小分别约为780、550、650 bp,与预期结果一致。
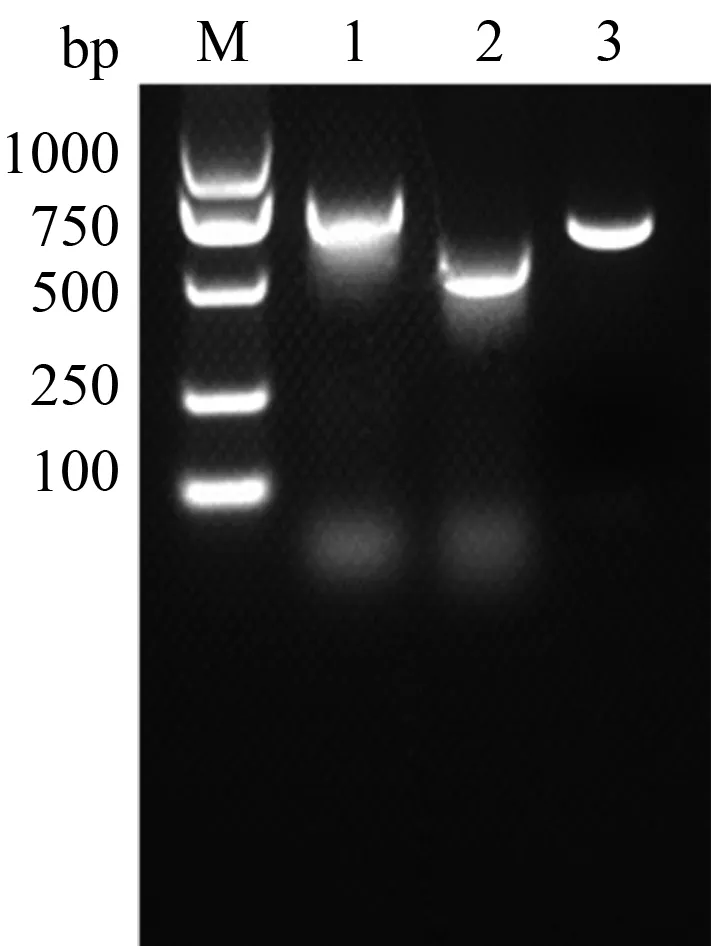
M.DL2000 DNA Marker;1.ORF3;2.ORF4;3.ORF5
2.6 HNhx毒株ORF3、ORF4和ORF5基因序列比对结果
将HNhx毒株的ORF3、ORF4和ORF5的基因序列与国内外不同来源的PRRSV毒株(表2)序列进行核苷酸和氨基酸相似性分析。结果如表3、4所示,HNhx毒株与美国分离株NADC30的相似性最高,ORF3、ORF4和ORF5基因与NADC30毒株的相似性依次为94.51%、96.28%和94.20%,氨基酸序列相似性依次为93.79%、93.82%和92.50%。虽然同源性很高,但HNhx毒株和NADC30毒株之间仍然有6.21%、6.18%和7.50%的差异。而HNhx毒株ORF3、ORF4和ORF5基因与国内流行的高致病性毒株JXA1的核酸相似性为82.35%、85.10%和84.08%,氨基酸相似性依次为79.92%、84.27%和83.00%。
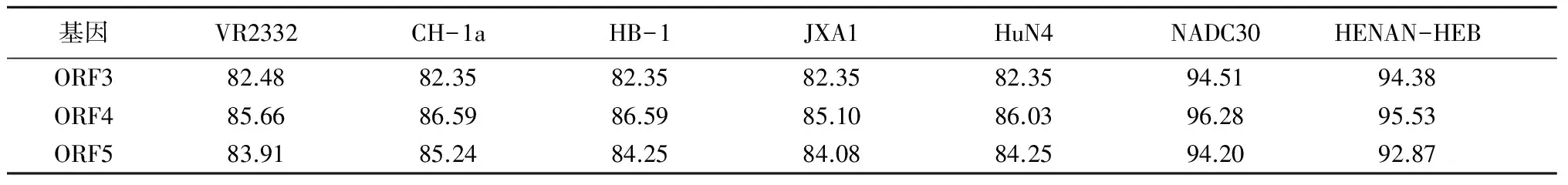
表3 核酸序列相似性比较 %

表4 氨基酸序列相似性比较 %
2.7 HNhx毒株ORF3、ORF4和ORF5进化树构建与分析结果
为了进一步分析分离得到的PRRSV流行毒株HNhx与其他流行毒株在遗传进化上的关系,将其基因组变异较大的ORF3、ORF4和ORF5基因与国内外主要流行的参考毒株(表2)分别建立系统进化树,结果如图6—8所示。HNhx毒株属于NADC30-like PRRSV亚群,而NADC30-like PRRSV亚群中所有的毒株又被分为不同的分支,其中NDAC30和XW015位于同一分支,HNhx的ORF3和ORF4与HENAN-HEB在同一分支,而ORF5与FJY04和FJZ03在同一分支中。进化关系上的差异显示了NADC30-like PRRSVs分离株在我国的进化情况。
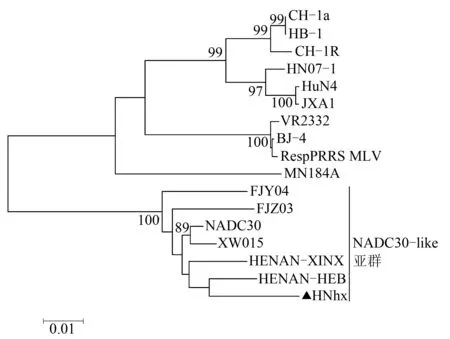
图6 基于分离毒株和参考毒株的ORF3基因构建系统进化树
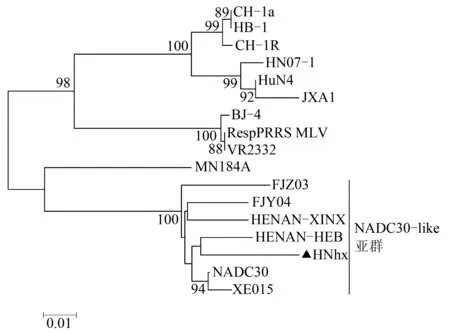
图7 基于分离毒株和参考毒株的ORF4基因构建系统进化树

图8 基于分离毒株和参考毒株的ORF5基因构建系统进化树
3 结论与讨论
PRRSV长期在我国流行,给生猪养殖业带来巨大经济损失[3]。2006年,由HP-PRRSV引起的高热、高死亡率的疫情,更是对我国生猪养殖业造成前所未有的打击[4]。近期,我国多个省份又相继爆发了PRRS疫情,研究发现,这是由北美地区输入的NADC30毒株引起的。本研究从河南省滑县地区发病猪场中采集阳性病料,并成功分离到PRRSV毒株HNhx。IFA、RT-PCR试验和Nsp2序列比对分析结果证明,该分离毒株为目前流行的NADC30-like毒株。HNhx毒株体外生长曲线测定结果表明,HNhx毒株的病毒滴度最高可以达到107.5TCID50/mL,并且与我国流行的高致病性毒株相似,能够引起宿主细胞迅速产生明显的病变。因此,HNhx毒株较强的复制能力可能是导致被感染猪出现急性症状的主要原因。
依据HNhx毒株ORF3、ORF4和ORF5核酸序列构建进化树,系统进化分析表明,HNhx毒株属于NADC30-like PRRSV亚群。而NADC30-like PRRSV亚群中所有的毒株又被分为不同的分支,其中NDAC30和XW015位于同一分支,HNhx的ORF3和ORF4与HENAN-HEB在同一分支,而ORF5与FJY04和FJZ03在同一分支中。进化距离和关系上的差异表明了NADC30-like PRRSV分离株进化演变的复杂性。HNhx毒株ORF3、ORF4和ORF5核酸序列与JXA1(HP-PRRSV)的相似性依次为82.35%、85.10%和84.08%,序列比对结果表明,NADC30-like毒株与HP-PRRSV毒株之间的亲缘关系较远。而目前我国临床上使用的疫苗主要是以HP-PRRSVs为亲本研制的弱毒疫苗,所以临床上正在广泛使用的商业化疫苗并不能为免疫宿主提供有效保护,这可能是导致NADC30-like毒株在我国多个地区相继流行的主要原因。
PRRSV的高度变异性是预防和治疗PRRS极其困难的主要原因。对分离的HNhx毒株的ORF3、ORF4和ORF5氨基酸序列进行分析后发现,与其他毒株相比,HNhx毒株的ORF3、ORF4和ORF5基因和氨基酸序列都与美国分离株NADC30毒株的相似性最高,但是他们之间仍然有6.21%、6.18%和7.50%的差异。核酸序列之间的差异性表明,HNhx毒株是由亲本毒株NADC30流入后进化演变而来。NADC30-like毒株不断进化和突变也加剧了PRRS防控的难度。
NADC30毒株的流入不仅增加了我国流行毒株的多样性,且其变异速度快,易与其他毒株重组,进一步增加了控制疫情的难度。分离河南地区流行的NADC30-like毒株,并进行毒株特性研究和进化分析,将为研制抵抗NADC30-like PRRSV毒株的疫苗,探索PRRSV感染机制及病原生物学相关研究奠定基础。
[1] Baron T,Albina E,Leforban Y,etal.Report on the first outbreaks of the porcine reproductive and respiratory syndrome(PRRS) in France.Diagnosis and viral isolation[J].Ann Rech Vet,1992,23(2):161-166.
[2] Wensvoort G,Terpstra C,Pol J M,etal.Mystery swine disease in the Netherlands:The isolation of Lelystad virus[J].Vet Q,1991,13(3):121-130.
[3] Zhou L,Yang H.Porcine reproductive and respiratory syndrome in China[J].Virus Res,2010,154(1/2):31-37.
[4] 王小敏,何孔旺,周忠涛,等.猪繁殖与呼吸综合征病毒变异株的分离鉴定及遗传变异分析[J].华北农学报,2014,29(1):232-238.
[5] 蒋志政,张改平,刘明阳,等.抗猪FcγRⅡb多抗阻断猪繁殖与呼吸综合征病毒抗体依赖增强作用研究[J].河南农业科学,2012,41(4):139-142,145.
[6] 侯婕,李睿,马红芳,等.猪繁殖与呼吸综合征病毒入侵受体唾液酸黏附素的表达与纯化[J].河南农业科学,2016,45(3):130-134.
[7] 赵朴,郑玉姝,赵坤,等.猪呼吸道疾病综合征常见病毒多重PCR方法的建立及应用[J].华北农学报,2014,29(3):64-67.
[8] 张美玲,简子健,陆桂丽,等.猪繁殖与呼吸综合征病毒新疆株的分离与鉴定[J].天津农业科学,2013,20(11):31-34.
[9] 韩一超,刘文俊,姚敬明,等.猪繁殖与呼吸综合征病毒Shanxi-6株全基因序列分析[J].华北农学报,2014,29(2):62-65.
[10] Tian K,Yu X,Zhao T,etal.Emergence of fatal PRRSV variants:Unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,2(6):e526.
[11] Johnson C R,Griggs T F,Gnanandarajah J,etal.Novel structural protein in porcine reproductive and respiratory syndrome virus encoded by an alternative ORF5 present in all arteriviruses[J].J Gen Virol,2011,92(Pt 5):1107-1116.
[12] Stadejek T,Oleksiewicz M B,Potapchuk D,etal.Porcine reproductive and respiratory syndrome virus strains of exceptional diversity in eastern Europe support the definition of new genetic subtypes[J].J Gen Virol,2006,87(Pt 7):1835-1841.
[13] 张明亮,张春杰,程相朝,等.豫西地区PRRSV新近流行株ORF5基因变异及Nsp2基因特征分析[J].河南农业科学,2012,41(1):137-141.
[14] 卢晓燕,周永辉,刘伟娟,等.豫西地区PRRSV猪繁殖与呼吸综合征病毒河南分离株NSP2和GP5基因遗传变异分析[J].华北农学报,2012,27(2):100-104.
[15] Zhou L,Wang Z,Ding Y,etal.NADC30-like strain of porcine reproductive and respiratory syndrome virus,China[J].Emerg Infect Dis,2015,21(12):2256-2257.
[16] Zhao K,Ye C,Chang X B,etal.Importation and recombination are responsible for the latest emergence of highly pathogenic porcine reproductive and respiratory syndrome virus in China[J].J Virol,2015,89(20): 10712-10716.
[17] Li Y,Ji G,Wang J,etal.Complete genome sequence of an NADC30-Like porcine reproductive and respiratory syndrome virus characterized by recombination with other strains[J].Genome Announc,2016,4(3):e00330-16.
Proliferation Characteristics and Phylogenetic Analysis of One NADC30-like PRRSV Strain Isolated in Henan
WANG Linjian1,2,GUO Zhenhua2,QIAO Songlin2,CHEN Xinxin2*,ZHANG Gaiping1,2*
(1.College of Life Sciences,Henan Agricultural University,Zhengzhou 450002,China; 2.Key Laboratory of Animal Immunology of the Ministry of Agriculture/Henan Provincial Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
In order to investigate the epidemic characteristics and genetic diversity of PRRSV in Henan province,lungs from diseased pigs showing clinical signs suspected of PRRSV were collected from pig farm in Huaxian area of Henan province.The samples were homogenized,diluted and centrifuged and the obtained supernatants were inoculated into PAM to isolate PRRSV.PAM showed obvious cytopathic effect(CPE),which revealed that PRRSV strain was isolated and was named HNhx.The result of indirect immunofluorescence(IFA) showed that the PAM infected with HNhx were positive for N protein of PRRSV.The isolated HNhx strain was identified as a NADC30-like PRRSV by RT-PCR using specific primers of NSP2.Genetics analysis showed that ORF3,ORF4 and ORF5 shared highest similarity with NADC30,respectively.Moreover,phylogenetic tree based on ORF3,ORF4 or ORF5 revealed that the PRRSV strain HNhx was clustered into NADC30-like subgroup.
PRRSV; isolation; identification; sequence analysis
2016-09-16
国家自然科学基金重大项目(31490601);现代农业(生猪)产业技术体系专项基金项目(CARS-36);河南省现代农业(生猪)产业技术体系项目(S2012-06)
王林建(1991-),男,河南新乡人,在读硕士研究生,研究方向:分子病原学和免疫学。E-mail:wljgnn@126.com
*通讯作者:陈鑫鑫(1987-),女,河南兰考人,助理研究员,博士,主要从事动物病毒疫病免疫机制研究。 E-mail:summerr_2016@163.com 张改平(1960-),男,河南内黄人,研究员,博士,主要从事动物免疫学及疫病快速检测技术研究。 E-mail:zhanggaiping2003@163.com
S852.4
A
1004-3268(2017)03-0122-07
