外源独脚金内酯对烟草腋芽伸长及独脚金内酯代谢途径相关基因表达的影响
2024-01-27田慧源唐博希王原秀郭凯阳刘国琴
田慧源,唐博希,王原秀,刘 帆,郭凯阳,刘国琴
(贵州大学烟草学院 / 贵州省烟草品质研究重点实验室,贵州 贵阳 550025)
烟草Nicotianatabacum是以叶片为主要收获物的经济作物和潜在的生物能源,也是研究植物基本生物过程的重要模式植物[1]。在生长过程中,烟草的枝条结构受顶端优势和发育过程的控制。通过去除顶端优势(在开花前去除花序),腋芽迅速长成枝条,这会严重降低烟草经济产量[2]。如何有效减少腋芽的产生从而提高烟叶产质量仍然是如今烟叶生产中面临的难题。因此,有必要了解烟草腋芽的生长机制,以制定抑制腋芽伸长的有效策略。在包括烟草在内的多种植物中,腋芽的生长均始于植物叶腋处分生组织(Axillary meristerm,AM)的发育。从细胞学上看,在腋芽的生长过程中,其腋分生组织形态、细胞数量及体积在不同生育时期存在差异[3]。AM 发育形成腋芽后,可分为两种发育情况:一种是由于顶端优势的存在或其他因素的影响,诱导腋芽休眠,使得腋芽进入生长停滞状态;第二种是腋芽持续生长发育形成侧枝,在该生长发育过程中会受到遗传因素、环境因素和植物激素的影响,其中植物激素对其生长发育发挥着关键的作用[4]。植物激素是在植物体内合成的一类微量信号分子,在低浓度下可以调控植物腋芽的生长发育[5]。吲哚乙酸(IAA)是最早被发现的植物激素,于顶芽或幼嫩组织中产生,并由植物顶端向植物基部进行极性运输,在植物腋芽的生长发育过程中发挥着重要的作用[6]。细胞分裂素(CTK)参与调控植物腋芽生长,在拟南芥Arabidopsisthaliana中,CTK 水平与腋芽生长速率正相关[7]。此外,油菜素内酯(BR)作为一种重要的植物甾醇类激素,在调控植物腋芽生长方面同样发挥着重要作用,能促进腋芽生长[8]。但关于BR 对烟草腋芽生长的影响尚不清楚。独脚金内酯(Strigolactone,SL)是继IAA、CTK、BR 之后发现的一类新型植物激素,参与植物生长发育并调控植物腋芽生长及分枝的形成[9],在调控植物腋芽生长的过程中与BR 存在拮抗作用[10]。
GR24 是一种SL 生物合成类似物,能够抑制植物腋芽生长[11]。TIS-108 作为SL 的生物合成抑制剂,能够抑制水稻Oryzasativa内源SL 的生物合成水平[12]。研究发现,SL 能够抑制植物腋芽的生长[13],其代谢途径相关基因在SL 抑制腋芽伸长过程中发挥着重要的调控作用[14]。AtD27基因是SL 生物合成的正调控因子,能够正调控SL 的生物合成[15],与植物腋芽的生长密切相关[16]。D14为SL 信号转导途径中的一个正调控因子,编码一种能使SL 释放小分子活性的蛋白,在腋芽起始发育中发挥作用,能够抑制植物分枝的形成[17]。DAD2作为水稻和拟南芥D14的同源基因,与D14具有相同的作用机制,能够正调控SL 的信号转导[18]。SMAX1/SMAX1-LIKE蛋白在SL 信号转导过程中发挥作用,SMAX1/SMAX1-LIKE 蛋白与MAX2 等因子进行相互作用,以调节植物侧枝的生长[19]。然而,关于SL 代谢途径相关基因在烟草腋芽生长过程中的调控作用研究较少。
迄今为止,大多数关于植物腋芽生长的研究都是采用模式植物进行,如菊花Chrysanthemum morifolium‘Jinba’[20]和 番 茄Solanum lycopersicum[21],而对烟草的研究较少[22]。目前,关于SL 对烟草腋芽生长发育影响的研究主要集中在生理代谢方面[23],少有参与SL 代谢途径相关基因的研究。因此,本研究探究打顶后烟草腋芽的分生组织发育变化以及在SL 处理下烟株腋芽长度的变化,运用转录组分析SL 生物合成及信号转导相关基因的表达谱,采用qRT-PCR 技术分析烟草打顶后SL 相关基因在腋芽不同生长发育阶段的表达模式变化,探讨SL 相关基因与腋芽伸长的关系。
1 材料与方法
1.1 材料
供试烟草品种为K326。
主要试剂:独脚金内酯人工合成类似物GR24(C17H14O5,分子量298.29,纯度>98%)购于上海翊圣生物科技有限公司;BR (C28H48O6,分子量490.68,纯度>98.05%)购于北京酷来博生物公司;SL 生物合成抑制剂TIS-108 (C20H21N3O2,分子量335.40,纯度>98%)购于北京索莱宝生物技术公司。
1.2 方法
1.2.1 材料培养
将烟草种子播种在12 孔育苗盘(长72 mm、宽49 mm、高62 mm)中,基质为0.85 L 水,每个育苗孔种植1 株幼苗。幼苗盘置于昼夜平均温度约26 ℃/17 ℃的人工气候箱中培养。烟草幼苗长至五叶一心阶段时,随机选取生长一致的烟苗移栽到外口径235 mm、高140 mm 的塑料花盆中培养,每盆基质10 kg。烟苗移栽后,按照常规栽培措施进行灌溉、施肥及病虫害管理。
1.2.2 试验设计
于2020 年6 月~2022 年9 月开展试验。
试验1:烟苗移栽14 d 后,选择生长条件相同的烟株进行打顶处理,将此时设为打顶0 h 并取样,将顶端切口下方第一节位腋芽连同其叶柄完整取下,去除叶片。然后在打顶2、4、6、8、10、12 和14 h 分别进行取样作为其他处理,总共8 个处理,每处理5 个重复,9 株为一个重复,每处理45 株。
试验2:烟株移栽50 d 后,选择生长一致、无病虫害的烟草植株进行外源激素处理。处理1:打顶后不对腋芽部位施加任何外源激素;处理2:打顶后第0~6 d,于每日上午8 点在腋芽部位外源施加10 µmol·L-1GR24 溶液100 µL,每日处理一次;处理3:打顶后第0~6 d,于每日上午8 点外源施加10 µmol·L-1TIS-108 溶液100 µL;处理4:打顶后0~6 d,于每日上午8 点在植株的腋芽部位外源施加5 µmol·L-1BR 溶液100 µL。外源激素在使用前,将体积分数0.2%吐温20 加入到10 µmol·L-1GR24、BR 溶液和TIS-108 溶液中。每处理设3 个重复,每重复30 株。
1.2.3 腋芽长度测定
在激素处理0、2、4、6 d 时,用直尺测量植株顶端打顶切口下方的第1~3 节位的腋芽长度,并取3 个节位的腋芽-80 ℃保存。
1.2.4 腋分生组织发育解剖结构观察
采用常规石蜡切片方法研究烟草腋芽处的分生组织发育变化[3]。
1.2.5 转录组测序
转录组测序所用样品为上述试验2 中烟株打顶后0 d、2 d、6 d 时第1 至3 节位的混合腋芽。样品总RNA 由Trizol 试剂进行提取,RNA 的完整性和纯度用Agilent 2100 RNA 6000 Nano 试剂盒进行检测[24]。转录组测序以 K326 全基因组(http://solgenomics.net/organism/Nicotiana_tabacum/genome/Edward 2017)作为参考基因组。
1.2.6 实时荧光PCR
根据基因CDS 序列用Primer5 软件设计引物(表1)。引物合成由重庆擎科生物科技公司完成。内参基因是L25(基因库登录号L18908)[25],反应体系按照Talent qPCR PreMix (SYBR Green)说明进行统一配置,检测步骤由Bio-Rad CFX96 实时荧光定量PCR 仪完成。试验共设置3 个技术重复,每个基因的相对表达量计算均采用2-△△CT方法[26]。

表1 用于表达分析的基因及其引物Table 1 Genes and their primers used in expression analysis
1.3 数据整理及图表制作
运用LSD 法对数据进行统计学分析,利用TBtools、Figdraw 等进行图表制作。
2 结果与分析
2.1 烟草腋分生组织的发育变化
烟草腋分生组织由中央母细胞区(CM)、周缘分生组织(PM)和肋状分生组织(RM)三个细胞区域组成(图1)。CM 位于整个腋分生组织顶端,该区域细胞高度液泡化、细胞体积较大,CM 侧面及基部的细胞可通过分裂产生PM 和RM。其中,PM 位于CM 两侧,细胞体积较小,细胞排列致密。RM 处于CM 的基部及PM 内侧的位置,该区域的细胞呈纵向排列(图1)。烟草腋分生组织的细胞学分区主要反映分生组织中各部分细胞分裂的差异,PM 细胞分裂较CM 细胞快,因此从细胞体积上看,PM 细胞较CM 细胞小。
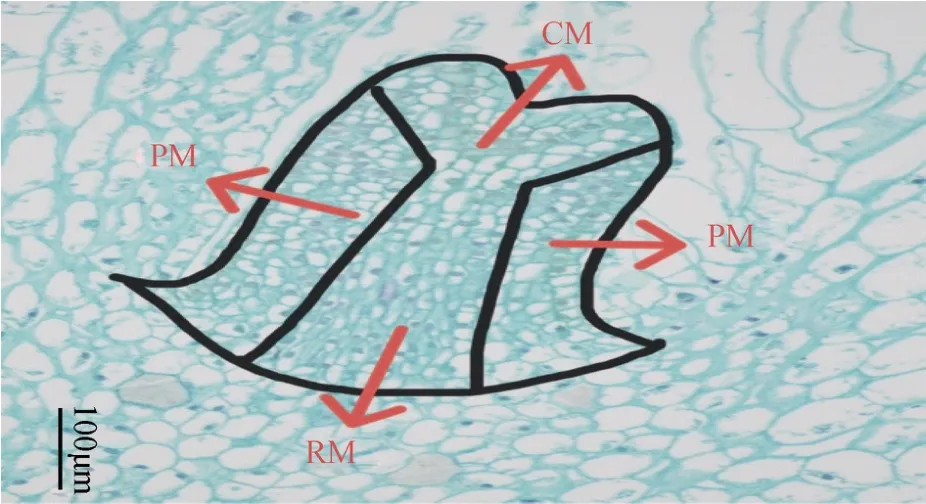
图1 烟草打顶10 h 后腋分生组织结构Fig. 1 Anatomical structure of tobacco axillary meristem at 10 h after decapitation
如图2 所示,打顶0 h 时,腋分生组织中CM区域的细胞向侧面和基部分裂,产生PM 的内层及RM 组织(图2 A)。打顶2 h 时,CM 区域的细胞数量增加,细胞由1 层分裂成为7 层,初步形成腋芽原基(图2 B)。4 h 后,CM 继续进行分裂,由于细胞分裂数量的增加,整个分生组织颜色加深(图2 C)。6 h 时,CM 区域的细胞体积增大,PM、CM 区域细胞数量增加明显(图2 D)。8 h~14 h 时,PM 区域的细胞均向叶腋处两侧继续分裂,促进叶原基发育,RM 纵向分裂促进腋芽原基径向生长,促进腋芽的伸长(图2 E~H),腋芽原基发育形成芽状。
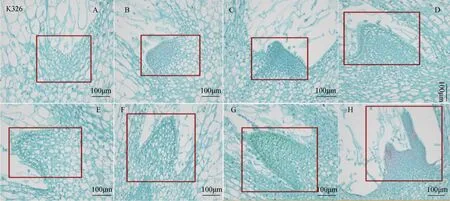
图2 烟草K326 打顶后腋分生组织的发育变化Fig. 2 The dynamics of axillary meristem of Nicotiana tabacum K326 after decapitation
2.2 不同植物生长调节剂对烟草腋芽伸长的影响
打顶后,腋芽长度增加,其中第1 节位的腋芽长度增长量最大,其次为第2 节位和第3 节位。处理6 d,第1~3 节位腋芽伸长量达到最大值(图3)。说明打顶能够促进烟草腋芽的伸长,尤其在处理6 d时增幅最大。
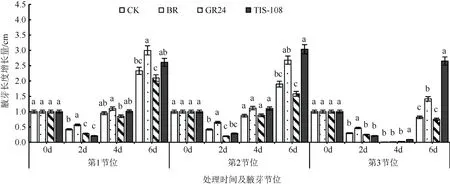
图3 GR24 和TIS-108 对烟草不同节位腋芽伸长的影响Fig. 3 The effects of GR24 and TIS-108 on the elongation of tobacco axillary buds in the section different position
不同植物生长调节剂(BR、GR24、TIS-108)对烟草腋芽长度的影响不同(图3)。在BR 处理中,第1~3 节位中的腋芽长度均保持在较高水平,在处理2 d 时显著高于CK、GR24 和TIS-108 处理,而在BR 处理4 d 时,第1~2 节位的腋芽长度与CK、TIS-108 处理无显著差异;TIS-108 处理与CK、BR、GR24 处理相比,第3 节位的腋芽在处理4 d 和6 d时长度显著增加;GR24 处理后,第1~2 节位腋芽长度的增长在处理2 d 时受抑制,与CK 和BR 处理差异显著,尤其在第2 节位中腋芽长度的降幅最大,较CK 和BR 处理分别下降52%和69.2%(图3)。可见,SLs 能够抑制烟草腋芽的伸长,且同一生长阶段不同节位烟草腋芽对GR24 的响应存在差异,而BR 与GR24 的作用效应相反,能够促进腋芽的伸长。
2.3 SL 生物合成及信号转导基因的转录组分析
在SL 的生物合成过程中,异素异构酶 D27 把all-trans-β-类胡萝卜素转化为9-cis-β-类胡萝卜素,而后由CCD7 (MAX3)将9-cis-β-类胡萝卜素转化为9-cis-β-apo-10′-类胡萝卜醛,CCD8 (MAX4)催化该物质转化为己内酯(Carlactone, CL),通过P450 等酶的催化作用,最终形成SL 进入SL 信号转导途径[27]。此时,D14 与F-box 蛋白MAX2、SMXLs 形成SCF复合体,该复合体存在开放式的空腔来容纳SL,受到刺激后,可将SL 水解为小分子活性物质CLIM(Covalently linked inter mediate molecule),进而激活SL 的信号传导,促进D53 降解,最终抑制植物分枝的生长[28]。
通过序列比对和注释参考发现了12 个与独脚金内酯相关的差异基因,其中D27、CCD7、CCD8基因与独脚金内酯生物合成有关,D14、DAD2和SMAX1、SMAX1-LIKE4、SMAX1-LIKE6基因与独脚金内酯信号转导有关(表2)。在处理2~6 d 时,在CK 和 GR (GR24)比较组中,CCD7(Nitab4.5_0003110g0040)、D27(Nitab4.5_0002828g0040)、DAD2(Nitab4.5_0000164g008) 、D14(Nitab4.5_0000279g0060)、SMAX1-LIKE4(Nitab4.5_0000056g 0010)呈上调表达,而SMAX1(Nitab4.5_0000244g 0070)的表达模式相反,呈下调表达。其中,CCD7(Nitab4.5_0003110g0040)的表达量上调 0.95~1.60倍,D27(Nitab4.5_0002828g0040)上调0.36~0.60倍,DAD2的表达量增加0.47~1.84 倍。在TIS(TIS-108) 与 GR24 比较组中,D27、D14仅在处理2 d 上调表达,DAD2仅在处理6 d 受到GR24 的诱导,而SMAX1-LIKE4在处理2~6 d 上调表达。CCD8(Nitab4.5_0001894g0040)和另一个CCD7基因(Nitab4.5_0004415g0050)的表达在两组间无显著变化。可见SL 影响烟草腋芽的伸长可能是通过调控其代谢途径相关基因的表达来实现的(图4)。
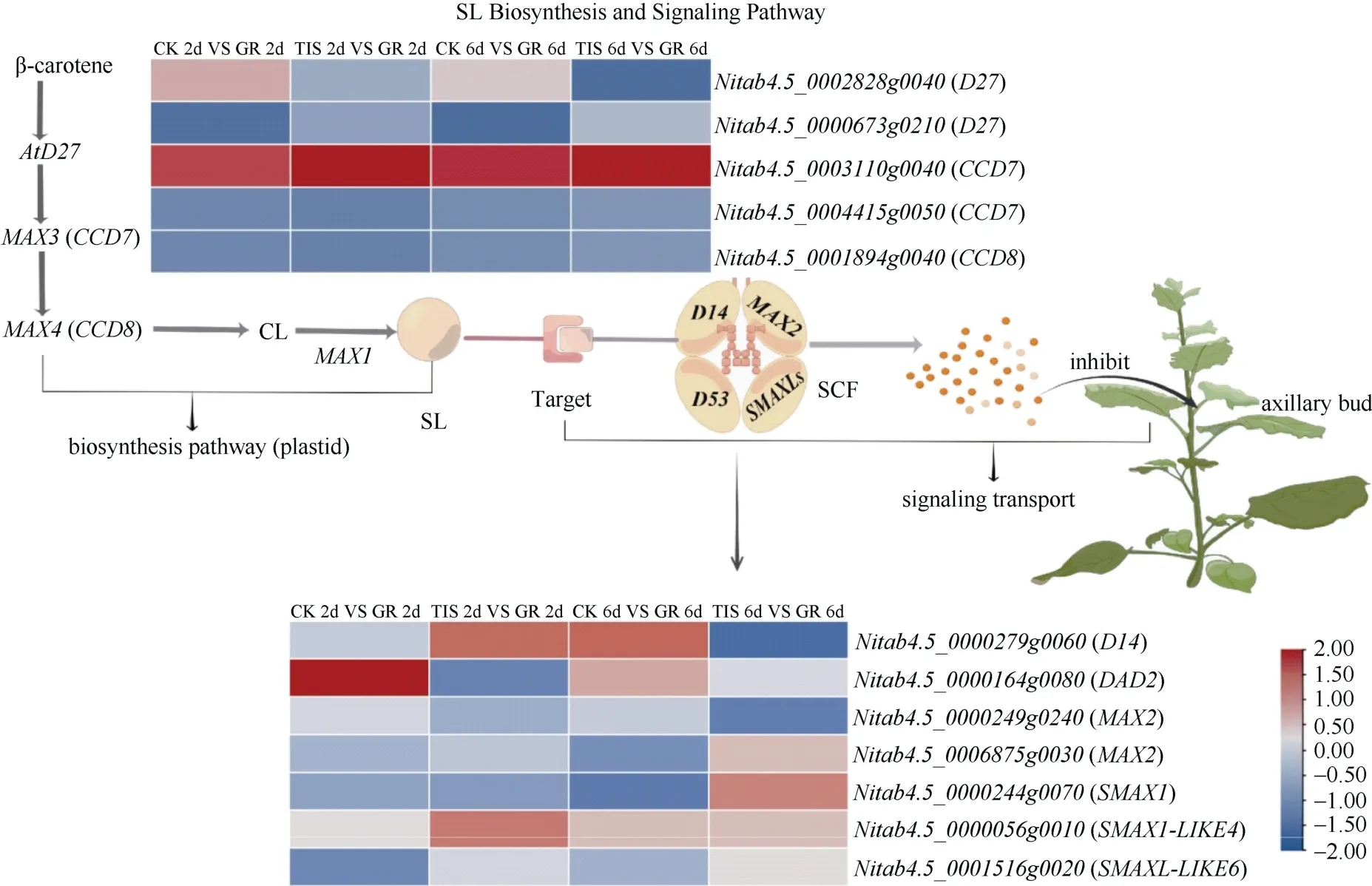
图4 SL 生物合成及信号转导基因在烟草腋芽中的表达谱Fig. 4 Expression profiles of strigolactone biosynthesis and signal transduction genes in tobacco axillary buds

表2 独脚金内酯合成和信号转导相关基因筛选与功能注释Table 2 Screening and functional annotation of genes related to strigolactone synthesis and signal transduction
2.4 SL 代谢途径相关基因表达验证
2.4.1 SL 相关基因在烟草腋芽生长过程中的表达变化
qRT-PCR 结果显示,在CK 中,打顶后,腋芽伸长过程中D27、DAD2、D14、SMAX1-LIKE4的相对表达量在处理2~6 d 均保持在低水平,显著低于GR24 和TIS-108 处理;相反,SMAX1基因呈高表达,在打顶2~4 d 均显著高于GR24 处理(图5)。GR24 处理后,与CK 和TIS-108 相比,D14、SMAX1-LIKE4基因的表达在处理2 d 受到GR24 的诱导,D27和DAD2在处理4 d 时高表达,而SMAX1在GR24 处理中低表达。在TIS-108 处理中,D14、DAD2、SMAX1-LIKE4和SMAX1的相对表达量与CK 之间无显著差异。说明D27、DAD2、D14、SMAX1-LIKE4基因可能在响应SL 抑制烟草腋芽伸长的过程中发挥正调控的作用,而SMAX1可能正调控烟草腋芽的伸长(图5 A~E)。
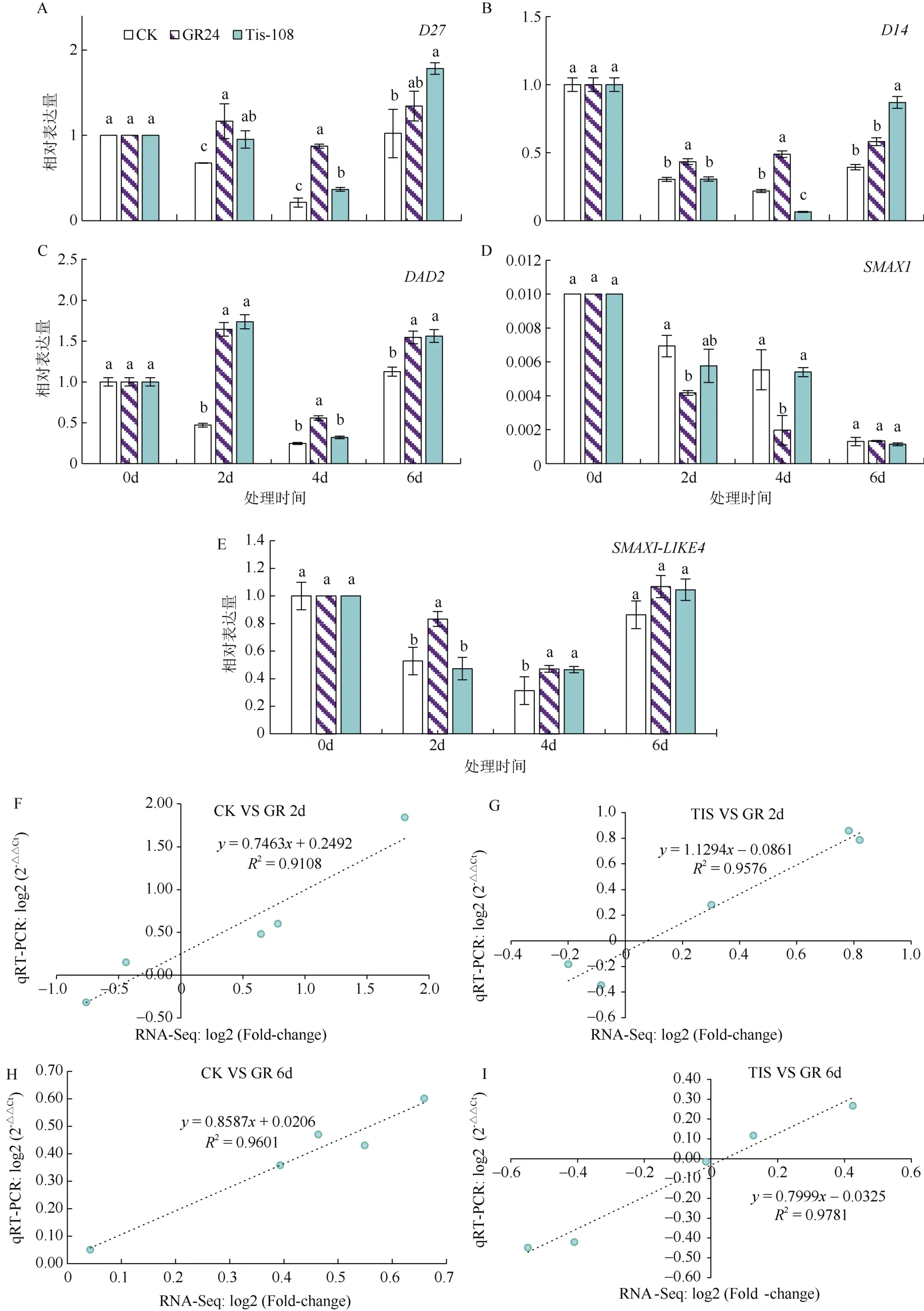
图5 GR24 和TIS-108 处理下SL 代谢途径相关基因的表达与qRT-PCR 验证Fig. 5 Expression and qRT-PCR validation of SL metabolic pathway-related genes under GR24 and TIS-108 treatments
2.4.2 qRT-PCR 与转录组数据的相关性分析
随机挑选5个参与SL生物合成及信号转导途径的基因进行qRT-PCR 验证,引物序列详见表1。结果发现,这些基因的表达模式高度符合RNA-Seq 结果,相关系数(R2)>0.91 (图5 F~I),从而验证了RNA-Seq 结果的可靠性。
3 结论与讨论
研究表明,马尾松Pinusmassoniana腋芽分生组织由中央母细胞区(CM)、周缘分生组织(PM)和肋状分生组织(RM)组成[29],本研究发现烟草腋芽的分生组织细胞区域与之相似。CM 位于腋分生组织的顶端,CM 细胞向下和两侧进行分裂产生PM 和RM,即CM 是产生所有组织的原细胞[30]。腋分生组织三个区域的细胞体积、排列形式存在差异,CM 细胞高度液泡化,细胞体积较大,而PM 细胞体积较小、排列致密,RM 细胞呈纵向分布。细胞的形态和排列方式影响其分裂特性,烟草腋芽分生组织的细胞学分区实际上是反映了腋分生组织中各部分细胞分裂的差异性,PM 细胞体积较CM 小,说明PM 细胞分裂比CM 快[3]。打顶后,腋分生组织分裂迅速,K236 的腋分生组织在打顶0~4 h 后细胞数量明显增多,而木本植物在打顶4 h 后其腋分生组织细胞数量才开始增加,这可能是受物种特异性的影响[30]。
腋芽是植物株型的重要构成元素之一,在多种影响腋芽生长发育的因素中,除了受自身发育的影响(腋分生组织的发育),植物激素也发挥着关键的作用[31]。GR24 是应用最广泛的SL 合成类似物,具有与内源性SL 相似的生物活性[32],可以抑制各种植物的腋芽生长[33]。GR24 对各种植物影响的研究主要集中在侧芽休眠上[34—35]、腋芽的萌发和生长[36]、芽分枝[37]或分蘖的形成与发育[36]。本研究更多地关注GR24 对腋芽伸长的影响。在第一节位的腋芽中,当不同生长调节剂处理6 d 后,与CK、BR 和TIS-108处理植株相比,GR24 处理植株的腋芽伸长率显著降低。研究表明 GR2 4 也能抑制拟南芥和豌豆Pisumsativum腋芽的生长和发育[38—39],这与本研究结果一致,说明GR24 能够抑制烟草腋芽的伸长。然而,腋芽在生长发育过程中,并不是受单一植物激素的影响,不同植物生长调节剂对腋芽生长的影响不同。TIS-108 对烟草腋芽生长的影响与SL 相反,与CK、BR、GR24 处理相比,在TIS-108 处理4 d和6 d 时,观察到第3 节位的腋芽长度显著增加,说明TIS-108 作为SL 合成抑制剂[10],可与P450s血红蛋白结合,如MAX1 酶(SL 生物合成酶),从而影响SL 代谢水平,削弱SL 对腋芽的抑制效应[10]。BR 作为一种重要的参与调控植物腋芽生长的植物激素,能够促进拟南芥和番茄腋芽的生长与侧枝的形成[40—41]。在本研究中,与CK、GR24、TIS-108处理相比,BR 处理2 d 时,烟草第1~3 节位腋芽的长度显著增加,说明BR 能促进烟草腋芽伸长,在共同调控烟草腋芽伸长的过程中,与SL 之间可能存在一定的拮抗作用[42]。在烟草腋芽生长过程中SL与BR、TIS-108 之间的互作机制还有待进一步研究。
相关研究表明,SL 调控腋芽生长过程中,其代谢途径相关基因发挥着重要的作用[12]。D27 是SL生物合成的关键酶,定位于植物叶绿体中,其同系物为MAX3 和MAX1/D10[43—45]。拟南芥和豌豆的D27突变体由于SL 生物合成缺陷而表现出高分枝表型,但通过外源施加SL 后,该高分枝表型得以抑制[46—47],D27可通过MAX/RMS/D途径调控水稻的分蘖,并促进分蘖中SL 的生物合成[48]。在本研究中,外源SL 可诱导烟草腋芽中SL 生物合成基因D27在处理4 d 时高表达,表明D27(Nitab4.5_0002828g0040)在SL 介导的抑制烟草腋芽伸长的过程中也发挥着正调控的作用[49],但其对烟草腋芽的具体调控机制有待进一步研究。
D14 和DAD2 是F-box 蛋白(MAX2)家族的成员[50],在SL 信号转导途径中发挥作用。D14突变体植株较野生植株的高度显著增加,同时呈现出高分蘖的表型,其表型类似于D3、HTD1/D17和D10突变体[51]。DAD2 是D14 的同系物,最早在牵牛花Pharbitisnil中鉴定出来,其突变体与D14突变体相似,具有高分枝表型,证实D14/DAD2在SL途径中起作用[52],并抑制腋芽的生长[53]。在本研究中,烟株打顶后,SL 分别在处理2~4 d 时显著诱导了D14(Nitab4.5_0000279g0060)与DAD2(Nitab4.5_0000164g0080)在腋芽中的表达,说明在烟草腋芽的生长过程中,D14与DAD2可能在SL 抑制烟草腋芽生长过程中发挥正调控作用,但具体的分子作用机制尚不清楚。SMAX1及其同源基因SMAX1-LIKE4(SMAXL 蛋白)在SL 信号通路的下游发挥阻碍因子的作用。在SL 信号转导途径上游中,D14 与D3 形成SCF 复合物,该复合物靶向识别下游的SMAXLs蛋白导致其降解,从而启动SL 信号转导[54]。研究表明,SMAX1还参与植物侧枝的调控[55]。拟南芥SMAX1通过改变TCP1和BRC1的表达来调控植物成熟期的叶片形态和枝条分枝[55]。在本研究中,SMAX1的表达受到GR24 抑制,而其同源基因SMAX1-LIKE4在腋芽不同生长发育时期出现不同程度的上调表达,说明SMAX1(Nitab4.5_0000244g 0070)和SMAX1-LIKE4(Nitab4.5_0000056g0010)虽然为同源基因,但对SL 的响应不同,可见,SMAX1(Nitab4.5_0000244g0070)可能在SL 抑制烟草腋芽生长过程中发挥着正调控的作用,其同源基因SMAX1-LIKE4(Nitab4.5_0000056g0010)可能负调控烟草腋芽的生长,但在烟草腋芽生长过程中该类基因具体的分子调控机制还有待进一步研究[56]。
综上所述,烟草腋芽的生长除了受自身分生组织发育的影响,还受植物激素的调控,不同的植物生长调节剂对烟草腋芽生长的影响不同,BR 促进烟草腋芽的伸长,而SL 抑制烟草腋芽的伸长,且在其参与调控腋芽生长的过程中,SL 代谢途径相关的基因(D27、D14、DAD2、SMAX1、SMAX1-LIKE4)发挥着重要的作用。
