不同浓度依达拉奉对低氧环境下c-kit+心脏干细胞的影响
2017-04-05文德重周敏薛松黄日太
文德重,周敏,薛松,黄日太
(上海交通大学医学院附属仁济医院,上海200127)
不同浓度依达拉奉对低氧环境下c-kit+心脏干细胞的影响
文德重,周敏,薛松,黄日太
(上海交通大学医学院附属仁济医院,上海200127)
目的 观察不同浓度的依达拉奉对于低氧环境下c-kit+心脏干细胞 (CSCs)的影响。方法 体外灌注酶解成年小鼠心脏,磁珠分选c-kit+CSCs,流式细胞仪和免疫荧光染色分别检测分选后干细胞纯度和表型。将c-kit+CSCs培养基中加入不同浓度依达拉奉(0、100、300、500、700、1 000 μmol/L),在1%氧条件下分别通过免疫荧光显微镜下DFCH-DA检测细胞活性氧(ROS)生产量、流式细胞仪检测凋亡率、Transwell检测细胞迁移能力、RT-PCR检测成纤维细胞生长因子(bFGF)mRNA表达。结果 依达拉奉浓度为1 000 μmol/L时所产生的ROS量最少,与其他浓度比较有统计学差异(P均<0.05)。依达拉奉浓度为1 000 μmol/L时细胞凋亡率最低,与0、100 μmol/L浓度比较有统计学差异(P均<0.05)。依达拉奉浓度为700 μmol/L时c-kit+CSCs迁移数最大,与0 μmol/L比较有统计学差异(P<0.05)。依达拉奉浓度为700 μmol/L时,c-kit+CSCs bFGF mRNA表达最高(P均<0.05)。结论 依达拉奉通过影响细胞的凋亡率、迁移率、ROS生成和bFGF mRNA的表达对c-kit+CSCs发挥保护作用,且在一定浓度范围内存在剂量依赖性。
心脏干细胞;依达拉奉;活性氧;细胞凋亡;细胞迁移;成纤维细胞生长因子
心脏干细胞(CSCs)移植为心肌梗死后心功能损伤的治疗带来了希望,目前已成为再生医学的研究热点。但是有研究发现干细胞移植后的存活率不超过10%,不足以修复坏死的心肌组织[1, 2]。主要是因为移植的干细胞处于缺血缺氧环境下,细胞氧化应激过度,导致细胞死亡。依达拉奉是一种新型的氧自由基清除剂,已广泛应用于急性脑缺氧性疾病。研究发现依达拉奉能够清除心肌缺血再灌注后产生的自由基,抑制细胞凋亡,对心肌具有一定的保护作用[3, 4]。但是,依达拉奉对于低氧下c-kit+CSCs的影响国内外文献报道较少。2016年4~11月,本文就不同浓度的依达拉奉对低氧条件下c-kit+CSCs活性氧(ROS)生成、凋亡率、迁移能力和成纤维细胞生长因子(bFGF)表达的影响进行了研究。
1 材料与方法
1.1 主要材料 SPF 级C57雄性小鼠, 6~8周龄,体质量18~20 g,购于上海杰思捷实验动物有限公司。胎牛血清(FBS)、Ⅱ型胶原酶、DMEM-F12培养基、N2、B27、胰蛋白酶、白血病抑制因子(LIF)、表皮生长因子(EGF)、bFGF、胰岛素-转铁蛋白-亚硒酸钠(ITS)、小鼠c-kit磁珠、CD45 磁珠、抗c-kit免疫荧光抗体、抗鼠c-kit PE流式抗体、PE Annexin V凋亡试剂盒、0.5%结晶紫、Transwell小室、DFCH-DA、依达拉奉、RNA 抽提试剂盒、逆转录试剂盒。
1.2 CSCs分离、分选及纯度检测 成年C57小鼠腹腔注射肝素100 IU,10 min麻醉后无菌条件打开胸腔,小心分离心脏,尽快将心脏悬挂于无菌心脏灌注装置,6-0丝线固定。用氧饱和的含0.1% Ⅱ型胶原酶的心肌消化液37 ℃灌注10 min,流量控制为4 mL/min。当心脏变白变软停止灌注,并将心脏转移至含预冷2%FBS的DMEM-F12培养基中,小心吹打,将心肌组织解离成单个细胞。40 μm滤网过滤,300 g离心1 min去除心肌细胞,将上清转移至另一离心管,再330 g离心7 min去除上清。细胞重悬于100 μL的PBS缓冲液中,加入5μL CD117 PE Labeling Reagent,常温避光孵育15 min。加入7 μL PE Selection Cocktail,混匀后常温避光孵育15 min。加入5 μL磁珠,吹打混匀,避光孵育10 min。加入2 mL 的PBS缓冲液混匀,并将流式管放于磁铁中静置5 min后,缓慢弃去上清液,重复4~5次。将分选的细胞培养于DMEM-F12,内含10%FBS、100 U/mL青霉素、100 μg/mL链霉素、10 ng/mL LIF、10 ng/mL bFGF、20 ng/mL EGF、1% ITS、1% B27、0.5% N2。分选后含有CD117 PE标记的CSCs重悬于100 μL的PBS缓冲液中,通过流式细胞术检测c-kit+CSCs纯度达到89.3%;免疫荧光染色显示细胞已经贴壁,大部分细胞为c-kit+CSCs。
1.3 不同浓度依达拉奉作用后c-kit+CSCs ROS生成检测 将培养的CSCs接种于24孔板中,每孔0.5×105个细胞,贴壁24 h。用含20 μmol/L DCFH-DA的培养基37 ℃避光孵育30 min后弃去,更换为含不同浓度依达拉奉(0、100、300、500、700、1 000 μmol/L)的细胞完全培养基,在37 ℃、1%O2、94%N2、5%CO2的培养箱中避光培养8 h。取出细胞,PBS 洗涤3次,免疫荧光显微镜488 nm波长下曝光1 s拍照。DFCH-DA在细胞中可被酯酶去乙酰基而变成没有荧光的DFCH,DFCH可以与细胞内产生的ROS结合,生成有绿色荧光的DFC。绿色荧光细胞数与ROS的生成呈正相关,以绿色荧光细胞数表示ROS生成数量。
1.4 不同浓度依达拉奉作用后c-kit+CSCs凋亡率检测 将培养的CSCs接种于24孔板中,每孔1×105个细胞,贴壁24 h后,将培养基更换为含不同浓度依达拉奉(0、100、300、500、700、1 000 μmol/L)的无血清DMEM-F12培养基中,在37 ℃、1%O2、94%N2、5%CO2的培养箱中避光培养48 h。收集细胞,预冷PBS洗涤2次,重悬于50 μL的结合液中,并加入2.5 μL的PE Annexin V和2.5 μL的7-AAD染色液。另设3管对照,分别为空白细胞管、仅加2.5 μL PE Annexin V 细胞管和仅加2.5 μL 7-AAD细胞管。混匀,室温避光孵育15 min,加入150 μL的结合液,混匀,上机检测。
1.5 不同浓度依达拉奉作用后c-kit+CSCs迁移能力检测 培养的CSCs用无血清的DMEM-F12培养基饥饿12 h。胰酶消化,加入10%FBS的DMEM-F12培养基中和,1 000 r/min离心5 min。重悬细胞于无血清的DMEM-F12培养基中,调整细胞浓度为2.5×105个/mL。吸取细胞200 μL,加入到8 μm的Transwell 小室上层。下层加入500 μL含不同浓度依达拉奉(0、100、300、500、700、1 000 μmol/L)10% FBS 的DMEM-F12培养基中,在37 ℃、1%O2、94%N2、5%CO2的培养箱中避光培养8 h。4%的多聚甲醛固定30 min,0.5%结晶紫染色30 min。用棉签将Transwell上层细胞擦去,显微镜下观察拍照。
1.6 不同浓度依达拉奉作用后c-kit+CSCs bFGF检测 将培养的CSCs接种于24孔板中,每孔1×105个细胞,贴壁24 h。更换为含不同浓度的依达拉奉(0、100、300、500、700、1 000 μmol/L)的无血清DMEM-F12培养基中,在37 ℃、1%O2、94%N2、5%CO2的培养箱中避光培养24 h。利用小剂量RNA 抽提试剂盒提取出总RNA,260/280 nm 吸光度用来判断RNA 的质量。总RNA(0.5 μg)用逆转录试剂盒转录成cDNA。之后使用bFGF引物进行PCR 扩增。样品电泳完毕后,将凝胶放入ChemiDoc MP 凝胶成像系统( Bio-Rad 公司,美国) 观察拍照,然后使用ImageLab软件进行数据处理。
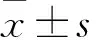
2 结果
2.1 不同浓度依达拉奉对c-kit+CSCs ROS生成的影响 依达拉奉可以减少低氧下c-kit+CSCs ROS的生成。依达拉奉浓度为0、100、300、500、700、1 000 μmol/L时,绿色荧光细胞数分别为(81±8)、(56±6)、(45±4)、(27±2)、(22±2)、(13±1)个。依达拉奉浓度为1 000 μmol/L时所产生的ROS量与其他浓度比较有统计学差异(P均<0.05)。依达拉奉浓度700 μmol/L与500 μmol/L比较,ROS生产量无统计学差异(P>0.05)。
2.2 不同浓度依达拉奉对c-kit+CSCs凋亡率的影响 依达拉奉可以降低细胞凋亡率。依达拉奉浓度为0、100、300、500、700、1 000 μmol/L时,c-kit+CSCs凋亡率分别为(44.6±4.70)%、(36.93±7.81)%、(31.43±5.01)%、(28.57±3.25)%、(28.8±1.75)%、(25.13±2.40)%。依达拉奉浓度为1 000 μmol/L时细胞凋亡率与0、100 μmol/L浓度比较有统计学差异(P均<0.05)。300~1 000 μmol /L浓度之间细胞凋亡率无统计学差异(P均>0.05)。
2.3 不同浓度依达拉奉对c-kit+CSCs迁移能力的影响 在低氧环境中,依达拉奉处理可以明显促进CSCs的迁移能力。依达拉奉浓度为0、100、300、500、700、1 000 μmol/L时, c-kit+CSCs迁移数分别为(93.3±6.6)、(97.3±4.5)、(120.3±8.3)、(128.0±6.2)、(139.3±2.9)、(138.0±7.9)个。依达拉奉浓度为700 μmol/L时c-kit+CSCs迁移数与0 μmol/L比较有统计学差异(P<0.05)。700 μmol/L与1 000 μmol/L、100 μmol/L与0 μmol/L比较,c-kit+CSCs迁移数均无统计学差异(P均>0.05)。
2.4 不同浓度依达拉奉对c-kit+CSCs bFGF表达的影响 依达拉奉可显著促进c-kit+CSCs bFGF的表达。依达拉奉浓度为0、100、300、500、700、1 000 μmol/L时,c-kit+CSCs bFGF mRNA 表达分别为0.59±0.05、1.21±0.03、1.32±0.09、1.46±0.17、1.74±0.09、0.87±0.05。依达拉奉浓度为700 μmol/L时,c-kit+CSCs bFGF mRNA表达最高(P均<0.05)。100~500 μmol /L浓度之间c-kit+CSCs bFGF mRNA表达无统计学差异(P均>0.05)。
3 讨论
CSCs是一类存在于自体心肌组织中的干细胞,可以向心肌、血管平滑肌、内皮细胞方向分化。研究发现,c-kit+CSCs移植后可通过细胞分化、新生血管形成、旁分泌等途径改善心肌梗死后心功能,成为干细胞移植的研究热点[5, 6]。但是移植到体内的干细胞长期存活率较低,并不能持续改善心功能。
依达拉奉具有较好的细胞保护作用,已经广泛应用于心血管疾病基础和临床研究[7, 8]。但是研究发现,在不同情况下依达拉奉表现出不同的细胞保护效应。张蔼玲等[9]研究结果显示,依达拉奉预处理H9c2心肌细胞,可显著减少氯化钴诱导的ROS 生成,还能通过维持线粒体膜电位的稳定性起到保护作用。Sukmawan等[10]研究结果显示,依达拉奉可通过提高细胞一氧化氮水平和降低ROS的产生,保护犬缺血再灌注冠脉血管内皮细胞,减轻冠脉内皮细胞的损伤。Hassan 等[11]研究显示,在异丙肾上腺素诱导的心肌梗死大鼠中,依达拉奉预处理可通过减少氧化应激、维持细胞膜的完整性、抗凋亡、抗炎症等途径,调节对心肌细胞的保护功能。刘品刚等[12]研究认为,依达拉奉是通过降低心肌半胱氨酸天冬氨酸蛋白酶-3及炎症因子TNF-α、IL-6 的表达,抑制炎症诱导的凋亡,发挥心肌保护作用。Tsujita 等[13]在对50例急性心肌梗死患者注射30 mg依达拉奉后发现可显著改善灌注后心肌梗死面积,有效减少灌注心律失常的发生。蔡志福等[14]研究结果显示,在心脏直视手术中,依达拉奉可以减少血清中的丙二醛含量,降低心肌酶漏出量,提高心肌细胞SOD的活性,减轻心肌细胞损伤。本研究结果显示,不同浓度依达拉奉处理都可以降低低氧环境下c-kit+CSCs ROS的含量。且随着依达拉奉浓度的增加,ROS的含量逐渐减少;当浓度为1 000 μmol/L时,ROS的含量达到最小值。在晚期凋亡率方面,当依达拉奉浓度在300~1 000 μmol/L时,虽然随着浓度增加细胞凋亡率逐渐下降,但这种下降的幅度越来越小。依达拉奉处理可以促进低氧环境下c-kit+CSCs的迁移和bFGF的生成。浓度为100~700 μmol/L时,随着浓度的增加,迁移细胞数逐渐增加,在700 μmol/L浓度时达到最高,但当浓度达到1 000 μmol/L时,迁移率不再增加。依达拉奉浓度在100~700 μmol/L之间,c-kit+CSCs bFGF mRNA表达量逐渐升高。这一结果与其他研究结果相似[15]。
综上所述,依达拉奉对低氧环境下c-kit+CSCs损伤具有较好的保护作用,且在一定浓度范围内对c-kit+CSCs的影响具有剂量依赖性。但是,当c-kit+CSCs移植到心梗环境中依达拉奉的这种保护作用是否仍然存在还需要进一步验证。
[1] 李红敏, 刘琳, 梅香, 等. 大鼠骨髓间充质干细胞移植在心肌梗死区长期存活的观察[J]. 中华心血管病杂志, 2011,39(2):171-175.
[2] 林楚伟, 周胜华, 戴海鹰,等. 骨髓间充质干细胞移植大鼠梗死心肌后的存活状况[J]. 中国组织工程研究, 2014,18(41):6628-6632.
[3] Onogi H, Minatoguchi S, Chen XH, et al. Edaravone reduces myocardial infarct size and improves cardiac function and remodelling in rabbits[J]. Clin Exp Pharmacol Physiol, 2006,33(11):1035-1041.
[4] Makazan Z, Saini HK, Dhalla NS. Role of oxidative stress in alterations of mitochondrial function in ischemic-reperfused hearts[J]. Am J Physiol Heart Circ Physiol, 2007,292(4):H1986-1994.
[5] Dawn B, Stein AB, Urbanek K, et al. Cardiac stem cells delivered intravascularly traverse the vessel barrier, regenerate infarcted myocardium, and improve cardiac function[J]. Proc Natl Acad Sci USA, 2005,102(10):3766-3771.
[6] Stastna M, Abraham MR, van Eyk JE. Cardiac stem/progenitor cells, secreted proteins, and proteomics[J]. FEBS letters, 2009,583(11):1800-1807.
[7] 康银玲. 依达拉奉注射液对心肌缺血再灌注损伤的保护作用[J]. 中国医学创新, 2014,11(20):49-51.
[8] 吴云良. 依达拉奉对大鼠心肌缺血再灌注损伤的影响[J]. 中国现代医生, 2011,49(18):14-15.
[9] 张蔼玲, 兰爱平, 郑东诞,等.依达拉奉保护H9c2心肌细胞对抗化学性低氧引起的损伤[J]. 中国动脉硬化杂志, 2012,19(4):304-308.
[10] Sukmawan R, Yada T, Toyota E, et al. Edaravone preserves coronary microvascular endothelial function after ischemia/reperfusion on the beating canine heart in vivo[J]. J Pharmacol Sci, 2007,104(4):341-348.
[11] Hassan MQ, Akhtar MS, Akhtar M, et al. Edaravone protects rats against oxidative stress and apoptosis in experimentally induced myocardial infarction: Biochemical and ultrastructural evidence[J]. Redox rep, 2015,20(6):275-281.
[12] 刘品刚,张松,万镇,等.依达拉奉对心肌梗死大鼠心肌caspase-3mRNA表达及血清TNF-α、IL-6水平的影响[J].山东医药,2016,56(5):25-27.
[13] Tsujita K, Shimomura H, Kaikita K, et al. Long-term efficacy of edaravone in patients with acute myocardial infarction[J]. Circ J, 2006,70(7):832-837.
[14] 蔡志福,陈铭伍,冼磊,等.依达拉奉在心脏不停跳手术中对心肌的保护作用[J].广东医学,2011,32(11):1481-1483.
[15] Zhang GW, Gu TX, Sun XJ, et al. Edaravone promotes activation of resident cardiac stem cells by transplanted mesenchymal stem cells in a rat myocardial infarction model[J]. J Thorac Cardiovasc Surg, 2016,152(2):570-582.
Effects of different concentrations of edaravone on c-kit+cardiac stem cells under hypoxic conditions
WENDezhong,ZHOUMin,XUESong,HUANGRitai
(RenjiHospital,SchoolofMedicine,ShanghaiJiaotongUniversity,Shanghai200127,China)
Objective To observe the effects of different concentrations of edaravone on c-kit+cardiac stem cells (CSCs) under hypoxic conditions. Methods The freshly isolated hearts were perfused with collagenase buffer, and the hearts were dissected into single cells, c-kit+cells were purified from the cells by immunomagnetic beads. Flow cytometric analysis was used to measure the purity of c-kit+cells, immunofluorescence was used to analyze the phenotype. For further study, c-kit+CSCs were treated with different concentrations of edaravone (0, 100, 300, 500, 700, 1 000 μmol/L), and then were divided into six groups. The reactive oxygen species (ROS) production was measured by DFCH-DA, apoptosis rate was analyzed by flow cytometer, cell migration was measured by 8-mm pore-size Transwell migration chamber, and the expression of basic fibroblast growth factor (bFGF) mRNA was determined by RT-PCR. Results The ROS production in the 1 000 μmol/L edavarone group was significantly decreased as compared with that of the other groups (allP<0.05). The apoptosis rate in the 1 000 μmol/L edavarone group was the lowest, and significant difference was found as compared with that in the 0 and 100 μmol/L edavarone groups (allP<0.05). The migration of c-kit+CSCs was the highest when edavarone concentration was 700 μmol/L, and significant difference was found as compared with that of the 0 μmol/L. When the concentration of edavarone was 700 μmol/L, the expression of bFGF mRNA in c-kit+CSCs was the highest (allP<0.05).Conclusion Edaravone has the protective effect on c-kit+CSCs by influencing the apoptosis rate, migration rate, ROS production and bFGF mRNA expression with a dose-dependent manner to some extent.
cardiac stem cells; edaravone; reactive oxygen species; apoptosis; cell migration; fibroblast growth factors
上海市自然科学基金资助项目(134119a5602)。
文德重(1990-),男,在读硕士,主要研究方向为房颤的发生机制。E-mail:wendezhongwencong@163.com
黄日太(1970-),男,医学博士,教授,主要研究方向为房颤的发生机制。E-mail: ahtai1018@yahoo.com
10.3969/j.issn.1002-266X.2017.17.004
R542.2
A
1002-266X(2017)17-0010-04
2016-12-05)
