EGCG乙酰化分子修饰取代度影响因素分析
2017-03-31张建勇江和源崔宏春王伟伟施莉婷
张建勇,江和源,*,崔宏春,王伟伟,施莉婷,3
(1.中国农业科学院茶叶研究所,农业部茶树生物学与资源利用重点实验室,浙江省茶叶加工工程重点实验室,杭州 310008;2.杭州市农业科学研究院茶叶研究所,杭州 310024;3.中国农业科学院研究生院,北京 100081)
EGCG乙酰化分子修饰取代度影响因素分析
张建勇1,江和源1,*,崔宏春2,王伟伟1,施莉婷1,3
(1.中国农业科学院茶叶研究所,农业部茶树生物学与资源利用重点实验室,浙江省茶叶加工工程重点实验室,杭州 310008;2.杭州市农业科学研究院茶叶研究所,杭州 310024;3.中国农业科学院研究生院,北京 100081)
为改善表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)的脂溶性和生物利用度,在乙酸乙酯体系中化学合成乙酰化EGCG。研究酰基供体乙酸酐用量、催化剂吡啶用量、溶剂乙酸乙酯用量、反应温度、反应时间对EGCG乙酰化分子修饰取代度的影响。结果表明,以0.19 g的EGCG为原料,乙酸酐用量0.04 mL、吡啶用量0.02 mL、乙酸乙酯用量20~60 mL、反应温度20~25 ℃、反应时间1~3 h有利于1~3取代度乙酰化EGCG生成;乙酸酐用量0.12~0.20 mL、吡啶用量0.06~0.20 mL、乙酸乙酯用量10~20 mL、反应温度17~25 ℃、反应时间5~9 h有利于4~6取代度乙酰化EGCG生成;乙酸酐用量0.40~0.80 mL、吡啶用量0.10~0.20 mL、乙酸乙酯用量5~10 mL、反应温度25~40 ℃、反应时间5~9 h有利于7~8取代度乙酰化EGCG生成。关键词:表没食子儿茶素没食子酸酯;乙酰化;取代度;分子修饰;生物利用度
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是茶叶中重要的功能成分,具有抗氧化、抗衰老、降血脂、降血压、降血糖、抗辐射、抗肿瘤、调节免疫等多种生物活性[1]。EGCG分子具有多羟基化学结构,水溶性较好,然而,EGCG在进入小鼠、大鼠、人等生物体内后,却由于脂溶性差[2-3],存在生物体生理环境下不稳定[4]、体内吸收缓慢[5]、生物利用度低[6-7]等诸多问题,限制了EGCG的进一步应用。采用分子修饰手段,有利于改变EGCG分子结构[8]、理化性质[9-10]、生物活性[11-15]及生物利用度[16-17]。
酰基化分子修饰是EGCG分子改性的重要方法,依据修饰部位不同分为C-酰化修饰和O-酰化修饰。早期关于脂酰化儿茶素的文献大部分是基于O-酰化反应,如儿茶素类与月桂酰氯[18]、肉豆蔻酰氯[19]、棕榈酰氯[20]、硬脂酰氯[21]、油酸酰氯[22]等不同长度的脂肪链反应生成相应的酸酯产物。长链脂酰基的空间位阻效应会影响周围酚羟基参与反应,进而阻碍其发挥生物活性作用;较长脂肪链易聚集沉淀,导致改性后儿茶素脂溶性不增反减。EGCG用较小的链烃(如乙酰基)修饰后稳定性增强、生物利用度和生理活性提高,被认为是一种潜在的抗癌药物前体[23-27]。目前,较多研究关注EGCG经乙酰化分子修饰的稳定性变化、生物活性和生物利用度变化等方面,然而有关EGCG乙酰化分子修饰不同取代度影响因素方面的研究报道较少。EGCG分子结构中有8 个酚羟基,这些酚羟基位点易被酰基化试剂乙酸酐亲电取代,取代位点数量即取代度受多种因素影响,本研究从EGCG乙酰化分子修饰化学合成反应体系的酰基供体乙酸酐用量、催化剂吡啶用量、溶剂乙酸乙酯用量、反应温度、反应时间等多个方面,考察这些因素对EGCG乙酰化取代度的影响,以期为不同取代度乙酰化EGCG的定向合成提供理论参考。
1 材料与方法
1.1 材料与试剂
EGCG(纯度≥98%) 无锡太阳绿宝科技有限公司;乙酸乙酯、乙酸酐、吡啶等试剂均为国产分析纯。
1.2 仪器与设备
600-717-2998高效液相色谱仪 美国Waters公司;R-215型旋转蒸发仪 瑞士Buchi公司;MR3001磁力搅拌器 德国Heidoph公司;DK-S24恒温水浴锅 上海精宏实验设备有限公司。
1.3 方法
1.3.1 酰基供体乙酸酐用量对EGCG乙酰化分子修饰取代度影响的测定
称取0.19 g的EGCG,溶于20 mL乙酸乙酯溶剂中,分别加入0.04、0.12、0.20、0.40、0.80、1.60、3.20 mL的酰基供体乙酸酐溶液,再依次加入0.10 mL吡啶,温度25 ℃条件下搅拌反应5 h,高效液相色谱(high performance liquid chromatography,HPLC)法检测各处理EGCG乙酰化分子修饰产物,采用外标法计算各乙酰化EGCG生成量。
1.3.2 催化剂吡啶用量对EGCG乙酰化分子修饰取代度影响的测定
称取0.19 g的EGCG,溶于20 mL乙酸乙酯溶剂中,加入0.20 mL的酰基供体乙酸酐溶液,再分别加入0.02、0.06、0.10、0.14、0.20 mL吡啶,温度25℃条件下搅拌反应5 h,HPLC检测各处理EGCG乙酰化分子修饰产物,采用外标法计算各乙酰化EGCG生成量。
1.3.3 溶剂乙酸乙酯用量对EGCG乙酰化分子修饰取代度影响的测定
称取0.19 g的EGCG,分别溶于5.0、10.0、20.0、30.0、60.0 mL乙酸乙酯溶剂中,加入0.20 mL的酰基供体乙酸酐溶液,再加入0.10 mL吡啶,温度25 ℃条件下搅拌反应5 h,HPLC检测各处理EGCG乙酰化分子修饰产物,采用外标法计算各乙酰化EGCG生成量。
1.3.4 反应温度对EGCG乙酰化分子修饰取代度影响的测定
称取0.19 g的EGCG,溶于20 mL乙酸乙酯溶剂中,加入0.20 mL的酰基供体乙酸酐溶液,再加入0.10 mL吡啶,分别在温度17、20、25、30、40 ℃条件下搅拌反应5 h,HPLC检测各处理EGCG乙酰化分子修饰产物,采用外标法计算各乙酰化EGCG生成量。
1.3.5 反应时间对EGCG乙酰化分子修饰取代度影响的测定
称取0.19 g的EGCG,溶于20 mL乙酸乙酯溶剂中,加入0.20 mL的酰基供体乙酸酐溶液,再加入0.10 mL吡啶,在温度25 ℃条件下,分别搅拌反应1、3、5、7、9 h,HPLC检测各处理EGCG乙酰化分子修饰产物,采用外标法计算各乙酰化EGCG生成量。
1.3.6 EGCG乙酰化分子修饰产物的HPLC分析
HPLC色谱系统:600-717-2998;色谱柱:依利特Hypersil ODS2(4.6 mm×250 mm,5 μm);柱温:30 ℃;检测波长:280 nm;运行时间:50 min;流速:1.0 mL/min;进样体积:5 μL;流动相:A相为乙腈-0.2%乙酸比5∶95(V/V),B相为乙腈-0.2%乙酸比95∶5(V/V),0~36 min内B相由0%增至100%。
1.4 数据处理
采用SAS 9.0统计分析软件进行数据处理分析,使用邓肯多重比较方法检验差异显著性,P<0.05为差异显著。
2 结果与分析
2.1 酰基供体乙酸酐用量对EGCG乙酰化分子修饰取代度的影响
EGCG在乙酸酐和吡啶的作用下,化学合成得到不同取代度乙酰化EGCG分子修饰产物,其非极性逐渐增加。采用HPLC方法分析EGCG乙酰化合成溶液,非极性较弱的EGCG(图1,出峰时间16.682 min)首先被洗脱出来,然后1~3取代度乙酰化EGCG(图1,出峰时间18.374~24.437 min,编号a-AceE)、取代度4~6乙酰化EGCG(图1,出峰时间24.754~27.100 min,编号b-AceE)、7~8取代度乙酰化EGCG(图1出峰时间28.701~30.568 min,编号c-AceE)依次被洗脱出来。
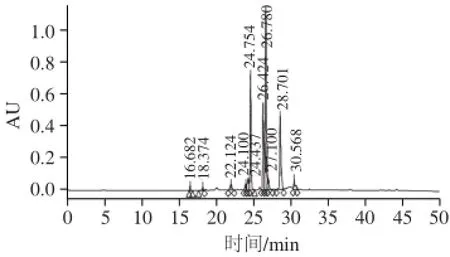
图 1 EGCG乙酰化处理后HPLC图谱Fig. 1 HPLC chromatogram of acetylated EGCG

图 2 乙酸酐用量对EGCG乙酰化取代度影响Fig. 2 Effect of acetyl anhydride dosage on substitution degree of acetylated EGCG
乙酰化EGCG的乙酰基基团由乙酸酐提供,乙酰基取代位点和取代度受酰基供体乙酸酐用量影响。从图2可知,随着酰基供体乙酸酐用量增加,a-AceE生成量逐渐减少,b-AceE生成量先增加后减少,c-AceE生成量逐渐增加,然后趋于稳定。乙酸酐用量在0.04 mL条件下,各乙酰化EGCG生成量由大到小依次为a-AceE>b-AceE>c-AceE;乙酸酐用量在0.12~0.20 mL条件下,各乙酰化EGCG生成量由大到小依次为b-AceE>a-AceE>c-AceE,即a-AceE生成量逐渐下降,b-AceE生成量逐渐增加,c-AceE生成量增加缓慢,0.04 mL≤乙酸酐用量<0.12 mL条件利于积累a-AceE,0.12 mL≤乙酸酐用量<0.20 mL条件利于积累b-AceE推测可能的原因是,乙酸酐在相对较低用量条件下EGCG与乙酸酐发生亲电取代反应后,生成了a-AceE和b-AceE,而a-AceE与乙酸酐进一步发生亲电加成反应,从而积累了较多b-AceE乙酸酐。
在0.40 mL≤乙酸酐用量<0.80 mL条件下,各乙酰化EGCG生成量由大到小依次为c-AceE>b-AceE>a-AceE,a-Ace未检出,b-AceE生成量逐渐下降,c-AceE快速积累;0.80 mL≤乙酸酐用量≤3.20 mL,a-Ace和 b-AceE未检出,c-AceE生成量趋于平衡。由此说明,乙酸酐用量0.40~0.80 mL条件下有利于c-AceE生成,可能的原因是,高剂量酰基供体乙酸酐与EGCG发生亲电取代时,倾向于同时取代EGCG的7 个或8 个酚羟基,而且b-AceE也可能与乙酸酐发生亲电取代反应生成c-AceE。
由上述分析可知,在本实验条件下,乙酸酐用量0.04 mL利于生成1~3取代度的乙酰化EGCG,乙酸酐用量0.12~0.20 mL利于生成4~6取代度的乙酰化EGCG,乙酸酐用量0.40~0.80 mL利于生成7~8取代度的乙酰化EGCG。
2.2 催化剂吡啶用量对EGCG乙酰化分子修饰取代度的影响

图 3 催化剂吡啶用量对EGCG乙酰化取代度影响Fig. 3 Effect of catalyst pyridine dosage on substitution degree of acetylated EGCG
吡啶是乙酰化EGCG合成的催化剂,可以有效降低乙酰化反应的活化能。由图3可知,吡啶用量为0.02 mL条件下,乙酰化EGCG生成量由大到小依次为a-AceE>b-AceE>c-AceE;吡啶用量为0.06 mL条件下,各乙酰化EGCG生成量由大到小依次为b-AceE>a-AceE>c-AceE;吡啶用量为0.10~0.20 mL范围内,各乙酰化EGCG生成量由大到小依次为b-AceE>c-AceE>a-AceE,即随着催化剂吡啶用量增加,a-AceE生成量逐渐降低,b-AceE、c-AceE生成量逐渐增加,说明催化剂吡啶用量增加有利于EGCG乙酰化取代度的提高,而且推测经过乙酰化分子修饰得到的a-AceE,在吡啶的催化下,仍继续发生亲电取代反应,从而生成取代度较高的b-AceE、c-AceE。
由上述分析可知,在本实验条件下,催化剂吡啶用量0.02 mL利于生成1~3取代度的乙酰化EGCG,催化剂吡啶用量0.06~0.20 mL利于生成4~6取代度的乙酰化EGCG,催化剂吡啶用量0.10~0.20 mL利于生成7~8取代度的乙酰化EGCG。
2.3 溶剂乙酸乙酯用量对EGCG乙酰化分子修饰取代度的影响
乙酸乙酯提供EGCG乙酰化分子修饰的化学合成溶剂系统,不同的溶剂乙酸乙酯用量代表不同的反应物浓度。由图4可知,乙酸乙酯用量5 mL条件下,各乙酰化EGCG生成量由大到小依次为c-AceE>b-AceE>a-AceE;乙酸乙酯用量在10~20 mL条件下,各乙酰化EGCG生成量由大到小依次为b-AceE>c-AceE>a-AceE;乙酸乙酯用量在20~60 mL范围条件下,a-AceE生成量逐渐增大,b-AceE生成量逐渐降低并将至未检出,c-AceE生成量继续降低并降至未检出,由此说明,随溶剂乙酸乙酯用量增加,a-AceE生成量逐渐增大,b-AceE生成量呈现先增加后下降趋势,c-AceE生成量逐渐下降。
由上述分析可知,乙酸乙酯用量20~60 mL利于生成1~3取代度的乙酰化EGCG;乙酸乙酯用量10~20 mL利于生成4~6取代度的乙酰化EGCG;乙酸乙酯用量5~10 mL利于生成7~8取代度乙酰化EGCG。
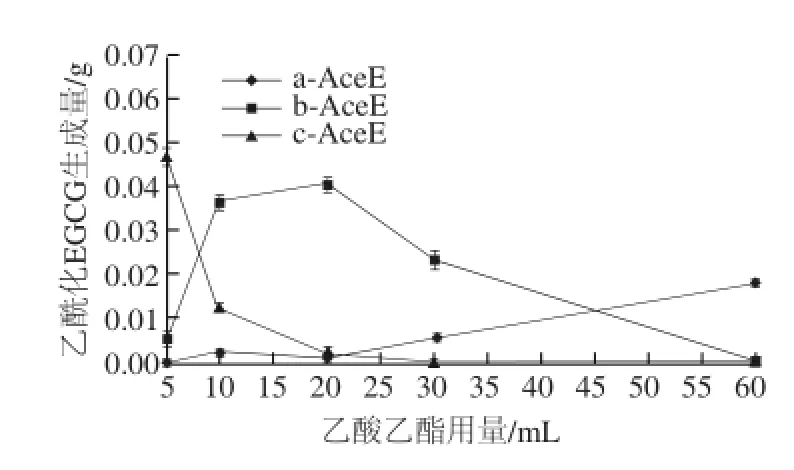
图 4 乙酸乙酯用量对EGCG乙酰化取代度影响Fig. 4 Effect of ethyl acetate dosage on substitution degree of acetylated EGCG
2.4 反应温度对EGCG乙酰化分子修饰取代度的影响

图 5 反应温度对EGCG乙酰化取代度影响Fig. 5 Effect of reaction temperature on substitution degree of acetylated EGCG
温度不仅影响EGCG乙酰化分子修饰化学合成的速率,而且可能对EGCG乙酰化分子修饰的取代度产生影响。由图5可知,反应温度在17~25 ℃范围内,各乙酰化EGCG生成量由大到小依次为b-AceE>c-AceE>a-AceE,且反应温度20~25 ℃条件下a-AceE生成量有所增加;反应温度在25~40℃范围内,b-AceE生成量呈逐渐下降趋势,c-AceE生成量呈逐渐上升趋势;反应温度为40 ℃条件下,各乙酰化EGCG生成量由大到小依次为c-AceE>b-AceE>a-AceE,由此说明,反应温度升高,EGCG乙酰化取代度也逐渐提高,且反应温度对低取代度的乙酰化EGCG生成量影响较小。推测其原因,可能是反应温度提高加快了EGCG与酰基供体乙酸酐、催化剂吡啶的分子对接几率,乙酰基团倾向于同时取代EGCG的多个酚羟基,从而生成较多c-AceE。
由上述分析可知,较低的反应温度(17~25 ℃)有利于生成4~6取代度的乙酰化EGCG,较高的反应温度(25~40 ℃)有利于生成7~8取代度的乙酰化EGCG,反应温度20~25 ℃利于生成1~3取代度的乙酰化EGCG。
2.5 反应时间对EGCG乙酰化分子修饰取代度的影响
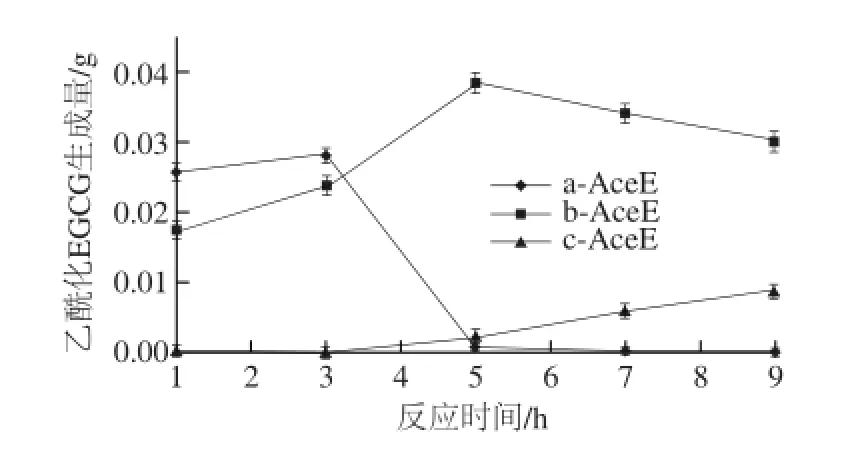
图 6 反应时间对EGCG乙酰化取代度影响Fig. 6 Effect of reaction time on substitution degree of acetylated EGCG
由图6可知,反应时间在1~3 h条件下,各乙酰化EGCG生成量由大到小依次为a-AceE>b-AceE>c-AceE;反应时间在5~9 h条件下,各乙酰化EGCG生成量由大到小依次为b-AceE>c-AceE>a-AceE,即随反应时间延长,a-AceE生成量逐渐下降,b-AceE生成量呈先增加后下降趋势,c-AceE生成量逐渐增大。
由上述分析可知,较短的反应时间(1~3 h)有利于1~3取代度的乙酰化EGCG,较长的反应时间(5~9 h)有利于4~6取代度、7~8取代度的乙酰化EGCG。
3 结 论
从本项研究的EGCG乙酰化分子修饰取代度主要影响因素分析可以得出,以0.19 g的EGCG为反应物进行乙酰化分子修饰时,不同取代度较佳合成条件分别为:1)乙酸酐用量0.04 mL、吡啶用量0.02 mL、乙酸乙酯用量20~60 mL、反应温度20~25 ℃、反应时间1~3 h有利于1~3取代度乙酰化EGCG生成;2)乙酸酐用量0.12~0.20 mL、吡啶用量0.06~0.20 mL、乙酸乙酯用量10~20 mL、反应温度17~25 ℃、反应时间5~9 h有利于4~6取代度乙酰化EGCG生成;3)乙酸酐用量0.40~0.80 mL、吡啶用量0.10~0.20 mL、乙酸乙酯用量5~10 mL、反应温度25~40 ℃、反应时间5~9 h有利于7~8取代度乙酰化EGCG生成。综合分析来看,乙酸酐用量、吡啶用量、乙酸乙酯用量、反应温度、反应时间等对EGCG乙酰化分子修饰取代度均产生影响,较大乙酸酐和吡啶用量、较小乙酸乙酯用量、较长反应时间、较高反应温度,有利于较高取代度的乙酰化EGCG生成,相反则有利于较低取代度的乙酰化EGCG生成。
EGCG酰基化分子修饰主要包括化学修饰和生物酶法修饰两种。酶法修饰具有反应条件温和、选择性高、环境友好等诸多优点[26-27],但目前仍存在成本高、反应时间较长、衍生物转化率不高、酰基化位点不明确等不足之处[30-33]。化学修饰法仍是目前EGCG酰基化分子修饰的主要手段,常使用酰氯、酸酐作为酰基供体。Lam等[34]利用吡啶作为催化剂,乙酸酐作为酰基供体,在溶液中反应24 h,催化合成得到全取代的乙酰化EGCG(即取代度为8的乙酰化EGCG)。Landis-Piwowar等[35]利用EGCG和乙酸酐,化学合成了全乙酰化EGGC、B环和D环部分位点取代的乙酰化EGCG。Kuhn等[36]化学合成了全乙酰化EGCG、D环上单取代度或2取代度的乙酰化EGCG。Utenovaa等[37]采用催化剂二甲氨基吡啶,催化EGCG分别与乙酸酐、丙酸酐、丁酸酐化学合成多个乙酰化EGCG。江和源[38]、刘晓辉[39]、白艳[40]、龙丹[41]等以乙酸乙酯为溶剂,吡啶为催化剂,乙酸酐作为酰基供体,化学合成得到不同取代度的乙酰化EGCG衍生物,并合成得到纯度>96%的全取代乙酰化EGCG。Ou Bingning等[42]以EGCG和ECG为原料,以乙酸乙酯为溶剂,吡啶为催化剂,乙酸酐作为酰基供体,30 ℃条件下反应5 h,获得5,7,3’,4’,5’,3”,4”,5”-octaacetyl-EGCG、5,7,3’,4’,3”,4”,5”-hepta-acetyl-ECG、7,3’,4’,5’,3”,4”,5”-hepta-acetyl-EGCG、以及3’,4’,5’,3’,4’,5”-hexa-acetyl-EGCG。
与上述研究报道的不同取代度乙酰化EGCG合成研究相比较,本研究侧重于系统分析不同取代度乙酰化EGCG生成的主要影响因素,包括酰基供体乙酸酐用量、催化剂吡啶用量、溶剂乙酸乙酯用量、反应温度、反应时间等,从研究结果来看,这些因素对于乙酰基取代位点的数目即取代度有不同程度的影响。有关这些因素对乙酰基取代位置的影响,以及不同取代度乙酰化EGCG结构与生物活性的构效关系,还有待深入研究。
[1] 龙丹, 江和源, 薛金金, 等. 儿茶素类的保健作用及机制[J]. 食品安全质量检测学报, 2013, 4(3): 774-782.
[2] HUO C D, DOU Q P, CHAN T H. Synthesis of phosphates and phosphates-acetates hybrids of green tea polyphenol (−)-epigallocatechine-3-gallate (EGCG) and its G ring deoxy analogs as potential anticancer prodrugs[J]. Tetrahedron Letters, 2011, 52(42): 5478-5483. DOI:10.1016/j.tetlet.2011.08.061.
[3] CELIZ G, DAZ M. Biocatalytic preparation of alkyl esters of citrus fl avanone glucoside prunin in organic media[J]. Process Biochemistry, 2011, 46(1): 94-100. DOI:10.1016/j.procbio.2010.07.022.
[4] CHIOU Y S, SANG S M, CHENG K H, et al. Peracetylated (−)-epigallocatechin-3-gallate (AcEGCG) potently prevents skin carcinogenesis by suppressing the PKD1-dependent signaling pathway in CD34+skin stem cells and skin tumors[J]. Carcinogenesis, 2013, 34(6): 1315-1322. DOI:10.1021/jf300441p.
[5] ZHONG Y, CHIOU Y S, PAN M H, et al. Anti-inf l ammatory activity of lipophilic epigallocatechin gallate (EGCG) derivatives in LPS-stimulated murine macrophages[J]. Food Chemistry, 2012, 134(2): 742-748. DOI:10.1016/j.foodchem.2012.02.172.
[6] GOMEZ-MASCARAQUEA L G, SOLERB C, LOPEZRUBIO A, et al. Stability and bioaccessibility of EGCG within edible micro-hydrogels. Chitosan vs. gelatin, a comparative study[J]. Food Hydrocolloids, 2016, 61: 128-138. DOI:10.1016/ j.foodhyd.2016.05.009.
[7] KOUTELIDAKIS A, ARGYRI K, SEVASTOU Z, et al. Bioavailability and bioactivity study of epigallocatechin gallate (EGCG) after in vitro digestion and in experimental mice model[J]. Clinical Nutrition Espen, 2016, 13: e55-e56. DOI:10.1016/ j.clnesp.2016.03.007.
[8] 白艳. 不同取代度乙酰化儿茶素的合成及应用研究[D]. 北京: 中国农业科学院, 2012: 4-6.
[9] 欧冰凝, 周焕第, 梁钢, 等. EGCG衍生物在高温和低温强光照射下的稳定性研究[J]. 广西医科大学学报, 2012, 29(5): 672-674. DOI:10.16190/j.cnki.45-1211/r.2012.05.005.
[10] 李哲, 朱松, 王洪新. 酶法酰化儿茶素EGCG及其产物在大豆油中的抗氧化性[J]. 食品科学, 2013, 34(8): 1-5.
[11] MATSUMOTO Y, KAIHATSU K, NISHINO K, et al. Antibacterial and antifungal activities of new acylated derivatives of epigallocatechin gallate[J]. Microbiology, 2012, 3: 1-10. DOI:10.3389/ fmicb.2012.00053.
[12] ZHONG Y, MA C M, SHAHIDI F. Antioxidant and antiviral activities of lipophilic epigallocatechin gallate (EGCG) derivatives[J]. Journal of Functional Foods, 2012, 4(1): 87-93. DOI:10.1016/j.jff.2011.08.003.
[13] WANG M F, ZHANG X C, ZHONG Y J, et al. Antiglycation activity of lipophilized epigallocatechin gallate (EGCG) derivatives[J]. Food Chemistry, 2016, 190: 1022-1026. DOI:10.1016/ j.foodchem.2015.06.033.
[14] 朱松, 马朝阳, 艾连中, 等. 酶促乙酰化EGCG清除自由基及抗脂质过氧化活性研究[J]. 现代食品科技, 2014, 30(1): 22-27; 37. DOI:10.13982/j.mfst.1673-9078.2014.01.003.
[15] 叶敏. 酰化表没食子儿茶酚没食子酸酯抗癌和降糖活性研究[D]. 重庆: 西南大学, 2013: 31; 42-43.
[16] ZHONG Y, CHIOU Y S, PAN M H, et al. Protective effects of epigallocatechin gallate (EGCG) derivatives on azoxymethane-induced colonic carcinogenesis in mice[J]. Journal of Function Foods, 2012, 4(1): 323-330. DOI:10.1016/j.jff.2011.12.011.
[17] WANG C C, XU H, MAN G C W, et al. Prodrug of green tea epigallocatechin-3-gallate (Pro-EGCG) as a potent anti-angiogenesis agent for endometriosis in mice[J]. Angiogenesis, 2013, 16(1): 59-69. DOI:10.1007/s10456-012-9299-4.
[18] 张健希, 张玉军, 晁燕, 等. 茶多酚脂溶性改性条件的确定及其抗氧化性能的研究[J]. 河北工业大学学报(自然科学版), 2008, 29(3): 15-19. DOI:10.16433/j.cnki.issn1673-2383.2008.03.017.
[19] 孙东, 陈平. EGCG肉豆蔻酸酯的制备、结构及其抗氧化活性[J]. 温州医学院学报, 2006, 36(3): 225-227. DOI:10.13771/j.cnki.33-1386/ r.2006.03.016.
[20] 卢聪聪. 茶多酚的化学改性和脂溶性茶多酚分离分析[D]. 上海: 上海交通大学, 2008: 6-10.
[21] 申雷, 章建浩, 靳国锋. 硬脂酰氯改性对茶多酚抗油脂氧化性能的影响[J]. 食品工业科技, 2012, 33(8): 159-164. DOI:10.13386/ j.issn1002-0306.2012.08.062.
[22] 龙丹, 江和源, 张建勇, 等. 儿茶素分子修饰方法及应用进展[J]. 茶叶科学, 2013, 33(1): 1-12. DOI:10.13305/j.cnki.jts.2013.01.013.
[23] 刘晓辉, 江和源, 张建勇, 等. 乙酰化EGCG的制备研究[J].安徽农业科学, 2009, 37(24): 11360-11363. DOI:10.13989/ j.cnki.0517-6611.2009.24.020.
[24] 李晶晶. EGCG通过Ku70及其乙酰化诱导人肺腺癌细胞株凋亡的初步研究[D]. 长沙: 中南大学, 2013: 109-112.
[25] 王金妮, 欧冰凝, 梁钢. 表没食子儿茶素没食子酸酯全乙酰化衍生物的合成及急性毒性试验[J]. 广西医学, 2012, 34(2): 129-133.
[26] 欧冰凝, 周焕第, 梁钢, 等. 表没食子儿茶素没食子酸酯全乙酰化衍生物的体内抑瘤作用研究[J]. 时珍国医国药, 2012, 23(9): 2116-2118.
[27] 欧冰凝, 韦海, 梁钢, 等. EGCG乙酰化衍生物对肝癌细胞细胞毒增敏作用[J]. 中国公共卫生, 2012, 28(6): 785-786.
[28] CELIZ G, MARTEARENA M R, SCARONI E, et al. Kinetic study of the alkyl fl avonoid ester prunin 6’’-O-laurate synthesis in acetone catalysed by immobilised Candida antarctica lipase B[J]. Biochemical Engineering Journal, 2012, 69: 69-74. DOI:10.1016/j.bej.2012.08.008.
[29] ZHU S, LI Y, MA C Y, et al. Optimization of lipase-catalyzed synthesis of acetylated EGCGby response surface methodology[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 97: 87-94. DOI:10.1016/j.molcatb.2013.08.002.
[30] ZHU S, LI Y, LI Z, et al. Lipase-catalyzed synthesis of acetylated EGCG and antioxidant properties of the acetylated derivatives[J]. Food Research International, 2014, 56: 279-286. DOI:10.1016/ j.foodres.2013.10.026.
[31] 朱松. 表没食子儿茶素没食子酸酯(EGCG)酶法乙酰化分子修饰及其产物的抗氧化性能研究[D]. 无锡: 江南大学, 2014: 4-6.
[32] 朱松, 娄在祥, 马朝阳, 等. 酶法制备乙酰化EGCG在油脂中的抗氧化性能研究[J]. 食品工业科技, 2013, 34(14): 94-98. DOI:10.13386/ j.issn1002-0306.2013.14.032.
[33] 李哲. 乙酰化EGCG的酶法制备及其在油脂中抗氧化应用研究[D].无锡: 江南大学, 2013: 7-8.
[34] LAM W H, KAZI A, KUHN D J, et al. A potential prodrug for a green tea polyphenol proteasome inhibitor: evaluation of the peracetate ester of (-)-epigallocatechin gallate [(-)-EGCG][J]. Bioorganic & Medicinal Chemistry, 2004, 12(21): 5587-5593. DOI:10.1016/ j.bmc.2004.08.002.
[35] LANDIS-PIWOWAR K R, KUHN D J, WAN S B, et al. Evaluation of proteasome-inhibitory and apoptosis-inducing potencies of novel (-)-EGCG analogs and their prodrugs[J]. International Journal of Molecular Medicine, 2005, 15(4): 735-742. DOI:10.3892/ ijmm.15.4.735.
[36] KUHN D, LAM W H, KAZI A, et al. Synthetic peracetate tea polyphenols as potent proteasome inhibitors and apoptosis inducers in human cancer cells[J]. Front Bioscience, 2005, 10(2): 1010-1023. DOI:10.2741/1595.
[37] UTENOVAA B T, MALTERUDB K E, RISEA F. Antioxidant activity of O-protected derivatives of (-)-epigallocatechin-3-gallate: inhibition of soybean and rabbit 15-lipoxygenases[J]. Arkivoc, 2007, 9: 6-16. DOI:10.3998/ark.5550190.0008.902.
[38] 江和源. 表没食子儿茶素没食子酸酯乙酰化物的制备方法: 101190910A[P]. 2008-06-04.
[39] 刘晓辉. 乙酰化EGCG衍生物的合成、纯化及应用特性研究[D]. 北京: 中国农业科学院, 2009: 42-43.
[40] 白艳, 江和源, 江用文, 等. 不同取代度乙酰化儿茶素的合成及体外抗氧化活性的研究[J]. 安徽农业科学, 2012, 40(31): 15408-15412. DOI:10.13989/j.cnki.0517-6611.2012.31.022.
[41] 龙丹. EGCG及全乙酰化EGCG的防晒特性研究[D]. 北京: 中国农业科学院, 2013: 15-17.
[42] OU B N, LIAO Z Z, LIANG G, et al. Synthesis and reversal activity of multidrug esistance of hepatocellular carcinoma of (−)-epigallocatechin gallate analogues[J]. Chinese Journal of Natural Medicines, 2011, 9(4): 274-279. DOI:10.1016/S1875-5364(11)60064-2.
Major Factors Affecting Substitution Degree of Acetylated EGCG
ZHANG Jianyong1, JIANG Heyuan1,*, CUI Hongchun2, WANG Weiwei1, SHI Liting1,3
(1. Key Laboratory of Tea Biology and Resources Utilization, Ministry of Agriculture, Key Laboratory of Tea Processing Engineering of Zhejiang Province, Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 2. Tea Research Institute , Hangzhou Academy of Agricultural Sciences, Hangzhou 310024, China; 3. School of Graduate, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Acetylated epigallocatechin gallate (EGCG) was chemically synthesized in ethyl acetate solvent system for improving the lipid solubility and bioavailability of EGCG. The effects of acetyl anhydride dosage, catalyst pyridine dosage, ethyl acetate dosage, reaction temperature and reaction time on the substitution degree of acetylated EGCG were studied. As a result, it was found that 0.04 mL of acetic anhydride, 0.02 mL of pyridine, 20–60 mL of ethyl acetate, a reaction temperature of 20–25 ℃ and a reaction time of 1–3 h were optimal for the synthesis of acetylated EGCG with a degree of substitution in the range from 1 to 3 from 0.19 g of EGCG. The optimal synthesis conditions for EGCG acetylation that provided a substitution degree between 4 and 6 were 0.12–0.20 mL of acetic anhydride, 0.06–0.20 mL of pyridine, 10–20 mL of ethyl acetate, a reaction temperature of 17–25 ℃, and a reaction duration of 5–9 h, while those for a substitution degree of 7–8 were 0.40–0.80 mL of acetic anhydride, 0.01–0.20 mL of pyridine, 5–10 mL of ethyl acetate, a reaction temperature of 25–40 ℃, and a reaction duration of 5–9 h.
epigallocatechin gallate (EGCG); acetylation; substitution degree; molecular modif i cation; bioavailability
10.7506/spkx1002-6630-201705009
TS201.2
A
1002-6630(2017)05-0054-06
张建勇, 江和源, 崔宏春, 等. EGCG乙酰化分子修饰取代度主要影响因素研究[J]. 食品科学, 2017, 38(5): 54-59. DOI:10.7506/spkx1002-6630-201705009. http://www.spkx.net.cn
ZHANG Jianyong, JIANG Heyuan, CUI Hongchun, et al. Major factors affecting substitution degree of acetylated EGCG[J]. Food Science, 2017, 38(5): 54-59. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705009. http://www.spkx.net.cn
2016-07-07
国家自然科学基金面上项目(31670692);中国农科院科技创新工程项目(CAAS-ASTIP-2016-TRICAAS)作者简介:张建勇(1982—),男,助理研究员,硕士,研究方向为茶叶化学与加工。E-mail:zjy5128@tricaas.com
*通信作者:江和源(1974—),男,研究员,博士,研究方向为茶叶化学与加工。E-mail:jianghy@tricaas.com
