兔皮胶原蛋白的加工特性
2017-03-31王雪蒙黄丹丹张宇昊
韩 霜,马 良,2,王雪蒙,杨 晖,黄丹丹,张宇昊,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学 国家食品科学与工程实验教学中心,重庆 400715)
兔皮胶原蛋白的加工特性
韩 霜1,马 良1,2,王雪蒙1,杨 晖1,黄丹丹1,张宇昊1,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学 国家食品科学与工程实验教学中心,重庆 400715)
以兔皮胶原蛋白为原料,对其加工特性进行系统研究。结果表明,兔皮胶原蛋白具有较强的吸水性,达到14.89 mL/g;其在酸性环境中有很高的溶解性,在pH值为3时,溶解度最高,在碱性环境中溶解度降至50%左右;离子质量浓度对胶原蛋白的溶解度有明显影响,其在NaCl质量浓度为0~2 g/100 mL时保持相对稳定,在NaCl质量浓度由2 g/100 mL增加至4 g/100 mL过程中急剧下降,而NaCl质量浓度大于4 g/100 mL后,胶原蛋白溶解度变化不再明显;当胶原蛋白的质量浓度小于1 g/100 mL时,兔皮胶原蛋白的乳化性随着胶原蛋白质量浓度的增加逐渐增加,但质量浓度超过1 g/100 mL时,乳化性降低,乳化稳定性随胶原蛋白质量浓度的变化呈现与乳化性相反的趋势;低质量浓度的胶原蛋白溶液在pH 3~6过程中,乳化性和乳化稳定性均呈下降趋势,随后,pH 6~9时乳化性和乳化稳定性缓慢增加后保持稳定;离子质量浓度在0.00~7.02 g/100 mL范围内,随离子质量浓度的增加,乳化性呈现出先升高后降低的趋势,而乳化稳定性则呈现先增加随后保持稳定的趋势,在离子质量浓度为5.85 g/100 mL时,胶原蛋白的乳化性与乳化稳定性较好。
胶原蛋白;吸水性;溶解性;乳化性
胶原蛋白是一种白色、不透明、无支链的三螺旋纤维状的蛋白质,主要存在于动物的皮肤、骨骼、软骨、肌腱、牙齿、血管和韧带中。它是哺乳动物体内含量最多、分布最广、并且与各种组织和器官功能相关的功能性蛋白质,占体内蛋白质总量的25%~30%[1],与组织的形成和成熟、细胞间信息传递、细胞增生和分化运动、细胞免疫、肿瘤转移以及关节润滑、伤口愈合、钙化作用、血液凝固和衰老有着密切的关系[2]。因其具有良好的生物相容性、可降解性、低过敏性以及生物活性,在食品加工[3-5]、化妆品[6-7]和医药保健[1-2]等领域有着广泛的应用。
胶原蛋白的吸水性、溶解性、乳化性和乳化稳定性是其添加在食品中和化妆品中时考虑的一些指标特性。Chuaychan[10]和黄亚冬[11]等采用酸法和酶法分别从鲈鱼鱼鳞中和点带石斑鱼鱼皮中提取胶原蛋白,胶原蛋白均在酸性pH 2~4时具有最高的溶解度;Veeruraj等[12]采用酸法和酶法从海洋鳗鱼中提取胶原蛋白,在酸性pH 1~4环境中有很高的溶解度,且在NaCl质量浓度为3.0~4.0 g/100 mL能够很好的溶解。Klompong等[13]对黄色条纹鲹鱼肉提取的蛋白质水解物进行研究,发现水解度越高,乳化能力、乳化稳定性以及起泡能力、泡沫稳定性越低。Wasswa等[14]对草鱼鱼皮蛋白质水解物的功能性质进行研究,发现水解度较低时,水解物的吸油能力和乳化能力较好,并且,持水能力随着水解程度的增加而增加。胡娜等[15]对乳化型猪皮胶原蛋白的乳化性进行研究,随着pH值由酸性变为中性,乳化性逐渐增加,pH值大于7时,乳化性趋于平稳且乳化性随着样品浓度增加而增加,随电解质浓度增加先增加后降低,以上研究均能对胶原蛋白在加工时提供一定的理论依据。
传统上胶原蛋白主要来源于哺乳动物如猪、牛的皮、韧带、结缔组织等,但受人畜共患病的困扰以及一些宗教地区的限制,以哺乳动物为来源的胶原蛋白的使用受到限制,因而水产胶原蛋白开始作为哺乳动物胶原蛋白的替代品受到越来越多的重视。但由于水产胶原蛋白的亚氨基酸含量低,热稳定性差,其在实际应用中受到多种限制[16]。近年来,随着兔肉产业的迅速发展,企业宰杀兔子后产生的大量兔皮没有得到很好地利用而产生浪费与环境污染现象。兔皮中富含胶原蛋白,兔皮胶原蛋白可以克服传统哺乳动物胶原蛋白在宗教和疫病角度的局限,同时也可克服水产胶原蛋白在功能特性方面的局限。因此,兔皮胶原蛋白的技术研发对兔肉加工业产业链的延伸具有潜在的应用指导价值。
本研究拟对兔皮胶原蛋白的这些加工特性进行测定,分析pH值和离子质量浓度对溶解度的影响以及胶原蛋白质量浓度、pH值和离子质量浓度对其乳化性和乳化稳定性的影响,旨在为兔皮胶原蛋白的加工应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜伊拉兔皮购于重庆市北碚区西南大学屠宰场;冰醋酸、NaOH、NaCl、H2SO4、Na2S、Ca(OH)2成都市科龙化工试剂厂;胃蛋白酶(1∶10 000) 北京Solarbio公司;花生油购于重庆市北碚区永辉超市。
1.2 仪器与设备
JA3003B电子天平 上海精天电子仪器有限公司;PHS-25型数显酸度计 杭州雷磁分析仪器厂;紫外-可见光分光光度计 上海菁华科技仪器有限公司;QL 901 Vortex漩涡混合器 海门市其林贝尔仪器制造有限公司;5810R冷冻离心机 德国Eppendorf公司;FD-1-50真空冷冻干燥机 北京博医康试验仪器有限公司;HHR数显恒温水浴锅 上海将任仪器有限公司;FSH-Ⅱ高速匀浆机 江苏金坛市环宇科学仪器厂;85-2磁力搅拌器 金坛市科析仪器有限公司。
1.3 方法
1.3.1 兔皮胶原蛋白的制备
参照王雪蒙等[17]的胶原蛋白提取方法,采用胃蛋白酶法从兔皮中提取胶原蛋白,工艺流程如下:
兔皮→前处理(清洗、脱毛、剪碎)→除杂→清洗→酸浸泡→打浆→酶解→盐析→纯化→冻干→胶原蛋白。
1.3.2 胶原蛋白吸水性测定
取0.3 g(m)胶原蛋白样品与10 mL(V0)蒸馏水在漩涡振荡器上混合30 s,在室温条件下静置30 min,5 000 r/min离心30 min,记录上清液体积VC/mL,按式(1)计算胶原蛋白的吸水性(water absorption capacity,WAC):
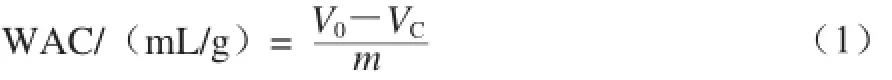
1.3.3 各因素对胶原蛋白溶解度的影响
1.3.3.1 胶原蛋白溶解度的测定
将胶原蛋白溶解于0.5 mol/L醋酸溶液中,溶液在4 ℃条件下搅拌直至胶原蛋白完全溶解,调节pH值或离子质量浓度,4 ℃条件下5 000 r/min离心30 min,采用双缩脲法[18]测定并计算上清液蛋白质的含量,上清液中蛋白质的含量占样品中总蛋白含量的百分数表示溶解度[19]。
1.3.3.2 pH值对胶原蛋白溶解度的影响
将8 mL胶原蛋白溶液(质量浓度为3 g/L)加入到离心管中,用NaOH或HCl分别调pH值至1~10,溶液用蒸馏水(已调到与溶液pH值一致)补到10 mL,4 ℃条件下5 000 r/min离心30 min,计算上清液中蛋白质的含量,上清液中蛋白质的含量占样品中总蛋白含量的百分数表示溶解度。
1.3.3.3 离子质量浓度对胶原蛋白溶解度的影响
将5 mL胶原蛋白溶液(质量浓度为6 g/L)分别与5 mL NaCl溶液(质量浓度分别为2、4、6、8、10、12 g/100 mL)混合,使NaCl质量浓度分别为1、2、3、4、5、6 g/100 mL,混合液在4 ℃条件下混匀,5 000 r/min离心30 min,计算上清液蛋白质的含量,上清液中蛋白质的含量占样品中总蛋白含量的百分数表示溶解度。
1.3.4 胶原蛋白乳化性和乳化稳定性的测定
1.3.4.1 胶原蛋白质量浓度对乳化特性的影响
在25 mL离心管中加入10 mL的胶原蛋白溶液,其中胶原蛋白质量浓度分别为0.20、0.30、0.40、0.50、0.75、1.00、1.50、2.00 g/100 mL,然后向胶原蛋白溶液中加入10 mL花生油,将离心管置于高速均质搅拌机中于8 000 r/min分散2 min使其分散均匀,后将其置于离心机中于1 500 r/min离心15 min后测量离心管中液体总高度和上层乳化层的高度[13],按式(2)计算乳化性。
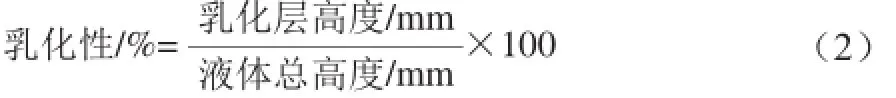
测量后将离心管置于70 ℃水浴锅中加热40 min,冷却后,于1 500 r/min离心15 min后,再次记录上层乳化层,按式(3)计算乳化稳定性。1.3.4.2 pH值对乳化特性的影响

在25 mL离心管中加入胶原蛋白溶液,分别调节pH值至2~9,使胶原蛋白溶液质量浓度为3 g/L,最终体积为10 mL,然后向胶原蛋白溶液中加入10 mL花生油,将离心管置于高速均质搅拌机中于8 000 r/min分散2 min使其分散均匀,后将其放置于离心机中于1 500 r/min离心15 min后测量离心管中液体总高度和乳化层的高度,分别测定乳化性和乳化稳定性。
1.3.4.3 离子质量浓度对乳化特性的影响
在25 mL离心管中加入10 mL质量浓度为3 g/L的胶原蛋白溶液,加入NaCl使溶液NaCl质量浓度分别为0.00、1.17、2.34、3.51、4.68、5.85、7.02 g/100 mL,然后向胶原蛋白溶液中加入10 mL花生油,在高速均质搅拌机中8 000 r/min分散2 min,于1 500 r/min离心15 min后测量离心管中液体总高度和乳化层的高度,分别测定乳化性和乳化稳定性。
1.4 数据分析
数据分析采用Microsoft Excel 2010和SPSS 17.0软件分析,每次实验设置3 个平行实验,数据以表示。
2 结果与分析
2.1 胶原蛋白吸水性的测定结果
吸水能力是胶原蛋白作为食品以及化妆品的生产制造过程中需要参考的重要功能性质[21]。测定结果表明兔皮胶原蛋白的吸水性为14.89 mL/g,而Kim等[22]从鳕鱼糜各种加工副产物中提取的胶原蛋白吸水性为8.58~15.92 mL/g,兔皮胶原蛋白的吸水性相对较高,这可能是因为兔皮胶原分子链上有较多的亲水基团,如羟基、氨基、酰胺基与水分子以氢键结合,在胶原蛋白的提取过程中亲水基团得到很好的保留。因此,兔皮胶原蛋白因其自身具有较好的吸水性,可以将其应用到化妆品及生物医药材料的制备中。
2.2 各因素对胶原蛋白溶解度的影响
2.2.1 pH值对胶原蛋白溶解度的影响
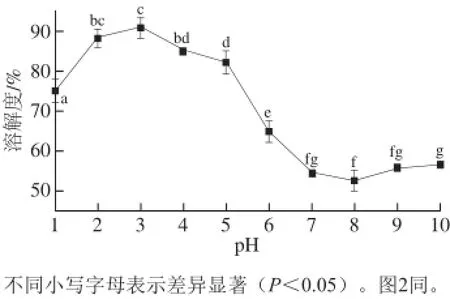
图 1 pH值对兔皮胶原蛋白溶解度的影响Fig. 1 Effect of pH on the solubility of rabbit skin collagen
由图1可知,胶原蛋白在酸性环境中有很高的溶解度,而在碱性条件下溶解度降至50%左右。在pH值为3时,胶原蛋白的溶解度最高,显著高于其他pH值下的溶解度(P<0.05)。在pH 3~7与胶原蛋白等电点(酸溶性和酶溶性胶原蛋白等电点分别为7和8)一致[23]。此外,Chuaychan[10]、Sinthusamran[24]等从鲈鱼鱼鳞、皮肤、鱼鳔中提取的胶原蛋白等电点介于5.76~6.64之间(酸溶性和酶溶性胶原蛋白等电点为4.95和5.76),Kaewdang等[25]从黄鳍金枪鱼鱼鳔中提取的酸溶性和酶溶性胶原蛋白等电点分别为6.05和5.93。提取方法不同,提取得到的胶原蛋白等电点也不相同。胃蛋白酶作用于胶原蛋白的端肽,导致α链中氨基酸组成的不同,而α和β链中的氨基酸组成,决定了胶原蛋白的电荷,不同来源胶原蛋白等电点的差异可能是由其氨基酸组成和分布决定的,尤其是表面的氨基酸组成[26]。
所以,在兔皮胶原蛋白的加工、制备成生物医药材料时,要使其充分溶解需将胶原蛋白溶于酸性环境中。
2.2.2 离子质量浓度对胶原蛋白溶解度的影响
由图2可知,盐的添加降低了兔皮胶原的溶解度,在NaCl质量浓度为1~2 g/100 mL时胶原蛋白的溶解度保持相对稳定,当NaCl质量浓度大于2 g/100 mL以后,胶原蛋白溶解度随盐质量浓度的增大而急剧下降,而NaCl质量浓度增至4 g/100 mL后,胶原蛋白溶解度呈现稳定趋势,这与Chuaychan等[10]从鲈鱼鱼鳞中提取的胶原蛋白以及Veeruraj等[12]从海鳗鱼中提取的胶原蛋白的溶解度与离子质量浓度的关系一致。所以兔皮胶原蛋白在加工时要考虑离子质量浓度对其溶解度的影响,将胶原蛋白溶解在溶液中时要尽量使离子质量浓度保持在2 g/100 mL以下,这样才能使胶原蛋白充分地溶解于溶液中。
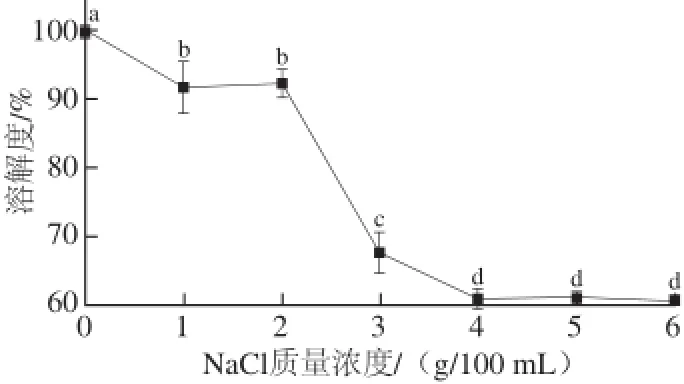
图 2 离子质量浓度对兔皮胶原蛋白溶解度的影响Fig. 2 Effect of ionic strength on the solubility of rabbit skin collagen
2.3 胶原蛋白的乳化性和乳化稳定性
2.3.1 胶原蛋白质量浓度对乳化特性的影响
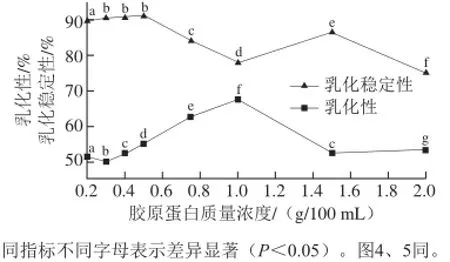
图 3 胶原蛋白质量浓度对其乳化性及乳化稳定性的影响Fig. 3 Effect of rabbit skin collagen concentration on its emulsifying capacity and emulsion stability
由图3可知,在较低质量浓度范围内,随着胶原蛋白质量浓度的增加,胶原蛋白乳化性逐渐增加,样品质量浓度达到1.0 g/100 mL时,乳化性达到最高值67.50%,当质量浓度超过1.0 g/100 mL时,乳化性呈现降低趋势。而胶原蛋白质量浓度对其乳化稳定性的影响恰恰相反,随着质量浓度的增加,乳化稳定性由高降低,当质量浓度超过1.0 g/100 mL时,胶原蛋白溶液的乳化稳定性保持略微增加。
胶原蛋白与油充分混匀,胶原与水和油在机械外力的作用下,胶原的亲油基团被吸附在油的表面,形成吸附膜[27],而亲水性氨基酸如丝氨酸、苏氨酸、酪氨酸以及谷氨酰胺、天冬酰胺等极性基团吸附于水层,与水形成氢键,从而形成了稳定的乳化液。随着胶原蛋白质量浓度的增加,胶原蛋白的亲油基团增加,亲油基团吸附于油层,乳化性逐渐增加;而胶原蛋白质量浓度超过1.0 g/100 mL,单位体积内胶原蛋白分子增多,不利于胶原蛋白的亲油基团的暴露,导致胶原蛋白与油形成的乳化层变薄,乳化性降低。
2.3.2 pH值对乳化特性的影响
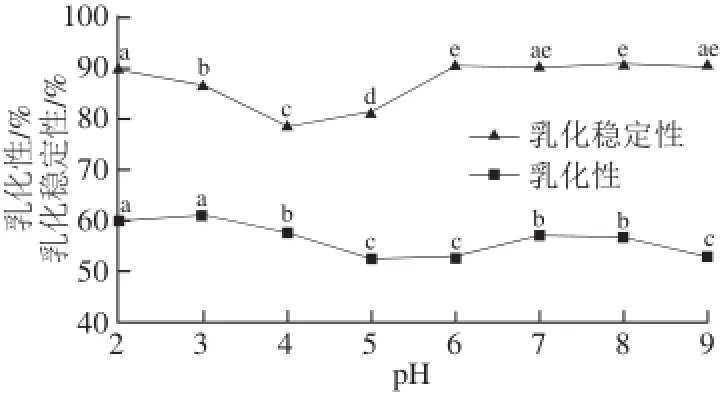
图 4 pH值对胶原蛋白乳化性及乳化稳定性的影响Fig. 4 Effect of pH on the emulsifying capacity and emulsion stability of rabbit skin collagen
从图4可知,pH值由酸变碱的过程中,胶原蛋白溶液乳化性和乳化稳定性呈下降趋势,随着pH值的继续升高,乳化性和乳化稳定性缓慢增加后保持稳定。这与余东华等[28]研究的pH值对不同分子质量段猪皮胶原蛋白酶解物的乳化性和乳化稳定性影响相似。在胶原蛋白溶液pH值由强酸变为弱酸过程时,胶原蛋白的构象发生变化,疏水基团的暴露减少,胶原蛋白的乳化性由60%降至55%左右,而当pH值变为中性时,胶原蛋白的构象又发生变化,胶原蛋白表面疏水基团增多,从而乳化性缓慢增加,pH值增加至9,乳化性略微降低。乳化过程是溶液中蛋白质分子的疏水基团与油相结合,亲水基团与水相结合形成介于疏水相与亲水相之间的稳定界面的过程。通常情况下,蛋白质的溶解度与乳化性呈正相关,但在本研究中,胶原蛋白的乳化性及乳化稳定性在中性条件下较高,这可能是由于胶原蛋白绝对溶解度很小,故构象的变化对乳化性的影响相对更大[29],处于等电点处的胶原蛋白构象发生了一些改变,基团中疏水区与亲水区暴露程度增加,从而乳化性增强。
因此,兔皮胶原蛋白在加工应用时应使pH值保持在中性范围内,在中性范围内,胶原蛋白的乳化性和乳化稳定性均保持在较高水平。
2.3.3 离子质量浓度对乳化特性的影响

图 5 离子质量浓度对胶原蛋白乳化性和乳化稳定性的影响Fig. 5 Effect of ionic strength on the emulsifying capacity and emulsion stability of rabbit skin collagen
由图5可知,随着离子质量浓度的增加,胶原蛋白的乳化性和乳化稳定性均呈增加趋势,随着离子质量浓度的继续增加,乳化性降低,乳化稳定性保持稳定。低质量浓度的NaCl加入到胶原蛋白溶液,会对胶原蛋白溶液的电荷产生影响,使胶原蛋白疏水基团暴露增多,增大其表面疏水性,使油滴更容易与胶原蛋白结合,乳化性会增加,在质量浓度为4.68~5.85 g/100 mL时达到最大,显著高于其他质量浓度条件下的乳化性(P<0.05)。但此时胶原蛋白的溶解性很低,可能也是因为与溶解度相比,其构象变化对胶原蛋白乳化性的影响更大的缘故。而当NaCl质量浓度增加至一定值,胶原蛋白分子构象发生变化,胶原蛋白分子间易产生聚集,引起乳化性的降低[15]。而胶原蛋白的乳化稳定性随着离子质量浓度的增加缓慢上升随后保持稳定。乳化稳定性变化在离子质量浓度为0 g/100 mL时最小,之后随质量浓度增大乳化稳定性也随之增加,离子质量浓度为2.34 g/100mL时,乳化稳定性趋于稳定。
因此,胶原蛋白作为乳化剂应用到食品中时,应使溶液的离子质量浓度保持在5 g/100 mL左右,保证胶原蛋白有较高的乳化性。
3 结 论
本实验制备的兔皮胶原蛋白的吸水性为14.89 mL/g。胶原蛋白在酸性环境中有很高的溶解性,在碱性环境中溶解度降至50%左右,在pH值为3时,溶解度最高。在NaCl质量浓度为0~2 g/100 mL时,胶原蛋白的溶解度保持相对稳定,当NaCl质量浓度高于2 g/100 mL时,胶原蛋白溶解度随盐质量浓度的增大而急剧下降,而NaCl质量浓度增至4 g/100 mL后,胶原蛋白溶解度保持稳定。在较低胶原蛋白质量浓度范围内,随着质量浓度的增加,胶原蛋白的乳化性逐渐增加,质量浓度超过1 g/100 mL时,乳化性降低,乳化稳定性与乳化性趋势相反;低质量浓度的胶原蛋白溶液pH值由酸变碱的过程中,乳化性和乳化稳定性呈下降趋势,随着pH值继续升高,乳化性和乳化稳定性缓慢增加后保持稳定;随着离子质量浓度的增加,胶原蛋白的乳化性和乳化稳定性均呈增加趋势,随着离子质量浓度的继续增加,乳化性降低,乳化稳定性保持稳定。
[1] 蒋挺大. 胶原与胶原蛋白[M]. 北京: 化学工业出版社, 2006: 3-45.
[2] 焦道龙, 陆剑锋, 张伟伟, 等. 水产动物胶原蛋白的研究现状及发展趋势[J]. 食品科学, 2009, 30(17): 334-338. DOI:10.3321/ j.issn:1002-6630.2009.17.079.
[3] BILEK S E, BAYRAM S K. Fruit juice drink production containing hydrolyzed collagen[J]. Journal of Functional Foods, 2015, 14: 562-569. DOI:10.1016/j.jff.2015.02.024.
[4] 高晶晶. 鳕鱼胶原蛋白在食品加工中的应用[J]. 农产品加工: 学刊, 2014(10): 79-80. DOI:10.3969/jissn.1671-9646(X).2014.10.055.
[5] 尹利端, 石丽花, 王桐, 等. 海洋胶原蛋白肽在功能性食品中的应用[J]. 明胶科学与技术, 2013(2): 55-58. DOI:10.3969/ j.issn.1004-9657.2013.02.001.
[6] 穆畅道. 一种胶原蛋白面膜及其制备方法: CN102138870 A[P]. 2011-08-03.
[7] 苗强. 一种鱼鳞胶原蛋白化妆品: CN101999992 A[P]. 2011-04-06.
[8] PARENTEAU-BAREIL R, GAUVIN R, BERTHOD F. Collagenbased biomaterials for tissue engineering applications[J]. Materials, 2010, 3(3): 1863-1887. DOI:10.3390/ma3031863.
[9] 王春侠. 胶原蛋白在医疗保健领域的应用研究[J]. 现代医药卫生, 2011, 27(23): 3588-3590.
[10] CHUAYCHAN S, BENJAKUL S, KISHIMURA H. Characteristics of acid-and pepsin-soluble collagens from scale of seabass (Lates calcarifer)[J]. LWT-Food Science and Technology, 2015, 63(1): 71-76. DOI:10.1016/j.lwt.2015.03.002.
[11] 黄亚冬, 邢克智, 刘海学, 等. 点带石斑鱼鱼皮和鳞片胶原蛋白的提取及理化性质的研究[J]. 天津师范大学学报(自然科学版), 2013, 33(2): 64-69. DOI:10.3969/j.issn.1671-1114.2013.02.013.
[12] VEERURAJ A, ARUMUGAM M, BALASUBRAMANIAN T. Isolation and characterization of thermostable collagen from the marine eel-f i sh (Evenchelys macrura)[J]. Process Biochemistry, 2013, 48(10): 1592-1602. DOI:10.1016/j.procbio.2013.07.011.
[13] KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as inf l uenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1317-1327. DOI:10.1016/j.foodchem.2006.07.016.
[14] WASSWA J, TANG J, GU X H, et al. Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp (Ctenopharyngodon idella) skin[J]. Food Chemistry, 2007, 104(4): 1698-1704. DOI:10.1016/ j.foodchem.2007.03.044.
[15] 胡娜, 乔美靓, 刘毅, 等. 乳化型猪皮胶原蛋白拘溶解性和乳化性研究[J]. 肉类研究, 2010, 24(6): 10-14.
[16] 申铉日, 夏光华, 董正华. 水产胶原蛋白的研究进展[J]. 明胶科学与技术, 2013(1): 1-8. DOI:10.3969/j.issn.1004-9657.2013.01.001.
[17] 王雪蒙, 于玮, 马良, 等. 兔皮胶原蛋白的提取及其结构鉴定[J]. 食品与发酵工业, 2016, 42(4): 209-213.
[18] 农业部. 乳与乳制品中蛋白质的测定双缩脲比色法: NY/T 1678—2008[S]. 北京: 中国农业科学院, 2008: 1-4. DOI:10.3969/ j.issn.1004-8685.2008.07.043.
[19] SINGH P, BENJAKUL S, MAQSOOD S, et al. Isolation and characterisation of collagen extracted from the skin of striped catf i sh (Pangasianodon hypophthalmus)[J]. Food Chemistry, 2011, 124(1): 97-105. DOI:10.1016/j.foodchem.2010.05.111.
[20] 高金龙, 莎丽娜. 羊皮胶原蛋白乳化性与乳化稳定性的研究[J]. 食品工业科技, 2011, 32(1): 65-67.
[21] SOUISSI N, BOUGATEF A, TRIKI-ELLOUZ Y, et al. Biochemical and functional properties of sardinella (Sardinella aurita) by-product hydrolysates[J]. Food Technology and Biotechnology, 2007, 45(2): 187-194.
[22] KIM J S, PARK J W. Characterization of acid-soluble collagen from pacific whiting surimi processing byproducts[J]. Journal of Food Science, 2004, 69(8): C637-C642.
[23] 赵玉勤, 王玉梅, 王斌, 等. 绿鳍马面鲀(Navodon septentrionalis)鱼头酸溶性与酶溶性胶原蛋白的分离纯化及理化性质研究[J]. 海洋与湖沼, 2015, 46(3): 703-709. DOI:10.11693/hyhz20150100016.
[24] SINTHUSAMRAN S, BENJAKUL S, KISHIMURA H. Comparative study on molecular characteristics of acid soluble collagens from skin and swim bladder of seabass (Lates calcarifer)[J]. Food Chemistry, 2013, 138(4): 2435-2441. DOI:10.1016/j.foodchem.2012.11.136.
[25] KAEWDANG O, BENJAKUL S, KAEWMANEE T, et al. Characteristics of collagens from the swim bladders of yellowfin tuna (Thunnus albacares)[J]. Food Chemistry, 2014, 155: 264-270. DOI:10.1016/j.foodchem.2014.01.076.
[26] WOO, J W, YU S J, CHO S M, et al. Extraction optimization and properties of collagen from yellowf i n tuna (Thunnus albacares) dorsal skin[J]. Food Hydrocolloids, 2008, 22: 879-887.
[27] THIANSILAKUL Y, BENJAKUL S, SHAHIDI F. Compositions, functional properties and antioxidative activity of protein hydrolysates prepared from round scad (Decapterus maruadsi)[J]. Food Chemistry, 2007, 103(4): 1385-1394. DOI:10.1016/j.foodchem.2006.10.055.
[28] 余东华, 徐志宏, 魏振承, 等. 不同分子质量段猪皮胶原蛋白酶解物乳化性质[J]. 食品科学, 2011, 32(15): 10-13.
[29] 高育哲, 徐红华, 李铁晶, 等. 定位酶解与蛋白质表面性质及结构特性关系的研究进展[J]. 大豆通报, 2008(2): 33-36.
Processing Characteristics of Rabbit Skin Collagen
HAN Shuang1, MA Liang1,2, WANG Xuemeng1, YANG Hui1, HUANG Dandan1, ZHANG Yuhao1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China)
In the present study, rabbit skin collagen was analyzed for its processing characteristics. The results showed that the water absorption capacity of rabbit skin collagen was 14.89 mL/g. The collagen had a high solubility in acidic environment, especially at pH 3, and the solubility was decreased to 50% in alkaline environment. Ionic strength had a signif i cant effect on the solubility of the collagen. At NaCl concentrations in the range of 0‒2 g/100 mL, the solubility of the collagen remained relatively stable, whereas it decreased sharply with NaCl concentration up to 4 g/100 mL, and then did not change signif i cantly at NaCl concentrations higher than 4 g/100 mL. The emulsifying capacity of the skin collagen increased with its concentration up to 1 g/100 mL, and then it began to decline with further increasing its concentration, but the opposite trend was observed for emulsion stability. Both emulsifying properties decreased with increasing pH from 3 to 6 and then gradually increased to a plateau with further increasing pH to 9. Emulsifying capacity presented a decreasing trend after an initial increase with NaCl concentration up to 7.02 g/100 mL, while emulsion stability remained stable after an initial increase. Both emulsifying capacity and emulsion stability were good at a NaCl concentration of 5.85 g/100 mL.
collagen; water absorption capacity; solubility; emulsif i cation
10.7506/spkx1002-6630-201705004
TS251.92
A
1002-6630(2017)05-0021-05
韩霜, 马良, 王雪蒙, 等. 兔皮胶原蛋白的加工特性[J]. 食品科学, 2017, 38(5): 21-25. DOI:10.7506/spkx1002-6630-201705004. http://www.spkx.net.cn
HAN, Shuang, MA Liang, WANG Xuemeng, et al. Processing characteristics of rabbit skin collagen[J]. Food Science, 2017, 38(5): 21-25. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705004. http://www.spkx.net.cn
2016-05-30
国家自然科学基金青年科学基金项目(31301425);中央高校基本科研业务费重大项目(XDJK2015A015);
中国博士后科学基金面上项目(2014M562267);中国博士后科学基金特别资助项目(2015T80951);
重庆市基础科学与前沿技术研究重点项目(cstc2015jcyjBX0116);第四批重庆市高等学校优秀人才支持计划项目
韩霜(1992—),女,硕士研究生,研究方向为食品化学与营养。E-mail:854512603@qq.com
*通信作者:张宇昊(1978—),男,教授,博士,研究方向为蛋白和生物活性肽。E-mail:zhy1203@163.com
