超声处理对大豆7S蛋白潜在致敏性的影响
2017-03-31祖琴琴朱杰瑞杨安树陈红兵
邓 涵,祖琴琴,朱杰瑞,杨安树,陈红兵
(南昌大学 食品科学与技术国家重点实验室,南昌大学中德联合研究院,江西 南昌 330047)
超声处理对大豆7S蛋白潜在致敏性的影响
邓 涵,祖琴琴,朱杰瑞,杨安树*,陈红兵
(南昌大学 食品科学与技术国家重点实验室,南昌大学中德联合研究院,江西 南昌 330047)
利用超声波改性处理大豆7S蛋白,并评估超声处理产物体外消化性及消化产物抗原性和潜在致敏性的变化。结果表明,7S蛋白耐唾液、胃液消化,但其在300 W超声处理80 min后易被十二指肠消化;进一步利用体外免疫球蛋白(immunoglobulin,Ig)G结合能力评估消化产物抗原性的强弱,超声处理7S蛋白后,随着超声处理时间(0~120 min)的延长,其消化产物的抗原性总体上呈现先升高后降低的趋势,在超声100 min时,消化产物的抗原性最低;利用体外IgE结合能力评估其潜在致敏性,随超声处理时间(0~120 min)的延长,大豆7S蛋白消化产物的IgE结合能力呈现先升高后降低的趋势,超声80 min时,其消化产物IgE结合能力最低。研究结果表明超声
大豆7S蛋白;超声;体外消化性;抗原性;潜在致敏性
大豆是一种营养丰富的食用蛋白资源。在亚洲,大豆制品消费已有上千年的历史,并且一直深受广大消费者的青睐[1-2]。然而,作为8大类过敏食物之一,大豆制品对于大豆过敏人群存在着潜在的危险[3]。据文献报道,90%的大豆过敏是由免疫球蛋白(immunoglobulins,Ig)E介导,可引发产生过敏性皮炎、胃肠道紊乱等一系列的症状[4-5]。大豆过敏患者约占食品过敏总人数的25%[6]。迄今为止,大豆过敏尚无特效疗法。因此,为了减少大豆过敏的危害,利用食品加工方法开发低致敏或脱敏的大豆制品刻不容缓[7]。大豆含有35%~40%蛋白质,按照沉降模式,可分为2S、7S、11S和15S 4 个主要组分[8]。在已发现的38 种大豆过敏原中,Gly m Bd 30K、Gly m Bd 28K和β-伴大豆球蛋白中的Gly m Bd 60K被认为是3 种主要的大豆过敏原,且都存在于大豆7S蛋白中[9]。因此,研究大豆7S蛋白的致敏性控制具有非常重要的意义。
高强度超声波是指机械振荡频率达到20~100 kHz的声波,其作为一种高效的食品加工技术被广泛应用于食品行业中。由于超声波的空化和直进流作用会使能量高度聚集,产生一系列高温、高压的物理效应,可导致部分蛋白质的空间结构发生改变[10]。有研究表明,超声处理能使食物过敏原结构的构象发生改变[11]。如利用超声处理虾过敏原提取物,再通过虾过敏患者的血清学实验发现:一定条件下超声处理能够降低虾过敏原蛋白的免疫活性,这可能是由于超声波破坏了虾过敏原的IgE识别位点[12]。也有研究发现[13-14],超声处理可使大豆7S蛋白一级结构因蛋白聚合发生变化,这些聚合物的形成可能掩盖抗原表位,进而使大豆的致敏性发生变化。目前国内外借助超声波加工降低大豆致敏性的研究很少,鉴于超声处理在降低其他食物过敏性方面有一定成效,所以期待其可以成功应用于生产低致敏豆制品。
基于南昌大学食品科学与技术国家重点实验室对超声强度对大豆蛋白影响的研究,首先将大豆7S蛋白经不同时间超声处理(40 kHz、300 W)[15]。然后经体外模拟唾液、胃液和十二指肠液消化,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、Tricine-SDS-PAGE方法分析超声处理对大豆7S蛋白消化性的影响,并采用体外IgG、IgE的结合能力评估消化产物的抗原性和潜在致敏性,研究旨在探讨利用超声处理降低大豆致敏性的现实意义,为生产低过敏大豆食品提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
东农42大豆 东北农业大学;β-巯基乙醇、考马斯亮蓝G-250、牛血清白蛋白(bovine serum albumin,BSA)标准品、Acr/Bis溶液、过硫酸铵(ammonium persulphate,AP)、预染Marker、低分子质量蛋白Marker 上海生工公司;甲叉丙烯酰胺-三羟甲基氨基甲烷(Bis-Tris)、甘氨脱氧胆酸钠、牛胆酸钠胰蛋白酶、卵磷脂、胃蛋白酶、胰蛋白酶、兔抗大豆蛋白血清、辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔IgG二抗、邻苯二胺(o-phenylenediamine,OPD) 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
SB-5200DTD超声波清洗机 宁波新芝生物科技股份有限公司;TU-1901紫外-可见分光光度计 北京普析通用仪器有限责任公司;PB-10型酸度计 德国Sartorius公司;Allegra 64 R高速冷冻离心机 美国Beckman公司;Power Pac 3000迷你型蛋白电泳仪、Model 1860酶联免疫检测仪、Universal HoodⅡ凝胶成像系统 美国Bio-Rad公司;ImmunoCAP 100荧光免疫分析仪 瑞典法玛西亚公司。
1.3 方法
1.3.1 大豆7S蛋白的提取
为减轻因研磨发热引起的大豆蛋白空间改变,称取一定质量大豆在液氮下进行研磨,以料液比1∶15(m/V)加入正己烷进行脱脂、风干,即得脱脂豆粉。大豆7S蛋白提取方法参照文献[16-17]进行,所得蛋白在经透析后置于-20 ℃储存备用。
1.3.2 大豆7S蛋白质量浓度的测定
以BSA制标准曲线用Bradford[18]法测定,紫外分光光度计595 nm波长处测其吸光度并绘制标准曲线。用50 mmol/L Tris溶解大豆7S蛋白,混匀,离心(8 000 r/min、4 ℃、30 min)取上清液。将样品质量浓度稀释到BSA蛋白标准曲线的范围内,取2.5 mL考马斯亮蓝G-250溶液与0.5 mL待测样品混匀,室温条件下静置3 min后测定吸光度,根据待测蛋白的稀释倍数和标准曲线计算样品质量浓度。
1.3.3 超声处理
稀释大豆7S蛋白至质量浓度为6 mg/mL,将其置于超声装置中40 kHz、300 W强度下分别处理0、20、40、60、80、100、120 min,处理后置于-20 ℃条件下冻存。
1.3.4 体外模拟消化
参照Amigo-Benavent等[19]的方法并略有调整。
1.3.4.1 模拟唾液消化
取1 mL超声处理后7S蛋白置于37 ℃水浴中,先加入1 mL唾液缓冲液反应15 min,再加入2.5 mL α-淀粉酶溶液(150 U)反应2 min,用1 mol/L HCl调pH值至3.5终止反应。
1.3.4.2 模拟胃液消化
取1 mL上述唾液消化产物置于37 ℃水浴中,与0.5 mL胃蛋白酶液,250 µL卵磷脂和250 µL NaCl(35 mmol/L,pH 2.0)反应60 min,用1 mol/L NaHCO3调pH值至7.0以终止反应。
1.3.4.3 模拟十二指肠液消化
取2 mL上述胃消化产物,与0.25 mol/L Bis-Tris(pH 6.5)、1 mol/L CaCl2、0.250 mol/L胆盐混合,置于37 ℃水浴中预热15 min后,加入0.5 mL胰蛋白酶、6 µL α-糜蛋白酶和2.784 mL超纯水反应60 min后,再置于85 ℃水浴锅中灭酶处理5 min。
1.3.5 SDS-PAGE和Tricine-SDS-PAGE
选用质量分数为12%分离胶、4%浓缩胶进行SDS-PAGE,检测大豆7S蛋白经超声处理以及体外消化后分子质量的变化。选用质量分数为4%浓缩胶、10%夹层胶和16.5%致密胶进行Tricine-SDS-PAGE,分析消化产物中小分子蛋白质的分子质量。浓缩胶恒流6 mA,分离胶电流调至12 mA,直至溴酚蓝指示剂涌动至分离胶底部,电泳结束。
1.3.6 游离巯基含量分析
采用Ellman[20]的方法:取不同超声时间处理的大豆7S蛋白溶于pH 8.0的缓冲液中(0.086 mol/L Tris-0.09 mol/L甘氨酸-4 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)),使其蛋白终质量浓度为2 mg/mL。向3 mL蛋白液中加入0.03 mL埃尔曼试剂,两者迅速混合,在20 ℃避光条件下静置反应15 min,在紫外分光光度计412 nm波长处读取吸光度,设置3 组平行。游离巯基的含量通过所测吸光度与摩尔消光系数13 600 L/mol的比值计算得出,单位为µmol/g。
1.3.7 体外IgG结合能力的评估
用方正滴定法确定最佳包被蛋白质量浓度和一抗稀释倍数[21]。采用竞争抑制酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)法测定IgG结合能力来评估消化产物抗原性的强弱。具体操作步骤如下:酶标板每孔加入最佳包被蛋白质量浓度的包被液,4 ℃条件下过夜。次日加入磷酸盐吐温(PBST)缓冲液洗3 次后,加入250 µL 1%的明胶在37 ℃条件下封阻1 h,洗涤3 次,置于4 ℃备用。取另一块酶标板,明胶封阻1 h,洗涤3 次后,加入体积比1∶1的不同质量浓度梯度的竞争抗原(不同超声处理时间的大豆7S蛋白)和一抗(兔抗大豆蛋白血清),37 ℃条件下温育1 h。从该板每孔中吸取100 µL转移至第一块板内,37 ℃条件下温育1 h,洗涤3 次。加入羊抗兔HRP酶标二抗(1∶5 000),37 ℃条件下温育1 h,加入100 µL OPD显色底物,避光反应15 min后加入50 µL H2SO4溶液终止反应,在酶标仪490 nm波长处测光密度值。按式(1)计算IgG抑制率。
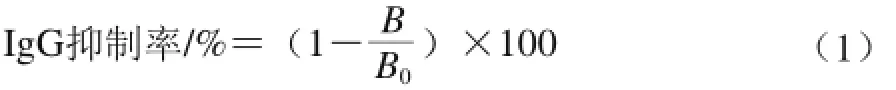
式中:B为不同超声时间下竞争蛋白的OD值;B0为无竞争蛋白时的OD值。
1.3.8 体外IgE结合能力的评估
利用ImmunoCAP 100荧光免疫分析仪筛选大豆过敏血清,以过敏患者血清作为一抗,构建血清池。实验中的7 位大豆过敏患者信息见表1。
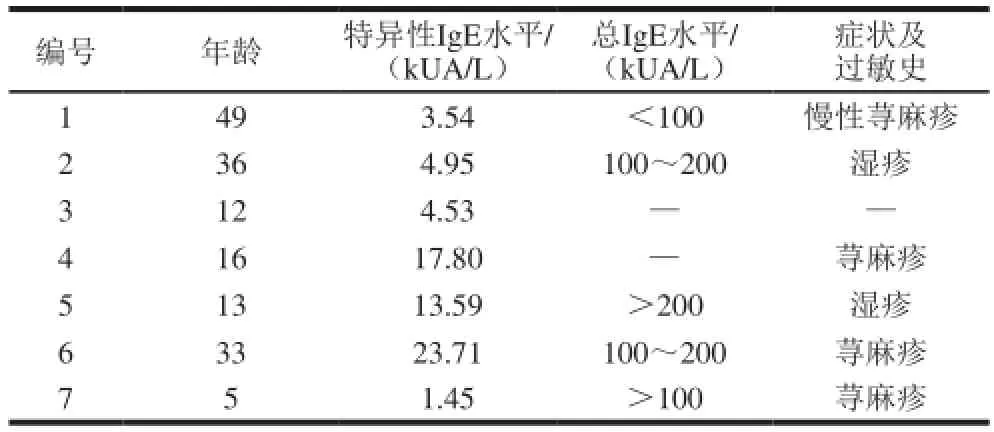
表 1 大豆过敏患者信息Table 1 Information about the patients with soybean allergy
具体方法与1.3.7节相似,部分稍作如下改变:包被未加工的7S蛋白和加工后的竞争蛋白质量浓度为15 µg/mL;一抗使用1∶15稀释的过敏患者人血清,与超声处理后的7S蛋白37 ℃温育1 h;二抗使用1∶5 000稀释的生物素标记的IgE二抗,37 ℃温育2 h,洗板结束后每孔加入100 µL 1∶60稀释的HRP-链霉素标记的亲和素,37 ℃温育1 h。按式(2)计算IgE抑制率。
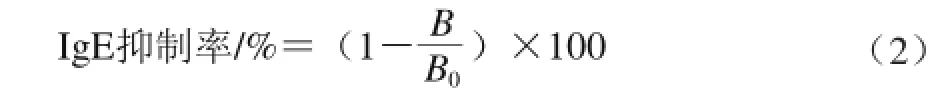
式中:B为不同超声时间下竞争蛋白的OD值;B0为无竞争蛋白时的OD值。
1.4 数据处理与统计分析
所有实验至少重复3 次,数据分析采用SPSS统计分析软件。统计显著性分析用单因素方差分析,以P<0.05表明具有显著性。
2 结果与分析
2.1 大豆7S蛋白质量浓度的确定
采用Bradford法绘制标准曲线得到线性回归方程:y=0.002 2x+0.001 9(R2=0.999 2),测得7S蛋白质量浓度为25.10 mg/mL。
2.2 超声处理大豆7S蛋白的电泳图
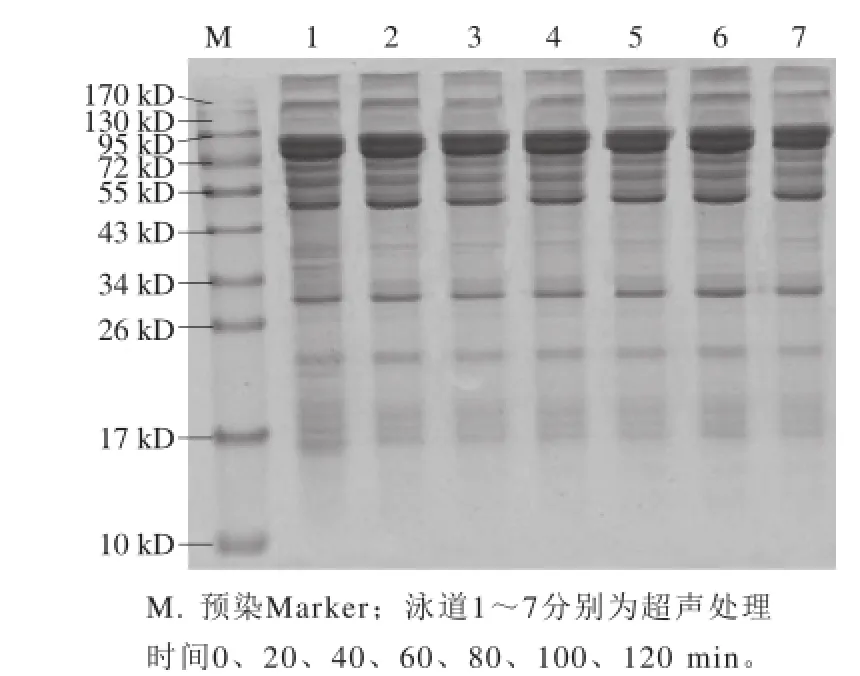
图 1 超声处理7S蛋白SDS-PAGE图Fig. 1 SDS-PAGE patterns of 7S globulin subjected to ultrasonic treatment
由图1可以看出,超声处理前后大豆7S蛋白电泳条带的组成与灰度并未发生显著变化,且随着超声时间的延长,SDS-PAGE显示的超声处理后大豆7S蛋白条带和灰度与未处理加工的大豆7S蛋白几乎一致,表明大豆7S蛋白超声处理后,其分子质量并未发生显著变化,这与Karki等[22]的研究结果相似。
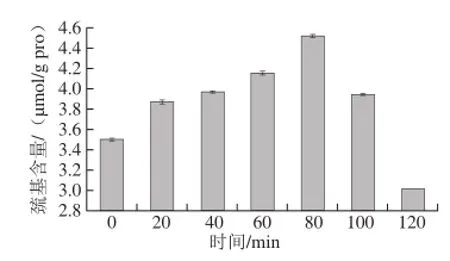
图 2 超声处理对大豆7S蛋白游离巯基的影响Fig. 2 Free -SH content in soybean 7S protein subjected to ultrasonic treatment
2.3 超声处理前后大豆7S蛋白游离巯基变化游离巯基含量变化可反映蛋白的变性程度,且对蛋白的功能性质有关键的影响[23]。经过不同时间超声处理的大豆7S蛋白游离巯基的变化如图2所示。随着超声处理时间的延长,游离巯基含量变化趋势为先增加后减少。超声0~80 min时,游离巯基含量增加,这可能是由于超声处理产生的空穴现象下的紊流、高压和剪切力的作用使掩埋的巯基暴露,或空穴作用破坏了蛋白分子中的二硫键,从而产生了新的游离巯基[11]。80 min时,巯基含量达到最高值,蛋白质破坏程度达到最大。超声时间超过80 min时,巯基含量反而呈现下降趋势。这可能是由于在高密度超声处理形成的空穴作用中产生了瞬态自由基(•OH、H•),这些自由基经交叉反应又产生氢过氧化物,氢过氧化物进一步氧化巯基,形成新的二硫键,该变化可导致蛋白结构发生折叠[24]。
2.4 体外模拟消化
2.4.1 模拟唾液和胃液消化
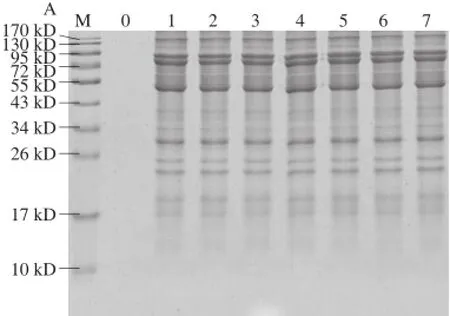
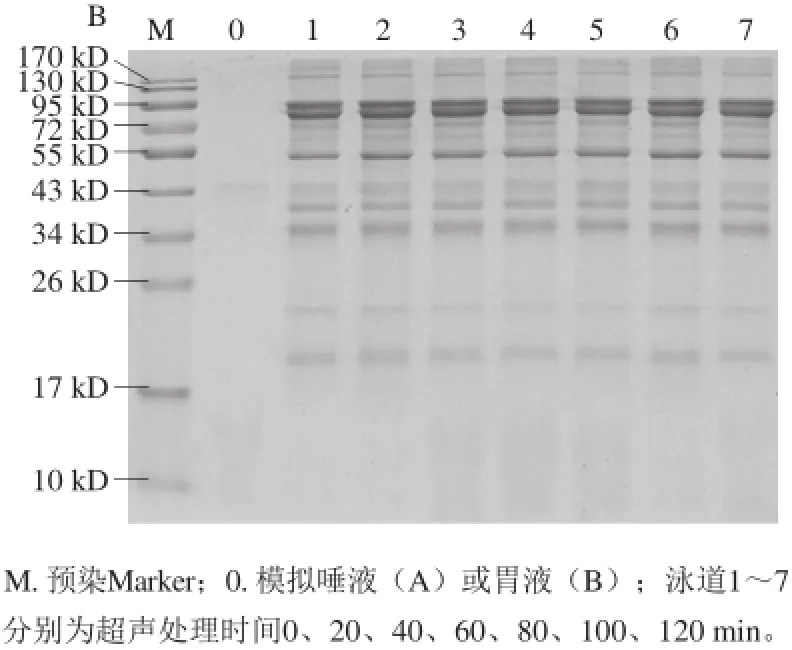
图 3 超声处理7S蛋白经体外模拟唾液(A)和胃液(B)消化后电泳图Fig. 3 Effect of ultrasonic treatment on salivary (A) and gastric (B) digestion of 7S globulin
如图3A和3B所示,与未超声的大豆7S蛋白比较,不同超声时间处理后的7S蛋白经唾液和胃液消化后蛋白分子质量并未发生明显变化,同时,其条带灰度也与未处理蛋白基本保持一致。结果表明:超声处理对大豆7S蛋白在唾液和胃液中消化性的影响没有显著差异。Bowman等[25]指出食物中致敏强的过敏原一般具有抗消化性。本研究电泳结果也表明在口腔和胃消化阶段,7S蛋白作为一种强致敏性的过敏原,具有较强的耐唾液和胃液消化性。
2.4.2 模拟十二指肠液消化
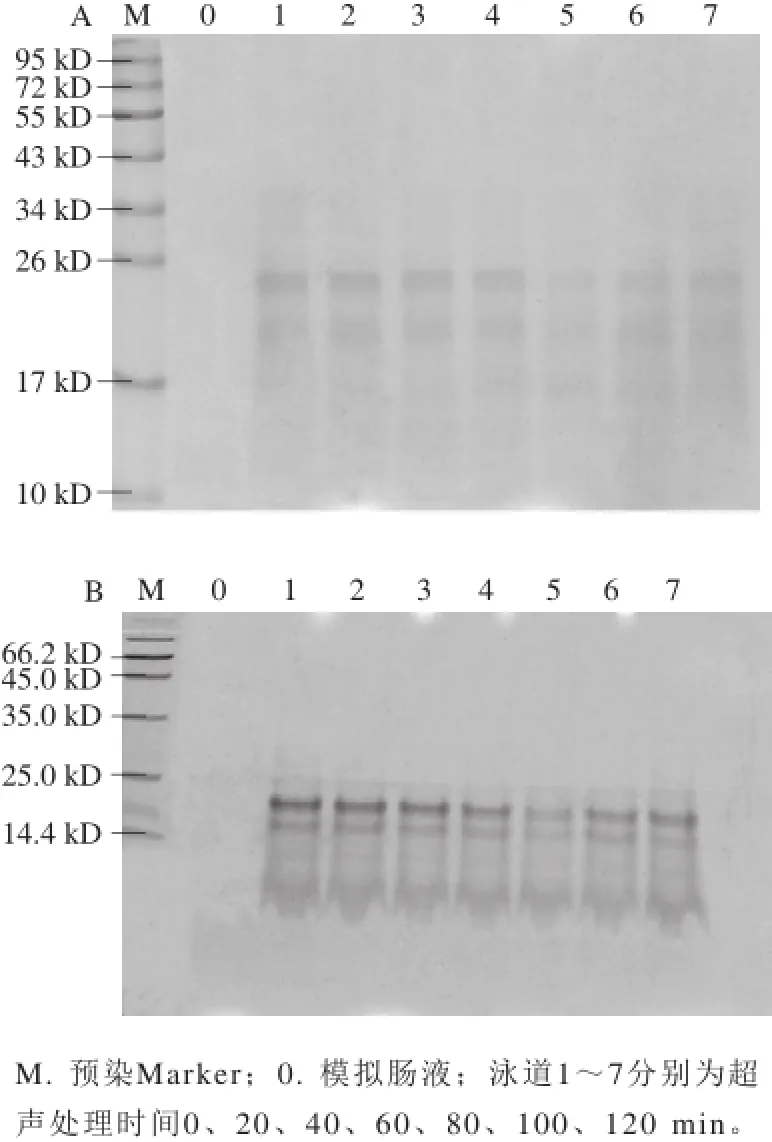
图 4 超声处理7S蛋白肠消化产物的SDS-PAGE(A)和Tricine-SDSPAGE(B)图Fig. 4 SDS-PAGE (A) and Tricine-SDS-PAGE (B) patterns of intestinal digestion products of 7S globulin subjected to ultrasonic treatment
如图4所示,未加工和不同时间超声处理的大豆7S蛋白经十二指肠液中消化后,其蛋白条带发生显著变化,产生一些分子质量<26 kD的小分子片段;同时,蛋白灰度减弱,即消化后残留的蛋白量呈现降低趋势,且在超声80 min时,大豆7S蛋白条带的灰度达到最弱。结果表明超声处理的大豆7S蛋白易被十二指肠消化,超声处理80 min时最易被消化,可能是由于此时超声处理后的蛋白质破坏程度达到最大,因此,最易被十二指肠液消化,这可从上述游离巯基结果得到证明。
2.5 超声处理大豆7S蛋白的消化产物与IgG结合能力
过敏原的抗原决定簇在经消化道进入免疫系统前只有保持足够完整又有免疫原性的蛋白或蛋白片段才具有潜在致敏的可能[26]。在利用间接竞争ELISA评估抗原性实验中,常用使IgG的抑制率达到50%时对应的竞争抗原的浓度即半抑制浓度(half maximal inhibitory concentration,IC50)值来表征IgG结合能力进而表征抗原性的强弱,IC50值越大,达到半抑制率所需竞争抗原浓度越高,即抗原性越弱。实验结果如图5所示,IC50值均大于0,超声处理(0~120 min)后的7S蛋白消化产物具有免疫原性。随着超声处理时间的延长,大豆7S蛋白的抗原性总体上呈现先升高后降低的趋势,且80 min时IC50值达到最小,约为5 µg/mL,此时7S蛋白的抗原性达到最高。
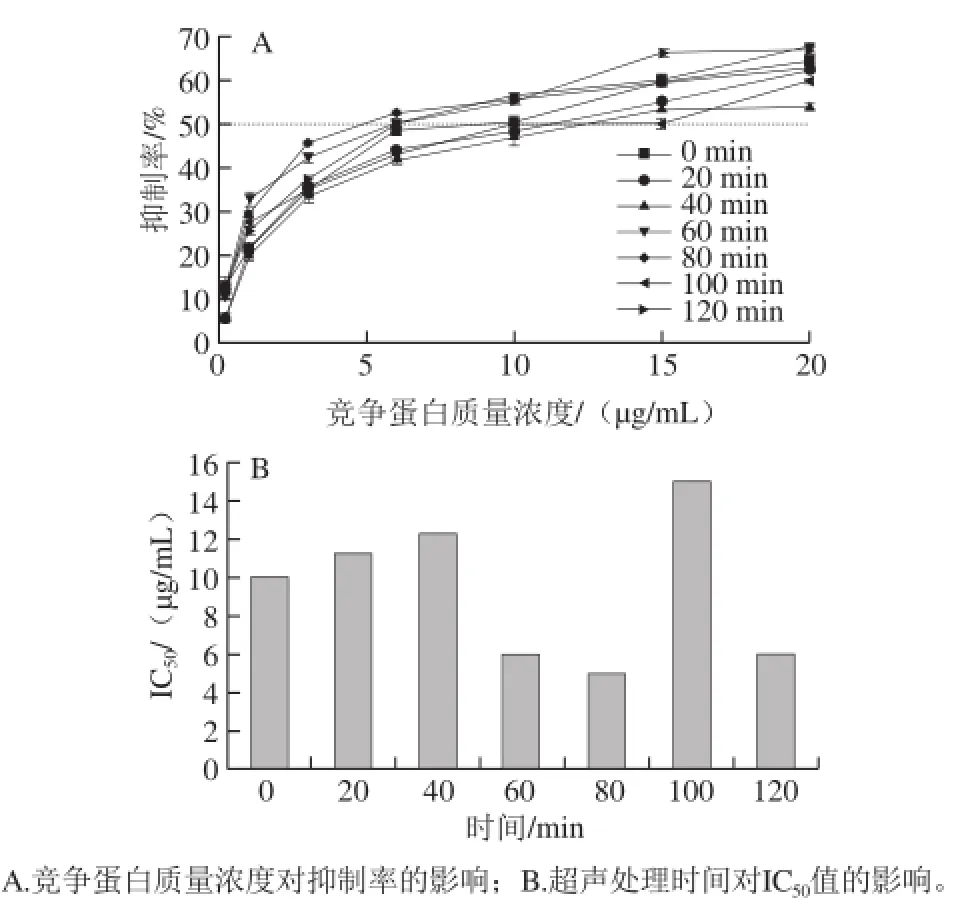
图 5 超声处理7S蛋白消化产物的IgG结合能力Fig. 5 IgG-binding capacity of digestion products of 7S globulin subjected to ultrasonic treatment
2.6 超声处理大豆7S蛋白的消化产物与IgE结合能力
通过比较不同时间超声处理后消化产物所对应的IgE抑制率来评估7S蛋白的潜在致敏性。抑制率越低,竞争抗原与过敏患者人血清的结合能力越弱,即潜在致敏性越低。实验结果如图6所示,随着7S蛋白超声处理时间的延长,其小肠消化产物的IgE抑制率总体呈现先增加后降低的趋势。与未超声处理(对照组)相比,分别经超声处理20、40 min后,7S蛋白肠消化产物的IgE抑制率有显著差异(P<0.05),40 min时,其潜在致敏性最高;延长超声时间,7S蛋白消化产物的IgE抑制率呈下降趋势,与超声处理40 min的样品相比,超声处理80 min后,其消化产物的IgE抑制率有极显著差异(P<0.01),此时,IgE抑制率达到了最低。这可能与经80 min超声作用后,大豆7S蛋白最易被十二指肠消化,导致其过敏原结构上的改变有关。
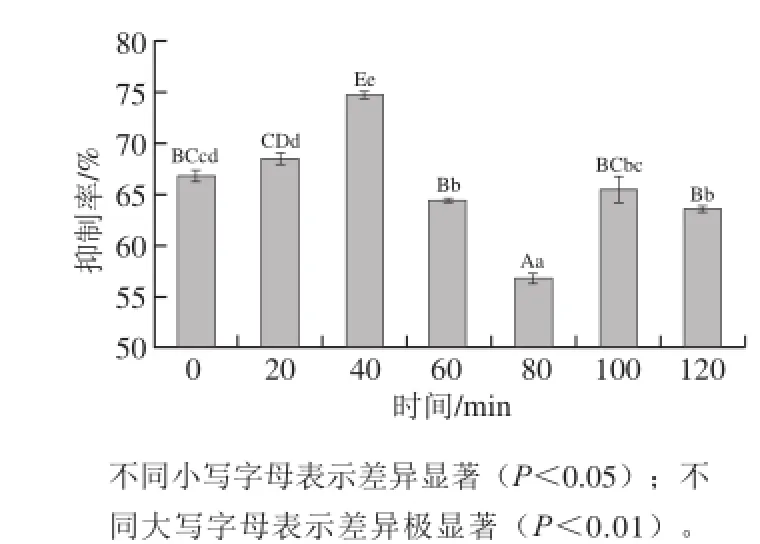
图 6 超声处理7S蛋白消化产物的IgE结合能力Fig. 6 IgE-binding capacity of digestion products of 7S globulin subjected to ultrasonic treatment
3 讨论与结论
超声已被广泛应用于食品加工中,但在食物过敏方面的研究却很少。Li Zhenxin等[12]利用超声波较全面地分析了其对虾的过敏原的影响,并取得较好的效果。Kasera[14]、Gulseren[24]等的研究结果都表明超声会影响蛋白质空间结构的改变,而食物过敏原大部分是蛋白质,因此通过超声处理改变过敏原结构,进而引起其致敏性变化的方法具有可行性。本研究首先对大豆致敏原7S蛋白进行不同时间的超声处理,测定其表面游离巯基含量的变化来分析蛋白质三级结构的改变,然后模拟人体胃肠消化,分析其消化产物致敏性的变化。
随着超声时间的延长,游离巯基的含量先升高又降低,可能是超声处理使7S蛋白结构展开,部分二硫键断裂,形成新的巯基,继续增加超声时间,巯基重新缔合形成二硫键,过敏蛋白发生进一步折叠,从而对某些过敏表位产生影响,这和孙英杰[27]的研究结果一致。国内外许多文献采用体外模拟胃肠液消化过敏原,并分析其消化产物的抗原性与致敏性变化,该方法被普遍认为是体外评估过敏原致敏性的一个重要手段[28],研究结果显示:超声处理对大豆7S蛋白在唾液和胃液中消化的影响不显著,但在十二指肠消化中,经超声处理后的蛋白可以被消化成小分子物质。在80 min时,7S蛋白消化产物的条带和灰度发生显著变化,消化程度最为显著,这可能是因为此时过敏原蛋白的三级结构展开程度最大,使更多的水解位点暴露在分子表面,促进亚基与水解酶充分接触。大豆过敏是由IgE介导的Ⅰ型超敏反应[5],而致敏原要保持完整的抗原决定簇才有致敏的可能性。从抗原性与致敏性的结果可以看出,不同超声时间处理7S蛋白消化产物都存在潜在致敏性,在超声处理时间40 min时,7S蛋白的抗原性、致敏性增强到最高点,可能与超声处理使过敏蛋白结构展开,暴露出更多IgE结合表位有关;随着超声时间的继续延长,7S蛋白的致敏性反而降低,在80 min时致敏性显著降低,这可能是由于超声处理时间的延长,使过敏蛋白结构发生折叠,从而掩埋了某些表位。过敏反应是一个十分复杂的过程,超声处理引起过敏原致敏性变化的机制还有待深入的研究。
本实验利用不同时间的超声处理对大豆7S蛋白的潜在致敏性进行研究,7S蛋白经过40 kHz、300 W超声强度加工处理80 min时,其三级结构破坏程度最大,也更易被十二指肠消化,且消化产物的潜在致敏性降至最低。
[1] YANG A, YU X W, ZHENG A, et al. Rebalance between 7S and 11S globulins in soybean seeds of differing protein content and 11SA4[J]. Food Chemistry, 2016, 210: 148-155. DOI:10.1016/ j.foodchem.2016.04.095.
[2] NISHINARI K, FANG Y, GUO S, et al. Soy proteins: a review on composition, aggregation and emulsif i cation[J]. Food Hydrocolloids, 2014, 39: 301-318. DOI:10.1016/j.foodhyd.2014.01.013.
[3] VERMA A K, KUMAR S, DAS M, et al. A comprehensive review of legume allergy[J]. Clinical Reviews in Allergy & Immunology, 2013, 45(1): 30-46. DOI:10.1007/s12016-012-8310-6.
[4] 田斌强, 邓乾春, 谢笔钧, 等. 食物过敏原与过敏性消除方法[J]. 食品科技, 2007, 32(11): 9-13. DOI:10.3969/j.issn.1005-9989.2007.11.003.
[5] WANG T, QIN G X, SUN Z W, et al. Advances of research on glycinin and β-conglycinin: a review of two major soybean allergenic proteins[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(7): 850-862. DOI:10.1080/10408398.2011.613534.
[6] KLEINE-TEBBE J, WANGORSCH A, VOGEL L, et al. Severe oral allergy syndrome and anaphylactic reactions caused by a Bet v 1- related PR-10 protein in soybean, SAM22[J]. Journal of Allergy and Clinical Immunology, 2002, 110(5): 797-804. DOI:10.1067/ mai.2002.128946.
[7] 杨慧, 陈红兵, 程伟, 等. 大豆主要过敏原及其脱敏方法的研究进展[J].食品科学, 2011, 32(21): 273-277. DOI:10.1067/mai.2002.128946.
[8] L’HOCINE L, BOYE J I. Allergenicity of soybean: new developments in identification of allergenic proteins, crossreactivities and hypoallergenization technologies[J]. Critical Reviews in Food Science and Nutrition, 2007, 47(2): 127-143. DOI:10.1080/10408390600626487.
[9] WU Y M, GUAN R X, LIU Z X, et al. Synthesis and degradation of the major allergens in developing and germinating soybean seed[J]. Journal of Integrative Plant Biology, 2012, 54(1): 4-14. DOI:10.1111/ j.1744-7909.2011.01092.x.
[10] SHRIVER S K, YANG W W. Thermal and nonthermal methods for food allergen control[J]. Food Engineering Reviews, 2011, 3(1): 26-43. DOI:10.1007/s12393-011-9033-9.
[11] 郭孝武, 冯岳松. 超声提取分离[M]. 北京: 化学工业出版社, 2008: 10-25.
[12] LI Z X, LIN H, CAO L M, et al. Effect of high intensity ultrasound on the allergenicity of shrimp[J]. Journal of Zhejiang University Science B, 2006, 7(4): 251-256. DOI:10.1631/jzus.2006.B0251.
[13] 祖琴琴, 华萍, 龚育清, 等. 基于食品物理加工技术对大豆过敏原的影响[J]. 食品工业科技, 2014, 35(5): 360-364. DOI:10.13386/ j.issn1002-0306.2014.05.064.
[14] KASERA R, SINGH A B, KUMAR R, et al. Effect of thermal processing and γ-irradiation on allergenicity of legume proteins[J]. Food and Chemical Toxicology, 2012, 50(10): 3456-3461. DOI:10.1016/j.fct.2012.07.031.
[15] YANG H, GAO J Y, YANG A S, et al. The ultrasound-treated soybean seeds improve edibility and nutritional quality of soybean sprouts[J]. Food Research International, 2015, 77: 704-710. DOI:10.1016/ j.foodres.2015.01.011.
[16] LIU C, WANG H L, CUI Z M, et al. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J]. Food Chemistry, 2007, 102(4): 1310-1316. DOI:10.1016/ j.foodchem.2006.07.017.
[17] NAGANO T, HIROTSUKA M, MORI H, et al. Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 941-944. DOI:10.1021/ jf00018a004.
[18] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical biochemistry, 1976, 72(1/2): 248-254. DOI:10.1016/0003-2697(76)90527-3.
[19] AMIGO-BENAVENT M, CLEMENTE A, FERRANTI P, et al. Digestibility and immunoreactivity of soybean β-conglycinin and its deglycosylated form[J]. Food Chemistry, 2011, 129(4): 1598-1605. DOI:10.1016/j.foodchem.2011.06.015.
[20] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. DOI:10.1016/0003-9861(59)90090-6.
[21] 袁水林, 熊鼎, 陈红兵, 等. 间接竞争 ELISA法检测牛乳中β-乳球蛋白含量的准确性评价[J]. 食品科学, 2014, 35(18): 100-104. DOI:10.7506/spkx1002-6630-201418020.
[22] KARKI B, LAMSAL B P, GREWELL D, et al. Functional properties of soy protein isolates produced from ultrasonicated defatted soy fl akes[J]. Journal of the American Oil Chemists’ Society, 2009, 86(10): 1021-1028. DOI:10.7506/spkx1002-6630-201418020.
[23] 涂宗财, 张雪春, 刘成梅, 等. 超高压微射流对花生蛋白结构的影响[J].农业工程学报, 2008, 24(9): 306-308.
[24] GULSEREN I, GUZEY D, BRUCE B D, et al. Structural and functional changes in ultrasonicated bovine serum albumin solutions[J]. Ultrason Sonochem, 2007, 14(2): 173-183. DOI:10.1016/ j.ultsonch.2005.07.006.
[25] BOWMAN C C, SELGRADE M K. Differences in allergenic potential of food extracts following oral exposure in mice reflect differences in digestibility: potential approaches to safety assessment[J]. Toxicological Sciences, 2008, 102(1): 100-109. DOI:10.1093/toxsci/ kfm288.
[26] 王翠燕, 孙璐, 周催, 等. BALB/c小鼠动物模型评价食物过敏性的可行性研究[J]. 中国食品学报, 2015, 15(11): 7-15. DOI:10.16429/ j.1009-7848.2015.11.002.
[27] 孙英杰. 超声波处理对大豆分离蛋白结构和功能性质影响研究[D].哈尔滨: 东北农业大学, 2014: 31.
[28] ASTWOOD J D, LEACH J N, FUCHS R L. Stability of food allergens to digestion in vitro[J]. Nature Biotechnology, 1996, 14(10): 1269-1273. DOI:10.1038/nbt1096-1269.
Effect of Ultrasonic Treatment on the Potential Allergenicity of Soybean 7S Globulin
DENG Han, ZU Qinqin, ZHU Jierui, YANG Anshu*, CHEN Hongbing
(State Key Laboratory of Food Science and Technology, Nanchang University, Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China)
Soybean 7S globulin was modif i ed by ultrasonic treatment, and the changes in its in vitro digestibility, and the antigenicity and potential allergenicity of its digestion products were evaluated. Results showed that the 7S globulin was resistant to saliva and gastric juice, but it was easy to be digested in the duodenum after ultrasonic processing 300 W for 80 min. The antigenicity assessed by in vitro IgG binding showed that the antigenicity of the digestion products increased fi rstly but then decreased as the ultrasonic processing time (0‒120 min) increased, reaching the lowest level at 100 min. The potential allergenicity assessed by in vitro IgE binding exhibited an initial increase followed by a decrease with ultrasonic processing time up to 120 min, reaching the lowest level at 80 min. These results suggest that soybean 7S globulin with ultrasonic processing for 80 min has a lower potential allergenicity.
soybean 7S globulin; ultrasonic; in vitro digestibility; antigenicity; potential allergenicity
10.7506/spkx1002-6630-201705006
TS214.2
A
1002-6630(2017)05-0032-06
邓涵, 祖琴琴, 朱杰瑞, 等. 超声处理对大豆7S蛋白潜在致敏性的影响[J]. 食品科学, 2017, 38(5): 32-37. DOI:10.7506/ spkx1002-6630-201705006. http://www.spkx.net.cn
DENG Han, ZU Qinqin, ZHU Jierui, et al. Effect of ultrasonic treatment on the potential allergenicity of soybean 7S globulin[J]. Food Science, 2017, 38(5): 32-37. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705006. http://www.spkx.net.cn
2016-06-30
国家高技术研究发展计划(863计划)项目(2013AA102205);国家自然科学基金地区科学基金项目(31460439);江西省科技厅对外科技合作计划项目(20142BDH80002);江西省青年科学家培养对象计划项目(20122BCB23006);江西省科技厅知识产权局项目(20143BBM26107)
邓涵(1996—),女,硕士研究生,研究方向为食品安全。E-mail:denghan1996@163.com
*通信作者:杨安树(1972—),男,教授,博士,研究方向为食品科学。E-mail:yanganshu@ncu.edu.cn
80 min具有降低大豆7S蛋白潜在致敏性的作用。
