多糖-酚酸缀合物的合成及特性研究进展
2017-03-28李金凤叶发银赵国华
李金凤,叶发银,赵国华,2*
1(西南大学 食品科学学院,重庆, 400715) 2(重庆市特色食品工程技术研究中心, 重庆, 400175)
·综述与专题评论·
多糖-酚酸缀合物的合成及特性研究进展
李金凤1,叶发银1,赵国华1,2*
1(西南大学 食品科学学院,重庆, 400715) 2(重庆市特色食品工程技术研究中心, 重庆, 400175)
多糖改性一直是食品科学的重点研究内容之一。近年来,利用生物活性物质(如抗氧化剂)对多糖进行改性备受关注,可在改善多糖理化特性的同时能赋予多糖新的生物活性。利用抗氧化性酚酸改性多糖就是其中的一个热点。文中在广泛调研文献的基础上,对多糖-酚酸缀合物的合成方法(生物合成法和化学合成法)、产物的理化性质(热稳定性、溶解性、溶液黏度、结晶性)和生物活性(抗氧化性、抑菌性、对代谢酶的影响)以及应用方面进行总结。在此基础上指出了多糖-酚酸缀合物研究中存在的问题。
酚酸;多糖;改性;缀合物;生物活性;理化性质
多糖是自然界存在的最为丰富的天然聚合物,也是食品重要的组成成分,如淀粉、膳食纤维等。多糖的理化特性对由其构成的食品的品质有重要的影响,如多糖的可消化性、水溶性、溶液粘度、成膜性以及凝胶特性等[1]。按结构决定性能的原理,多糖的这些特性本质上是由多糖的分子结构所决定的[2]。当天然多糖的某些特性不能满足特定食品生产的需要时,可通过改变多糖的结构(改性)使其具备使用的性能要求。常见的多糖改性方法包括化学改性、物理改性与生物改性。化学改性是最常见的多糖改性方式,如淀粉的羧甲基化、乙酰化、辛烯基琥珀酰化等[3]。传统的多糖改性往往利用一些常规化学试剂与多糖反应进而在多糖链中引入特定基团使其理化性能发生改变。这种方式虽然能大幅度改善多糖特定的理化
性能,但并不会赋予多糖新的生物活性。近年来,研究报道显示利用生物活性物质对多糖进行改性可在改善其理化特性的同时改善或赋予多糖生物活性,其中利用酚酸对多糖的改性(多糖-酚酸缀合物)备受关注。作为酚类化合物的一个亚类,酚酸主要存在于植物性食物中,且种类繁多,诸如没食子酸、阿魏酸、咖啡酸等。它们是天然抗氧化剂,具有清除自由基、抵抗活性氧、供电子或供氢还原能力[4]。本文对多糖-酚酸缀合物的合成方法、特性及应用进行了综述。
1 多糖-酚酸缀合物的合成方法
多糖-酚酸缀合物的合成方法主要有生物合成法和化学合成法2种。表1 给出了不同多糖-酚酸缀合物的合成方法、所用试剂、缀合化学键等信息。
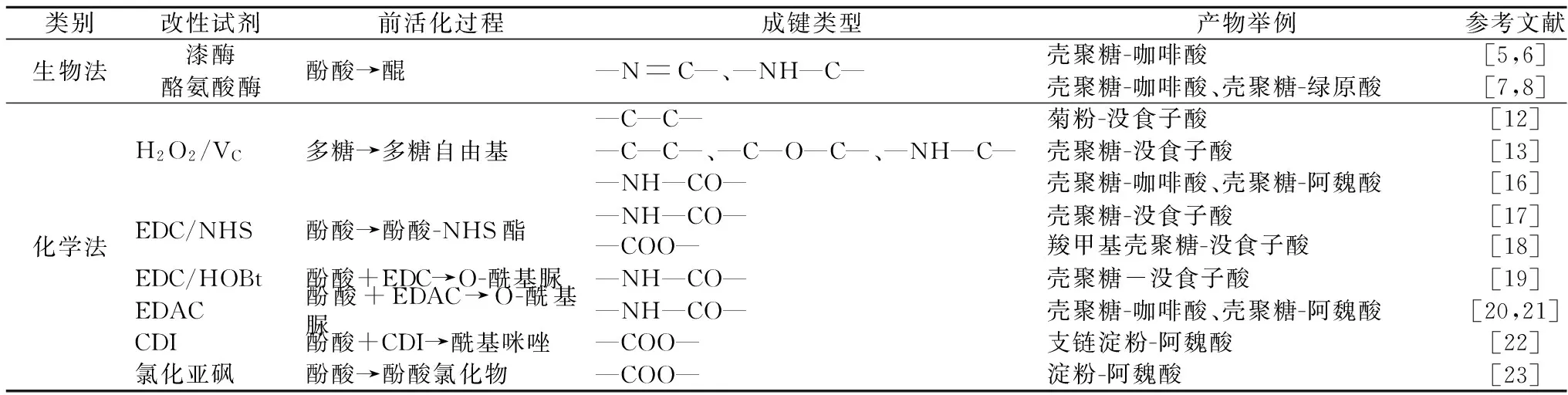
表1 多糖酚酸缀合物的合成方法
注:EDC为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐;NHS为N-羟基琥珀酰亚胺;HOBt为1-羟基苯并三唑;EDAC为1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐;CDI为N,N′-羰基二咪唑。
1.1 生物合成法
生物合成法主要用于壳聚糖-酚酸缀合物的合成。壳聚糖与酚酸的反应机理受pH影响较大,pH=6.5时,利用漆酶和酪氨酸酶对酚类化合物的催化作用将其转化为反应活性较高的醌,后者再与壳聚糖发生非酶促反应生成壳聚糖-酚酸缀合物[9],在非酶促反应阶段,活性醌的羰基与壳聚糖的氨基发生席夫碱反应(途径1),或/和活性醌苯环上非取代的碳与壳聚糖氨基发生迈克尔加成反应(途径2)[10]。pH=4.5时,氨基的质子化使壳聚糖失去亲核性,不能与亲电体反应[11],酚酸的羧基可直接与壳聚糖的羟基反应形成酯键。图1给出了pH=6.5时漆酶催化合成壳聚糖-没食子酸缀合物的反应历程。
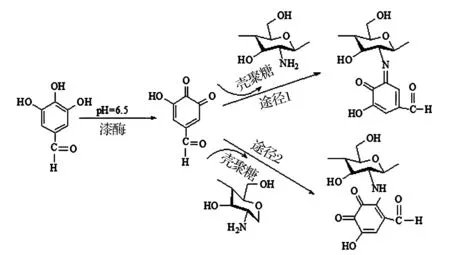
图1 壳聚糖-没食子酸缀合物的生物合成过程[6]Fig.1 Biological synthesis method of chitosan-gallic acid conjugates[6]
1.2 化学合成法
化学合成方法是利用特定的非酶催化反应使多糖与酚酸接枝,根据反应特性可分为自由基反应、酯化反应和缩合反应3种。自由基反应常以H2O2/VC体系引发·OH,可用于酚酸与壳聚糖、菊粉等多糖间缀合物的合成(图2)。该方法利用自由基体系产生的·OH夺取多糖链上—OH、—NH2或—CH2—上的H使多糖活化为多糖自由基[14]。同样,·OH可夺取酚酸苯环上羟基邻位或对位的H(如没食子酸的2和5位)形成酚酸自由基[15]。最后,酚酸自由基与多糖自由基
反应形成多糖-酚酸缀合物。但也有研究表明,酚酸可以与壳聚糖发生自由基反应而形成酰胺键[16]。
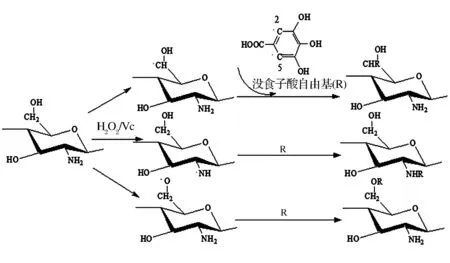
图2 自由基反应合成壳聚糖-没食子酸缀合物[13]Fig.2 Synthesis of chitosan-gallic acid conjugates by radical reaction[13]
缩合反应和酯化反应主要是利用化学试剂如1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC) 、N,N′-羰基二咪唑(CDI)、1-乙基-3-(3-二甲基胺丙基)碳化二亚胺盐酸盐(EDAC)等与酚酸反应使酚酸活化,活化后的酚酸与多糖的活性基团反应而使二者发生接枝。对壳聚糖而言,酚酸可对其糖环C-2位氨基取代形成酰胺键,也可对糖环C-3和C-6位羟基取代形成酯键[17];诸如淀粉之类的中性多糖,酚酸一般通过取代其糖环上的羟基而形成酯键[22-23]。图3为阿魏酸经不同方式活化后分别与淀粉和壳聚糖合成缀合物的反应示意图。在以EDC作为酚酸活化剂的案例中,常将其与N-羟基琥珀酰亚胺(NHS)或1-羟基苯并三唑(HOBt)联用,因为NHS可以抑制酚酸-NHS酯被水解为异脲和羧酸盐,而HOBt可减少EDC过量产生副产物N-酰基脲,从而提高反应速率[24]。
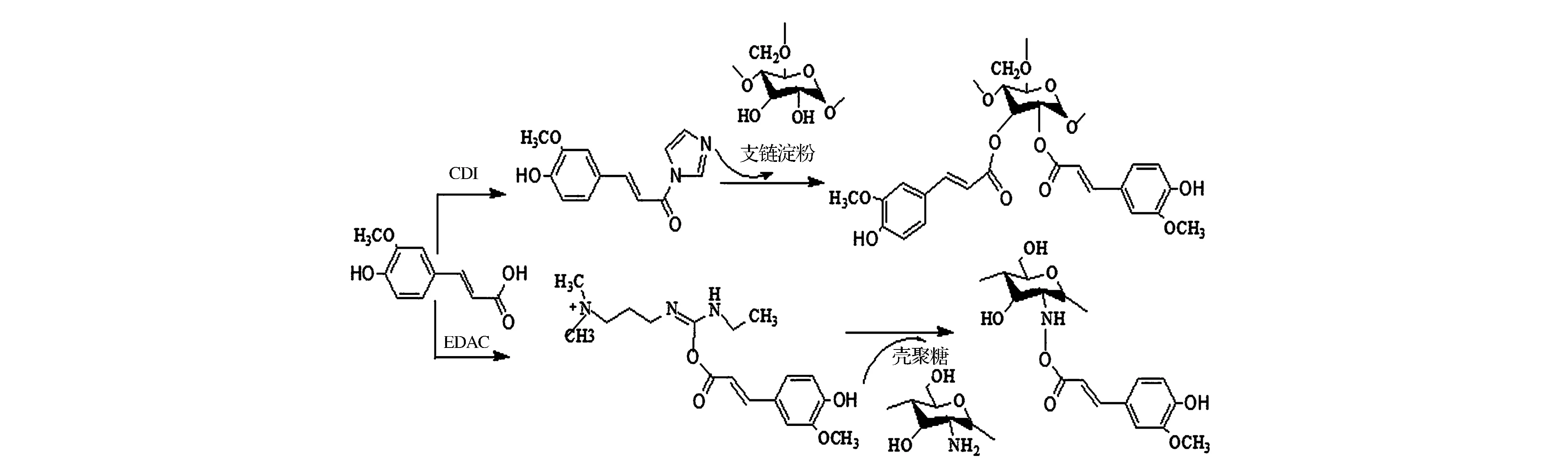
图3 缩合反应和酯化反应生成壳聚糖-阿魏酸缀合物[21]和支链淀粉-阿魏酸缀合物[22]Fig.3 Synthesis of chitosan - ferulic acid[21] and amylopectin-ferulic acid conjugates[22]conjugates by condensation reaction and esterification reaction
对比多糖-酚酸缀合物生物合成法与化学合成法,生物合成法不使用任何化学试剂,具有环保安全和副反应弱等优点,但对反应条件要求苛刻,同时反应会导致酚酸中的羟基氧化,使合成产物的抗氧化活性降低[5];相反,化学合成法的安全与环境风险较高,且具有反应剧烈、副反应不易控制等缺点,同时反应试剂、中间副产物的残留会对终产物的安全构成隐患[21]。
2 多糖-酚酸缀合物的特性
2.1 多糖-酚酸缀合物的理化特性
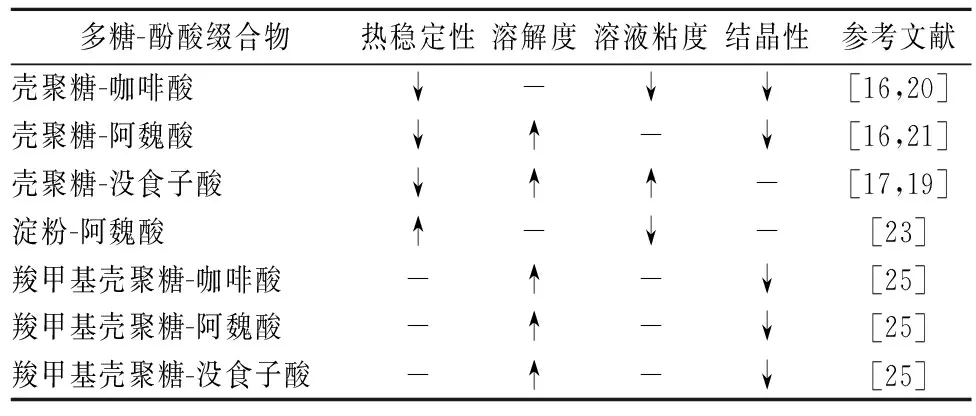
表2 多糖-酚酸缀合物理化性质的变化趋势
注:-表示文献未报道该特性,“↑”表示多糖-酚酸缀合物较原多糖在该理化性质上增强,“↓”则表示降低。
表2给出了多糖-酚酸缀合物理化性质的变化趋势,多糖-酚酸缀合物的理化特性主要包括以下4个方面:(1)热稳定性。多糖-酚酸缀合物的热稳定性与多糖和酚酸密切相关。如酚酸取代会使壳聚糖热稳定性降低[17]而却会使淀粉的热稳定性提高[23]。其热稳定性变化与酚酸种类有关,如壳聚糖-咖啡酸缀合物的热稳定性比壳聚糖-阿魏酸缀合物的高[16]。(2)溶解性。酚酸改性常使壳聚糖的水溶性显著改善而对淀粉的溶解性无显著影响。这是因为酚酸基团的导入使多糖分子之间的氢键强度降低,由于多糖链集聚使得空间位阻增大,此外酚酸基团含有众多羟基使缀合物与水的相互作用被加强[17]。(3)溶液粘度。多糖-酚酸缀合物的粘度与多糖和酚酸种类有关。如壳聚糖-没食子酸缀合物溶液粘度增加主要有两个方面的原因:一是没食子酸与壳聚糖的不同位点结合,新的结构使其具有较大的分子量,链长增长并变得更粘稠,另一方面可能是由于没食子酸氧化产生的共价交联作用[19]。(4)结晶性。酚酸缀合往往使多糖-酚酸缀合物的结晶性降低,其主要原因可能是酚酸基团与多糖链之间的聚合产生了明显的空间位阻[25]。
2.2 多糖-酚酸缀合物的抗氧化活性
大多酚酸都具有良好的抗氧化性,所以酚酸缀合往往能使多糖(如淀粉等)获得抗氧化性或使其(如壳聚糖等)抗氧化性显著增强。此外,壳聚糖-酚酸缀合物可实现双途径抗氧化,壳聚糖链可钝化金属离子而酚酸基团能快速清除自由基,且壳聚糖链的存在能使形成的酚酸自由基更加稳定[6,27]。
表3给出了相同测定方法下常见多糖及多糖-酚酸缀合物的自由基清除能力。当多糖链一定时,多糖-酚酸缀合物的抗氧化性还受以下因素控制:(1)酚酸基取代度。多糖链上酚酸基的取代度越高,产物的抗氧化性也越强[26]。(2)酚酸种类。如羧甲基壳聚糖-酚酸缀合物抗氧化性强弱酚酸顺序为,没食子酸>咖啡酸>阿魏酸。一般来说酚酸邻位或对位的羟基越多,其抗氧化性越好[28]。(3)缀合方式。在酚酸与多糖链一定的情况下(表1),可通过不同机制使二者缀合,获得的产物的抗氧化性也有较大差异。如在pH=6.5时合成的壳聚糖-没食子酸缀合物的抗氧化性与pH=4.5时要高出约35%,这主要因为是不同反应条件下形成的化学键不同[29]。
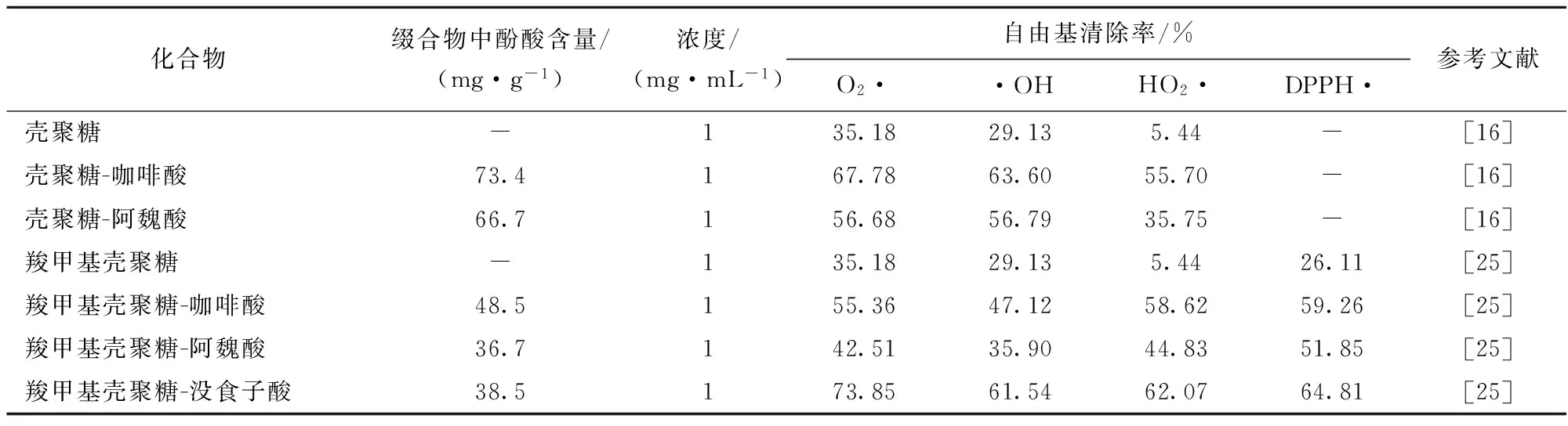
表3 多糖-酚酸缀合物的自由基清除能力
注:-表示文献未报道该特性。
2.3 壳聚糖-酚酸缀合物的抑菌活性
壳聚糖是具有抑菌活性的多糖,其通过在细菌细胞表面结合,影响细胞膜的通透性和营养能量的获得,并渗入细胞与核酸、蛋白质等带负电荷物质结合或螯合关键金属离子等途径发挥其抑菌性[30]。研究表明,壳聚糖-酚酸缀合物的抗氧化活性明显高于母体壳聚糖[31-33]。壳聚糖-酚酸缀合物的抑菌活性具有如下特点:(1)革兰氏阳性菌的抑菌效果比革兰氏阴性菌好。(2)pH对其抑菌活性有显著影响。pH=4.5时,壳聚糖-咖啡酸缀合物对细菌如大肠杆菌、单增李斯特菌的抗菌活性较高,而pH=6.5时,它对真菌的抑菌活性较高[6,33]。表4给出了几种壳聚糖-酚酸缀合物对9种细菌的最低抑菌浓度。
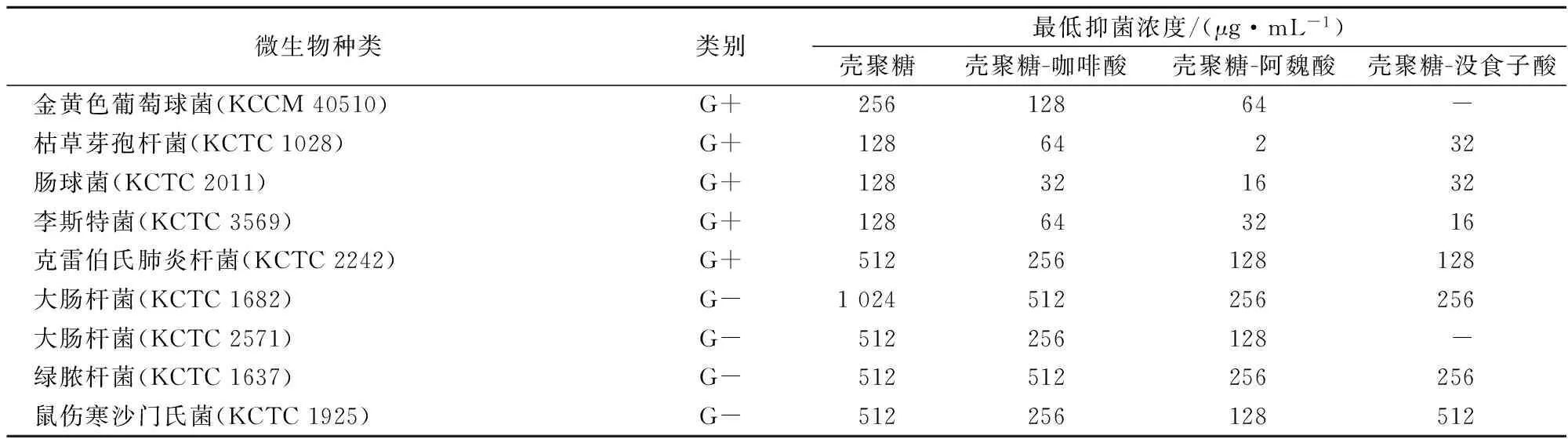
表4 壳聚糖-酚酸缀合物的抑菌活性[31-33]
注:-表示文献未报道该特性。
2.4 壳聚糖-酚酸缀合物对代谢酶的影响
壳聚糖-酚酸缀合物对代谢酶类有显著的影响。CHO等[34]和SENEVIRATHNE等[35]发现,壳聚糖-咖啡酸、壳聚糖-没食子酸缀合物可提高体内超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶的活性。一方面可能源于酚酸对抗氧化酶mRNA表达增强[36],另一方面可能与多糖的免疫活性有关[37]。壳聚糖-没食子酸缀合物可抑制α-葡萄糖苷酶和α-淀粉酶的活性[38],具有作为新型抗糖尿病药物或食品添加剂的潜能。CHO等[39]发现壳聚糖-没食子酸缀合物能够抑制乙酰胆碱酯酶的活性,可以通过提升类胆碱的传递预防阿尔茨海默病。但多糖-酚酸缀合物对代谢酶的研究大多为体外研究,动物实验或临床研究还相当缺乏。
3 多糖-酚酸缀合物的应用
如上所述,多糖-酚酸缀合物具有诸多优异性能,在食品和药物行业应用前景广阔。目前对多糖-酚酸缀合物的应用主要集中在2个方面:(1)用于食品包装材料。表5列出了壳聚糖-酚酸缀合物在食品包装方面的应用。(2)用作药物或食品功能成分的载体。羧甲基壳聚糖-没食子酸缀合物可用于抗氧化蛋白(如超氧化物歧化酶)或其他天然药物的纳米载体[18],而葡聚糖-阿魏酸缀合物的水凝胶可作为VE的载体,实现VE的控制释放[44]。

表5 壳聚糖-酚酸缀合物在食品包装方面的应用
4 结语与展望
多糖-酚酸缀合物的研究近年来取得了显著的进展,尤其在其合成、特性及应用研究等方面备受关注。综合评价当前的研究状况,多糖-酚酸缀合物的研究有待从以下几个方面加强:(1)源于壳聚糖具有较高的反应能力(氨基与羟基),目前对壳聚糖-酚酸缀合物的研究最多,对其他多糖-酚酸缀合物的报道较少,究其原因,主要是缺乏合成安全高效中性多糖-酚酸缀合物的方法。(2)多糖-酚酸缀合物是一种化学修饰产物,安全性对其应用至关重要,但现有的研究资料不多。(3)多糖-酚酸缀合物的代谢途径是阐释其生物学功效所必需的,但对此方面的研究尚缺。(4)多糖-酚酸缀合物对食品体系其他营养成分如蛋白质、维生素的影响也值得进行深入研究。
[1] KOOCHEKI A, MORTAZAVI S A, SHAHIDI F, et al. Rheological properties of mucilage extracted from Alyssum homolocarpum seed as a new source of thickening agent[J]. Journal of Food Engineering, 2009, 91(3):490-496.
[2] UHRICH K E, CANNIZZARO S M, LANGER R S, et al. Polymeric systems for controlled drug release[J]. Chemical Reviews, 1999, 99(11):3 181-3 198.
[3] KAUR B, ARIFFIN F, BHAT R, et al. Progress in starch modification in the last decade[J]. Food Hydrocolloids, 2012, 26(26):398-404.
[4] LIU J, LU J F, KAN J, et al. Synthesis, characterization andinvitroanti-diabetic activity of catechin grafted inulin[J]. International Journal of Biological Macromolecules, 2014, 64(2):76-83.
[5] ALJAWISH A, CHEVALOT I, PIFFAUT B, et al. Functionalization of chitosan by laccase-catalyzed oxidation of ferulic acid and ethyl ferulate under heterogeneous reaction conditions[J]. Carbohydrate Polymers, 2012, 87(1):537-544.
[7] LIU Y, ZHANG B, JAVVAJI V, et al. Tyrosinase-mediated grafting and crosslinking of natural phenols confers functional properties to chitosan[J]. Biochemical Engineering Journal, 2014, 89(16):21-27.
[8] KUMAR G, PAYNE G F S P J. Enzymatic grafting of a natural product onto chitosan to confer water solubility under basic conditions[J]. Biotechnology & Bioengineering, 1999, 63(2):154-165.
[9] MUZZARELLI R A A, LITTARRU G, MUZZARELLI C, et al. Selective reactivity of biochemically relevant quinones towards chitosans[J]. Carbohydrate Polymers, 2003, 53(1):109-115.
[10] SAMPAIO S, TADDEI P, MONTI P, et al. Enzymatic grafting of chitosan onto Bombyx mori silk fibroin: kinetic and IR vibrational studies[J]. Journal of Biotechnology, 2005, 116(1):21-33.
[11] OSMAN Z, AROF A K. FTIR studies of chitosan acetate based polymer electrolytes[J]. Electrochimica Acta, 2003, 48(8):993-999.
[12] ARIZMENDI-COTERO D, GMEZ-ESPINOSA R M, DUBLN G O, et al. Electron paramagnetic resonance study of hydrogen peroxide/ascorbic acid ratio as initiator redox pair in the inulin-gallic acid molecular grafting reaction[J]. Carbohydrate Polymers, 2016, 136:350-357.
[13] CURCIO M, PUOCI F, IEMMA F. Covalent insertion of antioxidant molecules on chitosan by a free radical grafting procedure[J]. Journal of Agricultural & Food Chemistry, 2009, 57(13):5 933-5 938.
[14] MUN G A, NURKEEVA Z S, DERGUNOV S A, et al. Studies on graft copolymerization of 2-hydroxyethyl acrylate onto chitosan[J]. Reactive & Functional Polymers, 2008, 68(1):389-395.
[15] UYAMA H, MARUICHI N, TONAMI H, et al. Peroxidase-catalyzed oxidative polymerization of bisphenols[J]. Biomacromolecules, 2002, 3(1):187-193.
[16] LIU J, WEN X Y, LU J F, et al. Free radical mediated grafting of chitosan with caffeic and ferulic acids: Structures and antioxidant activity[J]. International Journal of Biological Macromolecules, 2014, 65(5):97-106.
[17] PASANPHAN W, CHIRACHANCHAI S.Conjugation of gallic acid onto chitosan: An approach for green and water-based antioxidant[J]. Carbohydrate Polymers, 2008, 72:169-177.
[18] YU S H, MI F L, PANG J C, et al. Preparation and characterization of radical and pH-responsive chitosan-gallic acid conjugate drug carriers[J]. Carbohydrate Polymers, 2011, 84(2):794-802.
[19] XIE Min-hao, HU Bing, WANG Yan, et al. Grafting of gallic acid onto chitosan enhances antioxidant activities and alters rheological properties of the copolymer[J]. Journal of Agricultural & Food Chemistry, 2014, 62(37):9 128-9 136.
[20] AYTEKIN A O, MORIMURA S, KIDA K. Synthesis of chitosan-caffeic acid derivatives and evaluation of their antioxidant activities[J]. Journal of Bioscience & Bioengineering, 2011, 111(2):212-216.
[21] SAREKHA W, RANGRONG Y. Preparation, characterization and antioxidant property of water-soluble ferulic acid grafted chitosan[J]. Carbohydrate Polymers, 2013, 96(2):495-502.
[22] ZHU Jian-fei, HENG Yin-xue, ZHANG Dong-xian, et al.Synthesis and characterization of enzymatically cross-linked feruloylamylopectin for curcumin encapsulation[J]. International Journal of Biological Macromolecules, 2016,85:126-132.
[23] MATHEW S, ABRAHAM T E. Physico-chemical characterization of starch ferulates of different degrees of substitution[J]. Food Chemistry, 2007, 105(2):579-589.
[24] FANGKANGWANWONG J, AKASHI M, KIDA T, et al. One-pot synthesis in aqueous system for water-soluble chitosan-graft-poly(ethylene glycol) methyl ether[J]. Biopolymers, 2006, 82(6):580-586.
[25] LIU Jun, LU Jian-feng, KAN Juan, et al. Preparation, characterization and antioxidant activity of phenolicacids grafted carboxymethyl chitosan[J]. International Journal of Biological Macromolecules, 2013, 62 :85-93.
[26] CHO Y S, KIM S K, AHN C B, et al. Preparation, characterization, and antioxidant properties of gallic acid-grafted-chitosans[J]. Carbohydrate Polymers, 2011, 83(4):1617-1622.
[27] WANVIMOL P, BUETTNER G R, SUWABUN C. Chitosan gallate as a novel potential polysaccharide antioxidant: an EPR study[J]. Carbohydrate Research, 2010, 345(1):132-140.
[28] CHEN J H, HO C T. Antioxidant activities of caffeic acid and its related hydroxycinnamic acid compounds[J]. Journal of Agricultural and Food Chemistry,1997,45(7):2374-2378.
[30] KAMIL J Y V A, JEON Y J, SHAHIDI F. Antioxidative activity of chitosans of different viscosity in cooked comminuted flesh of herring (Clupeaharengus)[J]. Food Chemistry, 2002, 79(1):69-77.
[31] LEE D S, WOO J Y, AHN C B, et al. Chitosan-hydroxycinnamic acid conjugates: Preparation, antioxidant and antimicrobial activity[J]. Food Chemistry, 2014, 148(3):97-104.
[32] CHO Y S, LEE D S, KIM Y M, et al. Protection of hepatic cell damage and antimicrobial evaluation of chitosan-catechin conjugate[J]. Journal of the Korean Society for Applied Biological Chemistry, 2013, 56(6):701-707.
[33] DAE-SUNG L, JAE-YOUNG J. Gallic acid-grafted-chitosan inhibits foodborne pathogens by a membrane damage mechanism[J]. Journal of Agricultural & Food Chemistry, 2013, 61(26):6 574-6 579.
[34] CHO Y S, KIM S K, JE J Y. Chitosan gallate as potential antioxidant biomaterial[J]. Bioorganic & Medicinal Chemistry Letters, 2011, 21(10):3 070-3 073.
[35] SENEVIRATHNE M, JEON Y J, KIM Y T, et al. Prevention of oxidative stress in Chang liver cells by gallic acid-grafted-chitosans[J]. Carbohydrate Polymers, 2012, 87(1):876-880.
[36] ZHONG W, YAN T, LIM R, et al. Expression of superoxide dismutases, catalase, and glutathione peroxidase in glioma cells-establishment of cell lines derived from a series of solid tumors[J]. Free Radical Biology & Medicine, 1999, volume 27(12):1 334-1 345.
[37] YUAN Cheng-fu, HUANG Xiu-ning, CHENG Li, et al. Evaluation of antioxidant and immune activity of Phellinus ribis glucan in mice[J]. Food Chemistry, 2009,115:581-584.
[38] LIU Jun, LU Jian-feng, KAN Juan, et al. Synthesis of chitosan-gallic acid conjugate: Structure characterization and in vitro anti-diabetic potential[J]. International Journal of Biological Macromolecules, 2013, 62(11):321-329.
[39] CHO Y S, KIM S K, AHN C B, et al. Inhibition of acetylcholinesterase by gallic acid-grafted-chitosans[J]. Carbohydrate Polymers, 2011, 84(1):690-693.
[40] SCHREIBER S B, BOZELL J J, HAYES D G, et al. Introduction of primary antioxidant activity to chitosan for application as a multifunctional food packaging material[J]. Food Hydrocolloids, 2013, 33(2):207-214.
[41] NUNES C, ÉLIA M,NGELA C, et al. Chitosan-caffeic acid-genipin films presenting enhanced antioxidant activity and stability in acidic media[J]. Carbohydrate Polymers, 2013, 91(1):236-243.
[42] WORANUCH S, YOKSAN R, AKASHI M. Ferulic acid-coupled chitosan: Thermal stability and utilization as an antioxidant for biodegradable active packaging film[J]. Carbohydrate Polymers, 2015, 115(115):744-751.
[43] ZHAVEH S, MOHSENIFAR A, BEIKI M, et al. Encapsulation of Cuminum cyminum essential oils in chitosan-caffeic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus[J]. Industrial Crops & Products, 2015, 69(6):251-256.
[44] CASSANO R, TROMBINO S, MUZZALUPO R, et al. A novel dextran hydrogel linking trans-ferulic acid for the stabilization and transdermal delivery of vitamin E[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2009, 72(1):232-238.
Synthesis and characterization of polysaccharide-phenolic acid conjugates
LI Jin-feng1, YE Fa-yin1, ZHAO Guo-hua1,2*
1(College of Food Science, Southwest University, Chongqing 400715, China)2(Chongqing Special Food Programme and Technology Research Center, Chongqing 400715,China)
Polysaccharide modification is a key research point in food science for a long time. In recent years, polysaccharide modification with bioactive chemicals (such as antioxidants) attracted much attention. This novel modification method not only improved physicochemical properties of polysaccharide substrate but also showed its new potential of new bioactivities. Modifying polysaccharide with antioxidant phenolic acids is one of those hot topics. On the basis of extensive literature investigation, the synthesis of polysaccharide-phenolic acid conjugates (biosynthesis and chemical synthesis), their physical and chemical properties (thermal stability, solubility, solution viscosity, crystallinity), biological activities (antioxidant activity, antibacterial properties, effects on metabolic enzymes) and applications are summarized. Furthermore, future perspectives involved in polysaccharide-phenolic acid conjugates are discussed.
phenolic acid; polysaccharides; modification; conjugate; physicochemical properties; biological activity
10.13995/j.cnki.11-1802/ts.201702042
硕士研究生(赵国华教授为通讯作者,E-mail:zhaoguohua1971@163.com)。
国家自然科学基金面上项目(31371737);重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001);中国博士后科学基金面上资助(2014M552301)
2016-03-04,改回日期:2016-05-20
