外阴阴道念珠菌病病原菌对11种抗真菌药物体外敏感性分析
2017-03-28晏亮邓淑文张东兴潘炜华廖万清
晏亮 邓淑文,2 张东兴 潘炜华 廖万清
(1.上海市医学真菌分子生物学重点实验室 上海市医学真菌研究所 上海长征医院皮肤病与真菌病研究所 全军皮肤病重点实验室 海军军医大学附属长征医院皮肤科,上海 200433;2.苏州高新区人民医院检验科,苏州 215129;3.广东省梅州市人民医院皮肤科,梅州 514028)
外阴阴道念珠菌病 (vulvovaginal candidiasis,VVC)是仅次于细菌性阴道炎的第二常见的阴道感染性疾病,影响了众多女性健康[1]。本研究检测了VVC患者阴道分泌物分离的53株念珠菌对11种抗真菌药物的体外敏感性,为VVC临床用药提供信息。
1 材料和方法
1.1 菌株来源
收集上海长征医院妇科门诊2016年10月~2017年1月VVC患者阴道分泌物分离的念珠菌共53株。以近平滑念珠菌ATCC 22019和克柔念珠菌ATCC 6258作为质控菌株。
1.2 方法
真菌培养与鉴定 采用无菌棉拭子在VVC患者的阴道后穹隆处取分泌物置于无菌管内,接种于科玛嘉念珠菌显色培养基,30℃条件下培养24~48 h后初步判断菌种,初次培养分离后转种于沙氏培养基,30℃条件下培养48 h。提取菌株DNA后 (Lysis Buffer for Microorganism to Direct PCR,Takara),以NL-1 (5-GCATATCAATAAGCGGAGGAAAAG)和NL-4 (5-GGTCCGTGTTTCAAGACGG)为引物进行PCR扩增26S核糖体基因D1/D2区序列[2],PCR产物送至美吉测序公司测序,所得序列在BLAST数据库进行比对,确认菌种。
药敏方法 共检测11种药物,分别为:阿尼芬净 (Ani)、卡泊芬净 (Cas)、米卡芬净 (Mic)、两性霉素B (AmB)、5-氟胞嘧啶 (5-FC)、氟康唑 (Flu)、伊曲康唑 (Itr)、伏立康唑 (Vori)、泊沙康唑 (Posa)、艾莎康唑 (isavuconazole,Isa)、雷夫康唑 (ravuconazole,Rav)。参照美国国家临床实验室标准化委员会 (CLSI)推荐的M27-A3和M27-S4 (肉汤微量稀释法参考方案)进行药敏测定,重复3次以保证数据可靠性[3-4]。各药物的浓度范围、MIC判读时间、白念珠菌MIC解读折点见表1。泊沙康唑、艾莎康唑、雷夫康唑这三种新三唑类药物尚无明确的MIC解读折点,参照国外文献,对念珠菌MIC≤1 μg/mL定义为敏感[5-7]。
两株质控菌株对氟康唑、伊曲康唑、伏立康唑、两性霉素B、5-氟胞嘧啶、阿尼芬净、卡泊芬净、米卡芬净的MIC值均在质控范围内 (对三种新三唑类药物尚无质控范围数值)。
2 结 果
2.1 菌种鉴定
53例VVC分离培养的致病菌以白念珠菌为主,为49例 (92.4%),其次为光滑念珠菌2株 (3.8%),热带念珠菌1株 (1.9%),酿酒酵母1株 (1.9%)。
2.2 药敏结果
49株白念珠菌对11种抗真菌药物的敏感性结果见表2。
表1药物浓度范围、MIC判读时间、解读折点
Tab.1Drug concentration ranges,time of MIC reading,interpretive breakpoints

药物药物浓度范围(μg/mL)MIC判读时间白念珠菌MIC范围(μg/mL)SSDDRAni0.016⁃824h≦0.250.5≧1Cas0.016⁃824h≦0.250.5≧1Mic0.016⁃824h≦0.250.5≧1AmB0.0313⁃1624h≦1⁃a≧25⁃FC0.125⁃6448h≦48⁃16≧32Flu0.0313⁃1624h≦24≧8Itr0.0313⁃1648h≦0.1250.25⁃0.5≧1Vori0.0313⁃1648h≦0.1250.25⁃0.5≧1Posa0.0313⁃1648h≦1⁃⁃Isa0.0313⁃1648h≦1⁃⁃Rav0.0313⁃1648h≦1⁃⁃
注:a.暂无解读标准;S.敏感,SDD.剂量依赖,R.耐药
表249株白念珠菌对11种抗真菌药物的敏感性
Tab.2Antifungal susceptibility of 49Candidaalbicansisolates to 11 antifungal agents
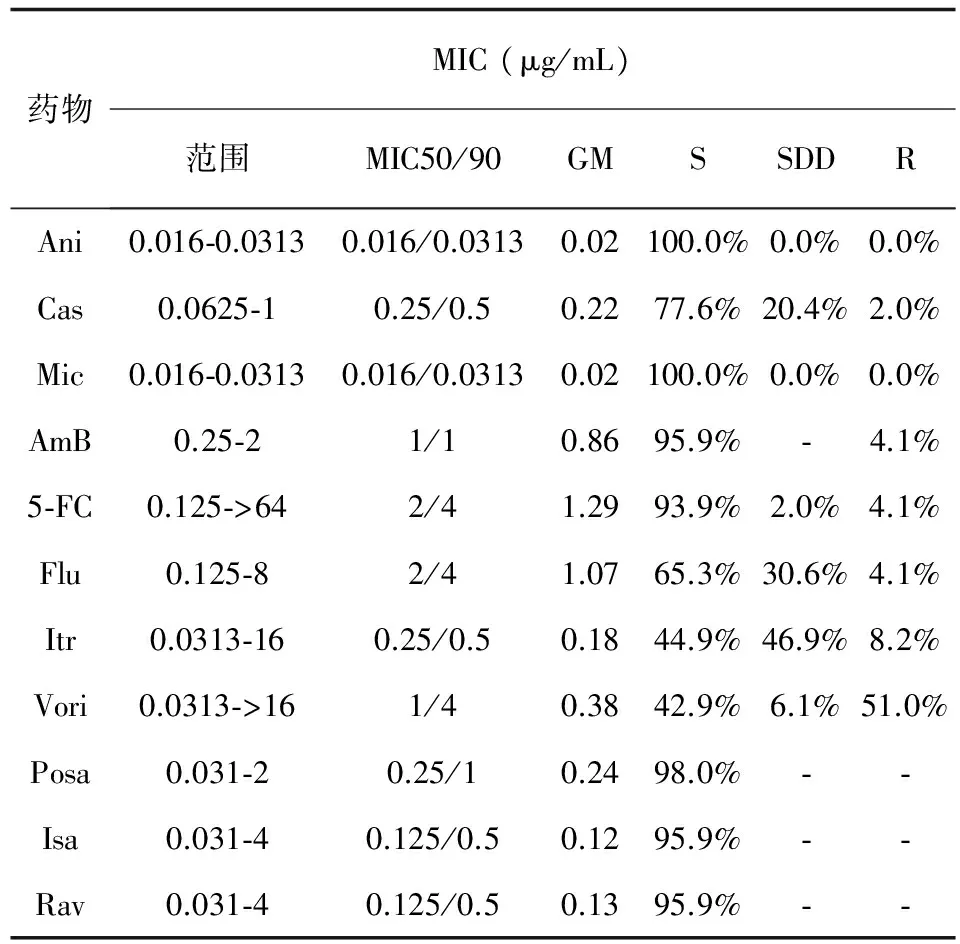
药物MIC(μg/mL)范围MIC50/90GMSSDDRAni0.016⁃0.03130.016/0.03130.02100.0%0.0%0.0%Cas0.0625⁃10.25/0.50.2277.6%20.4%2.0%Mic0.016⁃0.03130.016/0.03130.02100.0%0.0%0.0%AmB0.25⁃21/10.8695.9%⁃4.1%5⁃FC0.125⁃>642/41.2993.9%2.0%4.1%Flu0.125⁃82/41.0765.3%30.6%4.1%Itr0.0313⁃160.25/0.50.1844.9%46.9%8.2%Vori0.0313⁃>161/40.3842.9%6.1%51.0%Posa0.031⁃20.25/10.2498.0%⁃⁃Isa0.031⁃40.125/0.50.1295.9%⁃⁃Rav0.031⁃40.125/0.50.1395.9%⁃⁃
从表2中可以看出所有白念珠菌分离株对阿尼芬净和米卡芬净均敏感,绝大多数白念珠菌分离株对两性霉素B、5-FC和三种新三唑类药物敏感,大部分对卡泊芬净和氟康唑敏感;而对伊曲康唑和伏立康唑,白念珠菌分离株体外敏感性较差,敏感率小于50%。
4株非白念珠菌对11种抗真菌药物的MIC值见表3。因本研究中收集的非白念珠菌数目少,而且对各种非白念珠菌的体外药敏解读折点尚不全面,此处并未根据4株非白念珠菌对11种抗真菌药物的MIC值进行敏感性判定。
表34株非白念珠菌对11种抗真菌药物的MIC值
Tab.3MICs of 4 non-albicansCandidaspecies isolates to 11 antifungal agents

药物MIC(μg/mL)酿酒酵母(n=1)热带念珠菌(n=1)光滑念珠菌(n=2)Ani0.250.0160.1250.125Cas10.511Mic0.1250.0160.03130.016AmB0.251115⁃FC0.1250.1250.1250.125Flu10.5864Itr0.50.1250.58Vori0.250.250.1251Posa10.2512Isa0.1250.06250.251Rav0.1250.06250.1251
3 讨 论
VVC是育龄期女性的常见病,约70%~75%的妇女一生中至少有过1次VVC病史[1]。局部外用咪唑类制剂和口服氟康唑是VVC的一线治疗[8],随着OTC抗真菌药物的滥用和治疗周期的过分延长,VVC念珠菌对这些唑类耐药也时有发生,因此药敏监测对指导临床用药有重要意义。
现有的抗真菌药可分为以下5类:多烯类 (制霉菌素和两性霉素B)、唑类 (分为咪唑类和三唑类)、核苷类 (灰黄霉素、5-氟胞嘧啶)、烯丙胺类 (特比萘芬等)、棘白菌素类 (阿尼芬净、卡泊芬净和米卡芬净等)[9],而用于VVC治疗的一线抗真菌药为咪唑类 (克霉唑、咪康唑、噻康唑、布康唑、特康唑等)和氟康唑[8];制霉菌素外用制剂和伊曲康唑口服制剂在临床也较常使用;5-FC外用、两性霉素B外用、5-FC联合两性霉素B外用均有报道用于传统治疗失败的非白念珠菌引起的复杂性VVC,并有不错的疗效 (真菌学治愈率70%~100%)[10-13];棘白菌素类和泊沙康唑尚未应用在VVC的治疗上,主要应用在系统性念珠菌感染中[14],德国一研究报道了应用口服泊沙康唑结合外用环丙酮胺治疗光滑念珠菌引起的RVVC患者,15例中14例获得了临床和真菌学治愈[15]。艾莎康唑、雷夫康唑是广谱抗真菌的新三唑类药物,分别处于念珠菌病的III、II期临床试验中,在系统性念珠菌病分离的念珠菌体外药敏试验中已经证明活性良好[16-17],但尚无其对VVC分离念珠菌的体外敏感性数据。
应春妹等[18]报道在115株来源于上海三家医院VVC患者的白念珠菌对氟康唑的敏感率为83%、对伏立康唑敏感率为81%,该研究中氟康唑和伏立康唑的敏感率均明显高于本研究的结果。杨连娟等[19]报道了67株VVC分离念珠菌对伊曲康唑的敏感率为48.1%,与我们的结果类似。王东江[20]报道了59株非复发性VVC分离白念珠菌对7种抗真菌药的体外敏感性,这些白念珠菌对氟康唑、伏立康唑、5-FC、阿尼芬净、米卡芬净的敏感率与我们的结果类似,但其对伊曲康唑 (81.4%)和卡泊芬净 (100%)的敏感率则高于我们的结果。吴永琴等[21]报道了93 株VVC分离的白念珠菌对氟康唑、伊曲康唑、伏立康唑、5-FC、两性霉素B的耐药率分别为6.5%、24.5%、2.2%、2.2%、0%,氟康唑、伊曲康唑、5-FC、两性霉素B的耐药率与本研究差异不大,但对伏立康唑的耐药率明显低于本研究 (伏立康唑的耐药率为51.0%),这明显的差异可能与两个研究应用的伏立康唑解读折点不同有关 (本研究:MIC≥1 μg/mL判定为耐药,吴永琴等人的研究:MIC≥4 μg/mL判定为耐药)。
我们的研究中,95%以上的白念珠菌分离株对3个新三唑类药物敏感,4株非白念珠菌对这三个药物的MIC值基本也≤1 μg/mL,这提示泊沙康唑、艾莎康唑、雷夫康唑对VVC分离念珠菌体外活性良好,有潜力日后应用在VVC的治疗上,尤其是复杂性VVC。
本研究中VVC分离念珠菌对唑类、卡泊芬净、5-FC、两性霉素B有一定的耐药性,因此,在临床工作中,应重视VVC的病原菌鉴定及药敏分析,尤其是复杂性VVC,这对指导抗真菌药物的选择、提高治愈率有十分重要的意义。
[1] Sobel JD.Vulvovaginal candidosis[J].The Lancet,2007,369(9577):1961-1971.
[2] Kurtzman C,Robnett C.Identification of clinically important ascomycetous yeasts based on nucleotide divergence in the 5'end of the large-subunit (26S) ribosomal DNA gene[J].J Clin Microbiol,1997,35(5):1216-1223.
[3] CLSI.Reference method for broth dilution antifungal susceptibility testing of yeasts;approved standard;CLSI document M27-A3[S].2008.
[4] CLSI.Reference method for broth dilution antifungal susceptibility testing of yeasts;Fourth informational supplement (M27-S4)[S].2012.
[5] Pfaller M,Messer S,Boyken L,et al.Cross-resistance between fluconazole and ravuconazole and the use of fluconazole as a surrogate marker to predict susceptibility and resistance to ravuconazole among 12,796 clinical isolates ofCandidaspp[J].J Clin Microbiol,2004,42(7):3137-3141.
[6] Guinea J,Peláez T,Recio S,et al.Invitroantifungal activities of isavuconazole (BAL4815),voriconazole,and fluconazole against 1,007 isolates ofZygomycete,Candida,Aspergillus,Fusarium,andScedosporiumspecies[J].Antimicrob Agents Ch,2008,52(4):1396-1400.
[7] Marcos-Arias C,Eraso E,Madariaga L,et al.Invitroactivities of new triazole antifungal agents,posaconazole and voriconazole,against oralCandidaisolates from patients suffering from denture stomatitis[J].Mycopathologia,2012,173(1):35-46.
[8] Workowski KA,Bolan GA.Sexually transmitted diseases treatment guidelines (2015)[J].Reproductive Endocrinology,2015,(24):51-56.
[9] 魏文华,曲秀君,胡欣,等.抗真菌药物研究进展[J].中国现代药物应用,2012,6(23):111-112.
[10] Sobel JD,Chaim W,Nagappan V,et al.Treatment of vaginitis caused byCandidaglabrata:use of topical boric acid and flucytosine[J].Am J Obstet Gynecol,2003,189(5):1297-1300.
[11] Phillips AJ.Treatment of non-albicansCandidavaginitis with amphotericin B vaginal suppositories[J].Am J Obstet Gynecol,2005,192(6):2009-2012.
[12] White D,Habib A,Vanthuyne A,et al.Combined topical flucytosine and amphotericin B for refractory vaginalCandidaglabratainfections[J].Sex Transm Infect,2001,77(3):212-213.
[13] Hetticarachchi N,Ashbee HR,Wilson JD.Prevalence and management of non-albicans vaginal candidiasis[J].Sex Transm Infect,2010,86(2):99-100.
[14] das Neves J,Pinto E,Teixeira B,et al.Local treatment of vulvovaginal candidosis[J].Drugs,2008,68(13):1787-1802.
[15] Tietz H-J.Treatment of chronic vulvovaginal candidiasis with posaconazole and ciclopiroxolamine[J].Health,2010,2(06):513.
[16] Seifert H,Aurbach U,Stefanik D,et al.Invitroactivities of isavuconazole and other antifungal agents againstCandidabloodstream isolates[J].Antimicrob Agents Ch,2007,51(5):1818-1821.
[17] Pfaller M,Messer S,Hollis R,et al.Invitroactivities of ravuconazole and voriconazole compared with those of four approved systemic antifungal agents against 6,970 clinical isolates ofCandidaspp[J].Antimicrob Agents Ch,2002,46(6):1723-1727.
[18] Ying C,Zhang H,Tang Z,et al.Antifungal susceptibility and molecular typing of 115Candidaalbicansisolates obtained from vulvovaginal candidiasis patients in 3 Shanghai maternity hospitals[J].Sabouraudia,2015,54(4):394-399.
[19] 杨连娟,高志琴,顾伟鸣,等.67例阴道念珠菌病临床分析及药敏试验[J].中国真菌学杂志,2008,(06):346-348.
[20] 王东江,郭建,周爱萍,等.外阴阴道念珠菌病病原谱及抗真菌药物敏感性特征[J].检验医学,2016,(09):750-754.
[21] 吴永琴,王志恒,高晶,等.外阴阴道念珠菌病患者耐氟康唑白念珠菌克隆流行分析[J].中国感染与化疗杂志,2017,(03):321-325.
