木犀草苷对HUVECs抗氧化损伤保护作用研究
2017-03-28孙超董坤马英丽
孙超,董坤,马英丽
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
木犀草苷对HUVECs抗氧化损伤保护作用研究
孙超,董坤,马英丽*
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
目的:采用过氧化氢(H2O2)体外诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤,构建HUVECs氧化损伤模型,观察蓬子菜中木犀草苷对损伤HUVECs的保护及损伤修复作用,并初步探讨其作用机制。方法:采用体外培养HUVECs,取对数期的细胞调整细胞密度为5×103/mL,置培养箱中培养至细胞增殖到80%左右时,将细胞随机分为5组:空白组、模型组(仅加入浓度为200 μmol/L的H2O2培养2 h),给药保护组(质量浓度分别为6.25、12.5、25 mg/L的木犀草苷培养24 h,之后加入浓度为200 μmol/L的H2O2培养2 h),每组设6个复孔。采用CCK8法检测细胞增殖抑制率,荧光分光光度法测定超氧化物歧化酶(SOD),谷胱甘肽(GSH-Px)的活性以及丙二醛(MDA)的含量;采用紫外分光光度法测定乳酸脱氢酶(LDH)的释放。Hoechst33328荧光染色观察木犀草苷对过氧化氢诱导的脐静脉内皮细胞损伤的影响。结果:与正常组比较,模型组培养液中LDH含量明显增加;SOD,GSH-Px活性降低,MDA含量明显升高(P均<0.01)。与模型组比较,给药各剂量组(6.25、12.5、25 mg/L)都能显著提高H2O2损伤的细胞的存活率,明显抑制HUVECs的LDH的释放,显著减少HUVECs的MDA的含量,提高SOD的活性。结论:蓬子菜木犀草苷对氧化损伤的HUVECs具有保护及修复作用。
蓬子菜;木犀草苷;氧化损伤
血管疾病的临床学研究发现,血管内皮细胞作为细胞与血液的屏障不仅具分泌的功能,还参与血管生理学功能的调节。血管内皮细胞的损伤是引起多种血管疾病(如心脑血管疾病,静脉血栓等)的重要原因之一[1]。氧化应激产生的活性氧被认为是导致血管内皮细胞损伤的主要因素,因此抗氧化损伤方面的研究对治疗心,脑血管疾病具有重要的意义[2-3]。在木犀草苷的研究过程中发现,木犀草苷有直接清除活性氧自由基的作用,能提高体内抗氧化酶的活性,降低过氧化物质生成[4],临床上应用木犀草苷治疗下肢静脉血栓取得了良好的疗效[5]。本实验通过体外建立过氧化氢损伤模型,探讨木犀草苷对HUVECs的保护、损伤及修复的作用机理。
1 材料与仪器
1.1 材料
木犀草苷(本实验室自提分离得到);人脐静脉内皮细胞(哈尔滨医科大学实验室提供);RPMI 1640培养基(Life Technologies Corporation);胰酶细胞消化液(碧云天生物技术研究所);CCK-8细胞增殖-毒性检测试剂盒(日本同仁化学研究所);PBS(北京中杉金桥生物技术有限公司);丙二醛MDA试剂盒、超氧化物歧化酶SOD试剂盒、乳酸脱氢酶LDH试剂盒、谷胱甘肽-过氧化物酶GSH-Px(南京建成生物工程研究所)。
1.2 仪器
超净工作台BSC-1300IIB2(苏州安泰空气技术有限公司);CO2恒温培养箱(Heal Force,HF90);倒置显微镜(日本奥林巴斯公司,CKX41);电热恒温水浴锅(HHS,上海博迅实业有限公司医疗设备厂);多功能酶标仪(美国伯腾仪器有限公司,Synergy 2);套筒式微量冷冻离心机(天美科学仪器有限公司,MX-307);微孔滤膜(0.22 μm,AMRESCO公司)。
2 实验方法
2.1 CCK8酶标法检测不同浓度木犀草苷对HUVECs生长的影响
实验分为正常对照组,不同浓度木犀草苷处理组(3.25、6.25、12.5、25、50、100 mg/L)。取对数期HUVECs,用胰酶消化后并吹打均匀以3×104每孔接种于96孔板中,于37°C、5%CO2培养箱中培养过夜;用含10%牛血的1640培养液稀释木犀草苷原液配成浓度3.25、6.25、12.5、25、50、100 mg/L工作液;将不同浓度的木犀草苷工作液加入96孔板中,继续培养24 h;弃掉上清液,每孔加入20 μl CCK-8放回培养箱继续培养30 min,酶标仪450 nm处检测。
2.2 HUVECs氧化损伤模型的建立
人脐静脉内皮细胞以3×103/ml接种于96孔板,实验分为空白对照组、过氧化氢损伤组(100、200、400、800 μmol/L)。每组设6个副孔。空白对照组每孔加入200μl无血清的1640培养液;过氧化氢各损伤组加入200μl无血清培养液配制的终浓度为100、200、400、800 μmol/L的H202;分别培养1 h、2 h、6 h、12 h、24 h后,吸弃旧培养基,每孔加入20 μl CCK-8(mg/mL),置于孵箱中孵育30 min,于酶标仪450 nm处读取吸光度值,计算过氧化氢对细胞的抑制率。通过对细胞抑制率的计算从而确定过氧化氢损伤模型的最适条件。
抑制率(%)=1-[各组吸光度值(A)/空白组吸光度值(A)]×100%
2.3 木犀草苷预处理对过氧化氢诱导脐静脉内皮细胞活力值的影响
取对数生长期的细胞,调整细胞密度为每孔3× 103个接种于96孔板,放置培养箱培养24 h。实验分组为空白组,模型组和给药组(6.25、12.5、25 mg/L)在给药24 h之后,加入浓度为200 μmol/L的 H2O2培养1 h。去除培养板中上清液,每孔分别加入20 μl CCK-8试剂,放置培养箱培养30 min,使用酶标仪在450 nm处检测其OD值。
2.4 测定HUVECs中的SOD活性GSH-Px的活性
取对数生长期的细胞,调整密度为每孔3×103个接入96孔板中,贴壁培养24 h。实验设空白组,模型组,给药组(6.25、12.5、25 mg/L)每组设6个副孔,给药24 h后,按H2O2损伤浓度为200 μmol/L损伤2 h,按照SOD和MDA试剂盒说明书,利用酶标仪分别检测SOD的活力和MDA的分泌水平。
2.5 测定脐静脉内皮细胞(HUVECs)中MDA和上清液中LDH的释放量
同“2.4”项处理相同后,按试剂盒说明书的要求操作,最后利用酶标仪分别对细胞内的GSH-Px和上清液中的LDH进行测定。
2.6 Hoechst33328染色观察细胞形态学变化
实验开始之前,提前将盖玻片放在70%乙醇中提前浸泡一段时间,无菌超净台上吹干后用PBS反复清洗3次。将处理过的盖玻片放入6孔板内,每孔可平行放入3个盖玻片,接入密度为5×105个/mL的内皮细胞,酒精消毒后放置培养箱中培养过夜。吸出培养液加入含有木犀草苷(6.25、12.5、25 mg/L)的1640培养基继续培养。待细胞增殖至80%左右时,采用含有过氧化氢的1640培养基刺激细胞发生凋亡。用移液枪吸尽培养液,每块盖玻片上滴入一滴固定液固定15 min。吸除固定液,用 PBS反复清洗3遍,每次2 min(洗涤时用手动摇晃数次)。加入0.5 mL Hoeehst33258染色液染色,避光染色10 min(染色时也应手动摇晃数次)染色后吸除染色液,用PBS清洗3次,每次2 min。在载玻片上滴一滴封片液荧光淬灭,将含有染好颜色细胞的盖玻片盖在载玻片上。(尽量避免气泡生成)调整荧光显微镜,采用CCD数码相机照相,采用图像分析处理软件NIS-Element:BR3.0处理。
3 结果
3.1 不同浓度木犀草苷对HUVECs生长的影响
结果见表1,与正常组比较,3.125、6.25、12.5、25、50、100、200、400 mg/L作用细胞24 h,其中6.25、12.5、25 mg/L作用后的细胞活力值明显上升,3.25 mg/mL作用细胞后未见明显提高,50、100、200 mg/L作用细胞后呈现抑制细胞增殖的趋势,当给药浓度为400 mg/L时,与空白组比,细胞活力值明显降低,表明高浓度木犀草苷抑制细胞的生长。结合实验操作及临床应用药物适用范围,后续试验选用药物浓度为6.25、12.5、25 mg/L。
表1 不同浓度Luteoloside对HUVECs活力值的影响(±s)

表1 不同浓度Luteoloside对HUVECs活力值的影响(±s)
C(μg/mL) Time(h) OD Proliferation(%) 0 24 1.126±0.003 100 3.125 24 1.114±0.015 101.33 6.25 24 1.159±0.001 102.93 12.5 24 1.163±0.055 103.29 25 24 1.180±0.052 104.80 50 24 1.118±0.052 99.29 100 24 1.061±0.058 94.23 200 24 1.052±0.036 93.43 400 24 0.858±0.036 76.20
3.2 HUVECs氧化损伤模型的建立
CK-8检测结果显示,随着过氧化氢浓度的升高,脐静脉内皮细胞(HUVECs)抑制率逐渐升高(表2)。当过氧化氢浓度为200 μmol/L,作用时间2 h时,细胞抑制率为51.29%,过氧化氢浓度为400 μmol/L时,细胞抑制率为 72.13%。当过氧化氢浓度达到 800μmol/L时,细胞抑制率可达到92.77%。随着作用时间的延长,细胞抑制率明显增高,当作用时间为12 h时,过氧化氢损伤浓度为200 μmol/L时,细胞抑制率为 94.58%、浓度为 400 μmol/L时,抑制率为96.59%、浓度为800 μmol/L时,抑制率为98.17%,即细胞趋于全部死亡。因此过氧化氢浓度为200 μmol/L,作用2 h时,抑制率为50%作用为理想造模条件。
表2 Influence of H2O2on HUVECs(n=6,±s)

表2 Influence of H2O2on HUVECs(n=6,±s)
浓度(μmol/L)1 h 2 h 6 h 12 h 24 h 100 25.15 37.73 45.54 52.83 66.02 200 40.15 51.29 78.99 94.58 95.52 400 60.15 72.13 95.65 96.59 98.29 800 85.70 92.77 95.71 98.17 99.52
3.3 木犀草苷预处理对过氧化氢诱导脐静脉内皮细胞活力值的影响
结果见表3,CCK-8检测结果显示:Luteoloside预处理组细胞活力值均高于过氧化氢模型组(P<0.05),其中Luteoloside(6.25、12.5、25 μg/mL)三个浓度组对过氧化氢诱导的HUVECs增殖作用显著(P<0.01),并随着给药浓度的增大,对过氧化氢诱导的细胞活力值下降具有明显的上调作用。木犀草苷高剂量组(50、100 μg/mL)细胞活力值也高于模型组,但其差异微弱,不具有统计学意义(P>0.05)。在预处理12~72 h不同条件下,给药组对过氧化氢诱导的细胞活力值下降都具有上调趋势,其作用显著(P<0.01),但不同时间的条件没有显著性差异(P>0.05),因此在后续的实验研究中选择药物作用时间为24 h。
表3 不同浓度的Luteoloside对氧化损伤的HUVECs增值的作用(±s)

表3 不同浓度的Luteoloside对氧化损伤的HUVECs增值的作用(±s)
注:与H2O2组比较,*P<0.05,**P<0.01;与Control比较,△P<0.05,△△P<0.01。
组别 OD Inhibitory rate(%) Control 2.188±0.063 0 H2O2组 1.370±0.024△△46.21 Luteoloside(3.125 ug/mL)+H2O 1.499±0.008**39.20 Luteoloside(6.25 ug/mL)+H2O21.581±0.009**34.33 Luteoloside(12.5 ug/mL)+H2O21.599±0.038**33.31 Luteoloside(25 ug/mL)+H2O21.679±0.039**28.79 Luteoloside(50 ug/mL)+H2O21.496±0.012**39.14 Luteoloside(100 ug/mL)+H2O21.452±0.021*41.63
3.4 木犀草苷对HUVECs中的SOD活性及GSH-Px活性的影响
结果见图1~2。木犀草苷各药物浓度组和空白组的SOD、GSH-Px活性明显高于过氧化氢损伤组(P<0.01);随着药物浓度的增加,SOD活性有逐渐升高的趋势,药物组之间两两比较,木犀草苷低浓度组与中浓度组比较,中浓度组与高浓度组比较差异无统计学意义(P>0.05),低浓度组与高浓度组比较差异显著(P<0.01)。

图1 Luteoloside对氧化损伤HUVEC细胞培养液中SOD活性的影响(±s)

图2 Luteoloside对氧化损伤HUVEC细胞培养液中GSH-Px活性的影响(±s)
3.5 木犀草苷对受损HUVECs中MDA和LDH含量的影响
结果见图3~4。与空白组比较,模型组细胞上清液中MDA含量明显高于空白对照组(P<0.01)。与模型组比较,药物组中MDA的含量明显低于模型组(P<0.01),Luteoloside能明显降低细胞培养液中MDA的含量(P<0.01),并随着给药浓度的增高,抑制脂质过氧化产物(MDA)合成的能力逐渐增强。给药物组各个浓度组间比较,其差异均有统计学意义(P<0.01)。

图3 Luteoloside对氧化损伤HUVEC细胞培养液中MDA含量的影响(±s)
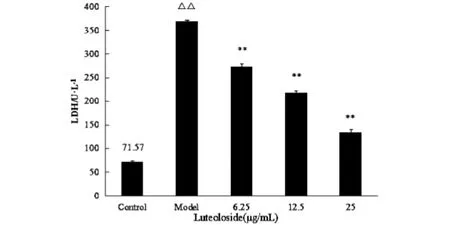
图4 Luteoloside对氧化损伤HUVEC细胞上清液中LDH含量的影响(±s)
3.6 各组荧光显微镜结果
结果如图5所示:在荧光显微镜下观察,空白组细胞形态正常,结构完整,细胞与细胞之间排列紧凑,分布均匀,染色均匀且程度较浅,在视野中呈现浅蓝色染核形态。与空白组比较,模型组细胞体积明显缩小,细胞核会呈碎块状致密浓染,颜色有些发白部分细胞呈亮蓝色浓染并有荧光小体产生。与模型组相比,木犀草苷保护组荧光小体较少,细胞结构比较正常,排列比较紧凑,细胞核染色呈浅蓝色染核形态,凋亡细胞伴随的细胞质染色即荧光小体随着给药浓度的增高,荧光小体逐渐减少,浓染细胞数量呈递减趋势,表明木犀草苷具有抑制过氧化氢诱导的脐静脉内皮细胞凋亡的作用。

图5 各组荧光显微镜结果
4 讨论
蓬子菜资源丰富,民间药用广泛且药用史长,其主要的化学成分为黄酮类、蒽醌类、环烯醚萜类、具有保护心脑血管、抗炎、抗血栓、止血、消肿、抗肿瘤、抗氧化等多种生物活性[6-10]。木犀草苷(luteoloside)即木犀草素-7-O-葡萄糖苷(luteolin-7-O-glucoside),为黄酮类化合物,是一种广谱、有效的抗氧化剂,其结构中含有多个酚羟基,可与氧自由基反应生成共振稳定的半醌式自由基结构,阻断自由基链式反应,并通过单电子转移方式清除体内的自由基,提高抗氧化酶的活性,还原氧化物质,发挥其抗氧化的作用。本次试验对超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性、丙二醛(MDA)及乳酸脱氢酶(LDH)的含量进行测定。实验结果表明,与空白组比较,过氧化氢损伤模型组中SOD及GSH-Px活性显著降低(P<0.01),而 MDA及上清液中的 LDH显著增加(P<0.01);与模型组比较,木犀草苷预处理各组SOD及GSH-Px活性明显增高,而MDA和LDH含量显著降低(P<0.01)。表明木犀草苷具有提高HUVEC细胞抗氧化能力,减轻由自由基攻击细胞膜引起的脂质过氧化损伤,减轻过氧化氢损伤HUVEC细胞程度。综上所述木犀草苷可能具有升高氧化损伤的HUVECs中SOD、GSH-Px活性及降低MDA和LDH含量,对由过氧化氢造成的HUVECs氧化损伤具有保护作用。
[1]Wang YK.Cureuligoside attenuates human umbilical vein endothelial cell injury by H2O2[J].J Ethnopharmacol,2010,132:233-239.
[2]Griendling KK,FitzGerald GA.Oxidative stress and cardiovascular injury.PartⅡ[J].Animal and human studies Circ,2003,108:2034-2040.
[3]Griendling KK,FitzGerald GA.Oxidative stress and cardiovascular injury.Part I.Basic mechanisms and in vivo monitoring of ROS[J].Circulation,2003,108,1912-1916.
[4]周玲,解砚英,李杰,等.木犀草素-7-O-葡萄糖苷对缺血缺氧培养乳鼠心肌细胞的保护作用[J].中药新药与临床药理,2008,19(4):259-261.
[5]赵刚,吴明远,田旭升,等.蓬子菜冲剂对降钙素基因相关肽和肾上腺髓质水平的影响[J].中国中西医结合外科杂志,2007,13 (1):66-68.
[6]董坤,寇韩旭,宁馨,等.蓬子菜中香叶木苷对急性血瘀及血管内皮功能影响的实验研究[J].中医药信息,2015,32(6):20-22.
[7]苑海刚,薛凤,赵钢.蓬子菜水溶液对糖尿病患者皮肤溃疡的临床疗效观察[J].中医药信息,2016,33(2):87-89.
[8]朱华,梁东艳,廖月葵,等.总黄酮化合物药理作用研究进展[J].广西中医药,2003,7(20):3-5.
[9]寇韩旭,董坤,宁馨,等.蓬子菜总黄酮对急性血瘀大鼠血液流变学影响及作用机制的研究[J].中医药学报,2015,43(1):11-15.
[10]苑海刚,薛凤,赵钢.蓬子菜水溶液对大鼠皮肤溃疡创面修复影响的实验研究[J].中医药学报,2016,44(2):40-42.
R28
A
1002-2406(2017)02-0005-04
国家自然科学基金项目(No.201281274034);教学部博士点博导类基金资助项目(No.20112327110006)
孙超(1989-),男,硕士研究生,主要研究方向:中药及复方药效物质基础。
马英丽*(1954-),女,教授,博士研究生导师,主要研究方向:中药及复方药效物质基础和质量标准化研究。
2016-05-20
修回日期:2016-06-01
