总评“归一值”优选陕产延胡索产地加工工艺
2017-03-28宋艺君郭涛王昌利孙静张伟
宋艺君,郭涛,王昌利*,孙静,张伟
(1.陕西中医药大学药学院,陕西 咸阳 712046;2.解放军第451医院,陕西 西安 710054)
质量工艺
总评“归一值”优选陕产延胡索产地加工工艺
宋艺君1,郭涛2,王昌利1*,孙静1,张伟1
(1.陕西中医药大学药学院,陕西 咸阳 712046;2.解放军第451医院,陕西 西安 710054)
目的:优选陕产延胡索产地加工工艺。方法:对新鲜延胡索大小分档,进行蒸后切片、煮后切片、微波后切片、直接切片及传统法等产地加工处理,测定不同处理方法对浸出物含量、有效成分含量的影响,并优选最佳产地加工工艺。结果:微波后切片法总生物碱、延胡索乙素及原阿片碱含量均优于煮后切片法、蒸后切片法、直接切片法和传统加工法,而水溶性和醇溶性浸出物含量无明显差异。结论:研究为陕产延胡索初加工技术提供科学依据,为其产地加工炮制一体化建立基础。
延胡索乙素;原阿片碱;产地加工;延胡索;微波法
延胡索为罂粟科植物延胡索(Corydalis yanhusuo W.T.Wang)的干燥块茎,产于浙江、陕西、安徽等地,近年来,陕西发展成为延胡索的主产区,已占到全国总产量的70%[1]。由于延胡索药材自身的性质,经采挖后,易发霉变质,因此药材在炮制前应先进行产地加工。文献多报道有关浙产延胡索的产地加工研究[2-5],而陕产延胡索产地加工的系统研究笔者未见报道。且陕产延胡索产地加工无统一的操作标准,导致加工后饮片质量差异较大。因而本实验通过浸出物、总生物碱、延胡索乙素和原阿片碱等不同考察指标,比较了煮后切片法和直接切片法、传统法、蒸后切片法及微波后切片法等产地加工方法的差异,优选出最佳的产地加工方法,为延胡索产地加工炮制一体化建立基础。
1 仪器与试药
U3000高效液相分析仪(赛默飞世尔科技公司);岛津UV-2550紫外可见分光光度仪(岛津公司); ST-803中药材切片机(瑞安市赛特机电有限公司)。
延胡索乙素对照品(批号110726-201516)、原阿片碱对照品(批号110853-201404)均购于中国食品药品检定研究所;乙腈、甲醇为色谱纯;其余试剂为分析纯。
延胡索新鲜药材采自陕西城固县,经陕西中医药大学药学院胡本祥教授鉴定为罂粟科植物延胡索(Corydalis yanhusuo W.T.Wang)的新鲜块茎。
2 方法与结果
2.1 不同产地加工方法延胡索饮片的制备
将延胡索鲜品除去须根、泥沙杂质、洗净后摊开沥干水分,大小分档,分别按表1加工方法加工处理。
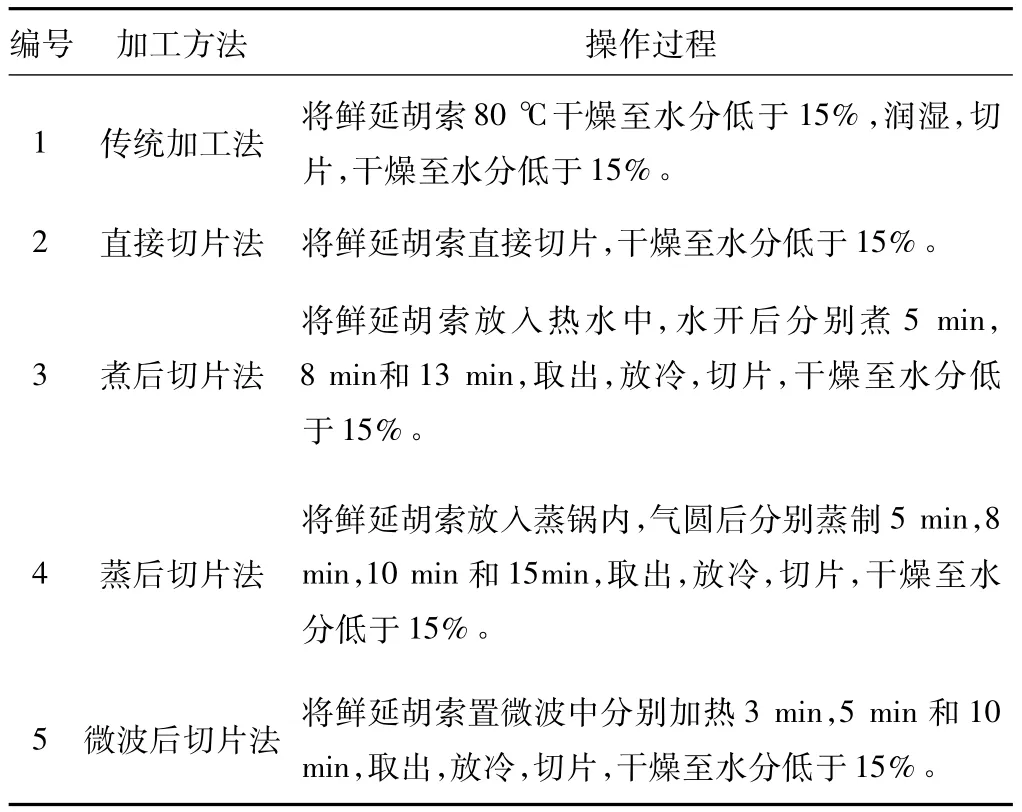
表1 延胡索不同产地加工方法
2.2 浸出物测定
据2015版《中国药典》四部2201(浸出物测定热浸法)测定稀乙醇浸出物、水浸出物。
2.3 总生物碱含量测定[6]
2.3.1 对照品溶液制备
精密称取延胡索乙素对照品适量,用95%乙醇定容于50 mL容量瓶,得到48 μg/mL的延胡索对照品溶液。
2.3.2 供试品溶液制备
精密称取延胡索粉末约0.5 g,分别置于250 mL圆底烧瓶中,加水(100 mL,80 mL)加热回流2次,每次保持微沸30 min。纱布过滤,合并滤液,离心,减压浓缩至50 mL,加氨水调至pH值10以上,移入250 mL分液漏斗中,用氯仿萃取2次每次50 mL,合并萃取液,加50 mL蒸馏水洗涤,弃去水层,合并氯仿液,回收氯仿至小体积,转入10 mL容量瓶中,用氯仿补充至刻度,备用。
2.3.3 最大吸收波长的确定
取上述所得样品1 mL于蒸发皿中水浴蒸干,用95%乙醇溶解定容至10 mL容量瓶中,备用。以无水乙醇溶液作为空白溶液,分别把上述对照品溶液和稀释后的样品溶液在紫外分光光度计进行全波长扫描,结果对照品溶液在280 nm处有最大吸收,样品溶液在273 nm处有最大吸收。最终选择检测波长280 nm,并在280 nm处测量样品的吸光度。
2.3.4 标准曲线绘制
精密吸取对照品溶液1.0,2.0,3.0,4.0,5.0 mL,置于5 ml容量瓶中,加95%乙醇定容至刻度,从而得到浓度为9.6,19.2,28.8,38.4,48.0 μg/mL的系列对照品溶液,以95%乙醇作为空白对照,在280 nm波长处测定吸光度,以浓度为横坐标(C),吸光度为纵坐标(A),绘制标准曲线,得回归方程为Y=0.019 9X+ 0.039 3,r=0.999 2,表明对照品浓度在9.6~48.0 μg/mL与吸光度呈良好的线性关系。
2.3.5 样品含量测定
取样品粉末 0.5 g,各 3份,精密称定,按照“2.3.2”项下供试品溶液制备方法制备供试品溶液,在280 nm测定吸收值,结果见表2。
2.4 延胡索乙素含量测定[7]
2.4.1 色谱条件及系统适用性试验
Hypurity C18色谱柱(250 mm×4.6 mm,5 um),以甲醇 -0.1%磷酸溶液(三乙胺调 pH值至6.0) (55∶45)为流动相,流速为1.0 mL/min,检测波长为280 nm,柱温30℃,进样量为10 μL。色谱图见图1。理论塔板数按延胡索乙素峰计算不低于3000,与其他峰的分离度均大于1.5。
2.4.2 对照品溶液制备
取经105℃干燥至恒重的延胡索乙素对照品适量,精密称定,加甲醇制成浓度为123.6 μg/mL的对照品溶液。
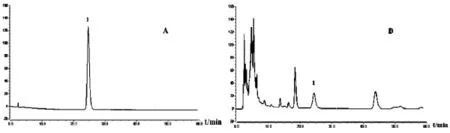
图1 对照品及延胡索饮片测定延胡索乙素HPLC图谱
2.4.3 供试品溶液制备
取样品粉末(过3号筛)约0.5 g,精密称定,置平底烧瓶中,精密加入浓氨试液-甲醇(1∶20)混合溶液50 mL,称定重量,冷浸1 h后加热回流1 h,放冷,再称定重量,用浓氨试液-甲醇(1∶20)混合溶液补足减失的重量,摇匀,滤过。精密量取续滤液25 mL,蒸干,残渣加甲醇溶解,转移至5 mL量瓶中,稀释至刻度,摇匀,滤过,取续滤液,即得。
2.4.4 线性关系考察
取“2.4.2”项下对照品溶液,分别进样2、4、6、8、10、20 μL,以峰面积(Y)对进样量(X,μg)进行线性回归,得回归方程Y=7.335 2X+0.454 4,r=0.999 9 (n=6),结果表明,延胡索乙素在进样量0.247 2~ 2.472 0 μg范围内与峰面积有良好的线性关系。
2.4.5 样品含量测定
取样品粉末各3份,每份0.5 g,精密称定,按照“2.4.3”项下供试品溶液制备方法制备供试品溶液,按照“2.4.1”项下色谱条件测定峰面积,结果见表2。
2.5 原阿片碱含量测定[8]
2.5.1 色谱条件及系统适用性试验
Hypurity C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈-三乙胺醋酸溶液(每1 000 mL水中加入冰醋酸30 mL,三乙胺8 mL)(18∶82)为流动相,流速为1.0 mL/min,检测波长为289 nm,柱温30℃,进样量为10 μL。色谱图见图2。理论塔板数按原阿片碱峰计算不低于3 000,与其他峰的分离度均大于1.5。

图2 对照品及延胡索饮片测定原阿片碱HPLC图谱
2.5.2 对照品溶液制备
取经105℃干燥至恒重的原阿片碱对照品适量,精密称定,加甲醇制成浓度为219.2 μg/mL的对照品溶液。
2.5.3 供试品溶液制备
取样品粉末(过3号筛)约0.5 g,精密称定,置平底烧瓶中,精密加入浓氨试液-甲醇(1∶20)混合溶液50 mL,称定重量,冷浸1 h后加热回流1 h,放冷,再称定重量,用浓氨试液-甲醇(1∶20)混合溶液补足减失的重量,摇匀,滤过。精密量取续滤液25 mL,蒸干,残渣加甲醇溶解,转移至5 mL量瓶中,稀释至刻度,摇匀,滤过,取续滤液,即得。
2.5.4 线性关系考察
取“2.5.2”项下对照品溶液1 mL,置10 ml的容量瓶中,加甲醇稀释至10 mL,同法再稀释10倍,得到对照品溶液浓度为2.19 μg/mL,分别进样10、20、30、40、50 μL,以峰面积(Y)对进样量(X,μg)进行线性回归,得回归方程Y=230.39X+0.009 6,r=0.999 4(n=5),结果表明,原阿片碱在进样量0.021 9~0.109 5 μg范围内与峰面积有良好的线性关系。
2.5.5 样品含量测定
取样品粉末各3份,每份0.5 g,精密称定,按照“2.5.3”项下供试品溶液制备方法制备供试品溶液,按照2.5.1项下色谱条件测定峰面积,结果见表2。
2.6 产地加工工艺选择
用Hassan的方法对浸出物等5个指标进行归一化处理[7],所有指标均为取值越大越好,计算公式为di=(Yi-Ymin)/(Ymax-Ymin),Ymin为指标中最小值,Ymax为指标中最大值。总评归一值OD=(d1+d2+d3 +…dk)/k(k为指标数),见表2。
不同初加工方法结果表明:微波法>煮法>直接切片法>传统法>蒸法,且从有效成分含量来看,微波法明显优于其他方法,而浸出物含量无明显差异,综合考虑,最终选择微波法作为延胡索的产地加工方法。
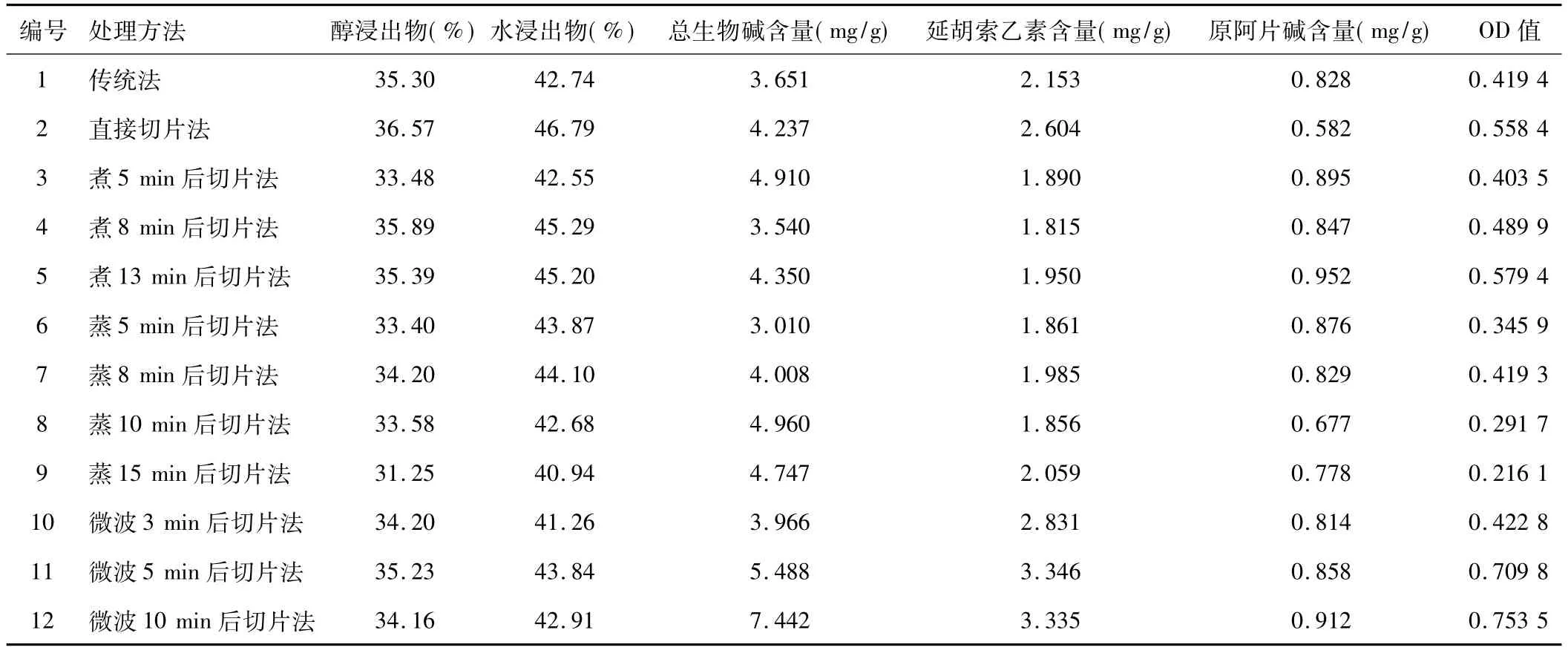
表2 延胡索产地加工工艺实验设计及结果
3 讨论
延胡索的产地加工方法有直接切片法、蒸后切片法、煮后切片法和传统切片法,其中煮法和蒸法都是常用的产地加工方法。近年来,有文献报道用微波后切片法对延胡索进行产地加工[9],本文经比较发现,用微波法进行产地初加工,可最大程度地减少总生物碱、延胡索乙素以及原阿片碱等主要成分的损失,可作为一种陕产延胡索产地加工方法推广使用。
对于延胡索产地加工工艺的筛选,本试验对浸出物、总生物碱、延胡索乙素以及原阿片碱含量等多个指标采用“归一化”法评价,对各考察指标进行“归一化”处理,以OD值为综合指标对延胡索产地加工工艺进行优化,优选其最佳的产地加工工艺。
本试验含量测定时,先尝试用一种色谱条件同时测定延胡索乙素和原阿片碱,通过流动相甲醇-水系统等度洗脱[7]和乙腈-水系统梯度洗脱[10],结果原阿片碱色谱峰分离度较小,且延胡索乙素色谱峰对称性差,均无法达到含量测定要求,因而分别用不同的色谱条件进行了含量测定。
[1]周晓龙.延胡索产销分析[J].中国现代中药,2013,15(4):340-341.
[2]张丽宏,游修琪,肖碧英,等.不同加工方法对延胡索质量的影响[J].中成药,2011,33(3):471-476.
[3]徐建中,孙乙铭,俞旭平,等.鲜元胡一体化加工炮制技术研究[J].中国中药杂志,2011,36(18):2484-2487.
[4]徐建中,俞旭平,孙乙铭,等.元胡饮片初加工实验研究[J].中药材,2011,34(7):1040-1043.
[5]王红,田明,王一,等.高效液相色谱法测定延胡索总生物碱滴丸中巴马汀碱和脱氢紫堇碱含量[J].中医药学报,2013,41(1): 63-64.
[6]施婷婷,王建新,李希.延胡索总生物碱提取工艺的实验研究[J].中药与临床,2014,5(3):14-16.
[7]国家药典委员会.中华人共和国药典[M].一部.北京:中国医药科技出版社,2015:140-279.
[8]张林,李元波,张爱军.总评“归一值”优选银马口服液的澄清工艺[J].中国实验方剂学杂志,2016,22(2):26-28.
[9]容穗华,高妮.正交试验优选延胡索微波炮制工艺[J].中国药房,2011,22(19):1769-1770.
[10]游修琪,顾雪竹,毛淑杰,等.延胡索产地不同加工品HPLC指纹图谱研究[J].中成药,2009,31(10):1481-1484.
R28
A
1002-2406(2017)02-0027-04
陕西中医药大学科研基金项目(No.2015PY12);陕西省教育厅重点实验室科研计划项目(No.14JS023)
宋艺君(1982-),女,讲师,博士,主要研究方向:中药饮片质量标准化和炮制技术研究。
王昌利*(1958-),男,教授,主要研究方向:中药新药。
2016-07-19
修回日期:2016-08-10
