REGγ敲除对细胞浸润的抑制作用
2017-03-27孙锦霞
孙锦霞,王 瑞,黄 钟
1)深圳大学医学部,广东深圳518060;2)聊城大学药学院,山东聊城252059

【生物工程 / Bioengineering】
REGγ敲除对细胞浸润的抑制作用
孙锦霞1,王 瑞2,黄 钟1
1)深圳大学医学部,广东深圳518060;2)聊城大学药学院,山东聊城252059
研究蛋白酶体激活因子REGγ对免疫细胞浸润能力的影响,分别腹腔注射李斯特菌于野生型和REGγ敲除小鼠,通过存活率检测、克隆形成、流式细胞术和苏木精-伊红染色实验研究,发现REGγ敲除小鼠表现为较低的存活率和李斯特菌清除能力.REGγ敲除显著抑制了中性粒细胞和单核细胞向感染部位的浸润.表明REGγ敲除后免疫细胞不能募集至感染部位,导致细菌未能被有效清除而在体内大量繁殖,最终引发败血症的发生,降低小鼠的存活率.
败血症;蛋白酶体;李斯特菌;中性粒细胞;单核细胞;细胞浸润;克隆形成实验;流式细胞术;苏木精-伊红染色
虽然现代医学进展突飞猛进,但细菌性感染引发的败血症仍然是威胁人类生命的世界难题[1].其中,以李斯特菌(ListeriaMonocytogenes)和沙门氏菌(S.typhimuriu)为主的食物性感染导致的死亡率一直处于较高水平.李斯特菌属于G+的胞内细菌,感染早期主要被中性粒细胞和巨噬细胞等髓系固有免疫细胞清除,腹腔注射或静脉注射李斯特菌诱导的菌血症模型被广泛用于宿主抵御细菌感染的机制研究[2-4].REGγ是普遍存在于蠕虫、昆虫和高等动物细胞中的蛋白酶体激活因子,可通过泛素-和腺嘌呤核苷三磷酸(adenosinetriphosphate,ATP)-非依赖的方式降解一些小肽或完整蛋白,参与许多重要的生理过程,如原癌基因SRC-3和PTTG1、抑癌基因P21和P53[5-8].文献[9]研究表明,败血症患者PBMC中REGγ表达上调,造血细胞中REGγ的缺失显著上调转录因子KLF2表达,进而抑制NF-κB介导的吞噬细胞对大肠杆菌和李斯特细菌的杀伤作用,加重小鼠败血症病情,降低小鼠存活率.本研究为探讨REGγ对免疫细胞浸润至感染部位的调控作用,以阐明细菌感染状态下,REGγ缺失对中性粒细胞和单核细胞浸润的调节作用.
1 材料与方法
1.1 主要试剂与仪器
心脑浸粉培养基购自美国BD公司;脂多糖(lipopolysaccharides,LPS)、2,2,2-三溴乙醇和2-甲基-2-丁醇购自美国Sigma公司;抗-GR1、抗CD11b、抗B220和抗CD3荧光标记抗体购自美国eBioScience公司;苏木精和伊红染色液购自上海碧云天公司;HBSS缓冲液(Hank’s平衡盐缓冲液)购于美国Gibco公司;体积分数4%的多聚甲醛固定液、NH4Cl、KHCO3和EDTA化学试剂购自上海生工生物工程股份有限公司.流式细胞仪购自美国BD公司;石蜡包埋剂、石蜡切片机和荧光正置显微镜购自德国Leica公司.
1.2 腹膜炎模型建立和检测
李斯特菌(listeria)由心脑浸粉培养基于37 ℃培养过夜, 此时光密度D(600)值约为1,菌液浓度为1×108mL-1,经PBS洗2遍后稀释至2.5×106mL-1.腹腔注射200μL李斯特菌于体质量和性别相同的8~12周野生型和REGγ敲除小鼠,每天记录小鼠存活率和体质量变化. 腹腔注射40μL李斯特菌于体质量和性别相同的8~12周野生型和REGγ敲除小鼠,3d后处死小鼠,取出肝脏和脾脏后称重,克隆形成实验检测组织中李斯特菌的负荷量.组织中加入1mLPBS(含有体积分数为0.025%的TritonX-100),经匀浆器研磨得到组织匀浆液,梯度稀释后涂板于脑心浸粉固体培养基培养过夜,统计长出单克隆数目.
1.3 流式细胞术
体质量和性别相同的8~12周野生型和REGγ敲除小鼠,经麻醉后取外周血,取出股骨和胫骨,10mLHBSS缓冲液(无Ca2+和Mg2+)(含有10g/LBSA和5mmol/LHepes)冲出骨髓细胞.腹腔注射400μL李斯特菌于体质量和性别相同的8~12周野生型和REGγ敲除小鼠,4h后麻醉小鼠,分别取血液和腹腔液.所得细胞经ACK缓冲液(含有0.15mol/LNH4Cl、10.0mmol/LKHCO3和0.1mmol/LEDTA)裂解去除红细胞,用PBS(含有10.0g/LBSA和5.0mmol/LEDTA)重悬,加入相应流式抗体,冰上避光孵育30min.染色结束,经PBS洗涤后上机检测,Flowjo软件分析实验结果.
1.4 苏木精-伊红(hematoxylin-eosin,HE)染色
腹腔注射1×105个李斯特菌于体质量和性别相同的8~12周野生型和REGγ敲除小鼠,3d后处死小鼠,取出肝脏立即放入体积分数为4%的多聚甲醛固定过夜.腹腔注射LPS(15mg/kg)于体质量和性别相同的8~12周野生型和REGγ敲除小鼠,8h后处死小鼠,取出肺组织立即放入体积分数为4%多聚甲醛固定过夜.固定后的组织经酒精脱水和二甲苯透明后,制备石蜡切片.依次经苏木精和伊红染色后,显微镜下观察REGγ敲除对免疫细胞浸润能力的影响,并采集图片.
1.5 统计学方法

2 结果与分析
2.1REGγ敲除降低小鼠抵抗李斯特菌感染的能力
分别腹腔注射200μL李斯特菌于野生型(REGγ+/+)和REGγ敲除小鼠(REGγ-/-)各10只,每天记录两组小鼠存活率和质量的变化.结果如图1,与野生型小鼠相比,李斯特菌感染后REGγ敲除小鼠的存活率和体重下降较快.

图1 李斯特菌感染后,野生型和REGγ敲除小鼠存活率和质量变化Fig.1 The changes of survival rateand average body weight of wild-type and REGγ-knockout mice after Listeria monocytogenes infection
分别腹腔注射40μL李斯特菌于6只野生型和7只REGγ敲除小鼠,3d后取出肝脏和脾脏,组织匀浆后梯度涂板.结果如图2,与野生型小鼠相比,李斯特菌感染后REGγ敲除小鼠的组织匀浆液长出的单克隆数目远多于野生型的小鼠的组织,每克组织经匀浆后再培养长出的细菌数论作n. 由图2可见,REG敲除小鼠抵抗李斯特菌感染的能力较弱.
2.2 静息状态下,REGγ对免疫细胞的调控作用
为了检测REGγ对免疫细胞浸润的影响,本研究比较了生理条件下,野生型和REGγ敲除小鼠骨髓和外周血中B(B220+)淋巴细胞、T(CD3+)淋巴细胞、中性粒细胞(GR1+CD11b+)和单核细胞(GR1-CD11b+)的分布差异.静息状态下,分别提取野生型和REGγ敲除小鼠的骨髓和外周血细胞,各3只,裂解红细胞后,流式细胞术检测各细胞所占百分比的差异.结果如图3,REGγ敲除对骨髓和外周血中各细胞所占的百分比没有影响.
2.3REGγ敲除抑制吞噬细胞浸润至感染部位

***表示P<0.00图2 李斯特菌感染后,野生型和REGγ敲除小鼠肝脏和脾脏的细菌负荷量Fig.2 Bacterial load in liver and spleen of wild-type and REGγ-knockout mice after Listeria monocytogenes infection
分别腹腔注射400μL李斯特菌于野生型和REGγ敲除小鼠各6只,4h后提取骨髓和外周血细胞.裂解红细胞后,流式细胞术检测中性粒细胞(GR1+CD11b+)和单核细胞(GR1-CD11b+)所占百分比的差异.结果如图4,相对野生型小鼠,李斯特菌感染后REGγ敲除小鼠中中性粒细胞和单核细胞所占腹腔液细胞的百分比明显降低,如图4(a)、(b)和(c),外周血中中性粒细胞所占百分比也显著降低,而单核细胞所占外周血细胞的百分比没有差异,如图4(a)、(d)和(e).
2.4 静息状态下,REGγ对免疫细胞的调控作用
分别腹腔注射40μL李斯特菌于野生型和REGγ敲除小鼠各6只,3d后取出肝组织.此外,分别腹腔注射LPS于野生型和REGγ敲除小鼠各6只,8h后取出肺组织.肝和肺组织经多聚甲醛固定,石蜡切片后进行HE染色.结果如图5,与未感染小鼠组织相比,李斯特菌感染或LPS注射菌均介导不同程度的免疫细胞浸润.但是,REGγ敲除小鼠肝组织中免疫细胞浸润明显低于野生型小鼠,如图5(a),REGγ敲除小鼠肺组织中免疫细胞浸润也明显低于野生型小鼠,且损伤程度也低于野生型小鼠,如图5(b).

图3 生理条件下,野生型、REGγ敲除小鼠中B、T淋巴细胞和中性粒细胞在骨髓和外周血细胞中的比例Fig.3 Percentage of B,T lymphocytes and neutrophils, monocytes in bone marrow and peripheral blood of wild-type and REGγ-knockout mice under physiological condition

**表示P<0.01; ***表示P<0.001图4 李斯特菌感染后,野生型和REGγ敲除小鼠中中性粒细胞和单核细胞向腹腔和外周血中的浸润Fig.4 Infiltration of neutrophils andmonocytes to peritoneal cavity and peripheral blood ofwild-type and REGγ-knockout mice after Listeria monocytogenes infection
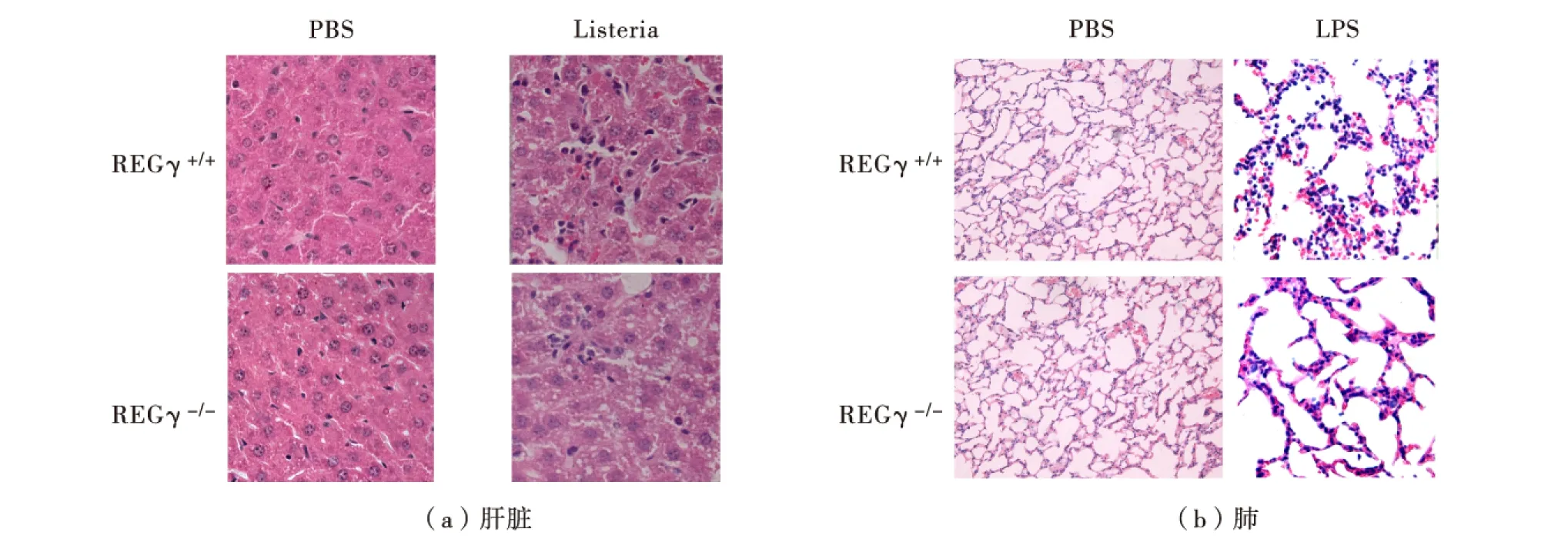
图5 李斯特菌感染和LPS注射后,野生型和REGγ敲除小鼠中免疫细胞向肝脏和肺组织的浸润Fig.5 (Color online)Immune cells infiltration to liver and lung of wild-type and REGγ-knockout mice after Listeria monocytogenes infection and LPS injection
3 讨 论
造血系统在感染早期发挥重要的防御作用,以中性粒细胞和单核巨噬细胞为主的固有免疫细胞充当早期抵御感染的主力军.免疫系统感应到感染的危险信号时,中性粒细胞迅速活化最早趋化至感染部位,吞噬杀伤以清除病原菌[10-12].通过释放细胞因子、趋化因子、抗菌肽、活性氧(reactiveoxygenspecies,ROS)和活性(nitricoxide,NO)等炎性介质,一方面发挥吞噬杀伤作用,另一方面可以趋化更多的免疫细胞浸润至此,以放大免疫应答反应,协同清除感染的病原菌,大多数的感染可止步于此.炎症细胞浸润在机体抵御病原菌感染过程中发挥至关重要的作用,但大量炎症细胞的浸润也是适可而止的,如果炎症反应过度,则周围正常组织也会成为免疫系统的攻击靶点,造成机体不必要的损伤[13].
REG家族包括REGα、REGβ和REGγ,其中,REGα和REGβ高表达于免疫细胞的细胞质和细胞核中,参与MHC-Ⅰ-抗原肽复合物的形成[14].REGγ仅分布在细胞核内,通过降解P53[8]、SirT1[15]、SirT7[16]、c-Myc[17]、KLF2[9]和IBε[18]等,参与调节衰老、脂肪代谢、细胞增殖、宿主防御、肠炎和能量平衡等生理、病理进程.本研究首次发现REGγ敲除抑制中性粒细胞和单核巨噬细胞浸润至感染部位.因此,REGγ缺失不仅可以直接调控中性粒细胞和单核巨噬细胞对病原菌的杀伤活性,而且抑制了其向感染部位的浸润,共同导致REGγ敲除小鼠感染部位的细菌不能有效的被清除,细菌大量增殖,进而进入血液循环系统,引发全身性的感染和组织器官的功能紊乱,即败血症,最终导致REGγ敲除小鼠的存活率下降.但是,关于REGγ对于细胞浸润的调控机制尚不清楚,还需深入研究.
结 语
感染发生时,骨髓中的血细胞将被动员而迁移至外周,最终穿过血管壁到达感染部位,中性粒细胞和单核巨噬细胞在抵抗局部感染中发挥主力军作用.蛋白酶体激活因子REGγ可能通过调节免疫细胞向感染部位的浸润和募集,参与调节机体宿主防御功能,后续仍需深入研究其调控机制.
/ References:
[1] Scallan E, Hoekstra R M, Angulo F J, et al. Foodborne illness acquired in the United States-major pathogens[J]. Emerging Infectious Diseases, 2011, 17(1): 7-15.
[2] Ribet D, Cossart P. How bacterial pathogens colonize their hosts and invade deeper tissues[J]. Microbes and Infection,2015,17(3):173-183.
[3] Khan S, Badovinac V. Listeria monocytogenes: a model pathogen to study antigen-specific memory CD8 T cell responses[J]. Seminars in Immunopathology, 2015, 37(3):301-310.
[4] Czuprynski C, Henson P, Campbell P. Killing of listeria monocytogenes by inflammatory neutrophils and mononuclear phagocytes from immune and nonimmune mice[J]. Journal of Leukocyte Biology, 1984, 35(2): 193-208.
[5] Mao I, Liu J, Li Xiaotao, et al. REGγ, a proteasome activator and beyond?[J]. Cellular and Molecular Life Sciences, 2008, 65(24): 3971-3980.
[6] Li Xiaotao, Lonard D, Jung S, et al. The SRC-3/AIB1 coactivator is degraded in a ubiquitin- and ATP-independent manner by the REGgamma proteasome[J]. Cell,2006,124(2):381-392.
[7] Hao Ying, Furuya F, Li Zhao, et al. Aberrant accumulation of PTTG1 induced by a mutated thyroid hormone beta receptor inhibits mitotic progression[J]. The Journal of Clinical Investigation,2006,116(11):2972-2984.
[8] Zhang Zhuo, Zhang Ruiwen. Proteasome activator PA28γ regulates p53 by enhancing its MDM2-mediated degradation[J].The EMBO Journal,2008,27(6):852-864.
[9] Sun Jinxia, Luan Yi, Xiang Dong, et al. The 11S proteasome subunit PSME3 is a positive feedforward regulator of NF-κB and important for host defense against bacterial pathogens[J].Cell Reports,2016,14(4):737-749.
[10] Fang Haoshu, Jiang Wei, Cheng Jin, et al. Balancing innate immunity and inflammatory state via modulation of neutrophil function: a novel strategy to fight sepsis[J]. Journal of Immunology Research, 2015, 2015(9): 187048.
[11] Ma A C, Kubes P P. Neutrophils,and neutrophil extracellular traps (NETs) in sepsis[J]. Journal of Thrombosis and Haemostasis, 2008, 6(3): 415-420.
[12] Brown K, Brain S, Pearson J, et al. Neutrophils in development of multiple organ failure in sepsis[J]. Lancet, 2006, 368(9530):157-169.
[13] Gahring L C, Osborne A V, Reed M, et al. Neuronal nicotinic alpha7 receptors modulate early neutrophil infiltration to sites of skin inflammation[J]. Journal of Neuroinflammation,2010,7(1):38.
[14] Sun Yuansheng, Sijts A J A M, Song Mingxia, et al. Expression of the proteasome activator PA28 rescues the presentation of a cytotoxic T lymphocyte epitope on melanoma cells[J]. Cancer Research, 2002, 62(10): 2875-2882.
[15] Dong Shuxian, Jia Caifeng, Zhang Shengping, et al. The REGγ proteasome regulates hepatic lipid metabolism through inhibition of autophagy[J]. Cell Metabolism, 2013,18(3):380-391.
[16] Sun Lianhui, Fan Guangjian, Shan Peipei, et al. Regulation of energy homeostasis by the ubiquitin-independent REGγ proteasome[J]. Nature Communications,2016,7: 12497.
[17] Li Shuangxi, Jiang Cong, Pan Jingjing, et al. Regulation of c-Myc protein stability by proteasome activator REGγ[J]. Cell Death Differentiation, 2015, 22(6): 1000-1011.
[18] Xu Jinjin, Zhou Lei, Ji Lei, et al. The REGγ-proteasome forms a regulatory circuit with IκBε and NFκB in experimental colitis[J]. Nature Communications, 2016,7: 10761.
【中文责编:晨 兮;英文责编:艾 琳】
The inhibitory effect of REGγ-knockout on cell infiltration
Sun Jinxia1, Wang Rui2, and Huang Zhong1†
1) Health Science Center, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China 2) College of Pharmacy, Liaocheng University, Liaocheng 252059, Shandong Province, P.R.China
Peritoneal injections ofListeriaMonocytogenestowild-typeandREGγ-knockoutmicewereperformedforanalyzingtherolesofproteasomeactivatorREGγinimmunecellinfiltration.Bysurvivalassay,cloneformationassay,flowcytometryandhematoxylin-eosinstaining,wefoundthatmicelackingREGγshowssignificantlylowersurvivalandListeriaMonocytogenesclearance.Furthermore,REGγdeficiencyobviouslyinhibitstheinfiltrationofneutrophilandmonocytetoinfectionsites.Thus,theresultssuggestthatREGγdeficiencysuppressesimmunecellrecruitmenttoinfectionsites,resultinginimpairedbacterialclearance.Rapidbacterialreproductioncausessepsiseventually,andleadstothereducedsurvivalrateofREGγ-knockoutmice.
sepsis; proteasome;ListeriaMonocytogenes;neutrophil;monocyte;cellinfiltration;cloneformationassay;flowcytometry;hematoxylin-eosinstaining
:Sun Jinxia, Wang Rui, Huang Zhong. The inhibitory effect of REGγ-knockout on cell infiltration[J]. Journal of Shenzhen University Science and Engineering, 2017, 34(2): 111-116.(in Chinese)
R 392
A
10.3724/SP.J.1249.2017.02111
国家自然科学基金资助项目(31401217);中国博士后科学基金资助项目(2014M0560672)
孙锦霞(1986—),女,深圳大学博士后研究人员. 研究方向:免疫学.E-mail:jinxia8608@126.com
Received:2016-12-16;Accepted:2017-01-27
Foundation:National Natural Science Foundation of China (31401217); Postdoctral Science Foundation of China (2014M0560672)
† Corresponding author:Professor Huang Zhong. E-mail: zhuang809@126.com
引 文:孙锦霞,王 瑞,黄 钟.REGγ敲除对细胞浸润的抑制作用[J]. 深圳大学学报理工版,2017,34(2):111-116.
