5-氮杂-2-脱氧胞苷对里氏木霉产纤维素酶的影响
2017-03-27周娇娇佘炜怡王浩入田生礼
周娇娇,佘炜怡,王浩入,谢 宁,田生礼
深圳大学生命与海洋科学学院,深圳市微生物基因工程重点实验室,广东深圳 518060

【生物工程 / Bioengineering】
5-氮杂-2-脱氧胞苷对里氏木霉产纤维素酶的影响
周娇娇,佘炜怡,王浩入,谢 宁,田生礼
深圳大学生命与海洋科学学院,深圳市微生物基因工程重点实验室,广东深圳 518060
为探究脱氧核糖核酸(deoxyribonucleic acid, DNA) 甲基化修饰对丝状真菌里氏木霉 (Trichodermareesei,T.reesei) 产纤维素酶基因表达的表观遗传调控机制,利用不同浓度(0~1.0mmol/L)的化学修饰剂5-氮杂-2-脱氧胞苷(5-Aza-2′-deoxycytidine, 5′-Aza)培养T.reeseiQM9414.通过测定滤纸酶活性(filterpaperenzymaticactivities,FPA)和羧甲基纤维素钠酶活性(carboxymethylcellulose-Naenzymaticactivities,CMCA)确定纤维素酶活性的变化;利用实时荧光定量PCR(real-timefluorescentquantitativepolymerasechainreaction,RT-qPCR)检测0.1mmol/L5′-Aza培养的T.reeseiQM9414中纤维素酶基因cbh1、egl1、 酶激活因子xyr1基因以及分解代谢阻遏因子cre1与ace1基因的表达水平;通过甲基化特异性PCR(methylationspecificPCR,MS-PCR)分析cre1、ace1、cbh1、egl1和xyr1基因上游序列的甲基化状态;利用Westernblot和DNA甲基化定量测定分析了DNA甲基转移酶和DNA的甲基化水平.结果显示,0.1mmol/L5′-Aza处理后的T.reeseiQM9414菌株的FPA和CMCA最高,比出发菌株T.reeseiQM9414分别高30%和53%;RT-qPCR结果显示,处理后的T.reeseiQM9414菌株中纤维素酶基因cbh1、egl1与酶激活因子xyr1基因的相对表达量均高于出发菌株,而分解代谢阻遏因子cre1和ace1基因的相对表达量与出发菌株无明显差异;MS-PCR结果显示,cbh1、egl1和xyr1基因的非甲基化状态高于出发菌株,而分解代谢阻遏因子cre1与ace1基因的非甲基化状态也无明显差异;Westernblot和DNA甲基化定量测定结果分别显示,5′-Aza处理后菌株的DNA甲基转移酶表达比出发菌株明显降低,全基因组DNA甲基化程度也有下降.研究结果表明,5′-Aza处理T.reeseiQM9414菌株后,纤维素酶活性明显增加,纤维素酶基因cbh1、egl1和激活因子xyr1基因表达水平的增加可能是通过DNA甲基转移酶影响DNA甲基化水平,最终调控基因的表达.
丝状真菌;里氏木霉;5-氮杂-2-脱氧胞苷;DNA甲基化;DNA甲基化转移酶;甲基化特异性PCR
表观遗传的现象包括脱氧核糖核酸(deoxyribonucleicacid,DNA)甲基化(methylation)、基因组印记(genomicimprinting)、母体效应(maternaleffects)、基因沉默(genesilencing)、核仁显性、休眠转座子激活和RNA编辑(RNAediting)等.与高等动植物相比,大多数真菌基因组DNA中胞嘧啶甲基化程度很低或不存在甲基化[1],多头绒泡菌的甲基化程度为1%[2].真菌基因组甲基化存在的机制尚不清楚[3].粗糙脉孢菌的基因组中的重复DNA序列相对较少,约占 8%,其中81%编码序列常发生甲基化[4].
文献[5]研究表明,在被美国食品和药物管理局(FoodandDrugAdministration,FDA)认证的DNA甲基转移酶抑制剂中,5-氮杂胞苷(5-Azacytidine)和5-氮杂-2-脱氧胞苷(5-Aza-2′-deoxycytidine, 5′-Aza)两者的应用最为广泛.其中,因5′-Aza只与DNA相结合,对RNA及蛋白质合成的影响较5-氮杂胞苷小,同时它的脱甲基化作用大约是5-氮杂胞苷的10倍,因此,已成为目前普遍使用的DNA甲基转移酶抑制剂[6].
目前,对里氏木霉(Trichodermareesei,T.reesei)纤维素酶基因表达的转录调控研究机制己经取得较大进展.已鉴定出纤维素酶基因相关的转录因子有CRE1、XYR1、ACE1和ACE2,但它们与表观遗传之间的作用还未见详细阐释[7].DNA甲基化也是调控基因转录的重要机制之一.近年来,国内外对真菌甲基化的研究主要是利用化学修饰试剂来提高次级代谢产物的含量及新物质的合成.张伟[8]研究表明,5-氮杂胞苷不仅能提高源于海葵的月状旋孢腔菌中大环内脂化合物的表达量达3倍多,且还从月状旋孢腔菌中分离了11种新的邻苯化合物;孙鉴昕[9]利用5-氮杂胞苷处理刺松藻内生真菌,分离出5种新的抗卤虫活性化合物;刘云凤[10]利用5-氮杂胞苷从来源于蕾二岐灯芯柳珊瑚的真菌曲霉中分离出12种新的萜类抗菌化合物.Vasanthakumari等[11]利用DNA甲基转移酶抑制剂处理青脆枝内生真菌,提高了喜树碱的含量.此外,还利用5-氮杂胞苷研究黄曲霉的表型以及黄曲霉素的合成.林剑青等[12]基于转录组测序研究黄曲霉对5-氮杂胞苷应答机制,发现5-氮杂胞苷诱导其产生白色绒毛状表型,并抑制黄曲霉素的生物合成;Yang等[13-14]研究发现,黄曲霉基因组缺乏甲基化,但5-氮杂胞苷能够影响基因表达调控,使其生产发育紊乱,菌株表型发生突变,不再合成黄曲霉素.但5-氮杂胞苷对里氏木霉的影响研究目前尚未见报道.
本研究采用含5′-Aza的培养基培养里氏木霉T.reeseiQM9414,研究DNA去甲基化对里氏木霉菌丝的生长以及纤维素酶表达的影响,为里氏木霉纤维素酶表达的调控机制提供实验依据.
1 材料与方法
1.1 材 料
1.1.1 菌 株
里氏木霉QM9414购自美国模式菌种收藏中心(AmericanTypeCultureCollection,ATCC).
1.1.2 试 剂
DNA分子质量标记(DNAmarker)、EPiTaqHS酶 (用于重硫酸盐处理后的DNA)和SYBR®PrimeScriptTMmiRNART-PCR反转录试剂盒均为日本Takara公司生产;DNMT1抗体与二抗、DNA甲基化定量检测试剂盒购自美国Epigentek公司;5′-Aza购自美国Sigma公司;真菌总核糖核苷酸(ribonucleicacid,RNA)提取试剂Trizol购自美国Invitrogen公司;牛血清蛋白(bovineserumalbumin,BSA)、(bicinchoninicacid,BCA)蛋白质定量试剂盒以及超敏(enhancedchemiluminescence,ECL)化学发光检测试剂盒购自美国ThermoScientific公司;DNA甲基化修饰试剂盒购自美国ZymoResearch公司;真菌基因组快速抽提试剂盒和其他试剂均购自上海生工生物工程股份有限公司.本实验所需的其余试剂均为国产或进口分析纯试剂.
1.1.3 实验用培养基配制
土豆葡萄糖培养基(potatodextroseagar,PDA):按照常规方法配置.
T.reesei液体基本培养基[7]:Mandels营养液浓缩液20mL、Mandels微量元素浓缩液1mL、CaCl2溶液20mL、无水葡萄糖20.0g、蛋白胨2.0g、1.0mol/L的柠檬酸缓冲液50mL、吐温80 1.0g,双蒸水(ddH2O)定容至1L,121 ℃高压灭菌30min.
50×Mandels营养盐浓缩液:(NH4)2SO470.0g、尿素15.0g、KH2PO4100.0g、KH2PO4100.0g、MgSO4·7H2O15.0g,ddH2O定容至1L.
100×Mandels微量元素浓缩液:FeSO4·7H2O5.0g、ZnSO4·7H2O1.7g、CoCl2·6H2O3.7g、MnSO4·H2O1.6g,ddH2O定容至1L.
产酶培养基:产酶培养基组分与基本培养基一致,用微晶纤维素(Sigma,PH101) 20.0g/L代替葡萄糖作为碳源.
质量分数为1%的CMC-Na:羧甲基纤维素钠10.0g,ddH2O定容至1L,加热并搅拌至完全溶解.
5′-Aza母液:取0.022 8g5′-Aza溶于100μL二甲基亚砜(dimethylsulfoxide,DMSO)中,配制成浓度为1.0mol/L的母液.
1.2 实验方法
1.2.1 不同浓度5′-Aza培养基培养里氏木霉
将T.reeseiQM9414接种于PDA平板上,于28 ℃恒温培养7d后,制备适量孢子悬液,计数并将其稀释至为1×108mL-1,取1μL孢子悬液于30mL液体基本培养基中,5′-Aza的终浓度分别为0.1、0.2、0.3、0.5和1.0mmol/L,于28 ℃ 250r/min条件下培养2d;按5%(体积分数)接种到含有不同浓度(0.1、0.2、0.3、0.5和1.0mmol/L)5′-Aza的产酶培养基中,于28 ℃ 250r/min条件下培养,收集不同时间培养的菌体,并将收集到菌体分组:第Ⅰ组为出发菌株T.reeseiQM9414;第Ⅱ组为0.1mmol/L5′-Aza培养的T.reeseiQM9414;第Ⅲ组为0.2mmol/L5′-Aza培养的T.reeseiQM9414;第Ⅳ组为0.3mmol/L5′-Aza培养的T.reeseiQM9414;第Ⅴ组为0.5mmol/L5′-Aza培养的T.reeseiQM9414;第Ⅵ组为1.0mmol/L5′-Aza培养的T.reeseiQM9414.
1.2.2T.reesei总RNA的提取、反转录PCR以及实时荧光定量PCR
使用Trizol试剂 (Invitrogen公司生产)提取T.reeseiQM9414总RNA,使用PrimeScriptRTreagentkitwithgDNAeraser试剂盒(Takara公司生产)去除基因组DNA(genomicDNA,gDNA).使用反转录PCR(reversetranscription,RT-PCR)试剂盒(Takara公司生产)合成cDNA第1链.根据实时荧光定量聚合酶链式反应(real-timefluorescentquantitativepolymerasechainreaction,RT-qPCR) 试剂盒 (Takara公司生产)说明,采用20μL反应体系,95 ℃ 预变性 2min;95 ℃ 10s,60 ℃ 30s,72 ℃ 30s,40个循环.各基因的引物序列见表1.

表1 RT-qPCR使用的引物
1.2.3 FPA和CMCA的测定
滤纸酶活力和羧甲基纤维素酶活力的测定参照文献[15]的方法.由于在反应过程中纤维素酶含量与释放的葡萄糖含量并非线性关系,根据国际纯粹与应用化学联合会公布的方法[15],以1 h内水解50 mg滤纸释放出2.0 mg葡萄糖或30 min内水解1%(质量分数)羧甲基纤维素释放出0.5 mg葡萄糖的酶液稀释倍数来计算FPA和CMCA活性,单位为U.按照1.2.1节取T.reeseiQM9414孢子悬液1mL培养,连续培养7d,从第2 天开始,每天固定时间取1mL培养液,于4 ℃ 12 000r/min离心5min,测定上清液酶活性.
1.2.4SDS-PAGE电泳检测
将T.reeseiQM9414接种于PDA平板上,于28 ℃恒温培养7d后,按照1.2.1节取T.reeseiQM9414孢子悬液1mL培养,按5%(体积分数)接种量转接至30mL含有微晶纤维素(20g/L)的诱导培养基中,于28 ℃ 250r/min培养72h.收集菌体细胞提取蛋白质,并定量,进行聚丙烯酰胺凝胶电泳(体积分数为12%),然后将蛋白转印至聚偏二氟乙烯(polyvinylidenefluoride,PVDF) 膜,用质量分数为5%的脱脂奶粉封闭液室温封闭2h,然后与鼠抗兔DNA甲基化酶(DNAmethylase,DNMT1)多克隆抗体(体积比为1∶500) 4 ℃ 孵育过夜,三羟甲基氨基甲烷缓冲液(tris-bufferedsalineTween,TBST) 清洗3次,每次5min,然后再与辣根过氧化物酶标记羊抗鼠抗体(体积比为1∶1 000) 室温孵育2h,TBST液再清洗6次,每次5min.在暗室中,按照ECL免疫试剂盒的说明书操作.
1.2.5DNA甲基化定量检测
将T.reeseiQM9414接种于PDA平板上,于28 ℃恒温培养7d后,制备适量孢子悬液接种于含5′-Aza的液体基本培养基中,于28 ℃ 250r/min条件下培养2d,真空抽滤,获取木霉菌丝体,置于研钵中加入液氮,将菌丝体研磨成粉状后转至2.0mL离心管中,使用生工生物工程公司的真菌基因组快速抽提试剂盒提取,具体步骤参见说明书.测定上述提取的各样品基因组DNA质量浓度,并稀释至同一质量浓度100ng/μL,取各样品基因组、阴性对照ME3和阳性对照ME4各1μL,定量检测DNA甲基化,具体方法参考Epigentek公司DNA甲基化定量检测试剂盒的说明书.
1.2.6MS-PCR
参照EZDNAMethylation-Gold试剂盒(ZymoResearch公司生产)说明书,将上述提取的各基因组样品进行重亚硫酸盐(bisulfite)修饰.修饰后,进行PCR验证.采用50μLPCR体系:DNA模板 100ng,PCR缓冲液 (10×) 5μL,Mg2+5μL,4×dNTP6μL,上下游引物各2μL,HSTaq0.25μL.94 ℃ 预变性 5min; 94 ℃ 30s,55 ℃ 30s,72 ℃ 30s,40 个循环,72 ℃ 7min最后延伸.引物见表2.

表2 甲基化特异性PCR使用的引物

(续表2)
2 实验结果
2.1 不同浓度5′-Aza培养基培养氏木霉菌丝的形态变化
在显微镜下观察菌丝结果见图1,在相同的40倍物镜下观察,与出发菌株T.reeseiQM9414相比较,经5′-Aza培养过T.reeseiQM941菌丝较长.其中,第Ⅴ组和第Ⅵ组的T.reeseiQM9414相对第Ⅱ组、第Ⅲ组和第Ⅳ组的分支多且较短.而第Ⅱ组、第Ⅲ组和第Ⅳ组的T.reeseiQM9414相对出发菌株菌丝较长且分支也较多,其中,第Ⅱ组的菌丝最长,形态最好.

图1 里氏木霉经不同浓度 5′-Aza(0~1.0 mmol/L)培养基培养48 h后菌丝形态变化Fig.1 Morphology variation of hypha of T.reesei incubated with different concentration(0-1.0 mmol/L) of 5′-Aza medium for 48 h
2.2 不同浓度5′-Aza培养里氏木霉后对FPA和CMCA的影响
根据上述结果,用不同浓度的5′-Aza培养里氏木霉并在产酶培养基中培养48 h,检测各菌液的FPA和CMCA,结果见图2.所有浓度5′-Aza培养的T.reeseiQM9414的FPA和CMCA在7d中都呈先升后降的趋势,且在第4天酶活性达到最高.其中,第Ⅱ、Ⅲ和Ⅳ组的菌株,两种酶活性均高于出发菌株;而第Ⅴ和第Ⅵ组的菌株,两种酶活性无明显升高并且低于出发菌株,所以在后面实验中第Ⅴ组和第Ⅵ组不作为实验组.第Ⅰ至第Ⅳ组的里氏木霉在产酶培养基中FPA的趋势线见图2(a).其中,第Ⅱ组的各个时段的酶活性比出发菌T.reeseiQM9414显著升高(P<0.001), 平均高出3.5U,在酶活性峰值96h时,第Ⅱ组的FPA比出发菌高出30%.第Ⅰ至第 Ⅳ组的里氏木霉在产酶培养基中CMCA的趋势线见图2(b).其中,第Ⅱ组的菌株的各个时段的酶活性相比出发菌显非常著升高(P<0.001), 平均高出约5.3U.在酶活性峰值96h时,第Ⅱ组的CMCA比出发菌高出 53%,表明去甲基化对纤维素酶合成有一定影响.
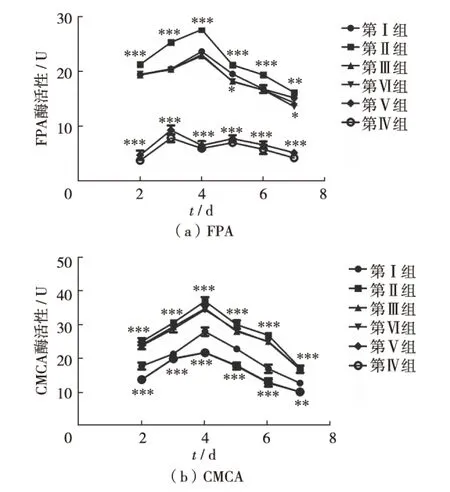
**表示P<0.01;***表示P<0.001图2 里氏木霉经不同浓度(0~1.0 mmol/L)的5′-Aza培养后FPA与CMCA随时间变化情况(±s,n=3)Fig.2 Time course of FPUase and CMCase activity in T.reesei incubated with different concentrations (0-1.0 mmol/L) of 5′-Aza (±s,n=3)
2.3 RT-qPCR分析5′-Aza培养后里氏木霉纤维素酶分解代谢阻遏因子cre1和ace1的变化
对第Ⅰ至第 Ⅳ组的样品进行RT-qPCR,实验结果见图3.图3(a)说明,在诱导培养48 h后,第Ⅱ组菌株cre1的mRNA相对表达量与出发菌株T.reeseiQM9414相比明显下降,而在诱导培养96h后,第Ⅰ至第 Ⅳ组菌株cre1的mRNA相对表达量变化不显著(P>0.05).ace1在第Ⅰ至第Ⅳ组的样品的菌株中表达量测定结果见图3(b).在诱导培养48h和96h后,与出发菌菌株中ace1的mRNA表达量相比,第Ⅱ组菌株ace1的mRNA相对表达量变化有显著性(P>0.05), 但变化量较小.综上可见,真菌基因甲基化程度较低,可能cre1与ace1基因启动子区甲基化程度更低,以至于5′-Aza培养后对其影响不大,故去甲基化培养可能对cre1与ace1的表达影响不显著.

*表示P<0.05; **表示P<0.01图3 不同浓度(0~0.3 mmol/L) 5′-Aza培养的里氏木霉对阻遏因子基因cre1和ace1的相对表达量的变化(±s,n=3)Fig.3 Change of relative expression of cre1 and ace1 genes in T.reesei incubated with different concentrations (0-0.3 mmol/L) of 5′-Aza for 48 h and 96 h respectively (±s,n=3)
2.4 RT-qPCR分析5′-Aza培养后纤维素酶基因cbh1与egl1以及激活因子xyr1的变化
里氏木霉纤维素酶是由多种酶组分组成的复杂酶系,为验证去甲基化是否会有效激活纤维素酶基因的表达,使用RT-qPCR分析第Ⅰ至第 Ⅳ组的菌株中纤维素酶基因cbh1、egl1和激活因子xyr1基因的相对表达量,结果见图4.
cbh1是主要编码纤维二糖水解酶CBH1的基因,结果如图4(a).在诱导48h时,以出发菌株T.reeseiQM9414中cbh1的mRNA表达量为1,第Ⅱ至第Ⅳ组菌株中cbh1的表达量分别是同时段出发菌株的89%、75%和73%,但在诱导96h后,第Ⅱ至第Ⅳ组菌株cbh1的相对表达量分别为同时段出发菌株的149.91%、125.86%和120.64%.在诱导培养96h后,第Ⅱ组菌株cbh1的表达量非常显著增加(P<0.01).
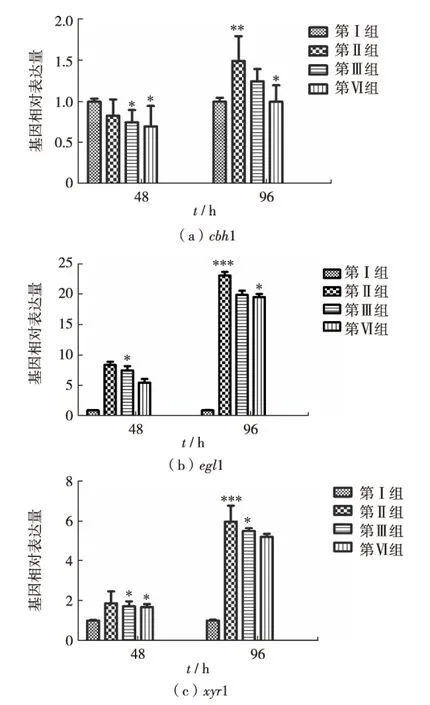
*表示P<0.05, **表示P<0.01,***表示P<0.001图4 不同浓度(0~0.3 mmol/L)5′-Aza培养里氏木霉对纤维素酶相关基因cbh1、egl1和xyr1相对表达量的变化(±s,n=3)Fig.4 Change of relative expression of cbh1, egl1 and xyr1 genes in T.reesei incubated with different concentrations (0-0.3 mmol/L) of 5′-Aza for 48 h and 96 h respectively (±s,n=3)
内切β-1,4-葡聚糖酶EGL1的编码基因是egl1, 结果见图4(b).培养48h,以出发菌T.reeseiQM9414中egl1的mRNA表达量为1,第Ⅱ至第Ⅳ组菌株中egl1的表达量分别是同时段的出发菌株的80.62%、75.97%和60.21%.在诱导96h时,第Ⅱ组菌株中egl1的表达量情况发生了非常显著变化(P<0.01),egl1的表达量是同时段出发菌株的230.43%.
调控木聚糖酶表达的转录因子XYR1的编码基因是xyr1,结果见图4(c),在诱导培养48h时,以出发菌T.reeseiQM9414中xyr1的mRNA表达量为1,第Ⅱ至第 Ⅳ组的菌株中xyr1的表达量分别为出发菌株的8.5、7.5和6.2倍.而在诱导96h时,第Ⅱ组的菌株中xyr1的表达量情况发生了非常显著变化(P<0.001),xyr1的表达量是同时段出发菌株的23.5倍.
2.5DNA甲基化的定量检测
表3为通过DNA甲基化定量检测试剂盒得到结果.由表3可见,第Ⅱ至第 Ⅳ组的菌株与出发菌株T.reeseiQM9414相比,甲基化程度明显下降,约为0.54%.
表3 DNA甲基化定量检测计算结果(±s, n=3)

1为第Ⅱ组菌株的蛋白样品;2为第Ⅲ组菌株的样品;3为第Ⅳ组菌株的样品;4为对照组样品图5 Western blot 分析甲基化酶DNMT1的表达量Fig.5 Western blot analysis of DNMT1 expression
2.6Westernblot分析DNA的DMT变化
在NCBI中检索到T.reeseiQM6a具有DNA甲基化酶1的蛋白(序列号:XP_006964860.1)与兔的DNMT1蛋白(序列号:XP_008248967.2), 经BLAST序列比对,得到两蛋白同源性为39%.Westernblot分析结果见图5.结果表明,相比对照组,实验组经 5′-Aza培养基培养后DNMT1表达量相对对照组明显减少.
2.7MS-PCR分析启动子区DNA甲基化情况
在真核生物体内,DNA甲基化主要发生在启动子区.而基因的编码区很少甚至没有.综上结果,MSP只采用了第Ⅰ和第Ⅱ组的菌株样品.
从图6MS-PCR显示的实验结果可知,出发菌株T.reeseiQM9414和第Ⅱ组的菌株样品中cre1、ace1、cbh1、egl1和xyr1基因的启动子区DNA都是部分甲基化,以非甲基化状态居多.阻遏因子cre1基因的启动子区甲基化,在培养前后变化不明显,该结果与RT-qPCR结果一致,而与纤维素酶表达的基因cbh1、egl1和xyr1的启动子区的非甲基化状态增加显著,但仍存在部分甲基化状态.

M为DL500 marker; 1为甲基化的cre1; 2为非甲基化的cre1; 3为甲基化的ace1; 4为非甲基化的ace1; 5为甲基化的cbh1; 6为非甲基化的cbh1; 7为甲基化的egl1; 8为非甲基化的egl1; 9为甲基化的xyr1; 10为非甲基化的xyr1; 11为阳性对照; 12为阴性对照图6 MS-PCR分析纤维素表达相关基因启动子甲基化状态的凝胶电泳图Fig.6 Electrophoresis of the promoter methylation status of cellulase related genes by MS-PCR
3 分析与讨论
与高等动植物相似,真菌表观遗传作用主要表现在基因组防御功能与基因表达的调控功能,同时也为真菌表观遗传的研究提供了新途径[16].文献[3]研究表明,突变不同的DNA甲基转移酶对真菌生长发育影响不同.粪盘菌DNA甲基化转移酶基因masc1突变同样没有明显的性状改变,但其甲基化诱导的前减数分裂(methylationinducedpremeiotically,MIP)的甲基化作用被阻断后,纯合的masc1双核突变株不能生长,而敲除masc2基因的突变体则对MIP甲基化无明显影响.本实验通过不同浓度5′-Aza(0~1.0mmol/L)培养后T.reeseiQM9414,发现DNA去甲基化可使菌体生长发生改变,菌丝变长且分支多而长.
FPA代表的是内切型葡聚糖酶、外切型葡聚糖酶、β-葡聚糖苷酶协同作用后的总酶活,是菌株整个纤维素酶系酶活力水平的综合体现.而CMCA主要代表内切β-1,4-葡聚糖苷酶的活力.本实验通过不同浓度5′-Aza培养T.reeseiQM9414后,发现可以不同程度地提高纤维素酶酶活性,其中0.1mmol/L的影响最为显著(P<0.001). 说明DNA去甲基化可以提高其纤维素酶的表达.而高浓度的5′-Aza培养T.reeseiQM9414酶活性较原菌酶活性下降.有研究表明,高浓度5′-Aza可通过抑制DNA的合成来诱导细胞周期的阻滞,影响细胞的增值,从而加快细胞的凋亡[17].而低浓度的5′-Aza可抑制甲基转移酶.在细胞分裂复制的过程中,低浓度的5′-Aza使甲基不能转移到胞嘧啶上.细胞在缺乏甲基转移酶时,接受甲基的能力降低,从而使DNA去甲基化.不同浓度的化学修饰剂5′-Aza对T.reeseiQM9414的FPA和CMCA的影响呈先升后降趋势,这可能与微生物生长状态有关,96h前微生物正处于对数生长期,其数量逐渐增多,产酶也逐渐增加,96h微生物正处于稳定生长期,其数量最多,产酶也最多,故96h酶活最高.而96h后微生物正处于衰亡期, 其数量逐渐增少,产酶也逐渐减少.5′-Aza作用后,DNA去甲基化,激活基因表达,故5′-Aza处理后的菌株酶活比出发菌高.
纤维素酶的表达是一个比较复杂的系统,具有正负调控,既有阻遏因子CRE1与ACE1的负调控,也有激活因子XYR1的正调控.根据RT-qPCR的实验结果,提示激活因子基因xyr1参与的正调控起最主要的作用,阻遏因子基因cre1与ace1参与的负调控作用不显著;MS-PCR的结果也进一步说明,可能在DNA去甲基化的情况下,cre1与ace1表达调控作用相对较小,而激活因子基因xyr1的启动子区非甲基化状态明显增加,调控XYR表达增加可能会促进纤维素酶的表达和酶活提高.RT-qPCR与MS-PCR的结果表明,纤维素酶表达的相关基因cbh1与egl1, 在5′-Aza的作用下,DNA启动子区去甲基化,激活基因转录,使其表达量提高,是纤维素酶表达量提高的最主要原因.
文献[18]研究发现,5′-Aza是一种强效生长抑制剂及细胞毒素剂,能够抑制DNA甲基转移酶的活性,从而调节基因表达、基因激活和沉默,故DNA甲基化定量检测得出不同浓度的5′-Aza培养的菌株的DNA甲基化程度都下降了.
真核生物已知的DMT可分为 5 个群,分别以哺乳动物的Dnmt1、Dnmt2、Dnmt3a与Dnmt3b、植物的染色质甲基化酶(chromomethylase,CMT)和粪盘菌的Masc1 为代表[19].真菌中已发现的 5 种DMT分别属于Dnmt1与Masc1.Christman等[20]研究表明,5′-Aza能够作为胞嘧啶的替代物与DNA甲基化转移酶(DNMT)的半胱氨酸残基相连接,使其构象发生改变,进而使其酶活失活.Westernblot结果表明,5′-Aza能够抑制DNMT1的表达量,可能有两个原因:一是DNMT1的基因表达受到抑制; 二是5′-Aza能够与酶蛋白的半胱氨酸残基结合使其构象发生改变,可能导致其抗原决定簇的位置以及疏水性发生改变,而不能与抗体结合.
真核生物DNA甲基化主要发生在启动子区.MS-PCR结果可能是由于DNMT1的表达部分被抑制所造成.在含0.1mmol/L5′-Aza培养基培养的T.reeseiQM9414菌株中,纤维素酶表达基因cbh1、egl1和xyr1的非甲基化与对照组均有明显提高,说明5′-Aza可以抑制DNA甲基化转移酶DNMT1的表达,从而导致基因启动子区甲基化状态下降,激活基因的表达.
结 语
5′-Aza处理T.reeseiQM9414菌株后,纤维素酶活性明显增加,纤维素酶基因cbh1和egl1与激活因子xyr1基因的表达水平增加可能是通过DNA甲基转移酶影响DNA甲基化水平,最终调控基因表达.
目前对于纤维素酶的研究,主要是通过基因工程改造的方式来克隆纤维素酶基因到真菌高效的表达系统,从而增加纤维素酶表达[21].本实验通过表观遗传的方法研究里氏木霉的纤维素酶表达,为真菌纤维素酶表达调控机制提供了实验依据.
/ References:
[1] Colot V, Rossignol J L. Eukaryotic DNA methylation as an evolutionary device[J]. Bioessays, 1999, 21(5): 402-411.
[2] Evans H H, Evans T E, Littman S. Methylation of parental and progeny DNA strands in physarum-polycephalum[J]. Journal of Molecular Biology, 1973, 74(4): 563-572.
[3] Kouzminova E, Selker E U. dim-2 encodes a DNA methyltransferase responsible for all known cytosine methylation inNeurospora[J].TheEmboJournal, 2001, 20(15): 4309-4323.
[4]MartienssenRA,ColotV.DNAmethylationandepigeneticinheritanceinplantsandfilamentousfungi[J].Science, 2001, 293(5532): 1070-1074.
[5]ChachadiVB,ChengH,KlinkebielD,etal. 5-Aza-2′-deoxycytidineincreasessialylLewisXonMUC1bystimulatingbeta-galactoside:alpha2,3-sialyltransferase6gene[J].InternationalJournalofBiochemistry&CellBiology, 2011, 43(4): 586-593.
[6] 李 伟, 施明亮, 毕京鹏, 等.DNA甲基转移酶抑制剂5-氮杂-2′-脱氧胞苷的抗胃肠道肿瘤机制研究[J]. 中国生化药物杂志, 2015, 35(2):80-83.LiWei,ShiMingliang,BiJingpeng,etal.MechanismofDNAmethyltransferaseinhibitor,5-Aza-2′-deoxycytidineagainstcolorectalandgastriccancer[J].ChineseJournalofBiochemicalPharmaceutics, 2015, 35(2):80-83. (inChinese)
[7] 辛 琪. 瑞氏木霉纤维素酶基因转录因子功能及染色质修饰在酶基因转录调控中的作用研究[D]. 济南:山东大学, 2013.XinQi.FunctionalanalysisoftranscriptionfactorsandtheinvolvementofchromatinmodificationinthetranscriptionregulationofcellulasegeninTrichodermareesei[D].Jinan:ShandongUniversity,2013.(inChinese)
[8] 张 伟. 化学表观遗传修饰法研究海葵来源月状旋孢腔菌代谢产物多样性初探[D].青岛:中国海洋大学,2014.ZhangWei.PreliminaryexplorationonthesecondarymatebolitesfromtheseaAnemone-Derivedfunguscochlioboluslunatususingchemicalepigeneticmodification[D].Qingdao:OceanUniversityofChina,2014.(inChinese)
[9] 孙鉴昕.表观遗传修饰剂对三株刺松藻内生真菌次级代谢产物生物活性的影响[D].青岛,青岛科技大学,2016.SunJianxin.Theeffectofepigeneticmodificationonthebiologicalactivityofsecondarymetabolitesofthreestrainsofendophyticfungifromcodiumfragile[D].Qingdao:QingdaoUniversityofScience&Technology, 2016.(inChinese)
[10] 刘云凤.两株中国南海柳珊瑚来源真菌次级代谢产物及其抗菌活性研究[D].青岛:中国海洋大学,2015.LiuYunfeng.Thesecondarymetabolitesandantimicrobialactivitiesoftwogorgonian-derivedfungifromtheSouthChinasea[D].Qingdao:OceanUniversityofChina, 2015.(inChinese)
[11]VasanthakumariMM,JadhavSS,SachinN,etal.Restorationofcamptothecineproductioninattenuatedendophyticfungusonre-inoculationintohostplantandtreatmentwithDNAmethyltransferaseinhibitor[J].WorldJournalofMicrobiology&Biotechnology, 2015, 31(10): 1629-1639.
[12] 林剑青,赵西西,贺竹梅.基于转录组测序的黄曲霉对5-氮杂胞苷应答机制研究[C]// 第四届全国微生物基因组学学术研讨会论文集,济南:[s.n.],2012: 1.LinJianqing,ZhaoXixi,HeZhumei.ResponsemechanismofAspergillusflavusto5-Azacytidinebasedonsequencingoftranscriptome[C]//ProceedingsoftheFourthNationalSymposiumonMicrobialGenomics.Jinan:[s.n.],2012: 1. (inChinese)
[13]YangKunlong,ZhuangZhenhong,ZhangFeng,etal.InhibitionofaflatoxinmetabolismandgrowthofAspergillusflavusinliquidculturebyaDNAmethylationinhibitor[J].FoodAdditivesandContaminants:PartA,2015,32(4):554-563.
[14]YangKunlong,LiangLinlin,RanFanlei,etal.TheDmtAmethyltransferasecontributestoAspergillusflavusconidiation,sclerotialproduction,aflatoxinbiosynthesisandvirulence[J].ScientificReports,2016,6: 23259.
[15]GhoseT.Measurementofcellulaseactivities[J].PureandAppliedChemistry, 1987, 59(2): 257-268.
[16]JeonJ,ChoiJ,LeeGW,etal.Genome-wideprofilingofDNAmethylationprovidesinsightsintoepigeneticregulationoffungaldevelopmentinaplantpathogenicfungus,Magnaportheoryzae[J].ScientificReports, 2015, 5: 8567.
[17]LoganPC,PonnampalamAP,RahnamaFA,etal.TheeffectofDNAmethylationinhibitor5-Aza-2′-deoxycytidineonhumanendometrialstromalcells[J].HumanReproduction,2010,25(11):2859-2869.
[18]ArmstrongRN,ColyerHA,SharpeDJ,etal. 5-aza-2′-deoxycytidine,aDNAmethylationinhibitor,inducesmiRNAexpressionchangesinacutemyeloidleukaemiacelllinesthattranscendsubtype[J].BritishJournalofHaematology,2011,153(1):14-15.
[19]ChenTaiping,LiEn.StructureandfunctionofeukaryoticDNAmethyltransferases[J].CurrentTopicsinDevelopmentalBiology, 2004, 60:55-89.
[20]ChristmanJK.5-Azacytidineand5-aza-2′-deoxycytidineasinhibitorsofDNAmethylation:mechanisticstudiesandtheirimplicationsforcancertherapy[J].Oncogene,2002,21(35):5483-5495.
[21] 龚映雪,台 艳,肖文娟,等.酵母多基因表达载体在纤维素生物转化中应用[J].深圳大学学报理工版,2010, 27(1):82-87.GongYingxue,TaiYan,XiaoWenjuan,etal.Constructionofsaccharomycescerevisiaeintegratedexpressionvectoranditsapplicationincellulosebioconvesion[J].JournalofShenzhenUniversityScienceandEngineering, 2010, 27(1):82-87.(inChinese)
【中文责编:晨 兮;英文责编:艾 琳】
Effect of 5-Aza-2′-deoxycytidine on the expression of cellulases inTrichodermareesei
Zhou Jiaojiao, She Weiyi, Wang Haoru, Xie Ning, and Tian Shengli†
College of Life Science and Marine Science, Shenzhen University, Shenzhen Key Laboratory of Microbial Genetic Engineering,Shenzhen 518060, Guangdong Province, P.R.China
Filamentous fungusTrichodermareeseiQM9414weretreatedwithdifferentconcentrationsofchemicalreagent5-Aza-2′-deoxycytidineinordertoexploreepigeneticregulatorymechanismofDNAmethylationoncellulaseexpression.Thenthecellulaseactivitieswithfilterpaperandcarboxymethylcellulose-Naenzymaticactivitieswereexamined.Real-timefluorescentquantitativePCR(RT-qPCR)wasusedtoanalyzetheexpressionsofcellulasegenecbh1,egl1,activatorgenexyr1,andmetabolicrepressorgenecre1andace1inthetreatedT.reeseiQM9414strains.Methylationstatusofupstreamofgenecbh1,egl1,xyr1,cre1andace1wasdetecedbymethylationspecificPCR(MS-PCR)analysis.Theresultsillustratethatthe0.1mmol/LtreatedstainsmanifestthehighestenzymaticactivitiesincludingfilterpaperandCMC-Naenzymaticactivities, 30%and53%higherthanthoseofthestartingstrainrespectively.RT-qPCRrevealsthattheexpressionlevelsofthegenecbh1,egl1,xyr1arealsohigherthanthoseofstartingstrain,whiletheexpressionsofgenecre1andace1arenotsignificantlychanged.FurtheranalysisbyMS-PCRindicatesthatthenon-methylatedstatusesofupstreamofgenecbh1,egl1,xyr1arehigherthanthoseofthestartingstrain,aswellasthegenecre1andace1arenotobviouslyvary.Furthermore,DNAmethyltransferasebytheWesternblotanalysisandDNAmethylationquantificationshowthattheexpressionlevelsofmethyltransferasetreatedwith5-Aza-2′-deoxycytidinearelowerthanthatofthestartingstrain,andthemethylationlevelsofgenomicDNAalsodecrease.Inshort,thecellulaseactivitiesofT.reeseiQM9414significantlyincreaseaftertreatmentwith5′-Aza.Theexpressionofcbh1,egl1andxyr1genesmayberelatedtoDNAmethylationbyDNAmethyltransferaselevel,andfinallyregulatecellulasegenesexpression.
filamentous fungus;Trichodermareesei(T.reesei); 5-Aza-2′-deoxycytidine(5′-Aza);DNAmethylation;DNAmethyltransferase;methylationspecificPCR(MS-PCR)
:Zhou Jiaojiao, She Weiyi, Wang Haoru, et al.Effect of 5-Aza-2′-deoxycytidine on the expression of cellulases inTrichodermareesei[J]. Journal of Shenzhen University Science and Engineering, 2017, 34(2): 122-131.(in Chinese)
Q
A
10.3724/SP.J.1249.2017.02122
国家自然科学基金资助项目(31601014);深圳市科技计划资助项目(JCYJ20150525092940997)
周娇娇(1988—),女,深圳大学硕士研究生,研究方向:微生物学.E-mail:1021834020@qq.com
Received:2016-09-29;Accepted:2016-12-21
Foundation:National Natural Science Fundation of China (31601014);Shenzhen Science and Technology Research Foundation(JCYJ20150525092940997)
† Corresponding author:Prefessor Tian Shengli.E-mail:sltian@szu.edu.cn
引 文:周娇娇,佘炜怡,王浩入,等.5-氮杂-2-脱氧胞苷对里氏木霉产纤维素酶的影响[J]. 深圳大学学报理工版,2017,34(2):122-131.
