家蚕MBP-Bmlp7蛋白的克隆表达及免疫学鉴定
2017-03-27蔡德丰杨平常刘志刚夏立新
曹 会,蔡德丰,杨平常,刘志刚,夏立新
1)深圳大学医学部,呼吸疾病国家重点实验室深圳大学变态反应分室,广东深圳518060;2)深圳市儿童医院检验科,广东深圳 518026

【生物工程 / Bioengineering】
家蚕MBP-Bmlp7蛋白的克隆表达及免疫学鉴定
曹 会1,蔡德丰2,杨平常1,刘志刚1,夏立新1
1)深圳大学医学部,呼吸疾病国家重点实验室深圳大学变态反应分室,广东深圳518060;2)深圳市儿童医院检验科,广东深圳 518026
克隆表达家蚕蚕蛹30 kD(1 kD=1 u)脂蛋白家族成员Bmlp7(Bombyxmorilipoprotein7)的融合蛋白,鉴定其致敏原性.合成Bmlp7的基因后连接至载体质粒pMAL-C5e上,在大肠杆菌BL21中诱导表达出麦芽糖结合蛋白(maltosebindingprotein,MBP)-Bmlp7,纯化后,利用Westernblot鉴定MBP-Bmlp7融合蛋白与家蚕过敏患者血清中特异性免疫球蛋白E(immunoglobulinsE,IgE)的结合能力.结果显示,纯化得到了纯度较高的MBP-Bmlp7融合蛋白,且该融合蛋白能够与家蚕过敏患者血清特异性IgE结合,说明Bmlp7是家蚕中一种潜在的致敏原.
免疫学;家蚕;30kD脂蛋白;表达纯化;免疫印迹;融合蛋白;免疫原性
家蚕作为一种重要的经济昆虫在中国已有近五千年的养殖历史,所产丝绸远销海内外,又因其蛹富含蛋白等营养物质[1],所以在我国很多地区都有食用蚕蛹的习惯.因接触蚕丝、丝绸和因食用蚕蛹引发的过敏反应的病例已有报道[2-3].现在已知,大多数的家蚕过敏是由特异性免疫球蛋白E(immunoglobulinsE,IgE)介导的I型过敏反应[2],临床主要表现为过敏性皮炎、肺炎、哮喘及更为严重的过敏性休克.由于家蚕过敏的普遍性与严重性,及蚕蛹食品安全的重要性,所以对家蚕过敏原的研究具有重要意义.
家蚕30kD(1kD=1u)脂蛋白家族是5龄蚕新出现的特异性变应原[4-5],包含18个成员[6].至今,该蛋白家族中哪些成员是过敏原尚不清楚.本研究合成了该蛋白家族中高表达Bmlp7的基因,构建原核表达载体,表达纯化重组蛋白,鉴定该蛋白与家蚕过敏患者血清中特异性IgE的结合能力.
1 材料与方法
1.1 标本与主要试剂
1.1.1 血清标本
家蚕过敏患者血清由深圳市儿童医院提供.
1.1.2 主要试剂
Amylose亲和柱(美国NEB公司);电泳及转膜装置(美国Bio-Rad公司);偶联辣根过氧化物酶(horseradishperoxidase,HRP)的鼠抗人IgE(美国SouthernBiotech公司);聚氰基丙烯酸正丁酯(bicinchoninicacid,BCA)蛋白定量试剂盒(北京索莱宝公司).
1.2 研究方法
1.2.1 基因合成及克隆表达载体的构建
从GeneBank网站下载Bmlp7蛋白的基因序列(登陆号:XM_012694938.1), 委托金斯瑞(南京)生物科技有限公司合成,并将其连接至pMAL-c5e质粒上.将重组质粒转化进大肠杆菌(Escherichiacoli,E.coil)BL21感受态细胞内,碱裂解法提取质粒,并用BamH I和HindⅢ进行双酶切鉴定.
1.2.2MBP-Bmlp7融合蛋白的诱导表达
将pMAL-Bmlp7重组质粒转化进E.coilBL21感受态细胞内,涂布至含氨苄青霉素的Luria-Bertani(LB)固体培养基上,37 ℃培养16h.选取单个菌落接种于含氨苄青霉素(质量浓度为50μg/mL)的LB液体培养基中,37 ℃,150r/min,培养16h.取上述菌液2mL分别加入到两瓶20mL含氨苄青霉素的LB培养基(含葡萄糖2g/L)中,37 ℃,200r/min,培养2h,加入终浓度为1mmol/L的异丙基-β-D-硫代吡喃半乳糖苷 (isopropylβ-D-1-thiogalactopyranoside,IPTG),将一瓶置于37 ℃,200r/min,继续培养4h;另一瓶置于16 ℃,150r/min,培养20h.进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (sodiumdodecylsulfate-polyacrylamidegelelectrophoresis,SDS-PAGE),SDS-PAGE浓缩胶(丙烯酰胺质量分数为5%)电压设为60V,分离胶(丙烯酰胺质量分数为10%)电压设为140V,电泳结束后,凝胶用考马斯亮蓝染色15min,脱色液脱至蛋白条带清晰,观察MBP-Bmlp7融合蛋白在高温(37 ℃)和低温(16 ℃)两种条件下的表达情况.
1.2.3Amylose亲和柱纯化MBP-Bmlp7融合蛋白
依照上述步骤,在37 ℃条件下大量表达目的蛋白.将大量表达的菌液离心收集沉淀,加入30mL的Column缓冲液(成分为20mmol/LTris-HCl、200mmol/LNaCl和1mmol/L的EDTA),超声破碎20min,于4 ℃、10 000r/min离心20min收集上清,并使用孔径为0.4μm的滤膜过滤,待用.于4 ℃条件下,Amylose亲和柱用10倍柱体积的column缓冲液平衡,上样约30mL,使融合蛋白挂柱,用8倍体积的column缓冲液洗脱杂蛋白,最后用Elution缓冲液(column缓冲液+10mmol/Lmatlose)洗脱目的蛋白,收集分装,于-80 ℃保存.使用BCA蛋白定量试剂盒定量蛋白,SDS-PAGE鉴定纯化的效果.
1.2.4Western-blot鉴定MBP-Bmlp7融合蛋白的免疫原性
使用湿转法(恒定电流300mA,60min)将聚丙烯酰胺凝胶中的蛋白质转移至聚偏二氟乙烯膜(polyvinylidenefluoride,PVDF膜)上,用含脱脂奶粉(质量分数为50g/L)的Western杂交膜清洗液(TrisbufferedsalinewithTween-20,TBST;由20mmol/L的Tris、150mmol/L的NaCl和体积分数为0.1%的吐温-20配制而成,调节pH=7.4)室温下封闭1h,封闭结束后,用TBST洗涤5min,将该PVDF膜放入槽中;按照体积比为1∶5将家蚕过敏患者的混合血清在含脱脂奶粉(质量分数为50g/L)的TBST中稀释,将稀释后的血清加入槽中并使其覆盖PVDF膜,4 ℃孵育过夜,孵育完成后,用TBST洗膜3次,每次5min;按体积比为1∶2 000加入稀释的偶联了HRP的鼠抗人IgE,室温孵育1h,之后再用TBST洗膜3次,每次5min;PVDF膜用电化学发光(electro-chemi-luminescence,ECL)的发光液在暗室中反应并成像.
2 实验结果
2.1pMAL-Bmlp7重组表达载体的鉴定
将Bmlp7基因碱基插入到pMAL-C5e质粒中,经过BamH I和HindⅢ双酶切鉴定,图1的核酸胶结果显示,双酶切所得片段长度与Bmlp7理论长度基本一致,约720碱基对(basepair,bp).

图1 重组pMAL-Bmlp7表达载体的双酶切鉴定Fig.1 Identification of the recombinant plasmid pMAL-Bmlp7 by restriction enzyme digestion
2.2MBP-Bmlp7融合蛋白的诱导表达及纯化
将含有pMAL-Bmlp7重组质粒的E.coilBL21加入到含有氨苄青霉素及葡糖糖的LB培养基中进行扩增培养,加入终浓度为1mmol/L的IPTG诱导目的蛋白的表达,经SDS-PAGE发现目的蛋白在高温(37 ℃)及低温(16 ℃)两种条件下都为可溶性表达,且表达量基本一致.利用Amylose亲和柱纯化MBP-Bmlp7融合蛋白,图2的SDS-PAGE结果显示,在约70kD处有目的蛋白条带出现,该条带与MBP-Bmlp7的理论相对分子质量(72.2kD)基本一致.

图2 融合蛋白MBP-Bmlp7的诱导表达及纯化Fig.2 Expression and purification of fusion protein MBP-Bmlp7
2.3MBP-Bmlp7融合蛋白的免疫学鉴定
选用家蚕过敏患者的混合血清作为一抗,对MBP-Bmlp7融合蛋白的免疫原性进行鉴定,并选用尘螨过敏患者血清和正常人血清作为阴性对照.同时以家蚕过敏患者混合血清作为一抗,鉴定MBP蛋白的免疫原性.图3结果显示,MBP-Bmlp7融合蛋白与家蚕过敏患者血清的特异性IgE结合,同时依据MBP蛋白条带为阴性,也可以进一步推测Bmlp7蛋白与血清特异性IgE结合.
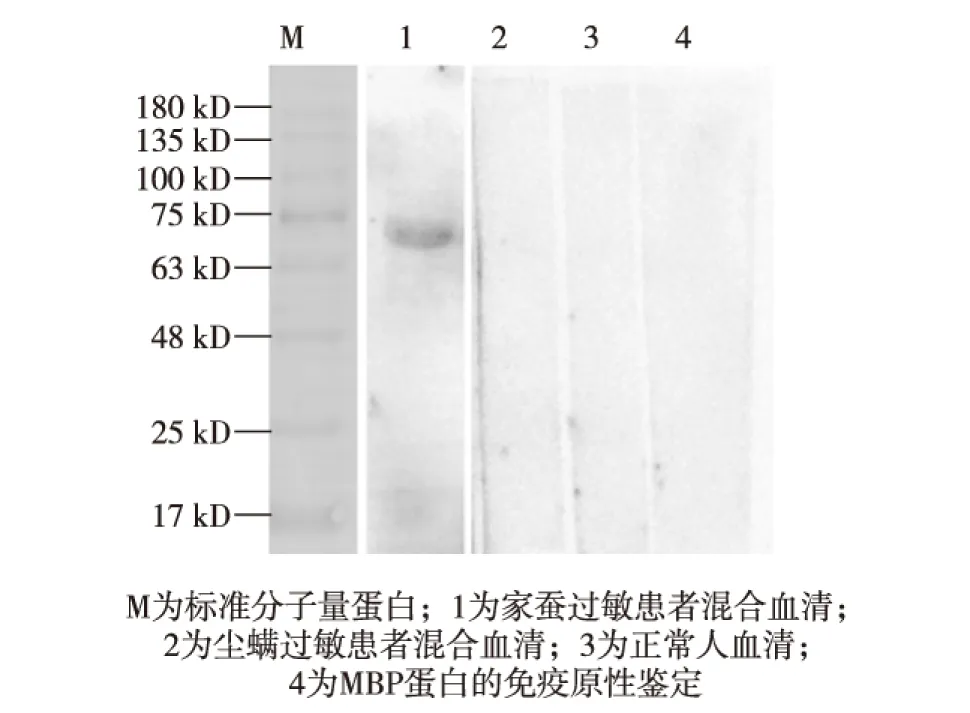
图3 MBP-Bmlp7融合蛋白的western blotting分析Fig.3 Analysis of IgE reactivity of fusion protein MBP-Bmlp7 by western blotting
3 讨 论
变态反应性疾病在世界各国的发病率约为10%~30%[7],且随着工业化的进程和人民生活质量的提高呈上升趋势.变态反应性疾病严重影响了人们的生活质量[8].
蔡国胜等[9-10]早在1989及1990年就先后报道了17例和51例蚕蛹性哮喘的病例.1994年王旭东等[11]对3个养蚕场90名工人进行了调查研究,发现有75.6%的工人因职业性接触而出现不同程度的呼吸道过敏症状, 其中15.6%的工人患有职业性哮喘.因食用蚕蛹而引发过敏的例子也常有报道[12].李维中等[13]利用蚕蛹粗浸液成功建立了小鼠哮喘模型,进一步证实了蚕蛹的过敏原性.
刘志刚等[14]对家蚕变应原tropomyosin进行了克隆表达,Westernblotting结果显示,该过敏原与病人血清有26%的阳性反应率.Zuo等[15]利用双向电泳从家蚕中寻找到了过敏原Bomm9,且证实该蛋白可能引起哮喘.胡维等[16-17]分别克隆表达了家蚕蚕蛹过敏原CPH30与表皮蛋白RR-2基序63前体(CPR63),并进行了抗原表位的预测,结果显示,重组的CPH30和CPR63都具有免疫原性,前者潜在的B细胞表位在第57~69位和第150~158位氨基酸区段,后者的B细胞表位在第21~40、37~56、47~66、64~83位氨基酸区段.同年,Jeong等[18]从热处理后的家蚕蚕蛹中找到一种新的热稳定过敏原27kD糖蛋白,且该过敏原的重组蛋白与家蚕过敏患者血清有33.3%的阳性反应率.
张杰等[19]利用Westernblot发现蚕蛹粗提液中主要过敏原是位于80kD和30kD的蛋白条带,并且在与IgE的反应中,30kD蛋白的反应强度高于80kD蛋白条带.通过质谱分析,发现这些30kD蛋白属于30kD脂蛋白家族.然而,对于30kD脂蛋白家族中哪些成员是致敏原尚不完全清楚.
本研究使用生物信息学及分子生物学手段,从Genebank网站下载Bmlp7蛋白的基因序列,合成后将其连接至pMAL-c5e质粒上,再将其转化进E.coilBL21中,诱导表达得到了分子量约为72.2kD的MBP-Bmlp7(MBP相对分子质量为42.5kD)融合蛋白,通过Amylose亲和柱纯化得到了纯度较高的目的蛋白.从免疫印迹结果可以看出,Bmlp7蛋白与家蚕过敏患者血清特异性IgE结合较强.
结 语
鉴定过敏原对于过敏性疾病的诊断与治疗具有重要的意义.家蚕是重要的昆虫过敏原,本研究通过克隆表达家蚕30kD脂蛋白家族成员的融合蛋白,鉴定出Bmlp7是一种潜在的过敏原,不仅为临床的诊断与治疗提供了依据,也为进一步深入研究与探索30kD脂蛋白家族成员奠定了基础.蚕蛹作为一种高蛋白、营养丰富的食物,此研究对蚕蛹食品安全有重要意义.
/ References:
[1] 邓明鲁. 中国动物药资源[M]. 北京:中国中医药出版社, 2007. Deng Minglu. Chinese animal medicine resources[M]. Beijing: China Press of Traditional Chinese Medicine, 2007.(in Chinese)
[2] Borelli S, Stern A, Wüthrich B.A silk cardigan inducing asthma[J].Allergy,1999,54(8):900-901.
[3] 袁水林,邹 丽,穆利霞,等.蚕蛹蛋白过敏与综合利用的研究进展[J].食品工业科技,2015, 36(18):375-380. Yuan Shuilin, Zou Li, Mu Lixia, et al. Research progress on the comprehensive utilization and allergy of silkworm protein[J].Science and Technology of Food Industry,2015,36(18):375-380.(in Chinese)
[4] 刘志刚, 张 杰, 林 格. 家蚕30 kD特异性变应原的分析、纯化与质谱鉴定[J]. 昆虫学报, 2007, 50(2):101-105. Liu Zhigang, Zhang Jie, Lin Ge. Analysis, purification and identification of the 30 kD specific allergen ofBombyxmoriusingmassspectrometry[J].ActaEntomologicaSinica, 2007, 50(2):101-105.(inChinese)
[5] 赵绮华,李 文,陈丽金,等.采用Westernblotting的方法分析蚕蛹致敏原成份[J].广西医学,2006, 28(1):43-45.ZhaoQihua,LiWen,ChenLijin,etal.AnalyzingtheallergencomponentsofsilkwormchrysalisbyWesternblotting[J].GuangxiMedicalJournal,2006,28(1):43-45.(inChinese)
[6]SunQuan,ZhaoPing,LinYing,etal.Analysisofthestructureandexpressionofthe30Kproteingenesinsilkworm,Bombyxmori[J].InsectScience,2007,14(1):5-14.
[7]FiocchiA,PawankarR,Cuello-GarciaC,etal.Worldallergyorganization-mcmasteruniversityguidelinesforallergicdiseaseprevention(GLAD-P):probiotics[J].TheWorldAllergyOrganizationJournal,2015,8(1):4.
[8] 刘志刚,杨成彬,闫 浩,等.Balb/c小鼠花生过敏模型的建立及发病机理[J].深圳大学学报理工版,2012, 29(2):165-170.LiuZhigang,YangChengbin,YanHao,etal.Establishmentandpathogenesisofmousepeanutallergymodel[J].JournalofShenzhenUniversityScienceandEngineering, 2012,29(2):165-170.(inChinese)
[9] 蔡国胜, 毛叶凤. 蚕蛹性哮喘17例报告[J]. 中国临床研究, 1989(3):10-11.CaiGuosheng,MaoYefeng. 17casesofasthmacausedbysilkworm[J].ChinaJournalofClinicalResearch, 1989(3):10-11.(inChinese)
[10] 蔡国胜, 毛叶风. 蚕蛹性哮喘51例报告[J]. 中华劳动卫生职业病杂志, 1990,8(4):232-233.CaiGuosheng,MaoYefeng. 51casesofasthmacausedbysilkworm[J].ChineseJournalofIndustralHygieneandOccupationalDiseases, 1990,8(4):232-233.(inChinese)
[11] 王旭东, 郑珊珊, 张宏誉,等. 养蚕工人职业性哮喘与特异性IgE水平[J]. 中国医学科学院学报, 1994,16(5):323-327.WangXudong,ZhengShanshan,ZhangHongyi,etal.AstudyofoccupationalasthmaandspecificIgEinsericultureworkers[J].ActaAcademiaeMedicinaeSinicae, 1994,16(5):323-327.(inChinese)
[12] 马照成,徐瑞彩,阎庆娟,等.蚕蛹致急性重症过敏性休克1例[J].中国麻风皮肤病杂志,2014, 30(11):646.MaZhaocheng,XuRuicai,YanQingjuan,etal. 1casesofacutesevereanaphylacticshockcausedbysilkworm[J].ChinaJournalofLeprosyandSkinDiseases,2014,30(11):646.(inChinese)
[13] 李维中, 詹政科, 杨成彬,等. 蚕蛹粗提浸液致敏小鼠哮喘模型的建立[J]. 免疫学杂志, 2014,3(2):162-165.LiWeizhong,ZhanZhengke,YangChengbing,etal.Establishmentofanasthmaticmousemodelsensitizedbysilkwormchrysaliscrudeextraction[J].ImmunologicalJournal, 2014,3(2):162-165.(inChinese)
[14] 刘志刚, 邬玉兰, 杨 睿, 等. 家蚕变应原tropomyosin基因的克隆表达、纯化及其免疫学活性鉴定[J]. 免疫学杂志, 2009(6):655-658.LiuZhigang,WuYulan,YangRui,etal.Cloning,expression,andpurificationofsilkworm(Bombyxmori)tropomyosingeneandidentifyingitsimmunologicalcharacteristics[J].ImmunologicalJournal, 2009(6):655-658.(inChinese)
[15]ZuoJianhong,LeiMingsheng,YangRui,etal.Bomm9fromBombyxmoriisanovelproteinrelatedtoasthma[J].MicrobiologyandImmunology, 2015, 59(7): 410-418.
[16] 胡 维,梁志林,王良录,等.家蚕蚕蛹过敏原CPH30的表达、纯化、免疫学鉴定及B细胞抗原表位预测[J].昆虫学报,2016, 59(4):377-381.HuWei,LiangZhilin,WangLianglu,etal.Expression,purification,immunologicalidentificationandBcellepitopeanalysisofallergenCPH30insilkworm(Bombyxmori)pupae[J].ActaEntomologicaSinica,2016,59(4):377-381.(inChinese)
[17] 梁志林, 李 平, 刘志刚,等. 家蚕蚕蛹过敏原表皮蛋白RR-2基序63前体(CPR63)的克隆表达、纯化鉴定及生物信息学分析[J]. 免疫学杂志, 2016,32(7):565-569.LiangZhilin,LiPing,LiuZhigang,etal.Clone,expression,purification,immunologicalidentificationandbioinformaticsanalysisofallergencuticularproteinRR-2motif63precursor(CPR63)ofsilkworm(Bombyxmori)pupae[J].ImmunologicalJournal, 2016,32(7):565-569.(inChinese)
[18]JeongK,SonM,LeeJune,etal.Allergeniccharacterizationof27-uaglycoprotein,anovelheatstableallergen,fromthepupaofsilkworm,Bombyxmori[J].JournalofKoreanMedicalScience,2016,31(1):18-24.
[19] 张 杰,刘志刚,林 格,等.家蚕蚕蛹变应原的鉴定、分离与纯化[J].热带医学杂志,2006, 6(5):496-498.ZhangJie,LiuZhigang,LinGe,etal.IdentificationandpurificationofproteinallergensfrompupaofBombyxmori[J].JournalofTropicalMedicine,2006,6(5):496-498.(inChinese)
【中文责编:晨 兮;英文责编:艾 琳】
Expression and immunological identification of MBP-Bmlp7 fromBombyxmori
Cao Hui1, Cai Defeng2, Yang Pingchang1, Liu Zhigang1, and Xia Lixin1†
1)Health Science Center, State Key Laboratory of Respiratory Disease for Allergy at Shenzhen University,Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China 2) Department of Clinical Laboratory, Shenzhen Children’s Hospital, Shenzhen 518026, Guangdong Province, P.R.China
The open reading frame of Bmlp7 from silkworm (Bombyxmori)waschemicallysynthesizedandclonedintoplasmidpMAL-c5e.TherecombinantplasmidpMAL-Bmlp7wastransformedintoE.coliBL21andexpressedasafusionprotein.Theproteinwaspurifiedusingamyloseaffinitychromatographyandpurifiedtohomogeneity.TheimmunoglobulinsE(IgE)reactivityofthefusionproteinwasassayedbywesternblottingusingseraofpatientwithsilkwormallergies.TheresultsshowthattheBmlp7fusionproteinhasIgEreactivitywiththepatientsera.
immunology;Bombyxmori; 30kDlipoprotein;expressionandpurification;immunoblotting;fusionprotein;immnogenicity
:Cao Hui, Cai Defeng, Yang Pingchang, et al. Expression and immunological identification of MBP-Bmlp7 fromBombyxmori[J]. Journal of Shenzhen University Science and Engineering, 2017, 34(2): 117-121.(in Chinese)
R392.8;Q
A
10.3724/SP.J.1249.2017.02117
国家自然科学基金资助项目(81273275);广东省科技计划资助项目(2014A020212422)
曹 会(1991—),男,深圳大学硕士研究生.研究方向:医药生化与分子生物学.E-mail:huiencao@163.com
Received:2016-09-13;Accepted:2016-11-01
Foundation:National Natural Science Foundation of China(81273275);Science and Technology Plan of Guangdong Province(2014A020212422)
† Corresponding author:Professor Xia Lixin.E-mail: xialixin@126.com
引 文:曹 会,蔡德丰,杨平常,等. 家蚕MBP-Bmlp7蛋白的克隆表达及免疫学鉴定[J]. 深圳大学学报理工版,2017,34(1):117-121.
