四种海洋藻华甲藻与红色赤潮藻的化学互感作用(allelopathy)初步研究
2017-03-26胡章喜唐赢中
王 欢, 胡章喜, 唐赢中
四种海洋藻华甲藻与红色赤潮藻的化学互感作用(allelopathy)初步研究
王 欢1, 2, 胡章喜1, 3, 唐赢中1, 3
(1. 中国科学院 海洋生态与环境科学重点实验室, 中国科学院海洋研究所, 山东 青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室, 山东 青岛 266071)
化学互感作用或化感作用(allelopathy)在浮游植物的种群相互作用及动力学过程中起着重要的调节控制作用, 已经成为有害藻华生态学研究中的重要领域。但在被研究的种类和化感作用的规律等方面还存在众多空白。本研究选取分离自中国和美国近海的重要藻华甲藻多环旋沟藻()、米氏凯伦藻()、剧毒卡尔藻()、短沟别什莱藻(), 在相同的试验条件下(72 h共培养)观察其与另一种常见的藻华甲藻红色赤潮藻()的化感作用。实验结果显示化感效应随种类和特别是起始细胞密度比率而分别表现为抑制或促进共存种的生长。与起始细胞密度为500个/mL的红色赤潮藻共培养时, 多环旋沟藻起始密度为250个/mL时促进红色赤潮藻生长, 米氏凯伦藻苏澳株和短沟别什莱藻在细胞密度低于1 000个/mL时促进红色赤潮藻生长, 同时起始密度为5 000~50 000个/mL的剧毒卡尔藻被红色赤潮藻促进生长。但是, 米氏凯伦藻深圳湾株在细胞密度500个/mL以上时均抑制红色赤潮藻生长, 多环旋沟藻在起始密度大于250个/mL时开始抑制红色赤潮藻生长, 且抑制效应在起始密度2 500个/mL时接近100%。米氏凯伦藻的化感作用在不同株系间表现出显著差异。结果说明有害藻华甲藻之间的化感作用表现出复杂的形式, 随着作用的种类和互相之间的密度比率变化而有互相促进、抑制或一方抑制(或促进)另一方等作用, 这对进一步认识藻华甲藻的种群动力学具有重要意义。
化感作用; 红色赤潮藻(); 多环旋沟藻(); 剧毒卡尔藻(); 米氏凯伦藻(); 短沟别什莱藻()
过去几十年来由微藻特别是甲藻引起的有毒有害藻华在世界范围内频繁暴发, 且若干藻华类甲藻还有向其他国家和地区扩散的趋势[1-2]。藻华暴发的原因既包含外部原因如海域的富营养化、全球气候变暖, 也源于众多藻华种特殊的生物(态)学特征, 如藻华种高营养吸收能力、快速增殖能力、混合型营养、对特殊环境条件的耐受性、特殊生活史、对捕食者的毒性、对竞争者的化学互感作用等[3]。
化学互感作用, 或化感作用(allelopathy), 是指植物之间通过向环境释放化学物质发生的种间相互作用[4], 理论上有抑制性化感作用和促进性化感作用二种, 但前者受到更多关注。比如双胞旋沟藻()能抑制海洋原甲藻()的生长[5], 三角褐指藻()和锥状斯氏藻()均对东海原甲藻()的生长产生强烈的抑制作用,三角褐指藻、锥状斯氏藻和东海原甲藻均对眼点拟微绿球藻()的生长产生显著促进作用[6]。亚历山大藻属的若干种类因为能产生麻痹性贝毒素(PSP毒素)而受到特别关注, 但其中好几种产生的强烈抑制共存藻类的化感物质却被证明并非PSP毒素[7]。可以说, 现已被研究过的重要藻华种类几乎都表现出对共存藻类一定程度的抑制性化感作用, 化感作用因而被认为是一种普遍存在于藻华藻类的竞争策略, 也因此被作为赤潮发生和演变的关键过程之一受到越来越多的关注[1,8]。所以, 研究每一种重要的藻华种类是否存在和如何表现出对共存种的化感作用对认识其藻华发生过程具有重要意义。但现有研究主要关注有害藻华种类对非藻华或非有害种类的化感作用, 而且更多的是发现和注重藻华种类对共存种的抑制性化感作用。
本研究中5种受试种类都是重要的藻华类甲藻, 特别是多环旋沟藻()、米氏凯伦藻()、红色赤潮藻()和剧毒卡尔藻(), 都是世界性的常见赤潮藻。多环旋沟藻能产生致鱼死亡的藻毒素, 也已证明具有很强的化感效应[9]。近20年来, 我国海域多次暴发多环旋沟藻赤潮, 如广东珠江河口海域曾多次暴发, 2010年浙江温岭也暴发了多环旋沟藻赤潮[10]。自1998年以来, 中国海域暴发的米氏凯伦藻赤潮屡见报道, 其中浙江和福建海域是赤潮暴发热点地区, 根据《中国海洋灾害公报》, 2012年在福建和浙江海域的3次米氏凯伦藻赤潮给渔业和当地养殖业造成超过20亿元的巨大经济损失。剧毒卡尔藻自20世纪50年代被发现以来, 先后在美洲、南美洲、欧洲、澳洲等多处都发生过大规模赤潮, 造成大量鱼类死亡[11-12]。中国海域先后也于2003年、2005年在香港和浙江海区发生剧毒卡尔藻赤潮[13]。短沟别什莱藻()也是世界性赤潮种, 但在我国于2009年才被首次发现报道, 目前对该种类的各种研究都还很少[14]。红色赤潮藻为世界性广布种, 也是最常见的赤潮原因种之一[15-16], 也是近年来我国多个海域的主要有害赤潮种[17-18], 如2011年烟台四十里湾的赤潮主要由红色赤潮藻引起[19]。该种在本研究中被作为化感作用受试生物的模式种, 因为若干研究表明该种对化感作用敏感[20-21]。我们相信通过研究这几种藻华甲藻之间的化感作用对认识浮游植物之间化感作用的复杂性和海洋有害藻华的发生等都具有非常重要的意义。
1 材料与方法
1.1 藻种来源及培养条件
实验所有藻种均为以毛细管分离法获得的单细胞培养系。多环旋沟藻CP1于2006年分离自美国纽约Paconic湾, 米氏凯伦藻(深圳湾株)于2012年12月分离于广东省深圳湾, 米氏凯伦藻(苏澳株)于2012年5月分离于福建省苏澳岛近岸, 剧毒卡尔藻于2014年4月分离于河北省北戴河近海, 短沟别什莱藻于2014年7月通过取自于浙江南麂列岛底泥中孢囊萌发, 毛细管分离建立纯培养, 分离、纯化后于实验室保种并长期培养, 红色赤潮藻CCMA256于2011年2月分离于厦门近海水样。
培养藻所用海水取自青岛市汇泉湾天然海水, 经沙滤处理后, 再用0.22 μm混合纤维膜过滤, 121℃高压灭菌后, 转至经高压灭菌的锥形瓶内, 添加f/2母液配制成培养液[22], 培养液盐度为32。藻种置于光照培养箱中培养, 培养温度为20℃±1℃, 光照强度为100 μmol /(m2·s), 光暗比为12 h︰12 h。整个培养、转接种、取样等过程均于超净工作台中无菌操作。
1.2 实验设计
红色赤潮藻在本研究中作为受试生物模式种, 以比较多环旋沟藻、米氏凯伦藻、剧毒卡尔藻和短沟别什莱藻对其化感作用的强度与形式。将指数生长中期(一般为接种后第4~5天)的红色赤潮藻分别与指数生长中期的多环旋沟藻、米氏凯伦藻、剧毒卡尔藻、短沟别什莱藻进行72 h两两共培养。实验在6孔细胞培养板中进行, 培养总体积为10 mL, 实验开始时全部重新添加 f/2培养基以保证实验中营养盐充足。实验组和对照组均设置3个平行, 综合考虑这几种甲藻在实验室的生长情况和各自细胞体积大小, 两两共培养实验组中初始密度设计见表1, 其中其他几种藻与红色赤潮藻的共培养实验中, 均设置红色赤潮藻的单培养对照组, 起始密度均用新鲜培养基调整到500个/mL。空白对照组为各种藻以对应密度单独培养。共培养结束时(72 h)取出10 mL 藻液, 用鲁哥试剂固定, 在显微镜下用浮游植物计数框计数, 每个样品计数3次, 取其平均值, 记录细胞密度。
1.3 数据处理与统计分析
计算共培养藻之间的抑制率按下式:
抑制率(Inhibition rate)=(1–treatment/control)100%[23]。其中,treatment表示实验组的藻细胞密度,control表示对照组的藻细胞密度。
试验结果的差异显著性检验采用SPSS21.0软件进行单因素方差分析, 取显著性水平为<0.01差异极显著,<0.05差异显著, 在图表中分别以“**”或“*”表示, 其中差异显著组计算其百分比抑制率, 并进行作图呈现结果。
表1 共培养组不同实验藻种初始密度设计

Tab.1 Initial cell densities of the respective test species in different co-culturing experiments
2 结果
2.1 多环旋沟藻与红色赤潮藻的化感作用
不同起始细胞密度的多环旋沟藻(250、500、1250和3500个/mL)在与起始密度500个/mL的红色赤潮藻共培养72 h后, 二种藻的最终密度与空白对照组均表现出显著差异(图1a, b;<0.05)。多环旋沟藻在低密度时(250个/mL)促进红色赤潮藻的生长, 但随着细胞密度的增加, 对红色赤潮藻表现为抑制效应且随密度增加而加强, 在3 500个/mL 时, 抑制率为99%。多环旋沟藻初始密度为250、500、1250、2 500和3 500个/mL时, 生长抑制率分别为–13%(促进)、10%、50%、98%、99%, 各组抑制率表现出显著差异(图1c;<0.05)。但与此同时, 多环旋沟藻初始密度为250、500、1 250、3 500个/mL时, 红色赤潮藻对其生长抑制率分别为16%、8%、39%和13%, 各组抑制率表现出显著差异(图1d,<0.05)。
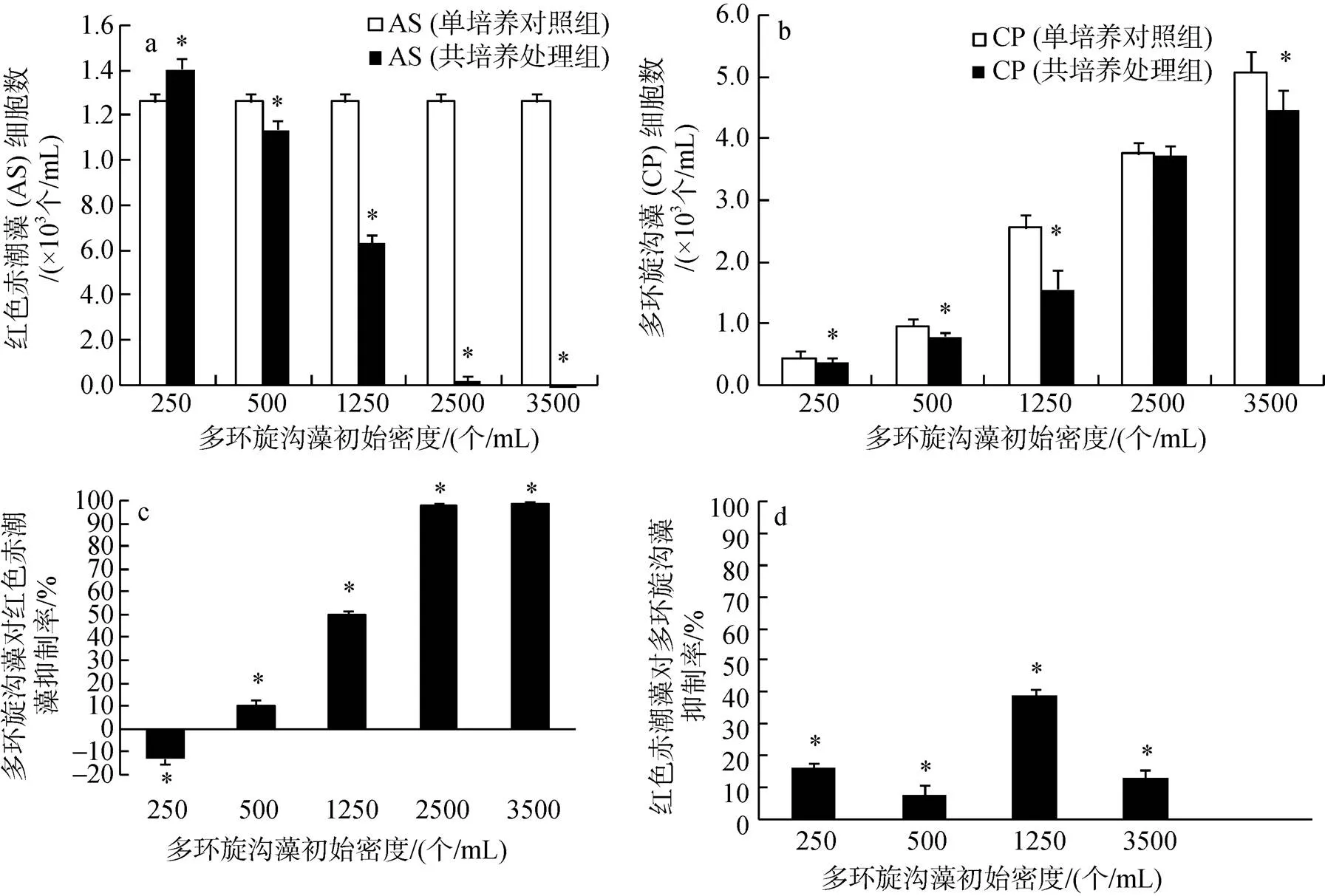
图1 C. polykrikoides (CP)与A. sanguinea (AS)72 h共培养时互相之间的化感作用
a. AS的细胞密度变化; b. CP的细胞密度变化; c. CP对AS的抑制率(%); d. AS对CP的抑制率(%)
a. Cell density of AS; b. Cell density of CP; c. Inhibition of CP on AS; d. Inhibition of AS on CP
2.2 剧毒卡尔藻与红色赤潮藻的化感作用
红色赤潮藻与剧毒卡尔藻72 h共培养后, 剧毒卡尔藻初始密度为5 000、25 000、37 500个/mL的处理组与空白对照组均表现出显著差异(图2a;<0.05)。当初始密度为5 000个/mL时, 剧毒卡尔藻促进红色赤潮藻的生长, 生长促进率达40%; 剧毒卡尔藻初始密度大于25 000个/mL时显著抑制红色赤潮藻生长(图2a)。在与500个/mL的红色赤潮藻72 h共培养条件下, 剧毒卡尔藻所有初始密度高于12 500个/mL的处理组中细胞终密度均显著高于其相应的对照组(One-way ANOVA,<0.05), 即红色赤潮藻促进剧毒卡尔藻生长(图2b)。剧毒卡尔藻初始密度为12 500、25 000、37 500、50 000个/mL时, 红色赤潮藻对其生长促进率分别为82%、54%、14%和15%, 各组生长促进率表现出显著差异(图2d;<0.05)。
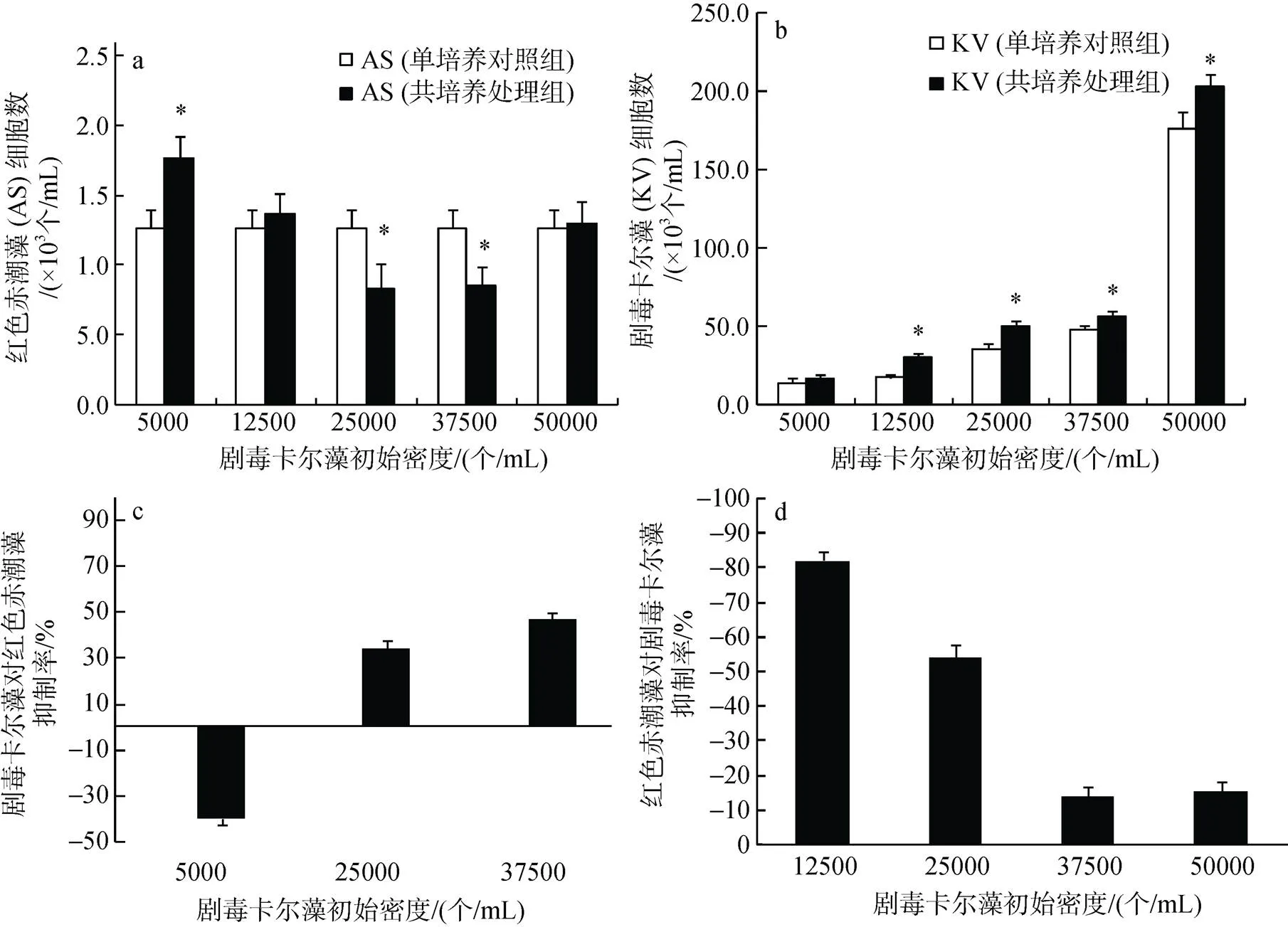
图2 K. veneficum (KV)与A. sanguinea (AS)72 h共培养时互相之间的化感作用
a. AS的细胞密度变化; b. KV的细胞密度变化; c. KV对AS的抑制率(%); d. AS对KV的抑制率(%)
a. Cell density of AS; b. Cell density of KV; c. Inhibition of KV on AS; d. Inhibition of AS on KV
2.3 短沟别什莱藻与红色赤潮藻的化感作用
不同起始细胞密度的短沟别什莱藻(500和1 000个/mL)与起始密度为500个/mL的红色赤潮藻72 h共培养后, 后者的最终细胞密度都显著高于对应对照组(图3a; One-way ANOVA,<0.05), 短沟别什莱藻显著地促进了红色赤潮藻的生长(生长促进率分别为95%和69%)(图3b)。
2.4 米氏凯伦藻与红色赤潮藻的化感作用
在起始细胞密度为500和1 000个/mL条件下与500个/mL的红色赤潮藻72 h共培养后, 二株分离自不同海域的米氏凯伦藻(分离自东海的苏澳株和南海的深圳湾株)分别表现为对红色赤潮藻的显著促进与抑制作用, 即苏澳岛株促进红色赤潮藻生长(促进率分别为9.8%和5.4 %)(图4a和4c), 而深圳湾株表现为抑制作用, 抑制率为21%和59%(图4b和4d; One-way ANOVA,<0.05)。
3 讨论与结论
海洋微藻的化感作用可以发生在微藻周围以及整个环境体系中[8,24-27], 某些微藻释放的有毒化感物质能抑制其他微藻的生长, 从而在竞争中占据优势而成为赤潮暴发的潜在诱因[28-29]。影响浮游植物化感效应最重要的因素就是所涉及的浮游植物种类[8]。例如, 东海原甲藻对锥状斯氏藻的生长没有显著影响, 但对眼点拟微绿球藻具有强烈的化感抑制作用[6]。球形棕囊藻()释放溶血毒素影响其他藻类的生长, 从而在环境资源竞争中占据优势, 维持自身的需要[30]。在关于海洋微藻化感作用研究中大多数选择的是藻华原因种和非藻华种, 且多数结果显示为抑制效应。本研究发现不同赤潮甲藻种类与红色赤潮藻之间的化感作用差异明显, 既有促进效应, 也有抑制效应以及低浓度促进但高浓度抑制三种情况。其中多环旋沟藻在初始细胞密度在3 500个/mL情况下对红色赤潮藻的抑制效果最强, 抑制率最高时几乎100%。米氏凯伦藻深圳湾株也对红色赤潮藻表现较强的化感抑制作用。另外红色赤潮藻对低细胞密度的多环旋沟藻也有较强的抑制效应。红色赤潮藻能显著促进剧毒卡尔藻的生长, 短沟别什莱藻和米氏凯伦藻苏澳株能显著促进红色赤潮藻的生长。另外, 多环旋沟藻在低浓度下, 其对红色赤潮藻有生长促进作用, 随着多环旋沟藻密度的增加, 对红色赤潮藻表现出抑制作用, 密度越大抑制作用越大。可见, 不同的细胞密度比可以显著影响化感效应的性质(抑制或促进)和强度。细胞密度不同, 释放至环境的化感物质浓度不同, 在未达到可以明显抑制共存种的浓度前则可能被作为营养物质吸收从而起生长促进作用。本实验选取种类均为藻华原因种, 说明在特定环境条件下它们都可能在竞争上获得优势。当这些藻华种在不同的密度比情况下, 其竞争结果也可能不同, 哪一种成为优势种, 化感作用可能在其中起到重要作用。

图3 B. brevisulcata (BB)与A. sanguinea (AS) 72 h共培养时互相之间的化感作用
a. AS的细胞密度变化; b. BB对AS的促进率(%)
a. Cell density of AS; b. Inhibition of BB on AS
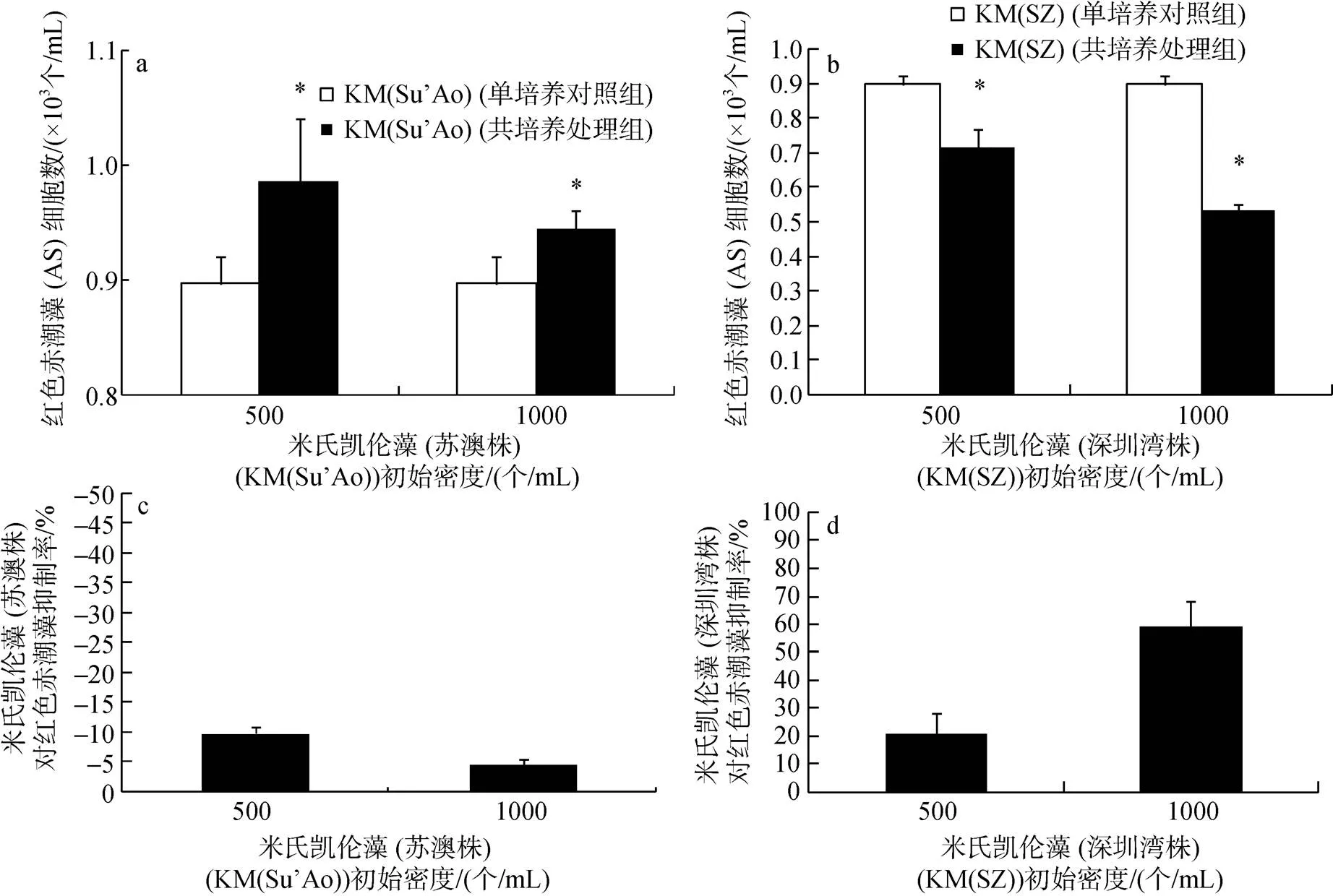
图4 K. mikimotoi (Su’Ao、SZ)与A. sanguinea (AS) 72 h共培养时互相之间的化感作用
a. AS和(Su’Ao)共培养时的细胞密度变化; b. AS和(SZ)共培养时的细胞密度变化; c.(Su’Ao)对AS的促进率(%); d.(SZ) 对AS的抑制率(%)
a. Cell density of(Su’Ao); b. Cell density of(SZ); c. Inhibition of(Su’Ao) on AS; d. Inhibition of(SZ) on AS
同种浮游植物对目标藻的化感作用具有株间差异性: 如亚历山大藻纽约株对有最大的化感抑制效应, 加拿大株则相对较弱[31]。本研究中也观察到同样的株间差异性: 在红色赤潮藻起始密度为500个/mL时, 米氏凯伦藻苏澳株在起始密度低于1 000个/mL时促进红色赤潮藻生长, 而同样细胞密度的米氏凯伦藻深圳湾株则显著抑制红色赤潮藻的生长。这种株间差异既可能是种群遗传分化决定, 也可能是不同株的暂时生理差异或健康状况造成的(如同样温度条件下化感物质的产率不同)。更确切的答案有赖于有关化感物质的准确鉴定和定量研究, 甚至需要化感物质合成涉及的有关基因的明确认识。
研究这几种藻华原因种之间化感作用对了解藻华原因种之间、浮游植物与其他生物之间的相互作用及作用机理具有重要意义。本研究在发现藻华甲藻化感作用的复杂性质之外, 还为未来的研究提出了更多的问题, 比如藻华原因种之间的化感物质是什么?促进作用一定是通过化感物质被作为营养物质吸收实现的吗?化感作用在每一个藻华种类形成藻华过程中究竟起了多大作用?等等。这都需要进一步深入研究, 如通过化感物质的提取和相关实验验证说明。另外, 由于室内实验与野外实验条件有差异, 真正地解释野外藻华原因种之间的化感作用更需要较为长期的探讨。
[1] Anderson D M, Cembella A D, Hallegraeff G M. Progress in understanding harmful algal blooms: Paradigm shifts and new technologies for research, monitoring, and management[J]Marine Science, 2012, 4(4): 143-176.
[2] Heisler J, Glibert P M, Burkholder J M, et al. Eutrophication and harmful algal blooms: A scientific consensus[J]Harmful Algae, 2008, 8(1): 3-13.
[3] 唐赢中, 胡章喜, 邓蕴彦. 休眠孢囊作为甲藻有害藻华年际频发和地理扩散一种关键机制的研究进展[J]海洋科学集刊, 2016, 51: 132-147. Tang Yingzhong, Hu Zhangxi, Deng Yunyan. Characteristical life history (resting cyst) provides a mechanism for recurrence and geographic expansion of harmful algal blooms of dinoflagellates: A review[J]. Studia Marina Sinica, 2016, 51: 132-147.
[4] Rice E. Allelopathy[M]2nd Edition. London: Academic Press, 1984: 43-78.
[5] 刘静雅, 双胞旋沟藻对共存浮游植物的化感效应及机制研究[D]. 广州: 暨南大学, 2013. Liu Jingya. Allelopathic Effects and Mechanisms ofon Competing Phytoplankton[D]. Guangzhou: Ji’nan University, 2013.
[6] 张珍萍. 四种海洋微藻间的化感作用效应研究[D]. 广州: 暨南大学, 2005.Zhang Zhenping. Effect of Allelopathy among Four Marine Microalgea[D]. Guangzhou: Ji’nan University, 2005.
[7] Zhu M, Tillmann U. Nutrient starvation effects on the allelochemical potency of(Dinophyceae)[J]Marine Biology, 2012, 159(7): 1449- 1459.
[8] Granéli E, Hansen P J, Allelopathy in Harmful Algae: A Mechanism to Compete for Resources?[M]. Berlin Heidelberg: Springer, 2005: 189-201.
[9] Tang Y Z, Gobler C J. Allelopathic effects ofisolates and blooms from the estuaries of Long Island, New York, on co-occurring phytoplankton[J]Marine Ecology Progress, 2010, 406(12): 19-31.
[10] 余文翎, 龙华, 王红霞, 等. 我国东海藻华新记录种多环旋沟藻赤潮事件分析[J]海洋开发与管理, 2011, 28(11): 66-68. Yu Wenling, Long Hua, Wang Hongxia, et al. Analysis of red tide events of the newly recorded species ofin East China Sea[J]. Ocean Development and Management, 2011, 28(11): 66-68.
[11] Bjornland T, Tangen K. Pigmentation and morphology of a marine(Dinophyceae) with a major carotenoid different from peridinin and fucoxanthin[J]Journal of Phycology, 1979, 15(4): 457-463.
[12] Deeds J R, Kibler S R, Tester P A, et al. Geographic strain variation in toxin production in(Dinophyceae) from southeastern estuaries of the United States[J]. Harmful Algae, 2002, 11(4): 145- 147.
[13] Zhou C, Fernández N, Chen H, et al. Toxicological studies of(Dinophyceae) isolated from East China Sea[J]. Toxicon, 2011, 57(1): 9-18.
[14] Luo Zhaohe, Yang Weidong, Xu Bin, et al. First record of(Dinophyceae) from Chinese coasts, withmorphological and molecular characterization of the strains[J]Chinese Journal of Oceanology and Limnology, 2013, 31(4): 835-845.
[15] Erdner D L. Centers for oceans and human health: a unified approach to the challenge of harmful algal blooms[J]Environmental Health, 2008, 7 Suppl 2(2): S2.
[16] Kudela R M, Ryan J P, Blakely M D, et al. Linking the physiology and ecology ofto better understand harmful algal bloom events: A comparative approach[J]Harmful Algae, 2008, 7(3): 278-292.
[17] Ignatiades L, Gotsisskretas O. A review on toxic and harmful algae in Greek Coastal Waters (E. Mediterranean Sea)[J]Toxins, 2010, 2(5): 1019-1037.
[18] 陈国斌. 厦门海域一次冬季血红哈卡藻赤潮的初步分析[J]福建水产, 2012, 34(5): 392-397. Chen Guobin. Primary analysis on red tide ofin winter in Xiamen Sea [J]. Journal of Fujian Fisheries, 2012, 34(5): 392-397.
[19] 高昊东, 邓忠伟, 孙万龙, 等. 烟台四十里湾赤潮发生与生态环境污染研究[J]中国环境监测, 2011, 27(2): 50-55. Gao Haodong, Deng Zhongwei, Sun Wanlong, et al. Study on the relationship between ecological environmental pollution and red tide occurring in Sishili Bay, Yantai[J]. Environmental Monitoring in China, 2011, 27(2): 50-55.
[20] Tang Y Z, Gobler C J. Sexual resting cyst production by the dinoflagellate: a potential mechanism contributing to the ubiquitous distribution of a harmful alga[J]J Phycol, 2015, 51(2): 298-309.
[21] Xu N, Tang Y Z, Qin J, et al. Ability of the marine diatomsandto inhibit the growth of co-occurring phytoplankton via allelopathy[J]Aquatic Microbial Ecology, 2015, 74(1): 29-41.
[22] 华汝成, 张道南. 海水单细胞藻类的培养与保种[J]集美大学学报: 自然科学版, 1981(1): 100-111. Hua Rucheng, Zhang Daonan. Cultivation and conservation of single cell algae in seawater[J]. Journal of Jimei University (Natural Science), 1981(1): 100-111.
[23] Williamson G B, Richardson D. Bioassays for allelopathy-measuring treatment responses with independent controls[J]Journal Of Chemical Ecology, 1988, 14(1): 181-187.
[24] Roy S, Alam S, Chattopadhyay J. Competing effects of toxin-producing phytoplankton on overall plankton populations in the bay of Bengal[J]Bulletin of Mathematical Biology, 2006, 68(8): 2303-2320.
[25] Prince E K, Myers T L, Kubanek J. Effects of harmful algal blooms on competitors: Allelopathic mechanisms of the red tide dinoflagellate[J]Limnology and Oceanography, 2008, 53(2): 531-541.
[26] Legrand C, Rengefors K, Fistarol G O, et al. Allelopathy in phytoplankton-biochemical, ecological and evolutionary aspects[J]Phycologia, 2003, 42(4): 406-419.
[27] Gobler C J, Lobanov A V, Tang Y Z, et al. The central role of selenium in the biochemistry and ecology of the harmful pelagophyte,[J]The ISME Journal, 2013, 7(7): 1333-1343.
[28] Hassoun M M, Meyer T E, Siqueira P R, et al. VLSI gray-scale morphology processor for real-time NDE image-processing applications[J]Proceedings of Spie, 1990, 1350: 370-379.
[29] Sheng L J, Peng X C, Dong Y W. Growth and hemolytic activities of Phaeocystis globosa Scherffel at different mutrients condition[J]Acta Ecologica Sinica, 2006, 26(3): 780-785.
[30] Prince E K, Poulson K L, Myers T L, et al. Characterization of allelopathic compounds from the red tide dinoflagellate[J]Harmful Algae, 2010, 10(1): 39-48.
[31] Hattenrath-Lehmann T K, Gobler C J. Allelopathic inhibition of competing phytoplankton by North American strains of the toxic dinoflagellate,: Evidence from field experiments, laboratory experiments, and bloom events[J]Harmful Algae, 2011, 11(11): 106-116.
(本文编辑: 张培新)
Preliminary investigation on the allelopathic effects of four common harmful algal bloom (HAB)-forming dinoflagellateson
WANG Huan1, 2, HU Zhang-xi1, 3, TANG Ying-zhong1, 3
(1. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Laboratory of Marine Ecology and Environmental Sciences, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China)
Allelopathy plays an important regulatory role in phytoplankton population interactions and dynamics, and has become an important area in the ecology of harmful algal blooms (HABs). But there are still many unknowns, both in the number of tested species and the general patterns of inter-specific allelopathic interactions. This study investigated the allelopathic effects of four common HAB-forming dinoflagellates,(from New York, USA),,, and(isolated from China), on another common HAB-forming dinoflagellate,. The choice ofas a test model organism in this current study was due to its reported sensitivity to allelopathyUnder our experimental conditions (72 h co-culturing), it was observed that the allelopathic effects varied from positive (growth-stimulating) to negative (growth-inhibiting) depending on the species and in particular the initial cell density ratio. When co-cultured with(initial cell density 500 cells/mL),promoted the growth ofat an initial cell density of 250 cells/mL while(strain Su’Ao) andpromotedat initial cell densities below 1 000 cells/mL. The growth of(with initial cell densities between 5 000 to 50 000 cells/mL) was promoted by. In contrast, with the same initial cell density for(500 cells/mL), the strain offrom Shenzhen Bay inhibited the growth ofat the initial densities > 500 cells/mL, andinhibited the growth ofat initial cell densities >250 cells/mL in a dose-response manner that reached 100% inhibition when the initial density was above 2 500 cells/mL. It is noteworthy that the two strains of(Su’Ao and Shenzhen Bay) exhibited significantly different allelopathic potency. The results demonstrated that the allelopathic interactions among HAB-forming species change from positive to negative, depending on the species and the ratio of initial cell density. We believe that these results will contribute to further understanding of the mechanisms and dynamics of HABs.
Allelopathy;;;;;
Dec. 30, 2016
王欢(1991-), 女, 重庆人, 博士生, 主要从事浮游植物生理生态研究, 电话: 0532-82898850, E-mail: wanghuan14@mails.ucas.ac.cn; 唐赢中,
, 研究员, 博士生导师, E-mail: yingzhong.tang@qdio.ac.cn
P76
A
1000-3096(2017)09-0094-08
10.11759/hykx20161230001
2016-12-30;
2017-03-21
国家自然科学基金重点项目(61533011); 国家基金委-山东省联合基金项目(U1606404); 鳌山科技创新计划项目(2016ASKJ02); 国家基金委-广东联合基金项目(U1301235)
[the National Natural Science Foundation of China projects (61533011); the NSFC-Shandong Joint Fund for Marine Ecology and Environmental Sciences (U1606404); the Scientific and Technological Innovation Project supported by the Qingdao National Laboratory for Marine Science (2016ASKJ02); the NSFC-Guangdong Joint Fund (U1301235)]
