牙鲆17β-HSD1基因克隆及其表达调控的初步研究
2017-03-26梁冬冬范兆飞邹玉霞谭训刚吴志昊
梁冬冬, 范兆飞, 邹玉霞, 谭训刚, 吴志昊, 焦 爽, 李 军, 尤 锋
牙鲆基因克隆及其表达调控的初步研究
梁冬冬1, 2, 3, 范兆飞1, 2, 3, 邹玉霞1, 2, 谭训刚1, 2, 吴志昊1, 2, 焦 爽1, 2, 李 军1, 2, 尤 锋1, 2
(1. 中国科学院 海洋研究所 中国科学院实验海洋生物学重点实验室, 山东 青岛 266071; 2. 青岛海洋科学与技术国家实验室实验海洋生物学与生物技术实验室, 山东 青岛 266071; 3. 中国科学院大学, 北京 100049)
17β-羟类固醇脱氢酶1(17β-HSD1)的主要作用是将雌酮(El)转化为发挥功能的雌二醇(E2)。作者从牙鲆()性腺转录组数据库获得该基因的开放阅读框(ORF)序列, 对其进行了验证, 并分析了该基因在高温、外源性激素处理条件下性腺分化期性腺组织中的差异表达以及cAMP和转录因子(NR5a2和NR0b1)在精巢原代细胞中对该基因表达的作用。结果显示, 牙鲆基因的ORF为873bp, 编码290个氨基酸, 与其他鱼类的有很高的相似性。半定量RT-PCR结果表明, 该基因在卵巢中高表达, 精巢有少量表达, 并且在雌性个体的鳃、头肾、肾、脾、胃和肠中也有表达。实时定量RT-PCR结果显示, 该基因在卵巢或精巢分化的关键时期表达量较高; 在精巢原代培养细胞中, 外源信号分子cAMP及转录因子NR5a2可以显著下调基因的表达(< 0.05), 且呈现剂量效应, 转录因子NR0b1对该基因的调控也与剂量有关。作者推测牙鲆基因在性腺分化中起一定的作用, 其表达受到调控因子的作用, 这些结果将有助于增加对鱼类性腺分化和发育的认识。
牙鲆(); 17β-羟类固醇脱氢酶1; ORF克隆; 表达; 调控
性类固醇激素在鱼类性腺分化过程中非常重要。17β-羟类固醇脱氢酶1(17β-HSD1)作为性激素合成途径中关键酶之一, 在很多物种中的主要作用是将雌酮(El)转化为雌二醇(E2)[1]。在关于人的研究中较为深入, 其在卵巢或胎盘等产类固醇激素的组织中高表达[2], 该基因在乳腺癌患者中表达上调, 导致产生过多的E2, 进而刺激肿瘤内的细胞增殖[3]。在鱼类研究中有一些报道, 如鲶鱼()的主要在卵巢中表达; 有些鱼类也有关于其催化雄激素合成的报道, 如在尼罗罗非鱼()中就可以将雄烯二酮转化成睾酮(T), 尽管效率不高[4-5]。因而, 17β-HSD1参与了E2和T的合成, 在硬骨鱼类的性腺分化和配子形成中起非常重要的作用。在除性腺外的其他组织中也表达并发挥作用, 如该基因在斑马鱼()的皮肤、肌肉和眼等其他组织中有少量表达[6]。
促性腺激素可通过环腺苷单核苷酸(cAMP)-蛋白激酶A(PKA)途径激活或抑制转录因子, 进而调控性类固醇激素合成酶基因的表达[7]。核受体超家族的NR5a2与共转录因子(如类固醇受体共调控因子1、剂量敏感性逆转因子(NR0b1: 核受体超家族的成员)等)相互作用也能调节性类固醇激素合成酶基因的表达[8], 如在NR0b1缺陷小鼠()精巢的Leydig细胞中, 芳香化酶基因表达上调4倍[9]。研究显示, NR5a2和NR0b1两者的相互作用也可以调控性类固醇急性调节基因()、3β-羟类固醇脱氢酶基因()等性激素合成途径上游基因的表达[10-11]。但在鱼类中, 关于NR5a2和NR0b1调控基因表达的报道还几乎未见到。
牙鲆()是中国、日本和韩国重要的海水养殖鱼种, 其雌性个体生长速度大于雄性个体[12], 因此, 研究牙鲆性别决定和性腺分化机制, 从而控制其性别具有很重要的实践价值。牙鲆性别由遗传和环境因素共同决定[13]: 在性腺分化期, 高温或外源睾酮处理牙鲆可使其发育为雄性个体, 而雌二醇处理可使其发育为雌性个体[12, 14]。及其转录因子Foxl2、Dmrt1和Sox9等参与性激素合成途径的下游激素的合成或调控, 进而影响牙鲆性腺分化[15-17]。基因在E2合成途径中是不可或缺的, 但在牙鲆中尚未见到关于该基因的报道。作者通过牙鲆性腺转录组数据获得并验证的开放阅读框(ORF)序列, 拟分析其在雌雄成体组织和性腺分化期性腺中的表达以及在cAMP孵育和过表达NR5a2或NR0b1的精巢原代细胞中的表达, 为进一步丰富对牙鲆性腺分化和发育分子生物学机制的认识提供参考依据。
1 材料和方法
1.1 实验用鱼
成体牙鲆(全长300 mm ± 20 mm)购于山东省青岛市南山水产市场, 暂养于中国科学院海洋研究所水族楼的3 m3充气海水鱼缸内, 暂养时间约30 d, 每天投喂2次商用适口饵料, 并换水2次。分别取3条雄鱼和3条雌鱼的性腺(精巢、卵巢)、脑、心脏、鳃、肝脏、肾、头肾、脾、肌肉、胃、肠、眼等12种组织, 一部分置于加有200 μL Trizol的1.5 mL离心管中, 冻存于液氮, 以备RNA提取。另一部分性腺样品固定于多聚甲醛中用于切片、苏木精-伊红(HE)染色以及镜检鉴定其性别和发育时期[18]。
雌核发育牙鲆幼鱼(遗传型为雌性)参照本实验室已建立的诱导方法诱导和培育获得[19]。设置对照组、28℃(HT组)、雌二醇(E2组)和睾酮(T组)处理实验组, 随机挑选全长12~15 mm的250尾雌核发育幼鱼分别饲养于中国科学院海洋研究所水族楼实验室内的90 L塑料缸中, 每组2个重复, 整个实验时间约120 d。每天换水2~3次, 光周期维持在14L: 10D。对照组、T组和E2组养殖温度为20~22℃; HT组的海水温度用加热棒控制, 且由18℃缓慢上升到28℃, 每天升高2℃, 最终维持在28℃± 0.5℃[20]。HT组和对照组投喂普通饵料; T组和E2组采用投喂饵料方式进行外源性激素处理, 幼鱼每天分别投喂含有5×10–6mg/kg T或E2(Sigma, 美国)的饵料2~6次[18, 21]。T和E2分别溶解在无水乙醇中, 均匀喷洒于饵料上, 黑暗条件下风干。所有处理的持续时期是从幼鱼全长15 mm到120 mm, 之后进行常规培育。分别在幼鱼全长30、40、60、80、110 mm时, 每组随机选取10尾幼鱼, 立即冷冻于液氮。然后取其性腺, 并每5尾幼鱼的样品混样进行RNA提取。每组各取全长150 mm左右的牙鲆20尾, 通过性腺的形态观察和冷冻切片与HE染色进行性别鉴定。
1.2 总RNA提取及模板cDNA的合成
用Trizol(Ambion, 美国)法提取牙鲆成鱼组织和各实验组鱼苗性腺样品的总RNA, 1%琼脂糖凝胶电泳和Nanodrop 2000(Thermo, 美国)分别检测所提取RNA的质量和浓度。按照反转录试剂盒EasyScript®one-step gDNA removal and cDNA synthesis superMix Kit(全式金, 北京)操作步骤将提取的RNA反转录成模板cDNA。
1.3 17β-HSD1基因ORF序列的验证
在牙鲆性腺转录组中, 经NCBI在线比对筛选获得含基因ORF在内的1312bp cDNA序列。用Primer Premier6.0软件设计扩增873bp ORF的引物-oF: 5′-ATGGACAAGAGGGTGGTGCT G-3′和-oR: 5′-TTAGTTTTCCTCGGCTGA GAA-3′, 对其进行测序验证。RT-PCR 25 μL反应体系(含1 μL模板, 10 μmol/L)参考2×Pfu MasterMix(康为世纪, 北京)说明书进行配制, 其反应条件如下: 95℃预变性10 min; 95℃变性30 s, 58℃退火30 s, 72℃延伸1 min, 35个循环; 最后72℃延伸10 min。扩增产物经纯化、连接、转化, 并经蓝白斑筛选和PCR检测, 将阳性克隆菌液送至上海桑尼生物技术有限公司进行测序。测序结果经NCBI在线比对进行确定。
1.4 多序列比对及系统进化树构建
根据cDNA序列, 用BioEdit翻译基因的氨基酸序列, 用DNAman软件进行氨基酸多序列比对, 系统进化树采用软件BioEdit和MEGA5.1的邻接法(Neighbor-Joining, NJ)结合GenBank 上各物种的该基因氨基酸序列进行比对聚类分析而完成的。各物种17β-HSD1氨基酸序列的GenBank数据库注册序列号如下: 斑马鱼(NM_205584)、尼罗罗非鱼(NM_ 001279795)、青鳉(, XM_004071297)、日本鳗鲡(, AY498620)、鲶鱼(KM034751)、小鼠(NM_010475)、大鼠(, NM_ 012851)、牛(, NM_001102365)和人(, NM_000413)。
1.5 半定量RT-PCR
通过半定量RT-PCR检测了基因在牙鲆雌雄个体12种组织中的表达。用Primer Premier6.0软件设计用于组织表达分析的引物序列-qF: 5′-TGAGGCAGATTCTTGAGGTC-3′和-qR: 5′-TTTCGGAAAACAGAGTCGC- 3′。以牙鲆作为内参基因, 其引物序列-qF: 5′-ACTACCTCATGAAGATCCTG-3′和-qR: 5′-TTGCTGATCCACATCTGCTG-3′。RT-PCR 20 μL反应体系(含1 μL模板, 10 μmol/L)参考2× GoldStar MasterMix(康为世纪, 北京)操作说明书配制, 其反应条件如下: 95℃预变性10 min; 95℃变性30 s, 55℃退火30 s, 72℃延伸1 min, 30个循环; 最后72℃延伸10 min。RT-PCR产物进行0.1%琼脂糖凝胶电泳检测。实验进行3次重复。
1.6 实时定量RT-PCR(qPCR)
通过qPCR方法检测了在牙鲆性腺分化期性腺组织中的表达。根据ORF序列用Primer Premier6.0软件设计定量分析引物qRT--F: 5′-CTCTTGGGCACCATCCAGAC CA-3′和qRT--R: 5′-TCTCTTCAACAGGTC GATACC-3′。以牙鲆作为内参基因[22], 其引物序列qRT--F: 5′-GGAATCCACGAGACCAC CTACA-3′和qRT--R: 5′-CTGCTTGCTGATCC ACATCTGC-3′。qPCR 20 μL反应体系(含0.5 μL模板, 10μmol/L)参考TransStart®Top Green qPCR SuperMix(全式金, 北京)操作说明书配制, 其反应条件如下: 94℃预变性30 s; 94℃变性5 s, 55℃退火20 s, 72℃延伸20 s, 40个循环。用Applied Biosystems QuantStudio 6荧光定量PCR仪(Life technologies)进行扩增。实验进行3次重复。基因的相对表达量用2–ΔΔCt方法计算分析。数据用均值±标准误表示。使用SPSS软件(IBM SPSS, Armonk, New York)中的单因素方差分析Dunnett’s检验来对组内基因表达的显著性进行分析(<0.05)。
1.7 cAMP孵育精巢原代细胞
利用体外培养的牙鲆精巢原代细胞, 进行了cAMP(索莱宝, 北京)对基因表达的调控研究。按照本实验室已有的方法进行牙鲆精巢组织的分离和细胞培养[23], 待精巢原代细胞数目达到2.6 × 105时, 用胰酶消化液消化, 混匀, 等体积地铺到6孔板(NEST, 中国)中, 设置3个重复。待细胞长到90%时, 分别用含0、75、150和300 μmol/L cAMP[24]的完全培养基对其进行孵育。72 h后, 收集精巢细胞用于RNA提取, 通过qPCR检测的表达水平。实验进行3次重复。RNA提取方法同1.2, qPCR所需引物和反应条件以及数据分析同1.6。
1.8 细胞转染
在1.7中培养的牙鲆精巢原代细胞同样用于分析转录因子NR5a2和NR0b1对基因表达的调控作用。表达质粒pcDNA3.1-或pcDNA3.1-的构建方法参考已有研究[25]。待6孔板的细胞密度达到90%以上, 根据Lipofectamine 2000(Life, 美国)转染试剂的操作方法, 将0、1、2、3 μg pcDNA3.1-或pcDNA3.1-表达质粒分别进行细胞转染, 48h后, 收集细胞用于RNA提取, 通过qPCR检测的表达水平。实验进行3次重复。RNA提取方法同1.2, qPCR所需引物和反应条件以及数据分析同1.6。
2 结果
2.1 牙鲆17β-HSD1蛋白分子序列比对和系统进化分析
根据转录组数据库中的cDNA序列, 对其ORF区进行了扩增和测序验证, 其ORF为873bp, 编码290个氨基酸。将其氨基酸序列与NCBI数据库中的其他脊椎动物同源基因的氨基酸序列进行多序列比对和系统进化树构建。多序列比对结果显示牙鲆17β-HSD1氨基酸序列与其他物种的同源序列相似度均达到83%以上(图1), 进化树也显示了该基因与尼罗罗非鱼和青鳉的同源基因聚为一簇(图2)。
2.2 17β-HSD1在牙鲆雌雄个体不同组织的差异表达
牙鲆在雌雄成鱼12种组织中的表达如图3所示。由图3可知在精巢、卵巢都有表达, 但呈现雌雄二态性, 卵巢表达量比精巢高。该基因也在雌性个体的鳃、肾、头肾、脾、胃和肠等组织中表达, 但在雄性个体除了精巢外的其他组织中均没有表达。

图1 牙鲆与其他脊椎动物的17β-HSD1氨基酸序列比对结果

图2 脊椎动物17β-HSD1氨基酸序列进化树分析
数值为1 000次迭加后分枝的可信度, 分枝的长度代表氨基酸的差异
Values of the tree represent bootstrap scores of 1000 trials and indicate the credibility of each branch; branch lengths are proportional to the number of amino acid changes
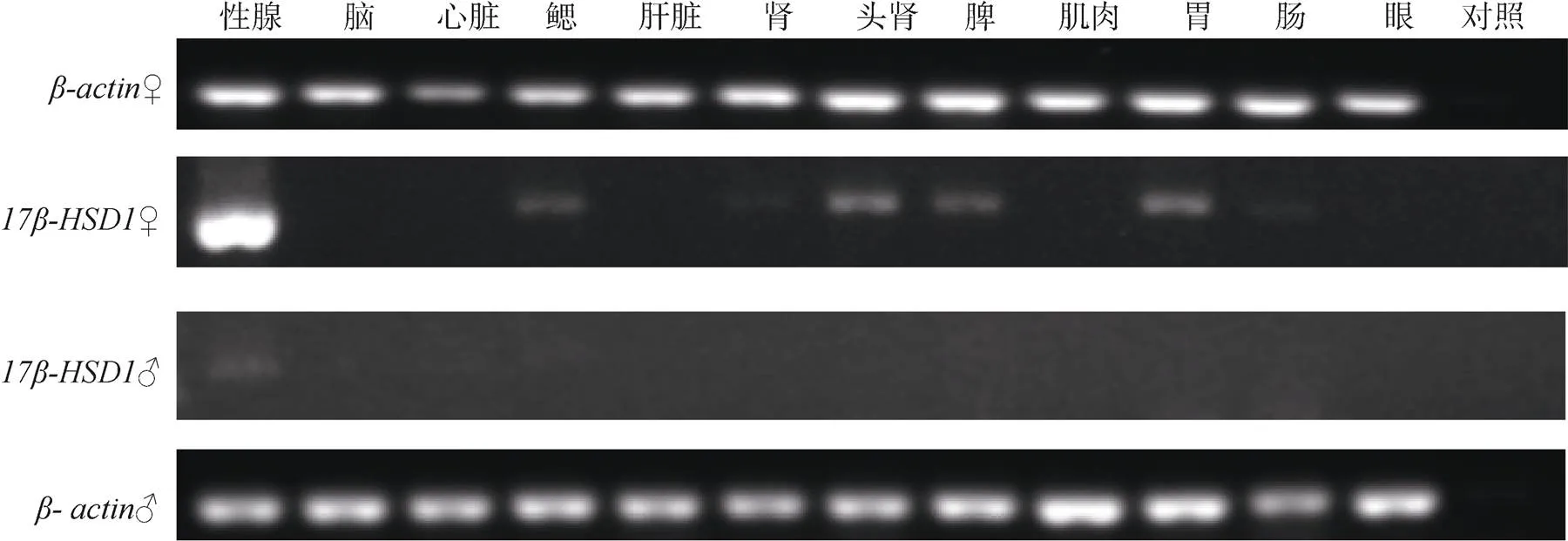
图3 牙鲆17β-HSD1基因在雌雄个体各组织中表达谱
2.3 17β-HSD1在牙鲆性腺分化期的性腺组织中的表达
性别鉴定结果表明, 雌核发育对照组中雌性比率为75%, E2组雌性比率为100%, 而HT和T组雄性比率为100%。在对照组和各处理组中的差异表达如图4所示。对照组中,在卵巢分化期的表达呈下降趋势。E2组中,在卵巢分化时(全长30、40 mm)的表达维持稳定, 而卵巢分化完成后(全长>40mm)则呈上升趋势, 随后呈下降趋势, 但在性腺分化完成后维持在较高水平。卵巢分化时该基因在E2组中的表达水平低于对照组, 但在卵巢分化完成后高于对照组。T组中,在精巢分化时(全长60 mm)呈现高表达, 但在分化前后却都维持较低水平的表达。HT组中的表达与T组类似, 但整体水平要低于T组。
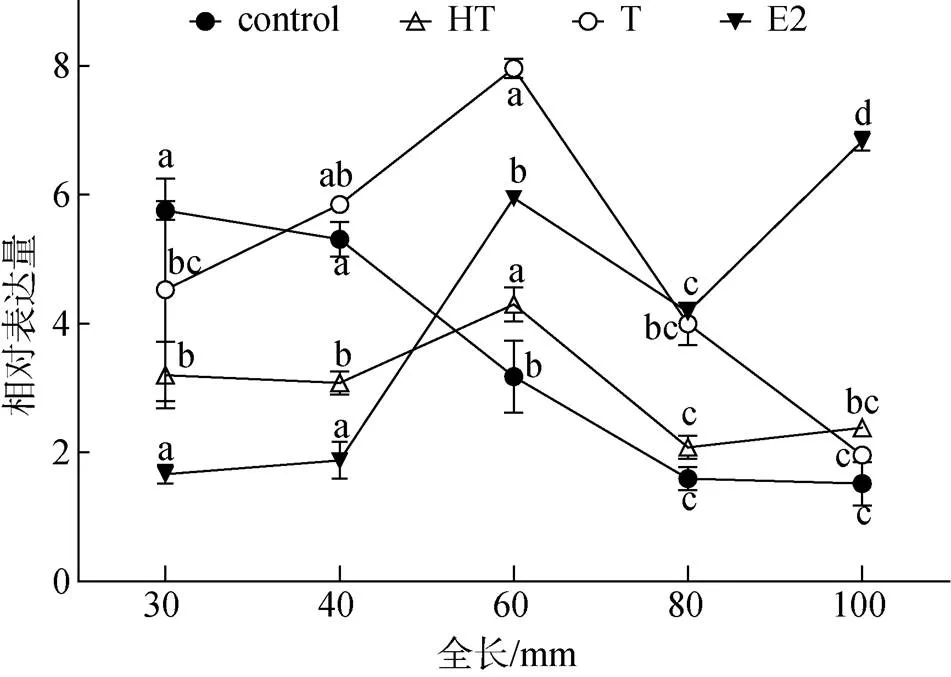
图4 牙鲆17β-HSD1基因在性腺分化期的表达
Control. 对照组; HT. 高温处理组; T. 睾酮处理组; E2. 雌二醇处理组。数据为3个样品均值±标准误, 不同字母(a, b, c, d)表示各处理组内不同时期之间的显著性(<0.05)
Data are the mean ± S.E.M. of three independent samples. Different lowercase letters (a, b, c, d) indicate significant differences between pairs of groups (< 0.05). Control. control group; HT. high temperature treatment group; T. testosterone treatment group; E2. 17β-estradiol treatment group
2.4 信号分子cAMP对17β-HSD1基因表达的调控
在cAMP孵育的牙鲆精巢原代细胞表达水平见图5, 不同浓度的cAMP均可以显著抑制精巢原代细胞中的表达(< 0.05), 但随着浓度的升高抑制效果减弱。
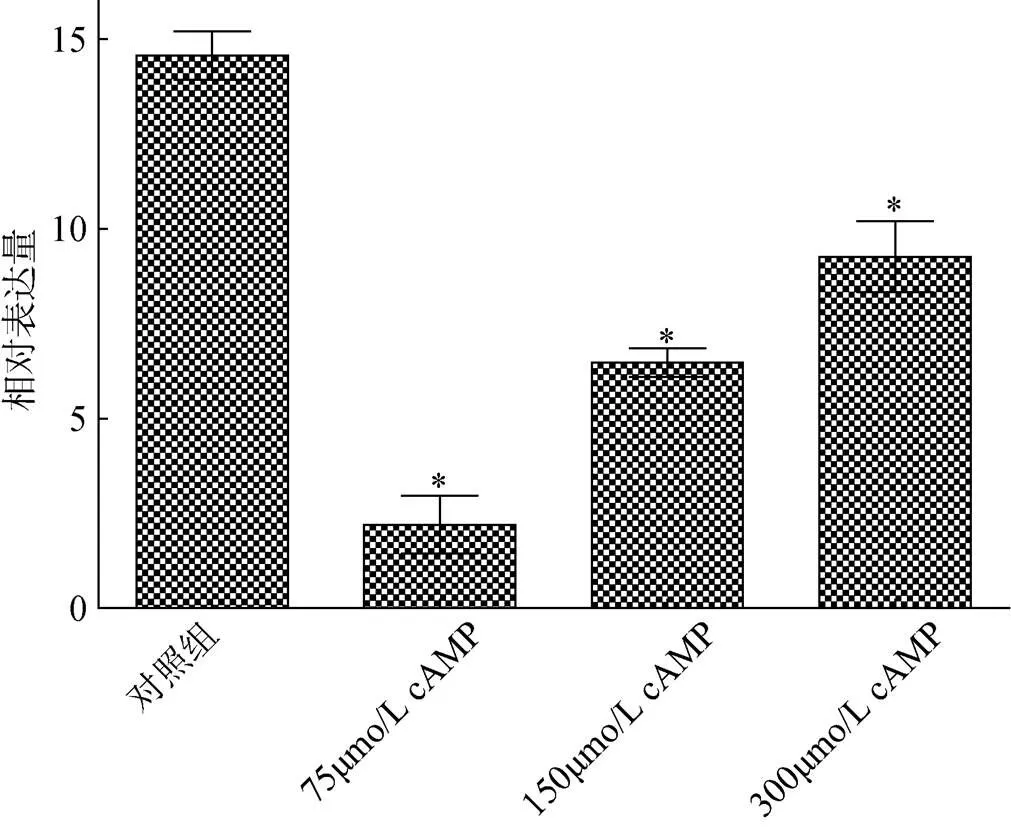
图5 不同浓度的cAMP在牙鲆精巢原代细胞中对17β- HSD1基因表达的调控
对照组. 0 μmol/L cAMP; 数据为3个样品均值±标准误; *.处理组与对照组相比较有显著性(< 0.05)
Control. 0 μmol/L cAMP; Data are the mean ± S.E.M. of three independent samples; *. indicates the significant difference (< 0.05)
2.5 转录因子NR5a2和NR0b1对17β- HSD1基因的调控作用
在过表达转录因子NR5a2和NR0b1的牙鲆精巢原代细胞中的差异表达见图6。细胞转染低浓度(1 g)pcDNA3.1-质粒对精巢原代细胞中的表达无作用, 而较高浓度(2和3μg)pcDNA3.1-质粒可以显著抑制其表达, 且随着浓度的升高抑制效果增强(图6 A)(< 0.05)。转染低浓度(1μg)pcDNA3.1-质粒可显著抑制精巢原代细胞中的表达, 而较高浓度(2 μg) pcDNA3.1-质粒可显著上调基因表达(图6 B)(< 0.05)。
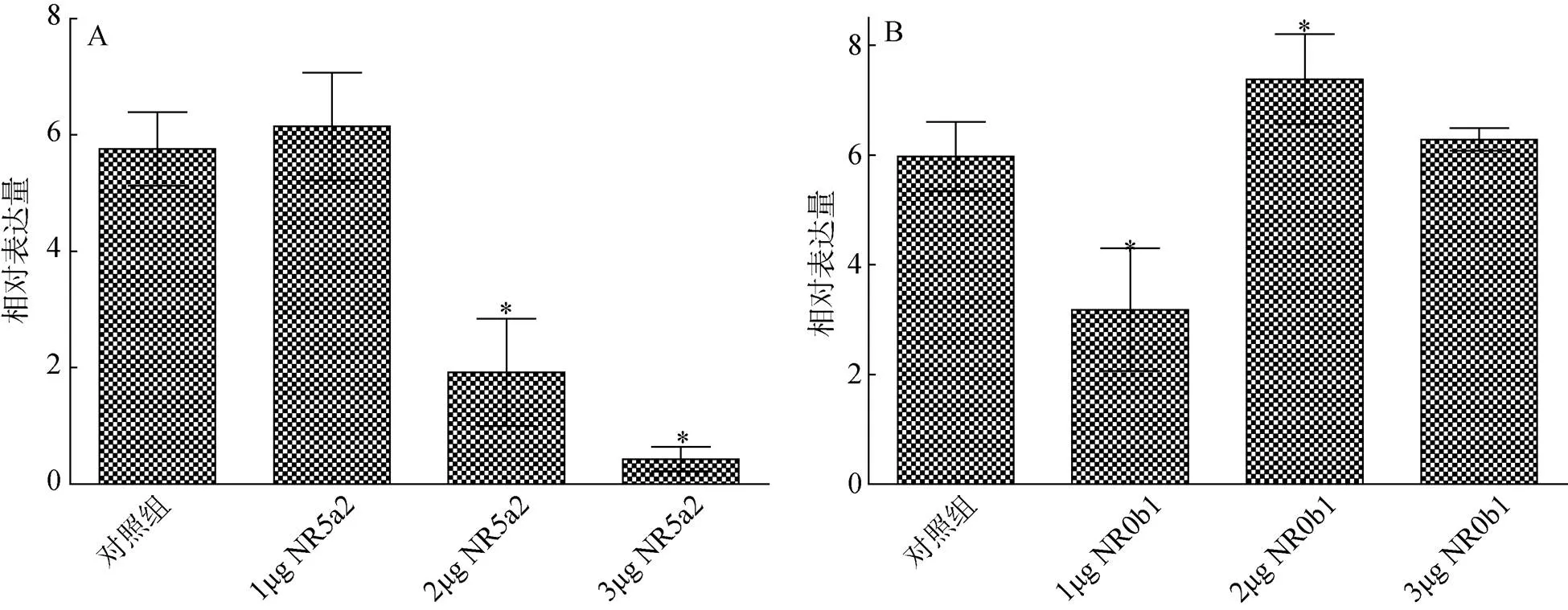
图6 转录因子NR5a2 (A)和NR0b1 (B)在牙鲆精巢原代细胞中对17β-HSD1基因表达的调控
对照组. 0 μg pcDNA3.1-or pcDNA3.1-质粒; 数据为3样品均值±标准误; *. 处理组与对照组相比较有显著性(<0.05)
Control. 0 μg pcDNA3.1-or pcDNA3.1-plasmid; Data are the mean ± S.E.M. of three independent samples; *. indicates the significant difference (< 0.05)
3 讨论
牙鲆基因与其他硬骨鱼类的同源基因有很高的相似性, 系统进化树表明其氨基酸序列与尼罗罗非鱼和青鳉聚为一簇, 进一步验证了从牙鲆中克隆的序列是。半定量RT-PCR结果显示, 牙鲆主要在卵巢中表达, 在精巢中表达较弱, 与斑马鱼和鲶鱼的结果类似[1, 6]。因为主要作用是将El转化为发挥功能的E2[1], 故牙鲆在成体性腺中表达, 可能参与其中性类固醇激素的合成。该基因也在牙鲆雌性个体的鳃、头肾、肾、脾、胃和肠中表达, 在雌鱼鳃中的表达量相对较高, 这是因为在硬骨鱼类的鳃中也能合成11-酮基睾酮所致[26]。至于雌鱼其他几种组织中也表达, 是因为这些组织中也有11-酮基睾酮或者E2合成, 还是该基因可能参与其他代谢途径激素合成尚不得而知。有意思的是, 该基因在牙鲆雄鱼除精巢以外的组织均不表达, 在其他鱼类中还未见到类似的报道, 其缘由仍需进一步研究。
性激素在硬骨鱼类性腺分化和配子发育中起重要作用[27], 而性激素合成是在类固醇激素合成酶的催化作用下完成的。17β-HSDs是一类重要类固醇激素合成酶, 主要参与E2和T的合成[28],则是17β-HSDs家族成员之一。报道显示, 尼罗罗非鱼不参与早期性腺分化性类固醇激素的合成, 但在配子发生中的作用是必需的[5]。而在鲶鱼中, 该基因却在性腺分化期的早期表达, 显示早期性腺分化和发育中该合成酶也起一定作用[1]。雌核发育牙鲆在遗传学上的性别是雌性的, 其性别表型形成会受到性腺发育期的外源因素如水温和性激素的影响, 高温和外源雄激素处理可以产生雄性表型, 而外源雌激素处理则可以产生雌性表型, 故是研究鱼类性腺分化的理想材料之一[20]。本研究对照组中, 牙鲆在分化前的性腺表达量相对较高, 说明该基因可能在卵巢分化前起作用。E2组,的表达量在卵巢分化完成后显著升高, 且最后维持较高水平, 提示该基因可能参与其后卵巢的发育。HT组,的表达在精巢分化时显著上调, 暗示该基因可能参与精巢的分化; 精巢分化完成后该基因表达量下调, 推测它可能不参与精巢后期的发育过程。该基因在T组表达水平的变化趋势与HT组非常类似, 在精巢分化期均有高表达, 进一步表明该基因参与精巢的分化。但HT组的表达水平比T组较低, 其原因还不得而知。性腺分化完成后在E2组的表达水平较对照组的高, 作者推测E2可能通过下丘脑-垂体-性腺轴上调该基因的表达, 但还需进一步研究。
促性腺激素可以通过cAMP-PKA信号转导途径磷酸化相应的转录因子来调控性类固醇激素合成相关基因如、和等的表达[29-32]。但关于cAMP和转录因子等对表达调控的报道还很少。为探究此调控作用, 作者用cAMP孵育牙鲆精巢原代细胞, 结果显示cAMP可以显著抑制的表达, 作用效果存在剂量效应。联丁酰基cAMP可以穿透细胞膜进入细胞[24], 直接影响该基因启动子区TATA框结合位点来抑制该基因表达。cAMP对表达的调控机制很复杂, 仍需进一步的验证。NR5a2和NR0b1是类固醇激素合成中重要的转录因子[32], 调控较多的类固醇激素合成酶基因的表达。人的NR5a2可以调控类固醇激素合成酶基因的表达[31], 高浓度NR5a2可能与启动子区作用位点结合来抑制其在精巢原代细胞中的表达。在小鼠中, NR0b1抑制的表达, 从而降低雌二醇的产生[9]。本研究中, NR0b1在牙鲆精巢原代细胞中也能调控的表达来参与雌二醇的合成, 且是剂量依赖性的调控。
综上所述,基因主要在牙鲆卵巢和精巢中表达, 且在精巢分化和卵巢分化前期表达上调对性腺分化有一定作用。基因在精巢原代细胞的表达受到信号分子cAMP和转录因子NR5a2和NR0b1的调控。由此可以推测基因在牙鲆性腺分化和发育的性类固醇激素合成中起重要的作用。
[1] Rajakumar A, Senthilkumaran B. Molecular cloning and expression analysis of 17β- hydroxysteroid dehydrogenase 1 and 12 during gonadal development, recrudescence and afterhCG induction in catfish,[J]. Steroids, 2014, 92(12): 81-89.
[2] Luu-The V, Labrie C, Simard J, et al. Structure of two in tandem human 17β-hydroxysteroid dehydrogenase genes[J]. Molecular Endocrinology, 1990, 4(2): 268- 275.
[3] Day M J, Tutill J H, Newman P S, et al. 17β-Hydroxysteroid dehydrogenase Type 1 and Type 2: Association between mRNA expression and activity in cell lines[J]. Molecular and Cellular Endocrinology, 2006, 248(1): 246-249.
[4] Lukacik P, Kavanagh K L, Oppermann U. Structure and function of human 17β-hydroxysteroid dehydrogenases[J]. Molecular and Cellular Endocrinology, 2006, 248(1): 61-71.
[5] Zhou L Y, Wang D S, Senthilkumaran B, et al. Cloning, expression and characterization of three types of 17β-hydroxysteroid dehydrogenases from the Nile tilapia,[J]. Journal of Molecular Endocrinology, 2005, 35(1): 103-116.
[6] Mindnich R, Deluca D, Adamski J. Identification and characterization of 17β-hydroxysteroid dehydrogenases in the zebrafish,[J]. Molecular and Cellular Endocrinology, 2004, 215(1): 19-30.
[7] Selstam G, Rosberg S, Liljekvist J, et al. Differences in action of LH and FSH on the formation of cyclic AMP in the prepubertal rat ovary[J]. Acta Endocrinologica, 1976, 81(1): 150-164.
[8] Nachtigal M W, Hirokawa Y, Enyeart-VanHouten D L, et al. Wilms’ tumor 1 and Dax-1 modulate the orphan nuclear receptor SF-1 in sex-specific gene expression[J]. Cell, 1998, 93(3): 445-454.
[9] Wang Z J, Jeffs B, Ito M, et al. Aromatase () expression is up-regulated by targeted disruption of Dax1[J]. Proceedings of the National Academy of Sciences, 2001, 98(14): 7988-7993.
[10] Sugawara T, Saito M, Fujimoto S. Sp1 and SF-1 interact and cooperate in the regulation of human steroidogenic acute regulatory protein gene expression 1[J]. Endocrinology, 2000, 141(8): 2895-2903.
[11] Zazopoulos E, Lalli E, Stocco D M, et al. DNA binding and transcriptional repression by DAX-1 blocks steroidogenesis[J]. Nature, 1997, 390(6657): 311-315.
[12] Yamamoto E. Studies on sex-manipulation and production of cloned populations in hirame,(Temminck & Schlegel)[J]. Aquaculture, 1999, 173(1): 235-246.
[13] Ospina-Alvarez N, Piferrer F. Temperature-dependent sex determination in fish revisited: prevalence, a single sex ratio response pattern, and possible effects of climate change[J]. PLoS One, 2008, 3(7): e2837.
[14] Sun P, You F, Ma D, et al. Sex steroid changes during temperature-induced gonadal differentiation in(Temminck & Schegel, 1846)[J]. Journal of Applied Ichthyology, 2013, 29(4): 886-890.
[15] Jo P G, An K W, Kim N N, et al. Induced expression of doublesex-and mab-3-related transcription factor-1 (DMRT-1) mRNA by testosterone in the olive flounder,ovary[J]. Journal of Aquaculture, 2007, 20(3): 199-202.
[16] Wen A, You F, Sun P, et al. CpG methylation of dmrt1 and cyp19a promoters in relation to their sexual dimorphic expression in the Japanese flounder[J]. Journal of Fish Biology, 2014, 84(1): 193-205.
[17] Yamaguchi T, Yamaguchi S, Hirai T, et al. Follicle-stimulating hormone signaling and Foxl2 are involved in transcriptional regulation of aromatase gene during gonadal sex differentiation in Japanese flounder,[J]. Biochemical and Biophysical Research Communications, 2007, 359(4): 935-940.
[18] 孙鹏, 尤锋, 张立敬等. 牙鲆性腺分化的组织学研究[J]. 海洋科学, 2009 3(3): 53-58. Sun Peng, You Feng, Zhang Lijing, et al. Histological evaluation of gonadal differentiation in olive flounder[J]. Marine Sciences, 2009, 3(3): 53-58.
[19] You F, Liu J, Wang X, et al. Study on embryonic development and early growth of triploid and gynogenetic diploid left-eyed flounder,(T.S.)[J]. Chinese Journal of Oceanology and Limnology, 2001, 19(2): 147-151.
[20] Wang L, You F, Weng S, et al. Molecular cloning and sexually dimorphic expression patterns ofandin olive flounder,[J]. Development Genes and Evolution, 2015, 225(2): 95-104.
[21] Kobayashi T, Kajiura-Kobayashi H, Nagahama Y. Induction of XY sex reversal by estrogen involves altered gene expression in a teleost, tilapia[J]. Cytogenetic and Genome Research, 2003, 101(3-4): 289-294.
[22] Zheng W, Sun L. Evaluation of housekeeping genes as references for quantitative real time RT-PCR analysis of gene expression in Japanese flounder ()[J]. Fish & Shellfish Immunology, 2011, 30(2): 638-645.
[23] Peng L, Zheng Y, You F, et al. Establishment and characterization of a testicular Sertoli cell line from olive flounder[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(5): 1054-1063.
[24] Kowalewski M P, Gram A, Boos A. The role of hypoxia and HIF1α in the regulation of STAR-mediated steroidogenesis in granulosa cells[J]. Molecular and Cellular Endocrinology, 2015, 401(2): 35-44.
[25] Fan Z, Zou Y, Jiao S, et al. Significant association ofpromoter methylation with environmental factors and gonadal differentiation in olive flounder[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 2017, 208(6): 70-79.
[26] Kime D E, Ebrahimi M. Synthesis of 17, 20α-and 17, 20β-dihydroxy-4-pregnen-3-ones, 11-ketotestosterone and their conjugates by gills of teleost fish[J]. Fish Physiology and Biochemistry, 1997, 17(1-6): 117-121.
[27] Nagahama Y. Molecular mechanisms of sex determination and gonadal sex differentiation in fish[J]. Fish Physiology and Biochemistry, 2005, 31(2-3): 105-109.
[28] Guiguen Y. Implication of steroids in fish gonadal sex differentiation and sex inversion[J]. Current Topics in Steroid Research, 2000, 3(1): 127-143.
[29] Rasheeda M K, Kagawa H, Kirubagaran R, et al. Cloning, expression and enzyme activity analysis of testicular 11β-hydroxysteroid dehydrogenase during seasonal cycle and after hCG induction in air-breathing catfish[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2010, 120(1): 1-10.
[30] Liu J, Heikkilä P, Kahri A I, et al. Expression of the steroidogenic acute regulatory protein mRNA in adrenal tumors and cultured adrenal cells[J]. Journal of Endocrinology, 1996, 150(1): 43-50.
[31] Guo C, Chung B. Cell-type specificity of human CYP11A1 TATA box[J]. The Journal of Steroid Biochemistry and Molecular Biology, 1999, 69(1): 329-334.
[32] Chen S, Zhang H, Wang F, et al. Nr0b1 (DAX1) mutation in zebrafish causes female-to-male sex reversal through abnormal gonadal proliferation and differentiation[J]. Molecular and Cellular Endocrinology, 2016, 433(C): 105-116.
(本文编辑: 谭雪静)
Molecular characterization, expression, and regulation ofin the olive flounder
LIANG Dong-dong1, 2, 3, FAN Zhao-fei1, 2, 3, ZOU Yu-xia1, 2, TAN Xun-gang1, 2, WU Zhi-hao1, 2, JIAO Shuang1, 2, LI Jun1, 2, YOU Feng1, 2
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China. 2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China. 3. University of Chinese Academy of Sciences, Beijing 100049, China)
17β-Hydroxysteroid dehydrogenase 1 (17β-HSD1) is an important enzyme as it is involved in the synthesis of both 17β-estradiol and testosterone. In this study,open reading frame sequence was obtained from the olive floundergonadal transcriptome data and verified. Phylogenetic tree analysis showed that flounder 17β-HSD1 was clustered with 17β-HSD1 proteins from fish species such asand. Semiquantitative RT-PCR results indicated the expression of 17β-HSD1 in the ovary was higher than that in the testis, and it was also expressed in the female gill, head kidney, kidney, spleen, stomach, and intestine. Real-time quantitative PCR analysis revealed upregulated expression patterns ofduring the key phases of ovarian and testicular differentiation.expression was significantly downregulated in the cultured primary testis cells treated with 75, 150, and 300 μmol/L cAMP (< 0.05). Moreover, transfecting the cultured primary testis cells with 2 and 3 μg NR5a2 and 1 μg NR0b1 significantly downregulated its expression, whereas it was significantly upregulated upon treatment with 2 μg NR0b1 (< 0.05), and all these regulations were dose-dependent. This study indicates thatis involved in flounder gonadal differentiation, and its expression is respectively regulated by cAMP, NR5a2, and NR0b1. These results may provide useful information for the study of fish gonadal differentiation.
;; ORF clone; expression; regulation
Mar. 3, 2017
梁冬冬(1990-), 男, 山东聊城人, 硕士研究生, 主要从事海水鱼类分子细胞生物学研究, E-mail: 867171624@qq.com; 尤锋,
, 研究员, E-mail: youfeng@qdio.ac.cn
Q75
A
1000-3096(2017)09-0065-09
10.11759//hykx 20170303001
2017-03-03;
2017-04-10
国家自然科学基金资助项目(41276171、31502156); 青岛海洋科学与技术国家实验室鳌山科技创新计划项目(2015ASKJ02); 鲆鲽类产业技术体系课题(NYCYTX-50-G03); 国家水产种质资源共享服务平台(2017DKA30470)
[National Natural Science Foundation of China, No. 41276171, 31502156; Qingdao National Laboratory for Marine Science and Technology, No. 2015ASKJ02; The National Flatfish Industry System Construction Programme, No. NYCYTX-50-G03; The National Infrastructure of Fishery Germplasm Resource , No.2017DKA30470]
