肿瘤相关巨噬细胞在骨髓增生异常综合征患者中的表达研究*
2017-03-23宋建新欧阳红梅甸自金蒋雅先汤一菲撒亚莲
宋建新,欧阳红梅,甸自金,闻 艳,蒋雅先,汤一菲,撒亚莲
(云南省第一人民医院:1.检验科;2.血液科;3.临床基础医学研究所,昆明 650032)
肿瘤相关巨噬细胞在骨髓增生异常综合征患者中的表达研究*
宋建新1,欧阳红梅1,甸自金1,闻 艳2,蒋雅先1,汤一菲1,撒亚莲3△
(云南省第一人民医院:1.检验科;2.血液科;3.临床基础医学研究所,昆明 650032)
目的 探讨CD68 (M1型+M2型)非恶性免疫性血液病患者、CD163 (M2型) 阳性巨噬细胞在骨髓增生异常综合征(MDS)患者骨髓中的表达。方法 采用免疫组织化学染色法检测20例非恶性免疫性血液病患者,25例低危MDS患者,17例高危MDS患者骨髓组织中CD68、CD163的表达。结果 CD68和CD163的表达阳性细胞数在MDS低危组分别为30.78±5.77和8.50±2.48,在对照组中为12.59±2.59 和2.74±0.77,其差异在两组间有统计学意义(P<0.05);高危组CD68表达阳性细胞数为61.26±4.21,高于对照组及低危组(P<0.05);高危组CD163表达阳性细胞数为49.59±4.88,高于对照组和低危组,组间差异有统计学意义(P<0.05);MDS病情进展与CD163浸润密度具有相关性(r=0.648,P<0.05)。结论 巨噬细胞在MDS患者骨髓中具有较高的浸润密度,且逐渐向M2型巨噬细胞极化,同时与MDS的病程进展具有相关性。
骨髓增生异常综合征;骨髓;巨噬细胞;CD68;CD163
骨髓增生异常综合征(myelodysplastie syndrome,MDS)是一组起源于造血干细胞,以骨髓病态造血,外周血一系或多系血细胞减少和高风险转化为急性白血病为特征的高度异质性疾病[1-2]。目前MDS的发病机制及其疾病进展的机制依旧不明。巨噬细胞(macrophages)是一类广泛分布于体内、动态的、具有迁移性的异质细胞群体,是机体免疫系统的重要组成部分[3]。在不同微环境作用下,巨噬细胞可极化为具有不同分子特征和功能特征的M1型或M2型,其对肿瘤发生、发展起着截然相反的作用[4]。M1型巨噬细胞具有抗原提呈和吞噬肿瘤细胞等细胞毒性效应,而M2型巨噬细胞参与肿瘤细胞的恶性增殖、抵抗凋亡,以及侵袭和转移,故又被称为肿瘤相关巨噬细胞(TAMs)。已有研究表明,CD68是人源巨噬细胞的泛标志物(M1型+M2型),CD163是识别M2型的标志物[3-4]。既往对巨噬细胞与恶性肿瘤发生、发展及预后关系的研究主要集中于实体瘤、淋巴瘤等方面[5-6],而在MDS中的研究鲜见报道。本文采用免疫组织化学的方法检测MDS患者骨髓组织中巨噬细胞表面的分子标志CD68、CD163来明确其在MDS发生、发展中的变化,探讨巨噬细胞在MDS发病中的作用,为阐明MDS发病机制提供重要信息。
1 资料与方法
1.1 一般资料 42例病例均来自本院血液科门诊及住院的初诊MDS患者,其中男29例,女13例,年龄51~83岁,中位年龄67岁。根据WHO(2008)分型标准,其中难治性贫血(RA)8例,难治性贫血伴有环状铁粒幼细胞(RARS)8例,难治性血细胞减少伴有多系发育异常(RCMD)6例,难治性血细胞减少伴有多系发育异常和环形铁粒幼细胞(RCMD-RS)3例,难治性贫血伴有原始细胞过多难治性贫血伴有原始细胞过多(RAEB)-Ⅰ 8例,RAEB-Ⅱ9例。根据国际预后积分系统(IPSS),低危8例,中危-1 17例,中危-2 8例,高危9例。将低危和中危-1定义为低危组(n=25),将中危-2和高危定义为高危组(n=17)。同时,选择非恶性免疫性血液病患者20例作为对照组,年龄、性别相匹配。本研究获本伦理委员会批准,并征得所有受试者知情同意。
1.2 方法
1.2.1 主要试剂 鼠抗人CD68、CD163抗体,SP免疫组织化学试剂盒购自Abcam公司。
1.2.2 试验方法 常规骨髓穿刺取骨髓组织,置于10% 甲醛固定液中交本院病理科进行脱水,石蜡包埋处理。
1.2.3 免疫组织化学检测CD68、CD163在骨髓组织中的表达 取骨髓活检组织的石蜡块,切3~4 μm厚的切片;采用SP免疫组织化学染色检测CD68、CD163的表达。染色步骤为:二甲苯脱蜡,梯度乙醇脱水,3%过氧化氢灭活内源性过氧化酶,磷酸盐缓冲液(PBS)清洗3次,进行抗原微炉热修复,正常山羊血清封闭,滴加一抗, 4 ℃孵育过夜;PBS清洗3次,滴加二抗,室温孵育10 min,PBS清洗3次;滴加二氨基联苯胺(DAB)显色,显微镜下控制显色时间在10~15 min,自来水冲洗,苏木素复染胞核,脱水透明,中性树胶封片。对照组用PBS替代一抗,其余步骤相同。
1.2.4 免疫组织化学染色结果判定 免疫组织化学染色结果由2位病理医师各自独立判断,结果相同者为最终检验结果,若有异议,由上级医师进行最终判断。在细胞膜或细胞质有黄褐色或棕黄染色沉着物为阳性。巨噬细胞体积较大,形态多样,呈类圆形或不规则形,偶见有多核细胞。在低倍镜(100倍)下选取5个染色较好的视野,后在高倍镜下(400倍)计数阳性细胞个数。
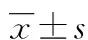
2 结 果
2.1CD68和CD163在骨髓组织中的表达CD68在对照组、低危组和高危组中的阳性细胞数分别为12.59±2.59、30.78±5.77和61.26±4.21。低危组高于对照组(t=13.22,P<0.05),高危组高于低危组(t=18.63,P<0.05)。CD163在对照组、低危组和高危组中的阳性细胞数分别为2.74±0.77、8.50±2.48、49.59±4.88。经统计学分析,CD163在低危组患者表达高于对照组(t=9.98,P<0.05),高危组CD163表达明显高于对照组和低危组(t=42.38、35.94,P<0.05),见图1。
A:CD68在对照组中的表达;B:CD163在对照组中的表达;C:CD68在低危组的表达;D:CD163在低危组的表达;E:CD68在高危组的表达;F:CD163在高危组的表达。
图1CD68与CD163在3组中的表达(×400)
2.2CD68和CD163表达的相关性 在对照组中CD163表达明显低于CD68的表达(P<0.05);在低危组中,CD163浸润密度有所增加,但仍明显低于CD68(P<0.05);高危组中CD68与CD163表达均明显增高,但二者相比差异无统计学意义(P>0.05),而CD163增高与CD68均呈明显正相关(r=0.824,P<0.05)。
2.3MDS与病情进展的相关性 对高危组和低危组CD163进行相关性分析,结果显示,患者的病情进展与CD163浸润密度具有相关性(r=0.648,P<0.05)。
3 讨 论
巨噬细胞分布在机体的各种组织中,发挥吞噬、趋化、分泌活性物质的作用,同时参与和调节免疫应答;其既参与维持机体内环境的平衡状态,又对疾病的形成起到促进作用[3]。巨噬细胞作为骨髓微环境的一个重要成员,在某些特定的细胞因子作用下可活化为TAMs,参与恶性肿瘤细胞的生存、增殖、浸润、转移,并与预后不良相关[3-6]。但目前对于MDS患者骨髓巨噬细胞的表达及其与病情进展的关系并不清楚。CD68相对分子质量约为110×103,是巨噬细胞的泛标记物(M1型+M2型);CD68及其配体参与细胞周期的调节,并可直接作用于肿瘤细胞,影响其凋亡及对药物的反应性。CD163是M2型巨噬细胞的标记物,在炎症环境中通过与配体结合促进单核细胞黏附、游出,并诱导炎性介质白细胞介素(IL)-10等细胞因子的释放参与肿瘤细胞免疫逃逸[3,7]。
M1型巨噬细胞通过提呈抗原,分泌促炎症细胞因子和趋化因子,参与Th1型免疫应答,发挥抗肿瘤作用[8]。M2型巨噬细胞抗原提呈能力较弱,分泌IL-10、转化生长因子β(TGF-β)等参与诱导Th2型免疫应答,抑制免疫,促进肿瘤生长、侵袭和转移的过程[3-7]。本文通过免疫组织化学检测MDS患者骨髓组织中巨噬细胞的数量随病情发展而增多,低危组CD68、CD163巨噬细胞数量明显高于对照组,高危组明显高于低危组。而在对照组中CD163表达明显低于CD68(P<0.05);低危组中,CD163浸润密度有所增加,但仍明显低于CD68(P<0.05),提示在对照组和MDS低危组骨髓微环境中,主要是以M1型巨噬细胞为主。由于M1型巨噬细胞可分泌包括肿瘤坏死因子(TNF)在内的多种炎性因子,这在一定程度上也解释了早期MDS骨髓细胞凋亡程度较为严重[9]。高危组中CD68与CD163表达均明显增高,CD68高于CD163,但二者相比差异无统计学意义(P>0.05),同时CD163增高与CD68均呈明显正相关,说明在MDS高危组中,是以M2型巨噬细胞在数量和功能上占优势。由此可见,MDS患者骨髓组织中巨噬细胞数量随着病情发生、发展而增加,并向M2型巨噬细胞极化,提示M2型巨噬细胞是MDS病情向不良方向发展的一个预警指标。
MDS患者骨髓微环境中M2型巨噬细胞的增多,可能是在MDS细胞来源的趋化因子、细胞因子的作用下[2-4],将外周血单核细胞大量招募进入骨髓后分化为巨噬细胞;在IL-10、IL-4等因子刺激下,极化为M2型巨噬细胞即TAMs;而TAMs本身也能分泌大量的CCL2、IL-10、TGF-β和血管内皮生长因子(VEGF),通过正向反馈促进巨噬细胞的招募与极化[10-12];因此,推测骨髓中巨噬细胞与MDS细胞间相互作用,形成一个恶性扩增环。但鉴于MDS发病的多因素性和巨噬细胞调节机制的复杂性,对于MDS患者骨髓中的巨噬细胞还有待进一步研究。
总之,MDS患者骨髓巨噬细胞的大量募集并逐渐向M2型极化,改变了骨髓微环境,使其更适合培育细胞恶性生物学行为,有利于肿瘤细胞的生存和增殖分化,推动MDS的发生、发展。
[1]Garcia-ManeroG.Myelodysplasticsyndromes:2015Updateondiagnosis,risk-stratificationandmanagement[J].AmJHematol,2015,90(9):831-841.
[2]CogleCR,SakiN,KhodadiE,etal.Bonemarrownicheinthemyelodysplasticsyndromes[J].LeukRes,2015,39(10):1020-1027.
[3]SchultzeJL,SchmiederA,GoerdtS.Macrophageactivationinhumandiseases[J].SeminImmunol,2015,27(4):249-256.
[4]YangC,HeL,HeP,etal.Increaseddrugresistanceinbreastcancerbytumor-associatedmacrophagesthroughIL-10/STAT3/bcl-2signalingpathway[J].MedOncol,2015,32(2):352.
[5]CaoW,PetersJH,NiemanD,etal.Macrophagesubtypepredictslymphnodemetastasisinoesophagealadenocarcinomaandpromotescancercellinvasioninvitro[J].BrJCancer,2015,113(5):738-746.
[6]徐原林,王华庆,钱正子,等.M2型巨噬细胞和调节性T细胞在弥漫性大B细胞淋巴瘤组织中的含量及其与患者预后的关系[J].中华肿瘤杂志,2013,35(6):450-455.
[7]李海涛,谭超,田书梅,等.肿瘤相关巨噬细胞在肿瘤微环境中的作用新进展[J].肿瘤防治研究,2015,42(11):1165-1168.
[8]YinY,HuangX,LynnKD,etal.Phosphatidylserine-targetingantibodyinducesM1macrophagepolarizationandpromotesmyeloid-derivedsuppressorcelldifferentiation[J].CancerImmunolRes,2013,1(4):256-268.
[9]沙琨.骨髓增生异常综合征骨髓细胞凋亡与TNF-α关系的探讨[J].中国实用医药,2014,9(23):91-92.
[10]ChenL,YuanW,ChenZ,etal.Vasoactiveintestinalpeptiderepressesactivationoftumor-associatedmacrophagesingastriccancerviaregulationofTNFα,IL-6,IL-12andiNOS[J].IntJOncol,2015,47(4):1361-1370.
[11]史兆坤,丁鹏,孙杰,等.单核细胞趋化蛋白-1趋化巨噬细胞迁移与侵袭的体外实验研究[J].昆明医科大学学报,2014,35(4):41-45.
[12]赵阳,赵勇.单核-巨噬细胞起源及发育分化的特征与分子调控[J].中国免疫学杂志,2014,30(1):126-132.
�验交流·
10.3969/j.issn.1671-8348.2017.02.025
云南省科技厅-昆明医科大学联合专项应用基础研究项目资助(2014FZ070)。
宋建新(1964-),副主任技师,大专,主要从事细胞形态学诊断和流式细胞术应用方面研究。△
R55
B
1671-8348(2017)02-0228-03
2016-07-10
2016-11-25)
