长链非编码RNA在脂多糖刺激的大鼠肠巨噬细胞中的差异表达
2017-03-23刘路路邹松钱小宝陈吉祥瞿建国崔磊张建新党胜春
刘路路,邹松,钱小宝,陈吉祥,瞿建国,崔磊,张建新,党胜春
(江苏大学附属医院 普通外科,江苏 镇江 212001)
肠黏膜屏障具有促进营养物吸收和防止细菌入侵的功能[1]。重症急性胰腺炎、炎性肠病和感染性腹泻综合征等许多疾病可导致肠屏障功能障碍[2-4]。巨噬细胞通过促进细胞因子分泌等作用方式调节炎症反应及免疫应答,在肠道免疫屏障中起重要作用[5]。
lncRNA转录物缺少显著的开放阅读框(open reading frame,ORF),由长度超过200个核苷酸分子组成,以前被认为是转录“噪音”[6-7]。随着lncRNA基因芯片、高通量测序技术和生物信息学的发展,越来越多的lncRNA被发现,在医学领域中引起相当大的关注[8-9]。它们具有许多生物学功能,包括基因组印记,染色体剂量补偿,X染色体沉默,染色体修饰,核内转运和转录激活[10]。最近研究[11-13]表明lncRNA参与调控许多生物过程和人类疾病,包括造血、癌症、肌肉生物学和免疫学等。最近研究[14-15]表明lncRNA可以调控炎症反应,其中最重要的效应细胞是巨噬细胞。然而,关于它们在肠巨噬细胞和肠屏障功能障碍中的潜在作用有待深入研究。在这项研究中,主要目的是研究LPS诱导培养大鼠肠巨噬细胞炎症模型中lncRNA的表达谱,为后期研究提供方向。
1 材料与方法
1.1 材料
SD大鼠200~250 g(扬州大学实验动物中心)。RPMI 1640培养基、FBS、青霉素和链霉素购自Hyclone公司。等渗细胞分离溶液(Percoll溶液)、胶原酶IV购自Worthington公司。一抗为CD14兔源多克隆抗体,按1:300稀释;二抗为FITC偶联山羊抗兔IgG(H+L),稀释比例为1:50(碧云天生物技术公司)。Agilent 2100生物分析仪(美国安捷伦科技公司)。TRIzol试剂、引物/探针、DEPC H2O、SuperScript III Reverse Transcriptase、SYBR Green I、oligo dT/Random primer、Platinum Taq DNA Polymerase、100mM dNTPs购自Invitrogen公司,miRNAeasy Mini Kit(QIAGEN公司)。Rnase Inhibitor购自Fermentas公司。上海其名生物技术公司进行选择芯片,设计探针,分析数据等工作。
1.2 方法
1.2.1 分离培养及鉴定肠巨噬细胞 分离培养及鉴定肠巨噬细胞同本课题组前期研究方法[16]。用RPMI 1640 培养基(10%FBS,青霉素 100 μg/mL;链霉素100 U/mL)将细胞浓度调到5×l05/L接种于96孔板和6孔板中,每孔分别为200 μL和2 mL,置于37 ℃、体积分数5%CO2的培养箱中培养。将其接种于24孔板,让其贴壁。待生长状态良好后,PBS清洗,甲醇固定后,分别加1 mL PBS-T、PBS-B 液并分别于 4 ℃下处理细胞 10 min,37 ℃处理细胞30 min。加一抗,4 ℃下孵育过夜。次日移除一抗PBS清洗5 min,加二抗37 ℃下孵育,1 h后用PBS洗涤3次,每次5 min。封片,用荧光显微镜观察并拍照,呈绿色荧光则阳性。
1.2.2 提取肠巨噬细胞总RNA 对照组不给药,实验组 LPS给药浓度为 1 mg/L,培养 6h后使用TRIzol试剂提取总RNA。用含RNA的水相和miRNAeasy Mini试剂盒进行总RNA纯化。通过使用分光光度计 2000(Thermo Scientific)测量 260 nm和280 nm处的吸光度的比率来评估RNA的纯度。在琼脂糖凝胶上观察测量RNA完整性。
1.2.3 基因芯片分析及构建共表达网络图在 Genminix Informatic Ltd(中国上海) 进行微阵列实验,选择 Affymetrix Gene Chip Mouse Transcriptome Array 1.0分析两组差异表达的lncRNA。芯片检测的大体步骤:样本RNA抽提及质量检测、cDNA合成、正义链cDNA片段化、生物素标记、芯片杂交、洗脱、扫描、检测信号值过滤去除低于背景的弱信号值。构建共表达网络图,计算基因间Pearson相关系数,根据其大小筛选有共表达关系的基因构建网络图。
1.2.4 RT-qPCR 大鼠肠巨噬细胞总RNA提取后转录为cDNA。先根据lncRNA-mRNA-Network分析结果,挑选差异>0.5的lncRNA。经过此步筛选,剩下32个lncRNA。然后结合差异lncRNA分析结果,挑选差异程度比较大的lncRNA。筛选的阈值为差异倍数为2倍及以上,经过此步筛选,剩下了7个lncRNA,再从中随机挑选1个上调及1个下调的lncRNA加以验证,为以后的研究做准备,其逆转录引物序列如下:NONMMUT024673上游引物 5'-TGT TGG GAT GTC AGC TCT GC-3',下游引物 5'-TGG GCT GTG ACG GAC TAA AC-3';NONMMUT047081上游引物 5'-TCA ATT CCA GGA CTC TGG ATG C-3',下游引物 5'-GGA TGG GTC TTC TAA TTG CAC C-3'。用 SYBR 染料法,以MUS-actin为参照。使用荧光定量PCR仪(CFX96TM Real-Time Systerm,Bio Rad),用2-ΔΔCt方法分析目的基因表达水平。
1.3 统计学处理
芯片差异lncRNA统计分析采用RVM修正后的t检验(two-samplet-test with random variance model),使用工具为BRB-array Tools(V4.3.2)。聚类分析使用的是层次聚类,工具为Cluster 3.0和TreeViewer;RT-qPCR用的是配对样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 肠巨噬细胞的分离培养与鉴定
用显微镜观察大鼠的肠巨噬细胞可见细胞生长状态良好,活力约80%~85%,绿色荧光是CD14阳性细胞,即为大鼠肠巨噬细胞(图1)。
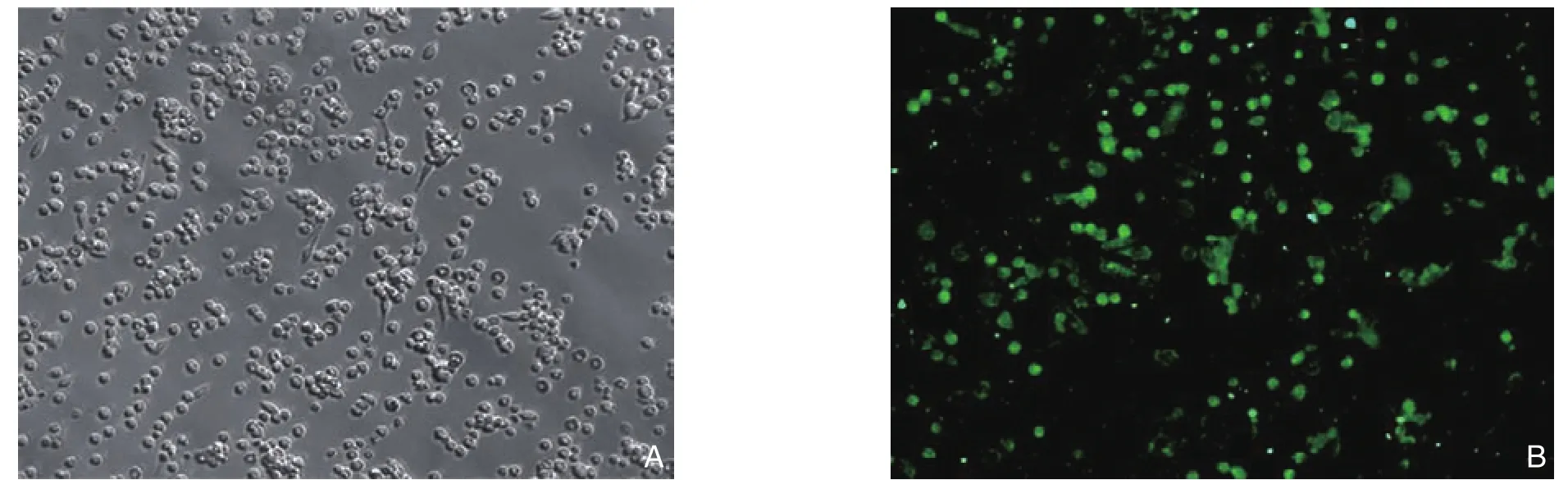
图1 肠巨噬细胞的鉴定(×100) A:光镜观察;B: CD14荧光染色Figure 1 Identi fication of intestinal macrophages A: Microscopic view; B: fl uorescence staining for CD14
2.2 基因芯片分析lncRNA表达谱
应用基因芯片分析LPS诱导的大鼠肠巨噬细胞组和未处理组之间lncRNA表达谱。LPS刺激的肠巨噬细胞组和对照组之间差异表达的lncRNA总共有357个,其中245个上调,112个下调(变化倍数>1.5)(表1)。通过分层聚类的方法分析了两组差异表达的lncRNA(图2),可见LPS处理和未处理的肠巨噬细胞间存在差异表达的lncRNA。
2.3 构建lncRNA-mRNA共表达网络
lncRNA-mRNA共表达网络分析探讨哪些lncRNA在大鼠肠巨噬细胞介导的炎症反应中的作用。结果表明,lncRNA NONMMUT047081,NONMMUT024673在网络中可能起重要作用(图3)。GO分析和通路分析显示这些编码基因参与多种生物过程,包括炎症反应,免疫应答和细胞凋亡。根据这些结果,筛选的lncRNA NONMMUT024673、NONMMUT047081可以进一步分析,以阐明在肠巨噬细胞介导的炎症反应中的作用,以及在肠屏障功能失调中的作用机制。
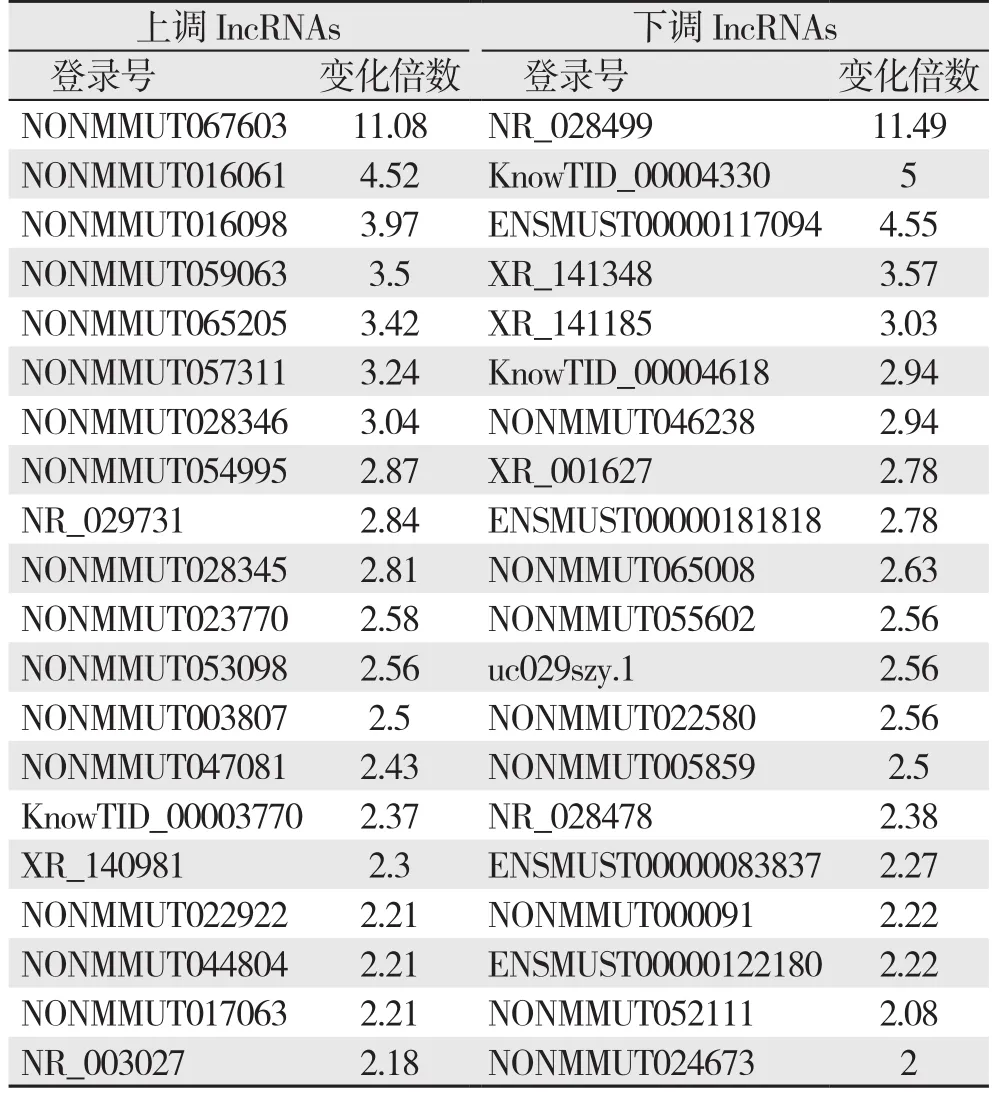
表1 前20个差异表达的lncRNATable 1 Top 20 differentially expressed lncRANs
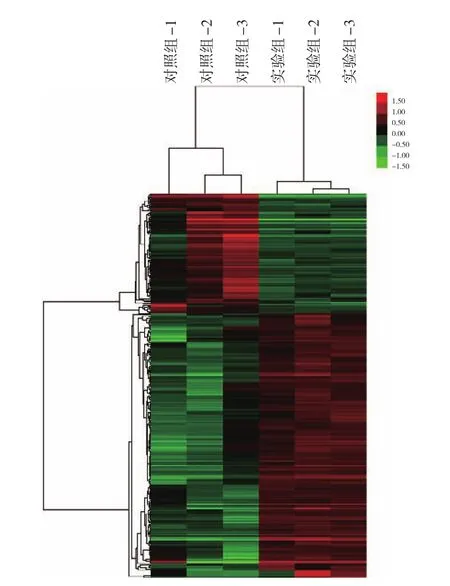
图2 分层聚类分析差异表达的lncRNAFigure 2 Hierarchical clustering analysis of the differentially expressed lncRNAs

图3 lncRNA-mRNA共表达网络图Figure 3 lncRNA-mRNA co-expression network plot
2.4 RT-qPCR验证
为验证芯片结果的准确性,采用RT-qPCR技术对筛选的两个差异表达lncRNA NONMMUT024673、NONMMUT047081进行验证,PCR结果与芯片结果一致(图4)。
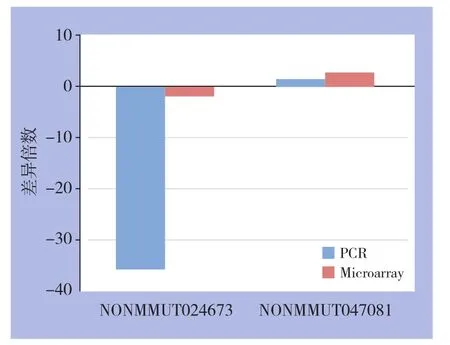
图4 RT-qPCR验证基因芯片数据Figure 4 Veri fication of microarray data by RT-qPCR
3 讨 论
肠黏膜屏障是保护人体的重要效应器,多种因素如炎症介质、细菌毒素、缺血再灌注损伤等可引起肠屏障功能障碍[17]。肠黏膜中的巨噬细胞占人体组织中绝大部分巨噬细胞,并在肠道免疫屏障中起重要作用,它可促进TNF-α、IL-6等炎症介质的产生,参与级联的形成,导致细胞功能障碍,从而引起肠屏障功能障碍[18]。LPS诱导中性粒细胞和单核细胞/巨噬细胞中TREM-1的表达,从而激活各种炎症细胞因子例如TNF-α及IL-6等,诱导中性粒细胞脱颗粒和单核-巨噬细胞吞噬,这些现象导致炎症反应的扩增[19]。已有研究[20]表明巨噬细胞吞噬氯膦酸二钠脂质体通过抑制Akt和MAPK(ERK1/2)来减少炎症因子释放。目前已有许多研究肠巨噬细胞来阻断炎症的过度激活,以保护肠黏膜屏障。
尽管lncRNA在一些领域取得了快速进展,但在炎症反应中的作用才崭露头角。最近,Carpenter等[21]证实小鼠lincRNA-Cox2与多种异质核核糖核蛋白(hnRNPs)相互作用以调控免疫应答基因的激活和抑制。Cui等[22]发现与IL-7受体α亚基(IL7R)基因的3'非翻译区(3'UTR)重叠的lnc-IL7R有助于炎症反应的调节。Chen等[23-24]揭示在溃疡性结肠炎中,lncRNA具有调节肠屏障功能的作用。此外lncRNA也具有调控巨噬细胞的作用,Ma等[25]研究表明linc-Tnfaip3RNA作为NF-κB的调控因子,可调控小鼠巨噬细胞的炎症基因转录。
本研究检测LPS诱导大鼠肠巨噬细胞的炎症模型中差异表达的lncRNA,结果显示,与对照组相比,LPS处理的大鼠肠巨噬细胞中差异表达的lncRNA共有357个,其中245个上调,112个下调(变化倍数>1.5)。lncRNA NONMMUT024673、NONMMUT047081在LPS刺激的肠巨噬细胞中差异表达显著。许多研究[26-27]表明lncRNA可以通过调节邻近编码基因的转录来起作用。笔者推测lncRNA NONMMUT024673及NONMMUT047081通过调节邻近的编码基因来调控炎症反应。因此需要运用生物信息学手段寻找表达差异lncRNA的靶基因,并用分子生物学技术加以验证。总之,本研究发现lncRNA在LPS刺激的大鼠肠巨噬细胞中差异表达谱,可能涉及调控肠屏障功能障碍时肠巨噬细胞引起的炎症反应,是肠屏障功能障碍潜在的靶点。
总之,本研究表明LPS处理的大鼠肠巨噬细胞改变了lncRNA在肠巨噬细胞中的表达谱。尽管需要更多的研究来证明这些lncRNA的确切调控机制,但我们鉴定的基因组数据可以增加在肠屏障功能障碍时,肠巨噬细胞中lncRNA调控炎症反应的了解,为进一步研究做准备。
[1] Shen L, Su L, Turner JR. Mechanisms and functional implications of intestinal barrier defects[J]. Dig Dis, 2009, 27(4):443–449. doi:10.1159/000233282.
[2] Xu GF, Guo M, Tian ZQ, et al. Increased of serum high-mobility group box chromosomal protein 1 correlated with intestinal mucosal barrier injury in patients with severe acute pancreatitis[J]. World J Emerg Surg, 2014, 9:61. doi: 10.1186/1749–7922–9–61.
[3] Lee SH. Intestinal permeability regulation by tight junction:implication on inflammatory bowel diseases[J]. Intest Res, 2015,13(1):11–18. doi: 10.5217/ir.2015.13.1.11.
[4] 邹忠东, 马留学, 姚和祥, 等. 联合应用乌药、大黄对重症胰腺炎肠屏障功能的保护作用[J].中国普通外科杂志, 2010, 19(3):315–317.Zou ZD, Ma LX, Yao HX, et al. Protective effect of Wu-yao and Dahuang herbs on gut barrier function in severe acute pancreatitis[J].Chinese Journal of General Surgery, 2010, 19(3):315–317.
[5] Zareie M1, McKay DM, Kovarik GG, et al. Monocyte/macrophages evoke epithelial dysfunction: indirect role of tumor necrosis factoralpha[J]. Am J Physiol, 1998, 275(4 Pt 1):C932–939.
[6] 马骧, 欧阳尧明, 景在平, 等. IncRNA在血管疾病中的作用机制研究进展[J]. 中国普通外科杂志, 2016, 25(12):1792–1795.doi:10.3978/j.issn.1005–6947.2016.12.020.Ma X, Ouyang YM, Jing ZP, et al. Research progress in action mechanisms of lncRNAs in vascular diseases[J]. Chinese Journal of General Surgery, 2016, 25(12):1792–1795. doi:10.3978/j.issn.1005–6947.2016.12.020.
[7] Ma L, Bajic VB, Zhang Z. On the classi fication of long non-coding RNAs[J]. RNA Biol, 2013, 10(6):925–933. doi: 10.4161/rna.24604.
[8] Derrien T, Johnson R, Bussotti G, et al. The GENCODE v7 catalog of human long noncoding RNAs: analysis of their gene structure,evolution, and expression[J]. Genome Res, 2012, 22(9):1775–1789.doi: 10.1101/gr.132159.111.
[9] Ponting CP, Oliver PL, Reik W. Evolution and functions of long noncoding RNAs[J]. Cell, 2009, 136(4):629–641. doi: 10.1016/j.cell.2009.02.006.
[10] Wilusz JE, Sunwoo H, Spector DL. Long noncoding RNAs:functional surprises from the RNA world[J]. Genes Dev, 2009,23(13):1494–1504. doi: 10.1101/gad.1800909.
[11] Sun, M, Kraus WL. From discovery to function: the expanding roles of long noncoding RNAs in physiology and disease[J]. Endocr Rev, 2015, 36(1):25–64. doi: 10.1210/er.2014–1034.
[12] Satpathy AT, Chang HY. Long noncoding RNA in hematopoiesis and immunity[J]. Immunity, 2015, 42(5):792–804. doi: 10.1016/j.immuni.2015.05.004.
[13] Kung JT, Colognori D, Lee JT. Long noncoding RNAs: past,present, and future[J]. Genetics, 2013, 193(3):651–669. doi:10.1534/genetics.112.146704.
[14] Carpenter S, Fitzgerald KA. Transcription of in fl ammatory genes:long noncoding RNA and beyond[J]. J Interferon Cytokine Res,2015, 35(2):79–88. doi: 10.1089/jir.2014.0120.
[15] Marques-Rocha JL, Samblas M, Milagro FI, et al. Noncoding RNAs, cytokines, and in fl ammation-related diseases[J]. FASEB J,2015, 29(9): 3595–3611. doi: 10.1096/fj.14–260323.
[16] 胡蓉, 吴朝阳, 党胜春, 等. 髓系细胞触发受体-1对大鼠肠巨噬细胞氧化应激的影响[J]. 江苏大学学报: 医学版, 2015, 25(5):378–381. doi:10.13312/j.issn.1671–7783.y140278.Hu R, Wu CY, Dang SC, et al. Effect of triggering receptor expressed on myeloid cells-1 expression on the oxidative stress of intestinal macrophages in rats[J]. Journal of Jiangsu University: Medicine Edition, 2015, 25(5):378–381. doi:10.13312/j.issn.1671–7783.y140278.
[17] Zhang XP, Zhang J, Song QL, et al. Mechanism of acute pancreatitis complicated with injury of intestinal mucosa barrier[J]. J Zhejiang Univ Sci B, 2007, 8(12):888–895. doi: 10.1631/jzus.2007.B0888.
[18] Leveau P, Wang X, Sun Z, et al. Severity of pancreatitis-associated gut barrier dysfunction is reduced following treatment with the PAF inhibitor lexipafant[J]. Biochem Pharmacol, 2005, 69(9):1325–1331. doi: 10.1016/j.bcp.2005.01.023.
[19] Bouchon A, Facchetti F, Weigand MA, et al. TREM-1 amplifies in fl ammation and is a crucial mediator of septic shock[J]. Nature,2001, 410(6832):1103–1107. doi: 10.1038/35074114.
[20] 李涛, 刘源, 李冉, 等. 氯膦酸二钠脂质体对大鼠重症急性胰腺炎肺损伤的影响及与Akt、MAPK(ERK1/2)通路的关系[J]. 中国普通外科杂志, 2016, 25(3):350–356. doi:10.3978/j.issn. 1005–6947.2016.03.008.Li T, Liu Y, Li R, et al. Alleviative effect of liposomal clodronate against lung injury in rats with severe acute pancreatitis and its relations with Akt and MAPK (ERK1/2) pathways[J]. Chinese Journal of General Surgery, 2016, 25(3):350–356. doi:10.3978/j.issn.1005–6947.2016.03.008.
[21] Carpenter S, Aiello D, Atianand MK, et al. A long noncoding RNA mediates both activation and repression of immune response genes[J]. Science, 2013, 341(6147):789–792. doi: 10.1126/science.1240925.
[22] Cui H, Xie N, Tan Z, et al. The human long noncoding RNA lnc-IL7R regulates the in fl ammatory response[J]. Eur J Immunol, 2014,44(7):2085–2095. doi: 10.1002/eji.201344126
[23] Chen SW, Wang PY, Liu YC, et al. Effect of Long Noncoding RNA H19 Overexpression on Intestinal Barrier Function and Its Potential Role in the Pathogenesis of Ulcerative Colitis[J]. In fl amm Bowel Dis, 2016, 22(11):2582–2592.
[24] Chen T, Xue H, Lin R, et al. MiR-34c and PlncRNA1 mediated the function of intestinal epithelial barrier by regulating tight junction proteins in in fl ammatory bowel disease[J]. Biochem Biophys Res Commun, 2017, 486(1):6–13. doi: 10.1016/j.bbrc.2017.01.115.
[25] Ma S, Ming Z, Gong AY, et al. A long noncoding RNA, lincRNATnfaip3, acts as a coregulator of NF-κB to modulate in fl ammatory gene transcription in mouse macrophages[J].FASEB J, 2017,31(3):1215–1225.
[26] Zhao F, Qu Y, Liu J, et al. Microarray pro filing and co-expression network analysis of LncRNAs and mRNAs in neonatal rats following hypoxic-ischemic brain damage[J]. Sci Rep, 2015,5:13850. doi: 10.1038/srep13850.
[27] Dong R, Du J, Wang L, et al. Comparison of long noncoding RNA and mRNA expression pro files in mesenchymal stem cells derived from human periodontal ligament and bone marrow[J]. Biomed Res Int, 2014, 2014:317853. doi:10.1155/2014/317853.
