CDX2基因干扰对人结肠癌细胞在裸鼠体内生长的影响
2017-03-23李孝彬郑见宝孙学军崔飞博余钧辉王训凯韩阳王恺
李孝彬,郑见宝,孙学军,崔飞博,余钧辉,王训凯,韩阳,王恺
(西安交通大学第一附属医院 普通外科,陕西 西安 710061)
结肠癌(colon cancer)是最常见的消化道恶性肿瘤之一,位居癌症发病率的第3位和癌症相关病死率的第4位[1-2],随着人们饮食结构和生活习惯的改变,其发病率和病死率呈逐年上升趋势[3]。尾型同源盒基因2(caudal-related homeobox 2,CDX2)属于同源盒基因(homeobox genes)家族中的一员,是肠道特异性的转录因子,对胚胎期消化道特别是结肠和小肠上皮的发育起着关键的作用,而且在成人结直肠上皮组织的分化和增殖调控中起着重要的作用[4-5]。结肠癌中存在着不同程度的CDX2表达缺失,恶性程度越高缺失就越严重,提示CDX2可能是一种抑癌基因[6]。目前干扰结肠癌细胞系中CDX2基因表达促进增殖的体内实验尚未见报道,本研究拟通过构建好的稳定CDX2基因干扰的结肠癌细胞株和对照细胞株种植于裸鼠皮下,构建人结肠癌裸鼠移植瘤模型,在体内水平初步探讨CDX2对结肠癌生长的影响。
1 材料与方法
1.1 材料
1.1.1 细胞、病毒与实验动物 人结肠癌细胞株SW480和HT29均为本实验室保存,培养于含10%胎牛血清的RPMI-1640培养液中,置于37℃、5%CO2培养箱中培养,取生长状态良好的细胞进行实验。慢病毒载体GV248-CDX2(CDX2-shRNA)、阴性病毒载体(NT-shRNA)由上海吉凯基因技术有限公司合成。36只4周龄雌性BALB/c裸鼠,平均质量13~16 g,购买自北京维通利华实验动物有限责任公司,动物合格证号为SCXK(京)2012-0001,在西安交通大学动物实验中心SPF条件下适应性饲养1周后开始实验。
1.1.2 主要试剂 胎牛血清为美国Gibco公司生产,RPMI-1640培养基为美国Corning公司产品,CDX2兔抗人一抗(D11D10)购自美国CST,Ki-67兔抗人一抗(PB0065)购自武汉博士德生物。二抗试剂盒多聚体抗兔IgG-HRP(SV0002)购自武汉博士德生物。
1.2 方法
1.2.1 稳定CDX2基因干扰的结肠癌细胞株建立及Western blot鉴定 在无菌24孔培养板中接种处于对数生长期的SW480、HT29细胞(5×104/孔),置于37℃、5% CO2培养箱中培养,待细胞密度达70%~80%时按转染复数(MOI)=10进行转染。分为3组,只加转染试剂组(空白对照组)、转染GV248-CDX2组(转染组)、转染阴性对照组(阴性对照组)。12 h后用含10%血清的的新鲜培养基换液继续培养,72 h后用嘌呤霉素进行筛选稳定转染慢病毒载体的细胞株。将SW480、HT29细胞接种于12孔板,收集各组细胞各5×106个,使用细胞裂解液提取蛋白。用BCA法进行蛋白含量测定。取 40 μg蛋白行 10% SDSPAGE电泳,然后转移至硝酸纤维素膜,5%脱脂奶TBST溶液37 ℃封闭 1 h,加入兔抗人 CDX2 抗体(1:1 000),于 4 ℃孵育过夜,TBST洗膜10 min×3次;加入二抗羊抗兔抗体1:5 000稀释液,常温孵育1 h,TBST洗膜8 min×4次,置入ECL显影剂中1 min,在凝胶成像系统曝光成像,以GAPDH为内参照。
1.2.2 结肠癌细胞株单细胞悬液制备 取对数生长期的各结肠癌细胞株,用0.25%的胰蛋白酶(含0.02%EDTA)消化1 min,含培养基血清终止消化,180×g离心5 min;弃上清,无血清培养液清洗细胞2~3次(除去培养液中所含蛋白质),PBS溶液混悬细胞,台盼蓝计数活细胞数,调整细胞浓度,制成终浓度为107个/mL的单细胞悬液备用。
1.2.3 裸鼠移植瘤模型的建立 取36只雌性裸鼠,随机分成6组,每组6只,分别于左腋下皮下注射各组肿瘤细胞100 μL(细胞密度均为1×107个/mL)。细胞种植完成后,每日观察并记录肿瘤出现时间,于 6、9、12、15、18、21、24、27 d 测量肿瘤的最长径和最短径,根据公式计算肿瘤体积,计算公式V=πab2/6(V:体积,a:肿瘤长径,b:肿瘤短径),绘制裸鼠肿瘤体积-时间曲线,横向比较3组情况。28 d后处死裸鼠,完整剥离肿瘤组织,电子天平称量肿瘤质量,取下的肿瘤组织一部分福尔马林固定,另一部分液氮中冻存,用作后续实验。
1.2.4 免疫组织化学检测各组移植瘤中Ki-67蛋白表达情况 按常规方法制作病理组织切片,HE染色,在光学显微镜下观察肿瘤组织结构。用免疫组化SABC法染色,一抗Ki-67稀释比例为1:400,严格按照二抗试剂盒多聚体抗兔IgG-HRP(SV0002)说明书进行操作。用已知结肠癌组织切片做阳性对照,以PBS代替一抗做阴性对照。光镜下观察细胞着色情况。
1.2.5 免疫组织化学结果判定 由2位病理科医师双盲阅片,参照Berry等[7]提出的基于3个参数的半定量计数方法,按细胞中Ki-67阳性细胞所占百分率和着色强度进行计分,每张组织切片随机选取10个高倍视野,计数300个细胞。首先对阳性细胞着色强度进行计分,不表达记0分,淡黄色记1分,棕黄色记2分,棕褐色记3分;然后对阳性细胞率计分,阳性细胞比率<25%记1分,阳性细胞占比26%~50%记2分,阳性细胞占比51%~75%记3分,阳性细胞占比>76%记4分。两者积分乘积为最后得分,定义为0~1分为阴性,2~3分为弱阳性(+),4~5分为阳性(++),>6分为强阳性(+++)。
1.2.6 Western blot检测移植瘤CDX2表达水平将移植瘤标本从液氮中取出,称量40 mg置于标记好的玻璃匀浆器内,快速研磨,提取组织蛋白。BCA法进行蛋白含量测定,Western blot检测移植瘤CDX2表达水平(步骤如上)。
1.3 统计学处理
采用SPSS18.0统计软件包进行统计分析,组间比较采用ANOVA方差分析,等级资料用Kruskal-Wallis检验。检验水准α=0.05。
2 结 果
2.1 稳定干扰CDX2表达的结肠癌细胞株筛选及鉴定
慢病毒载体转染人SW480、HT29结肠癌细胞,在转染72 h后荧光显微镜下观察到90%以上细胞中表达绿色荧光蛋白。用嘌呤霉素筛选稳定转染的HT29和SW480细胞株,2周后荧光显微镜下观察几乎每个细胞中表均达绿色荧光蛋白(图1)。Western blot结果显示,空白对照组和阴性对照组SW480和HT29细胞CDX2呈高表达,干扰组SW480和HT29细胞CDX2表达水平较空白对照组低70%以上(图2)。
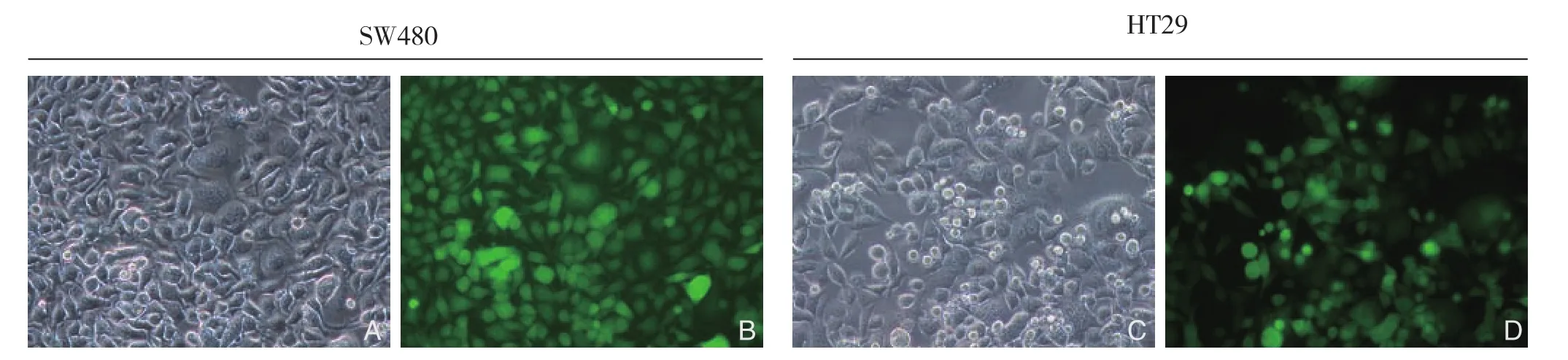
图1 慢病毒转染结肠癌细胞株 A、C:嘌呤霉素筛选2周后光镜下观察(×200);B、D:嘌呤霉素筛选2周后荧光显微镜下观察(×200)Figure 1 Infection of colon cancer cells with lentivirus A, C: Microscopic observation at 2 weeks after puromycin screening (×200);B, D: Fluorescence microscopic observation at 2 weeks after puromycin screening (×200)
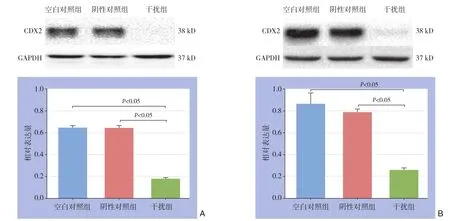
图2 Western blot分析CDX2表达 A:SW480;B:HT29Figure 2 Western blot analysis of CDX2 protein expression A: SW480; B: HT29
2.2 稳定干扰CDX2基因表达促进移植瘤的生长
各组细胞接种裸鼠皮下4~6 d后均可触及肿瘤,于第6天开始每天测量肿瘤长径、短径,绘制肿瘤生长曲线。结果显示两种细胞干扰组的移植瘤生长速度均明显快于各自的空白对照组和阴性对照组(均P<0.05),空白对照组和阴性对照组生长速度均无统计学差异(均P>0.05)(图3)。各组皮下移植瘤从第20天开始均出现不同程度的肿瘤破溃,28 d后处死裸鼠,完整剥离肿瘤并称重,不同组肿瘤大小和质量如图4所示,SW480干扰组质量明显高于SW480空白对照组和SW480阴性对照组[(679.11±102.07)mgvs.(379.36±82.32)mg;(679.11±102.07)mgvs.(362.58±88.89)mg];HT29干扰组组质量明显高于空白对照组和HT29阴性对照组[(715.78±103.50)mgvs.(427.07±77.30)mg;(715.78±103.50)mgvs.(420.99±78.00)mg],差异均有统计学意义(均P<0.05),两种细胞空白对照组和阴性对照组肿瘤质量均无统计学差异(均P>0.05)。
2.3 两种细胞不同处理组皮下移植瘤的病理学观察
剥脱瘤体后沿肿瘤长径切开,肉眼见各组人结肠癌细胞裸鼠皮下移植瘤均呈类球状、驼峰状或分叶状生长,质韧而硬,切面呈灰白色。HE染色后,在光镜下可见皮下移植瘤细胞形状不规则,大小不一,核大而深染,核浆比例明显增大,核异型明显,有病理性核分裂像,肿瘤大致呈实性团块或小条索状排列,确认为未分化或低分化腺癌(图5)。
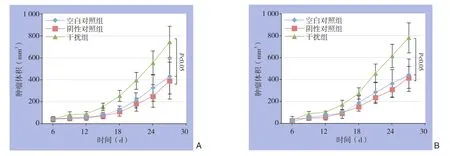
图3 各组皮下移植瘤生长曲线 A:SW480;B:HT29Figure 3 The growth-curves of the subcutaneous xenografts in each group A: SW480; B: HT29
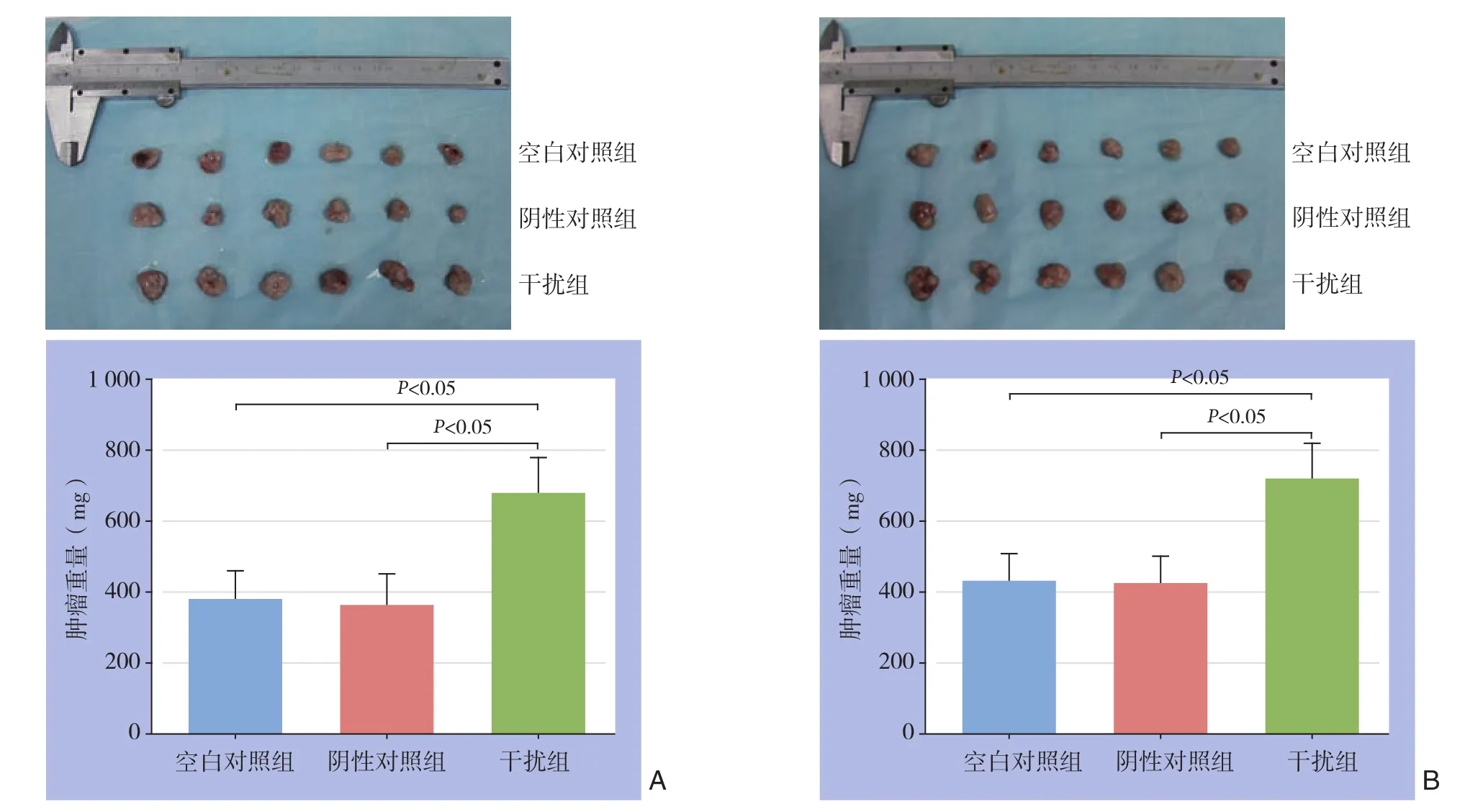
图4 各组皮下移植瘤大体标本及肿瘤质量比较 A:SW480;B:HT29Figure 4 The specimens of the xenografts in each group and comparison of the tumor weights A: SW480; B: HT29

图5 各组裸鼠皮下瘤的HE染色(×200)Figure 5 HE staining of the xenografts in each group (×200)
2.4 两种细胞不同处理组皮下移植瘤中Ki-67表达情况
Ki-67是一种比较肯定的核增殖标志物,其表达主要位于细胞核内[8],阳性表达表现为淡黄色、棕黄色或棕褐色。两种细胞干扰组的移植瘤中均见Ki-67高表达,而空白对照组和阴性对照组表达较弱(图6)。参照Berry N评分结果,SW480干扰组得分明显高于SW480空白对照组和SW480阴性对照组[(4.00±1.10)vs.(2.83±0.43);(4.00±1.10)vs.(2.67±0.52)];HT29干扰组得分明显高于HT29空白对照组和HT29阴性对照组[(4.83±2.31)vs.(2.67±0.82);(4.83±2.31)vs.(2.50±0.55)],差异均有统计学意义(均P<0.05)。Ki-67阳性细胞比率方面,SW480干扰组得分明显高于SW480空白对照组和SW480阴性对照组[(30.17±7.14)vs.(2 1.1 7±7.7 6);(3 0.1 7±7.1 4)v s.(19.17±4.22)];HT29干扰组得分明显高于HT29空白对照组和HT29阴性对照组[(40.50±11.26)vs.(19.83±9.04);(40.50±11.26)vs.(18.67±5.61)],差异均有统计学意义(均P<0.05)。

图6 免疫组化检测各组移植瘤组织Ki-67表达(×200)Figure 6 Immunohistochemical staining for Ki-67 expression in the xenografts of each group (×200)
2.5 两种细胞不同处理组皮下移植瘤中CDX2表达情况
Western blot结果显示两种细胞的空白对照组和阴性对照组的瘤组织在35 kDa左右处均出现较强的特异性条带,而干扰组则较弱(图7)。灰度值计算结果显示两种细胞干扰组瘤组织CDX2蛋白的表达均明显低于各自空白对照组和阴性对照组(均P<0.05),而空白对照组和阴性对照组比较则均无统计学差异(均P>0.05);裸鼠体内shRNA的干扰效率仍能维持在70%左右。

图7 Western blot检测各组移植瘤组织CDX2表达 A:SW480;B:HT29Figure 7 Western blot analysis of CDX2 protein expression in the xenografts of each group A: SW480; B: HT29
3 讨 论
肠上皮的发生、分化和增殖过程都是由肠道特异性基因精密调控的,这些基因包括Muc2、MOK(MAPK/MAK/MRK overlapping kinase)、LI-黏蛋白(liver-intestine cadherin)、ACAT2(acetoactyl-coenzyme aathiolase)等,这些基因的启动子区都存在着CDX2的特异性结合位点,所以CDX2的表达状况直接影响这些基因的表达,即这些基因可看作是CDX2的直接靶基因[9]。CDX2基因位于染色体13q12-13上,是一种肠特异性的转录因子,在胚胎发育肠道形成中起关键作用,并与细胞的凋亡、黏附、侵袭和迁移有关[10-12]。CDX2高表达时,CDX2和肠道特异性基因的启动子结合,促进靶基因表达,从而诱导胚胎极性的形成、器官的发生和组织的肠性分化,当CDX2低表达或不表达时,则促进细胞的增生和加快细胞的代谢,并进一步导致肿瘤的发生[9,13-15]。结肠腺瘤是结肠癌的癌前病变,在正常结直肠黏膜上皮-腺瘤-腺癌的发展过程中,CDX2的表达呈明显的下降趋势,表明CDX2的表达下调可能与正常结直肠黏膜上皮向结直肠腺癌的发生发展过程有关[16-17]。Chawengsaksophak等[18]研究发现,采用同源重组技术敲除小鼠的CDX2基因后,在12~28周内基因型为CDX2(+/-)的小鼠大部分体内可形成错构瘤性息肉和管状腺瘤,同时基因型为CDX2(-/-)的小鼠会在胚胎期内停止发育或死亡。CDX2在正常结肠组织中的表达显著高于结肠癌组织,CDX2表达缺失与较高的肿瘤分级、较晚的肿瘤分期、微卫星不稳定性、淋巴结转移等有关[6,19-21]。本课题组前期研究[22]表明CDX2蛋白癌组织中表达降低,正常结直肠黏膜组织中阳性率为95.0%,而在结直肠腺癌中表达阳性率仅为69.4%,并且CDX2表达缺失与肿瘤的分化程度、淋巴转移和肿瘤分期有关。多项研究[20,23-24]表明CDX2表达的缺失还可作为结直肠癌高危因素和预后不良的评估指标之一。在探讨CDX2对结肠癌细胞生长的体内实验中,本课题组前期通过构建CDX2过表达载体,转染LoVo细胞系并制备皮下移植瘤模型,发现CDX2过表达组移植瘤质量较空白对照组和阴性对照组明显减轻(P<0.05),这提示CDX2对结肠癌细胞的生长有抑制作用[25]。
为了进一步验证CDX2对结肠癌细胞增殖和生长的影响,本研究在结肠癌细胞系中干扰CDX2表达并构建了裸鼠皮下移植瘤模型,裸鼠皮下接种结肠癌细胞4~6 d后均可以触及皮下肿瘤,且接种SW480干扰组细胞裸鼠的肿瘤生长速度相对其他两组(SW480空白对照组、SW480阴性对照组)明显增快,而SW480空白对照组与SW480阴性对照组组的差异无统计学意义,结肠癌细胞株HT29皮下移植瘤模型中也得到了同样的结果。Ki-67是一种比较肯定的核增殖标志物,参照Berry N评分结果各组移植瘤中Ki-67表达情况,在SW480和HT29各不同处理组中,干扰组得分均明显大于相应空白对照组和阴性对照组,且差异具有统计学意义。
综上,在体内情况下CDX2可明显抑制结肠癌细胞的增殖和生长。CDX2基因作为一个结肠癌中重要的抑癌基因,可作为结肠癌的生物靶向治疗的新靶点。
[1] Guo P, Huang ZL, Yu P, et al. Trends in cancer mortality in China:an update[J]. Ann Oncol, 2012, 23(10):2755–2762.
[2] Arnold M, Sierra MS, Laversanne M, et al. Global patterns and trends in colorectal cancer incidence and mortality[J]. Gut, 2017,66(4):683–691. doi: 10.1136/gutjnl–2015–310912.
[3] Aarons CB, Mahmoud NN. 现代结直肠癌外科治疗的思考[J]. 中国普通外科杂志, 2015, 24(4):459–466. doi:10.3978/j.issn.1005-6947.2015.04.001.Aarons CB, Mahmoud NN. Current surgical considerations for colorectal cancer[J]. Chinese Journal of General Surgery, 2015,24(4):459–466. doi:10.3978/j.issn.1005–6947.2015.04.001.
[4] Grainger S, Savory JG, Lohnes D. Cdx2 regulates patterning of the intestinal epithelium[J]. Dev Biol, 2010, 339(1):155–165. doi:10.1016/j.ydbio.2009.12.025.
[5] 胡泽成, 赵华. 结直肠肿瘤标志物CDX2的研究现状[J]. 中国普通外科杂志, 2008, 17(4):391–393.Hu ZC, Zhao H. Research progress of colorectal neoplasms markers CDX[J]. Chinese Journal of General Surgery, 2008, 17(4):391–393.
[6] Olsen J, Eiholm S, Kirkeby LT, et al. CDX2 downregulation is associated with poor differentiation and MMR de ficiency in colon cancer[J]. Exp Mol Pathol, 2016, 100(1):59–66. doi: 10.1016/j.yexmp.2015.11.009.
[7] Berry N, Jones DB, Smallwood J, et al. The prognostic value of the monoclonal antibodies HMFG1 and HMFG2 in breast cancer[J]. Br J Cancer, 1985, 51(2):179–186.
[8] Romero Q, Bendahl PO, Klintman M, et al. Ki67 proliferation in core biopsies versus surgical samples - a model for neo-adjuvant breast cancer studies[J]. BMC Cancer, 2011, 11:341. doi:10.1186/1471–2407–11–341.
[9] 方义湖, 来茂德. 结直肠肿瘤的新标记——CDX2[J]. 国际遗传学杂志, 2006, 29(4):311–316. doi:10.3760/cma.j.issn.1673–4386.2006.04.017.Fang YH, Lai MD. CDX2, a New Marker for Colorectal Cancer[J]. International Journal of Genetics, 2006, 29(4):311–316.doi:10.3760/cma.j.issn.1673–4386.2006.04.017.
[10] Saad RS, Ghorab Z, Khalifa MA, et al. CDX2 as a marker for intestinal differentiation: Its utility and limitations[J]. World J Gastrointest Surg, 2011, 3(11):159–166. doi: 10.4240/wjgs.v3.i11.159.
[11] Simmini S, Bialecka M, Huch M, et al. Transformation of intestinal stem cells into gastric stem cells on loss of transcription factor Cdx2[J]. Nat Commun, 2014, 5:5728. doi: 10.1038/ncomms6728.
[12] Olsen J, Espersen ML, Jess P, et al. The clinical perspectives of CDX2 expression in colorectal cancer: a qualitative systematic review[J]. Surg Oncol, 2014, 23(3):167–176. doi: 10.1016/j.suronc.2014.07.003.
[13] Blache P, van de Wetering M, Duluc I, et al. SOX9 is an intestine crypt transcription factor, is regulated by the Wnt pathway, and represses the CDX2 and MUC2 genes[J]. J Cell Biol, 2004,166(1):37–47.
[14] Kawai H, Tomii K, Toyooka S, et al. Promoter methylation downregulates CDX2 expression in colorectal carcinomas[J]. Oncol Rep, 2005, 13(3):547–551.
[15] Yamamoto H, Bai YQ, Yuasa Y. Homeodomain protein CDX2 regulates goblet-speci fic gene expression[J]. Biochem Biophys Res Commun, 2003, 300(4):813–818.
[16] Bai YQ, Yamamoto H, Akiyama Y, et al. Ectopic expression of homeodomain protein CDX2 in intestinal metaplasia and carcinomas of the stomach[J]. Cancer Lett, 2002, 176(1):47–55.
[17] Mallo GV, Rechreche H, Frigerio JM, et al. Molecular cloning,sequencing and expression of the mRNA encoding human Cdx1 and Cdx2 homeobox. Down-regulation of Cdx1 and Cdx2 mRNA expression during colorectal carcinogenesis[J]. Int J Cancer, 1997,74(1):35–44.
[18] Chawengsaksophak K, James R, Hammond VE, et al. Homeosis and intestinal tumours in Cdx2 mutant mice[J]. Nature, 1997,386(6620):84–87.
[19] Hinoi T, Tani M, Lucas PC, et al. Loss of CDX2 expression and microsatellite instability are prominent features of large cell minimally differentiated carcinomas of the colon[J]. Am J Pathol,2001, 159(6):2239–2248.
[20] Bae JM, Lee TH, Cho NY, et al. Loss of CDX2 expression is associated with poor prognosis in colorectal cancer patients[J].World J Gastroenterol, 2015, 21(5):1457–1467. doi: 10.3748/wjg.v21.i5.1457.
[21] Nolte S, Zlobec I, Lugli A, et al. Construction and analysis of tissue microarrays in the era of digital pathology: a pilot study targeting CDX1 and CDX2 in a colon cancer cohort of 612 patients[J]. J Pathol Clin Res, 2017, 3(1):58–70. doi: 10.1002/cjp2.62.
[22] 郑见宝, 孙学军, 王炜, 等. HIF-1α与CDX2在结直肠腺癌组织中的表达及意义[J]. 中国普外基础与临床杂志, 2010, 17(12):1265–1269.Zheng JB, Sun XJ, Wang W, et al. Expressions of HIF-1α and CDX2 and Its Clinical Pathological Significance in Colorectal Adenocarcinoma[J]. Chinese Journal of Bases and Clinics in General Surgery, 2010, 17(12):1265–1269.
[23] Jiang G, Luo C, Sun M, et al. Methylation of CDX2 as a Predictor in Poor Clinical Outcome of Patients with Colorectal Cancer[J].Genet Test Mol Biomarkers, 2016, 20(11):710–714.
[24] Bilgin B, AN Sendur M, Akinci MB, et al. Negative CDX2 expression can be an important predictive and prognostic biomarker in stage II colon cancer[J]. J BUON, 2017, 22(1):282–283.
[25] 任海亮, 孙学军, 郑见宝, 等. 过表达CDX2抑制裸鼠结肠癌移植瘤的生长[J]. 中国肿瘤生物治疗杂志, 2011, 18(4):434–436.doi:10.3872/j.issn.1007–385X.2011.04.018.Ren HL, Sun XJ, Zheng JB, et al. Over-expression CDX2 inhibits growth of colorectal transplanted tumors in mude mice[J]. Chinese Journal of Cancer Biotherapy, 2011, 18(4):434–436. doi:10.3872/j.issn.1007–385X.2011.04.018.
