EphA2与VEGF-C在胃癌中的表达及其与淋巴管生成的关系
2017-03-23朱振华袁伟杰黄昌浩陈子华
朱振华,袁伟杰,黄昌浩,陈子华
(1. 湖南省长沙市中心医院 普通外科,湖南 长沙 410004;2. 中南大学湘雅医院 普通外科,湖南 长沙 410008)
胃癌是亚洲最常见的消化道恶性肿瘤,约占全球范围癌症死亡的10%以上,仅次于肺癌[1]。淋巴结转移是影响胃癌患者预后的重要因素[2],但是促进胃癌淋巴道转移的淋巴管生成机制还不明了。EphA2已被证实在胃癌、乳腺癌等多种肿瘤组织中明显过表达,并且与肿瘤微血管密度及患者预后密切相关[3]。VEGF-C是近年来发现的淋巴管内皮生长因子,其与受体VEGFR-3结合后可发生淋巴管内皮扩张,促使淋巴管形成[4]。为探究EphA2和VEGF-C两种蛋白在胃癌淋巴道转移中关系,本实验利用免疫组化SP法和real-time PCR方法分别检测EphA2与VEGF-C蛋白和mRNA在胃癌组织中的表达及两者相关性,同时用特异性淋巴管内皮标记物D2-40对淋巴管进行染色后分析EphA2和VEGF-C的表达对淋巴管生成的影响,为进一步抗肿瘤淋巴管生成的分子靶向治疗提供临床研究依据。
1 材料与方法
1.1 标本来源
收集82例中南大学湘雅医院自2012年12月—2013年6月收治的胃癌患者的癌组织及其距肿瘤边缘约2 cm的癌旁正常组织。所有患者术前均未行任何治疗,其中女36例,男46例;年龄分布31~81岁,中位年龄5.5岁;淋巴结转移者52例,无淋巴结转移者30例;按照国际抗癌联盟UICC 1997年TNM分期标准分期:I~II期40例,III期42例。
1.2 试剂
兔抗人EphA2多克隆抗体购自美国Millipore公司;兔抗人VEGF-C多克隆抗体和小鼠抗人D2-40单克隆抗体英国Abcam公司;即用型SP免疫组化染色试剂盒和DAB显色剂购自北京中杉金桥生物技术有限公司;逆转录试剂盒(GoScript TM Reverse Transcription System)购自美国Promega公司;SYBR Green购自瑞士Roche公司;引物由由上海生物生工公司合成。
1.3 方法
1.3.1 标本处理 82例标本均由10%福尔马林固定,常规石蜡包埋。蜡块切片,做免疫组织化学染色。所有石蜡标本(包括NK、RCCC)均连续切片,片厚约4 μm,共5张。其中1张作常规HE染色,3张作EphA2、VEGF-C、D2-40免疫组化染色,1张以PBS液代替一抗体作为阴性对照。随机抽取20例胃癌患者术后留取的新鲜标本进行real-time PCR。每例患者手术后30 min内取胃癌组织以及癌旁2 cm新鲜组织标本,同时随机选取2例患者远离肿瘤组织(>10 cm)的新鲜标本作为PCR阴性对照。所有标本放入已消毒的经1%DEPC水溶液处理过的EP管中,并迅速转移至-80 ℃低温冰箱中,供后续试验用。
1.3.2 免疫组化染色(SP二步法) 4 μm厚石蜡切片在65 ℃恒温箱中烘烤90 min后常规脱蜡以及水化,用3%H2O2室温下15 min消除内源性过氧化物酶,PBS漂洗 3次,每次 5 min;于 0.01 mol/L pH6.0 柠檬酸钠缓冲液中,用微波法进行抗原修复;PBS漂洗3次,每次5 min;滴加50 μL 3%BSA,37 ℃水浴箱孵育30 min;弃去封闭液,分别滴加1:100稀释的兔抗人EphA2多克隆抗体和兔抗人VEGF-C多克隆抗体以及1:150稀释的小鼠抗人D2-40单克隆抗体,37 ℃孵育1 h,用PBS代替一抗作阴性对照;PBS漂洗3次,每次5 min;分别滴加抗兔和抗鼠二抗,37 ℃孵育30 min。PBS漂洗 3 次,每次 5 min。DAB 显色 1~5 min,显微镜下观察染色情况,自来水冲洗2 min终止染色;苏木素复染细胞核20 s,常规脱水透明,中性树胶封片。
1.3.3 RNA提取和cDNA分析 TRIzol法提取总RNA。取100 mg组织置于盛有液氮的研钵中碾碎后加入1 mL TRIzol于继续碾磨成粉状,室温冷却后转移至 1.5 mL EP 管;1 1000r/min 4 ℃离心10 min后取上清至新的1.5 mL EP管。每管加入0.2 mL 氯仿,震荡 15 s混匀后室温放置 5 min,11 000r/min 4 ℃离心 15 min。吸取含总 RNA 的上层无色水相至一新的离心管中,每管加入等体积异丙醇,颠倒数次混匀,冰上静置 10 min 后 11 000r/min 4 ℃离心 10 min,弃上清。加入 1 mL 75% 乙醇(DEPC 水配制),颠倒混匀后 6 000r/min 4℃离心5 min。弃尽上清。待乙醇挥发干净后,加入适量DEPC水溶解,10 μL分装后,-70℃冻存。取OD260/OD280比值范围在1.8~2.0之间的RNA进行下一步实验。逆转录合成 cDNA:1 μL Oligo dT和1 μL总RNA加入到PCR小管中,补充DEPC水至 10 μL,混匀后,70 ℃ 5 min。按照逆转录试剂盒说明配置10 μL反应体系,混匀离心后42 ℃反应 1 h,然后 70 ℃ 10 min,将所得的 cDNA 置于-80 ℃保存备用。
1.3.4 real-time PCR 采用SYBR Green法进行real-time PCR。采用 primer 5.0 软件设计引物,VEGF-C 正 向:AAG GAG GCT GGC AAC ATA AC;VEGF-C 反 向:CCA CAT CTG TAG ACG GAC AC;EphA2 正向:GTG TAC AAG GGC ATG CTG AA;EphA2 反向:AAC TTG TCC AGG GCC CCA TT;β-actin 正 向:ACA GAG CCT CGC CTT TGC;β-actin 反向:ATC CTT CTG ACC CAT GCC CAC。按 照 10 μL SYBR Green、5 μL 稀 释 5倍的 cDNA、0.4 μL 正反向引物混合液和 4.6 μL DEPC水配置反应体系。按照95 ℃ 5 min预变性;95 ℃ 10 s;60 ℃ 1 min 进 行 40个循环;95 ℃5 s后,60 ℃ 1 min 的程序在 ABI7500 荧光定量PCR仪进行PCR扩增。
1.3.5 结果判断 ⑴ 免疫组化染色结果判定:EphA2与VEGF-C均为细胞浆表达的蛋白,因此阳性染色为胞浆内出现棕黄色染色,低倍镜下观察整个切片,分散选取5个不同的视野,高倍镜下观察细胞染色情况;综合阳性细胞百分率和染色强度进行结果判定。结果判定参照文献[5]报道,阳性细胞百分数≤5%为0分;6%~25%为1分,26~50%为2分;>50%为3分。染色强弱计分,阴性为0分;淡黄色染色为1分;中度黄色染色为2分;棕黄色染色为3分。按“阳性细胞+染色强弱”计总分,0~1分为阴性(-),2分为弱阳性(+),3~4分为中度阳性(++),5~6分为强阳性(+++)。阴性和弱阳性为低表达组,中度阳性和强阳性为高表达组。所有染色结果的判定均采用统一评分标准和双盲法,在完全不知样本临床资料的情况下,由两名研究者分别对实验结果进行评判、打分,所有评分过程均重复3次以上。⑵ 淋巴管密度(LVD)计数:对D2-40染色阳性淋巴管进行LVD计数。参照MEIDNER计数标准,每个标本先在光镜低倍视野下(10×4)确定组织中淋巴管最密集区及热点,再在高倍镜下(10×20)下观察着色腔,以此作为一个淋巴管,计数5个视野淋巴管数目并取其均数为肿瘤LVD的数量。
1.4 统计学处理
采用SPSS 18.0版统计软件对实验数据进行统计分析。比较EphA2蛋白和VEGF-C蛋白在胃癌、癌旁组织组间差异的显著性采用χ2检验,EphA2蛋白和VEGF-C蛋白在胃癌中表达的免疫组化结果与临床病理特征比较采用χ2检验,LVD在胃癌、癌旁组织组间以及在EphA2蛋白、VEGF-C蛋白高低表达组之间的差异性采用秩和检验,EphA2与VEGF-C蛋白的相关性检验采用Spearman等级相关分析,VEGF-C mRNA、EphA2 mRNA在癌、癌旁的比较采用秩和检验(经正态性检验,P<0.05,不符合正态分布),相关性检验采用pearson相关分析。P<0.05认为有统计学意义。
2 结 果
2.1 EphA2与VEGF-C蛋白在胃癌组织中的表达
EphA2和VEGF-C蛋白在胃癌组织中的阳性表达率分别为65.8%(54/82)和71.9%(59/82)(图1),而两者在癌旁组织中阳性表达率分别为42.6%、39%,差异均有统计学意义(均P<0.05)。
2.2 EphA2和VEGF-C蛋白高表达与胃癌临床病理特征之间的关系
分析结果显示,EphA2与VEGF-C蛋白表达与患者年龄、性别、肿瘤的大小以及肿瘤分化程度无明显关系(均P>0.05),但两种蛋白的表达与肿瘤浸润深度,有无淋巴结转移,TNM分期相关(均P<0.05)(表1)。
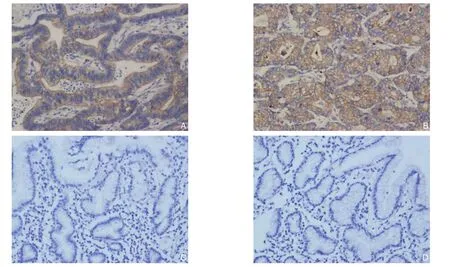
图1 胃癌组织EphA2与VEGF-C免疫组化检测(×400) A:EphA2阳性表达;B:VEGF-C阳性表达;C:EphA2阴性表达;D:VEGF-C阴性表达Figure 1 Immunohistochemical staining for EphA2 and VEGF-C in gastric cancer tissues (×400) A: Positive EphA2 expression;B: Positive VEGF-C expression; C: Negative EphA2 expression; D: Negative VEGF-C expression
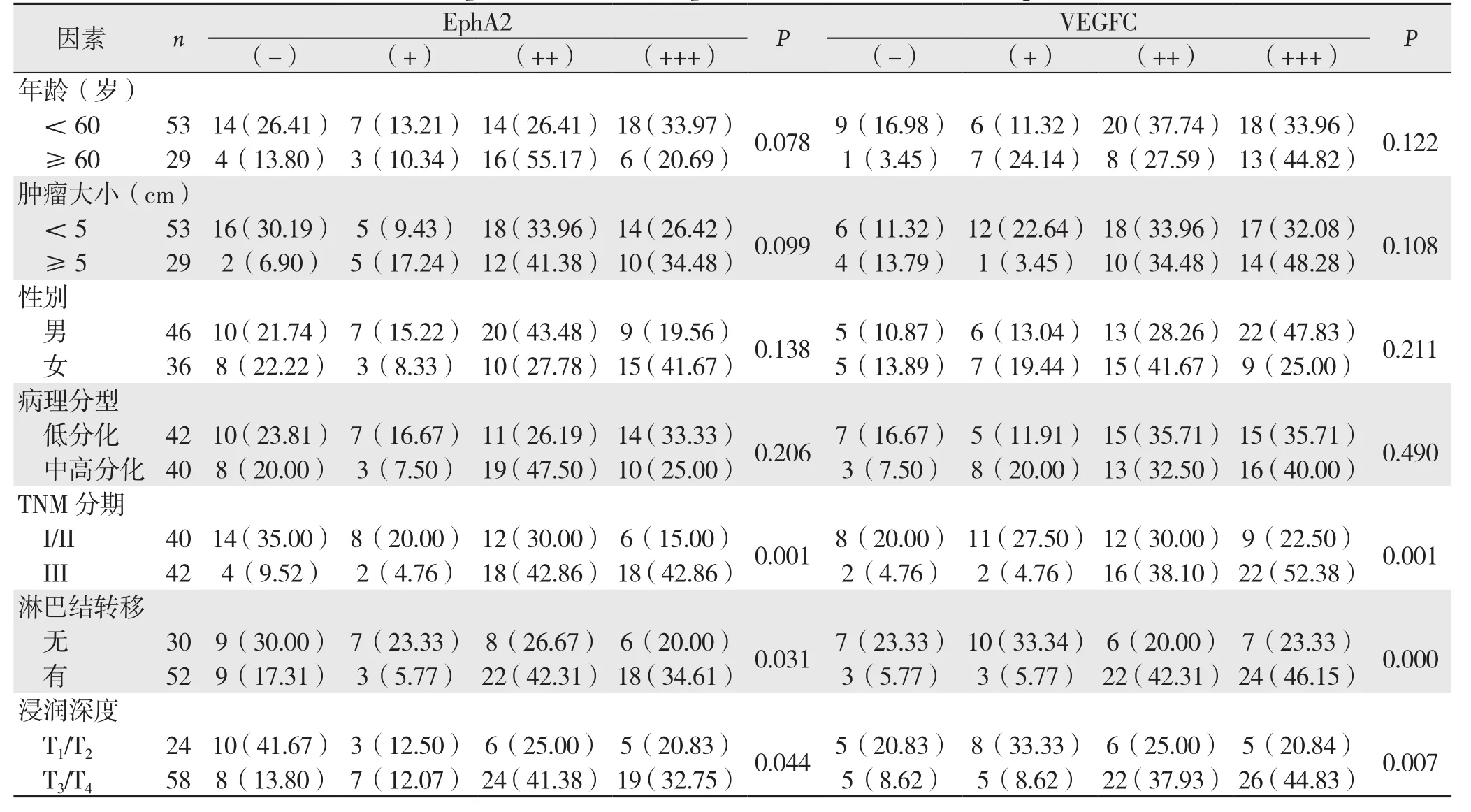
表1 EphA2与VEGF-C表达与胃癌临床病理特征的关系[n(%)]Table 1 Relations of EphA2 and VEGF-C expression with clinical factors of gastric cancer [n (%)]
2.3 EphA2和VEGF-C蛋白表达与LVD关系的分析
D2-40标记的淋巴管呈褐色染色(图2),EphA2和VEGF-C蛋白高表达组LVD计数分别为15.25±5.41、14.87±5.71,分别高于EphA2和V E G F-C蛋白低表达组(1 0.9 5±5.4 1、11.00±5.01)。秩和检验显示两者差异均有统计学意义(P=0.001、P=0.006)。

图2 D2-40免疫组化染色(×200) A:癌组织中(LVD计数14);B:癌旁组织(LVD计数4)Figure 2 Immunohistochemical staining for D2-40 (×200) A: Gastric cancer tissue (LVD count of 14); B: Adjacent gastric tissue (LVD count of 4)
2.4 EphA2与VEGF-C蛋白表达的相关性
EphA2蛋白与VEGF-C蛋白同为高表达者47例,同为低表达者16例,EphA2蛋白低表达而VEGF-C蛋白高表达者12例,EphA2蛋白高表达而VEGF-C蛋白低表达者7例,经Sperman等级相关分析显示EphA2和VEGF-C蛋白表达呈正相关(r=0.375,P=0.001),(表2)。
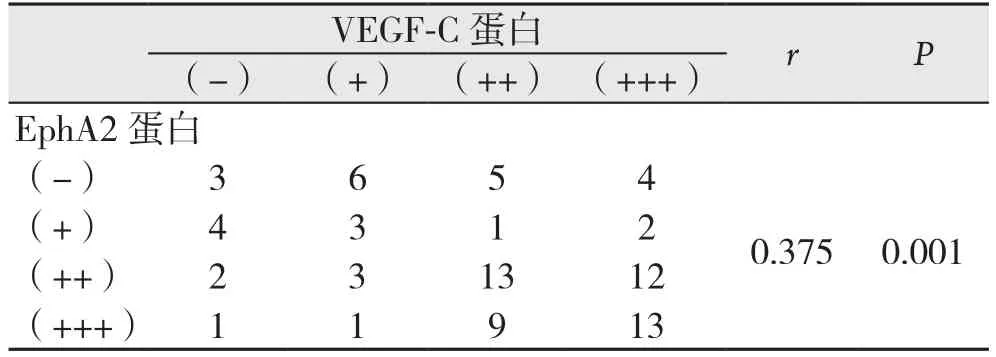
表2 EphA2与VEGF-C蛋白表达的相关性Table 2 Correlation between EphA2 and VEGF-C protein expressions
2.5 20例胃癌患者中VEGF-C、EphA2 mRNA表达情况及其两者的相关性分析
20例胃癌癌组织EphA2 mRNA相对表达量为3.00±1.48,而癌旁组织为1.57±0.70,差异有统计学意义(P=0.002);与EphA2 mRNA表达类似,20例胃癌患者癌组织VEGF-C mRNA相对表达量也明显高于癌旁组织[(3.33±1.76)vs.(1.86±0.94),P=0.009](表3)。采用Pearson相关分析结果显示EphA2 mRNA和VEGF-C mRNA表达量呈正相关(r=0.559,P=0.01) (图3)。
表3 EphA2、VEGF-C mRNA癌组织与癌旁组织中的相对表达量(±s,n=20)Table 3 Relative mRNA expression levels of EphA2 and VEGF-C in gastric cancer and adjacent tissues (±s,n=20)
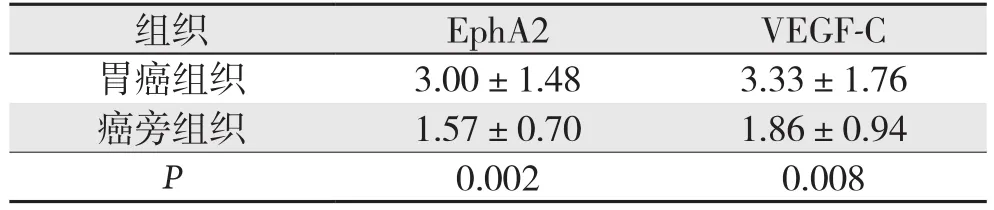
表3 EphA2、VEGF-C mRNA癌组织与癌旁组织中的相对表达量(±s,n=20)Table 3 Relative mRNA expression levels of EphA2 and VEGF-C in gastric cancer and adjacent tissues (±s,n=20)
组织 EphA2 VEGF-C胃癌组织 3.00±1.48 3.33±1.76癌旁组织 1.57±0.70 1.86±0.94 P 0.002 0.008
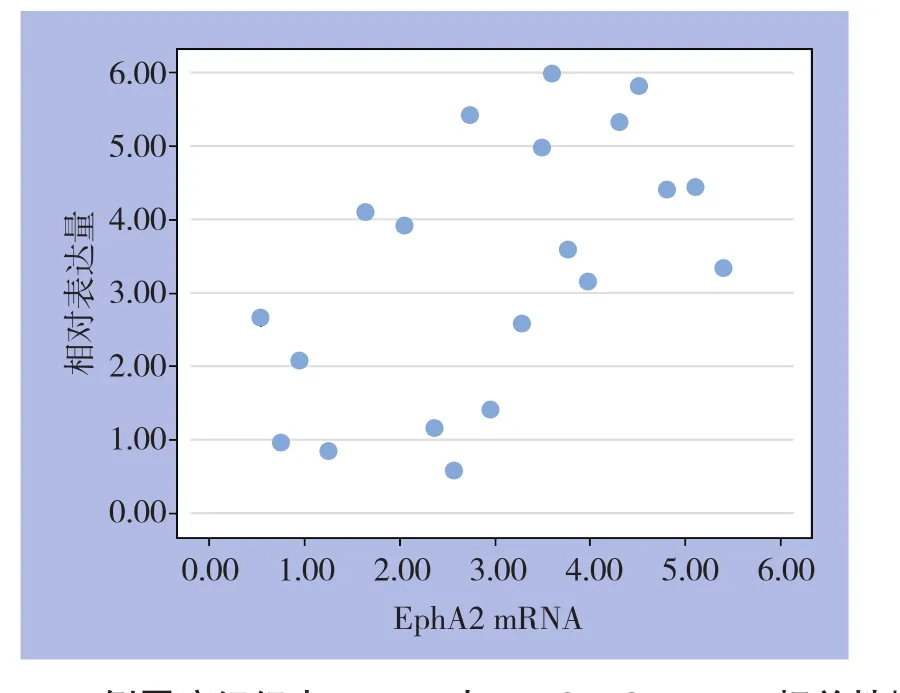
图3 20例胃癌组织中EphA2与VEGF-C mRNA相关性散点图Figure 3 Scatter plot for correlation between EphA2 and VEGF-C mRNA expressions in 20 specimens of gastric cancer tissue
3 讨 论
胃癌是中国发病率和病死率都位居前三的肿瘤[6]。虽然近年来随着D2为主的规范手术的推广以及术后合理的化疗,胃癌患者的生存率有所提高,但相较于结直肠癌这类术后生存率较高的恶性肿瘤,其治疗效果仍不满意[7]。癌细胞的扩散和转移是导致癌症患者死亡的主要原因,且大多经血道和淋巴道转移,其中胃癌以淋巴道转移为主[8]。新生淋巴管的生成是肿瘤转移的必然条件,EphA2和VEGF-C是近年来恶性肿瘤淋巴道转移的热点研究分子。
E p h受体酪氨酸激酶通过与糖基磷脂酰肌醇(GPI)样或跨膜的ephrin配体结合调解细胞的黏附、迁移和血管生成[9]。作为Eph家族的重要成员,ephrin-A1/EphA2已被证实在胃癌、乳腺癌、Kaposi肉瘤、舌癌等多种肿瘤组织中明显过表达,并且EphA2高表达与胃癌患者肿瘤TNM分期、浸润深度、淋巴结是否转移以及预后密切相关,与本文结果一致[3]。而D2-40作为恶性肿瘤淋巴管转移的重要参考指标,本研究中由D2-40所得的LVD计数与EphA2的高表达存在相关性,更加进一步提示EphA2的表达与胃癌淋巴结转移存在正相关,故考虑EphA2可能通过某个途径促进胃癌淋巴结转移。
目前研究[10-11]表明ephrin-A1/EphA2复合体可通过参与E-cadherin、β-catenin、VEGF[12]、Ras和MAPK信号通路[13]、RAF/MEK/ERK[14]等信号通道调控肿瘤细胞之间黏附性,破坏细胞间连接以及诱导EMT(上皮细胞-间充质转化)发生,进而导致肿瘤侵润和转移。本研究中real time-PCR结果显示癌组织中EphA2 mRNA表达水平显著高于癌旁组织,表明EphA2蛋白的高表达是受到转录水平调控。目前研究表明EphA2表达与乳腺癌[15]、非小细胞肺癌[16]、脑胶质瘤[4]等患者的预后相关。Yuan等[17]有研究提示高表达EphA2蛋白的胃癌患者预后较低表达者差,故可推测EphA2或可成为与预后有价值的判断指标。但是仅有EphA2单个指标,缺乏足够的特异性和敏感性,不足以评估胃癌患者的复发及转移风险。有必要进一步寻找特异性的促淋巴管生成因子及与EphA2的关系,为肿瘤淋巴转移提供特异性的检测指标。
VEGF-C是淋巴管生成特异性因子,能与位于淋巴管内皮细胞上的受体VEGFR-3结合,通过激活一系列反应,促进淋巴管内皮细胞增殖、迁移并抑制其凋亡,诱导毛细淋巴管的生成及发展,进而促进肿瘤内及肿瘤周围淋巴管生成,从而促使恶性肿瘤细胞进入淋巴系统发生远处转移,严重影响癌症患者的预后[18]。此外,实验中所见高表达VEGF-C蛋白的胃癌肿瘤组织中心区域较少看到开放性的淋巴管,但肿瘤边缘的组织中存在增生、扩张的淋巴管,与先前Saharinen等[19]研究结果基本一致,表明癌组织边缘新的淋巴管和毛细淋巴管形成对于恶性肿瘤的浸润、转移具有更加重要的意义和作用。RT-PCR结果表明胃癌组织VEGF-C的mRNA表达水平显著高于癌旁组织,进一步提示了胃癌与VEGF-C的mRNA表达相关。目前对VEGF-C参与肿瘤淋巴管生成机制的研究表明除肿瘤细胞本身能够分泌VEGF-C使癌组织中的VEGF-C水平升高外[20],VEGF-C还可通过胰岛素样生长因子受体(IGFIR)[21]、纤连蛋白1(FN1)[22]等多种途径上调其表达。当VEGF-C结合并激活其受体VEGFR-3,随后VEGFR-3胞内区与磷脂酰肌醇3激酶(PI3K)形成复合物并活化PI3K和Akt,引起下游分子Erk1/2磷酸化,从而发挥调节淋巴管生成的作用[18]。有研究[23]提示高水平的VEGF-C不仅可以增加了肿瘤附近淋巴管的生成,也增强肿瘤细胞的迁徙运动功能。VEGF-C通过多种途径来促进肿瘤的侵润及转移,从而促进肿瘤进展,缩短患者的生存时间。但VEGF-C目前还有许多调节机制不清,需要进一步研究。
本研究中EphA2与VEGF-C两种蛋白的相关性分析结果显示两者无论在蛋白水平还是mRNA表达水平都存在正相关趋势,提示在胃癌细胞中EphA2与VEGF-C在蛋白和mRNA水平上可能共同协调新生淋巴管生成,从而导致肿瘤的侵润和转移。有研究[24]表明,EphA2可能通过PI3K/Akt信号通路调节VEGF-C表达。EphA2缺陷的小鼠中重新表达EphA2后,后者可通过激活下游信号分子PI3K恢复内皮细胞重塑脉管的能力。而肿瘤细胞中的EphA2可引起下游PI3K磷酸化和Akt的473位丝氨酸磷酸化,通过抑制肿瘤细胞的凋亡来促进肿瘤细胞的转移[25],提示Akt是EphA2下游的重要分子。与此同时,细胞外基质蛋白Fibronectin的裂解体EDA可PI3K/Akt信号通路促进VEGF-C表达,而抑制PI3K/Akt信号通路后VEGF-C表达明显降低[5],说明VEGF-C也是PI3K/Akt信号通路的靶分子之一。
值得肯定的是,在胃癌的浸润转移中,EphA2与VEGF-C相互介导,促进胃癌的淋巴转移。但是具体的介导通路机制,待进一步研究证实。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69–90. doi: 10.3322/caac.20107.
[2] 欧阳喜, 郝腾飞. 胃癌淋巴结微转移的研究进展[J]. 中国普通外科杂志, 2015, 24(4):589–592. doi:10.3978/j.issn.1005–6947.2015.04.023.Ouyang X, Hao TF. Lymph node micrometastasis in gastric cancer:research advances[J]. Chinese Journal of General Surgery, 2015,24(4):589–592. doi:10.3978/j.issn.1005–6947.2015.04.023.
[3] Wykosky J, Debinski W. The EphA2 receptor and ephrinA1 ligand in solid tumors: function and therapeutic targeting[J]. Mol Cancer Res, 2008, 6(12):1795–1806. doi: 10.1158/1541–7786.
[4] Puttick S, Stringer BW, Day BW, et al. EphA2 as a diagnostic imaging target in glioblastoma: a positron emission tomography/magnetic resonance imaging study[J]. Mol Imaging, 2015, 14:385–399.
[5] Zhang X, Ding L, Diao Z, et al. CYR61 modulates the vascular endothelial growth factor C expression of decidual NK cells via PI3K/AKT pathway[J]. Am J Reprod Immunol, 2012, 67(3):216–223. doi: 10.1111/j.1600–0897.2011.01080.x.
[6] 陈万青, 张思维, 曾红梅, 等.中国2010年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014, 23(1):1–10. doi:10.11735/j.issn.1004–0242. 2014.01.A001.Chen WQ, Zhang SW, Zeng HM, et al. Report of cancer incidence and mortality in China (2010)[J]. China Cancer, 2014, 23(1):1–10.doi:10.11735/j.issn.1004–0242.2014.01.A001.
[7] Hacker U, Lordick F. Current standards in the treatment of gastric cancer[J]. Dtsch Med Wochenschr, 2015, 140(19):1417. doi:10.1055/s–0041–106868.
[8] Mocellin S, Nitti D. Lymphadenectomy extent and survival of patients with gastric carcinoma: a systematic review and metaanalysis of time-to-event data from randomized trials[J]. Cancer Treat Rev, 2015, 41(5):448–454. doi: 10.1016/j.ctrv.2015.03.003.
[9] Park I, Lee HS. EphB/ephrinB signaling in cell adhesion and migration[J]. Mol Cells, 2015, 38(1):14–19. doi: 10.14348/molcells.2015.2116.
[10] Huang J, Xiao D, Li G, et al. EphA2 promotes epithelialmesenchymal transition through the Wnt/beta-catenin pathway in gastric cancer cells[J]. Oncogene, 2014, 33(21):2737–2747. doi:10.1038/onc.2013.238.
[11] Thomson S, Petti F, Sujka-Kwok I, et al. A systems view of epithelialmesenchymal transition signaling states[J]. Clin Exp Metastasis, 2011,28(2):137–155. doi: 10.1007/s10585–010–9367–3.
[12] Cheng N, Brantley DM, Liu H, et al. Blockade of EphA receptor tyrosine kinase activation inhibits vascular endothelial cell growth factor-induced angiogenesis[J]. Mol Cancer Res, 2002, 1(1):2–11.
[13] Tandon M, Vemula SV, Mittal SK. Emerging strategies for EphA2 receptor targeting for cancer therapeutics[J]. Expert Opin Ther Targets, 2011, 15(1):31–51. doi: 10.1517/14728222.2011.538682.
[14] Hamaoka Y, Negishi M, Katoh H. EphA2 is a key effector of the MEK/ERK/RSK pathway regulating glioblastoma cell proliferation[J]. Cell Signal, 2016, 28(8):937–945. doi: 10.1016/j.cellsig.2016.04.009.
[15] Husa AM, Magić Ž, Larsson M, et al. EPH/ephrin profile and EPHB2 expression predicts patient survival in breast cancer[J]. Oncotarget, 2016, 7(16):21362–21380. doi: 10.18632/oncotarget.7246.
[16] Amato KR, Wang S, Hastings AK, et al. Genetic and pharmacologic inhibition of EPHA2 promotes apoptosis in NSCLC[J]. J Clin Invest, 2014, 124(5):2037–2049. doi: 10.1172/JCI72522.
[17] Yuan WJ, Ge J, Chen ZK, et al. Over-expression of EphA2 and EphrinA-1 in human gastric adenocarcinoma and its prognostic value for postoperative patients[J]. Dig Dis Sci, 2009, 54(11):2410–2417. doi: 10.1007/s10620–008–0649–4.
[18] Coso S, Zeng Y, Opeskin K, et al. Vascular endothelial growth factor receptor-3 directly interacts with phosphatidylinositol 3-kinase to regulate lymphangiogenesis[J]. PLoS One, 2012, 7(6):e39558. doi:10.1371/journal.pone.0039558.
[19] Saharinen P, Tammela T, Karkkainen MJ, et al. Lymphatic vasculature: development, molecular regulation and role in tumor metastasis and in fl ammation[J]. Trends Immunol, 2004, 25(7):387–395.[20] Chen JC, Chang YW, Hong CC, et al. The role of the VEGF-C/VEGFRs axis in tumor progression and therapy[J]. Int J Mol Sci,2012, 14(1):88–107. doi: 10.3390/ijms14010088.
[21] Zhang C, Hao L, Wang L, et al. Elevated IGFIR expression regulating VEGF and VEGF-C predicts lymph node metastasis in human colorectal cancer[J]. BMC Cancer, 2010, 10:184. doi:10.1186/1471–2407–10–184.
[22] Morita Y, Hata K, Nakanishi M, et al. Cellular fibronectin 1 promotes VEGF-C expression, lymphangiogenesis and lymph node metastasis associated with human oral squamous cell carcinoma[J].Clin Exp Metastasis, 2015, 32(7):739–753. doi: 10.1007/s10585–015–9741–2.
[23] Lim J, Ryu JH, Kim EJ, et al. Inhibition of Vascular Endothelial Growth Factor Receptor 3 Reduces Migration of Gastric Cancer Cells[J]. Cancer Invest, 2015, 33(8):398–404. doi:10.3109/07357907.2015.1047509.
[24] Brantley-Sieders DM, Caughron J, Hicks D, et al. EphA2 receptor tyrosine kinase regulates endothelial cell migration and vascular assembly through phosphoinositide 3-kinase-mediated Rac1 GTPase activation[J]. J Cell Sci, 2004, 117(Pt 10):2037–2049.
[25] Harada K, Hiramoto-Yamaki N, Negishi M, et al. Ephexin4 and EphA2 mediate resistance to anoikis through RhoG and phosphatidylinositol 3-kinase[J]. Exp Cell Res, 2011,317(12):1701–1713. doi: 10.1016/j.yexcr.2011.05.014.
