达芬奇机器人与腹腔镜手术治疗胃癌疗效比较的Meta分析
2017-03-23王沛云熊兵红曾玉剑田衍王昆华罗华友
王沛云,熊兵红,曾玉剑,田衍,王昆华,,罗华友,
(1. 昆明医科大学第一附属医院 胃肠外科,云南 昆明 650032;2. 云南省消化病研究所,云南 昆明 650032)
自1994年Kitano等[1]首次报道腹腔镜胃切除手术(laparoscopic gastrectomy,LG)后,腹腔镜微创技术因其创伤小、康复快等优点,在外科领域得到广泛认可[2]。然而,其二维画面、学习曲线长、手术器械灵活度欠佳、需多人配合等缺陷也阻碍了其进一步发展。2000年7月,由Intuitive Surgical公司研发的达芬奇机器人手术系统被美国食品与药品监督管理局(FDA)正式批准作为智能内窥镜微创手术系统应用于临床外科。2002年Hashizume等[3]首次报道了达芬奇机器人辅助胃癌根治手术(robotic gastrectomy,RG)后,机器人胃切除术在中国、意大利、韩国、日本等国家迅速发展。虽然多位学者对此类研究进行了荟萃分析,但是各位学者均着重于分析其近期疗效,未对3年生存率等远期疗效进行总结,且各个研究的部分结果存在差异,未能达成一致。再者,随着达芬奇机器人手术系统的不断发展,其技术和疗效仍在提升,相应的研究报道也在持续更新。另外,达芬奇机器人手术系统近年来才开始应用于部分胃癌手术患者,其在胃癌治疗中的地位尚未有定论,未纳入指南推荐。因此,本研究对国内外公开发表的关于RG与LG治疗胃癌的临床对比研究[4-20]进行Meta分析,旨在系统评价达芬奇机器人手术系统在胃癌临床治疗中的近远期疗效、安全性。
1 资料与方法
1.1 检索策略
以“Robotic OR da Vinci OR Robot-Assisted”、“Gastrectomy”、“Gastric”、“Cancer OR Carcinoma OR Tumor OR Neoplasm”、“Laparoscopic OR Laparoscopic-Assisted”和“机器人”、“达芬奇”、“胃切除术”、“胃癌”、“腹腔镜”为主要检索词,检索PubMed、Medline、Cochrane labrary、Embase、数字化期刊全文数据库(万方数据)、中国期刊全文数据库(CNKI)等数据库中关于RG与LG的临床对比研究。检索时间限定为2000年—2017年1月8日,通过“相关检索”功能拓宽范围,避免漏检。
1.2 文献纳入与排除标准
纳入标准:⑴ 公开发表关于RG与LG的随机/非随机对照(randomized controlled trial,RCT/non-randomized controlled trial,NRCT)研究;⑵ 研究对象证实为初次接受手术治疗的胃癌患者;⑶ 研究病例单组样本量大于30例,并提供明确的病例选择标准、分组方法;⑷ 至少提供1项RG与LG临床疗效对比数据;⑸ 来源于同一机构病例重复者,纳入质量较高和数据更详细的研究;⑹ 原始数据,连续性变量应提供平均数和标准差,计数资料应提供事件发生人数和样本总量。二分类变量应提供合并优势比(odds ratio,OR)值及95%可信区间(confidence interval,CI)或可换算成OR值及其95%CI的回归系数及其标准误差。排除标准:⑴ 非LG与RG对比研究;⑵ 研究病例包含其他良性胃肠疾病;⑶ 研究病例仅行姑息性胃大部切除术、减瘤术或短路手术;⑷ 研究中包含急诊手术病例;⑸ 文献中无法提取有效的对比数据;⑹ 重复发表的文献;⑺ 非同期对照研究;⑻ 在淋巴结清扫范围或病期上有明显分组倾向者。
1.3 数据提取
由2位研究员独立提取,存在争议时,双方讨论解决或由第3方决定。数据类型:⑴ 一般资料,包括作者、文献发表时间、研究类型、样本量、体质量指数(BMI)、肿瘤部位及大小、TNM分期;⑵ 结局指标,包括手术时间及失血量、淋巴结清扫数目、中转率、近远端切缘距离、R0切除率、术后住院时间、术后首次排气及进食时间、并发症发生率、3年生存率、病死率。
1.4 文献质量评价[21]
采用MINORS评分标准,对NRCT临床试验进行质量评估(0分:没有说明;1分:说明不充分;2分:说明充分)。为了更准确的评价本研究所纳入文献的质量,笔者对MINORS评分标准的第3、6、7、8条作了相应修改(表1)。
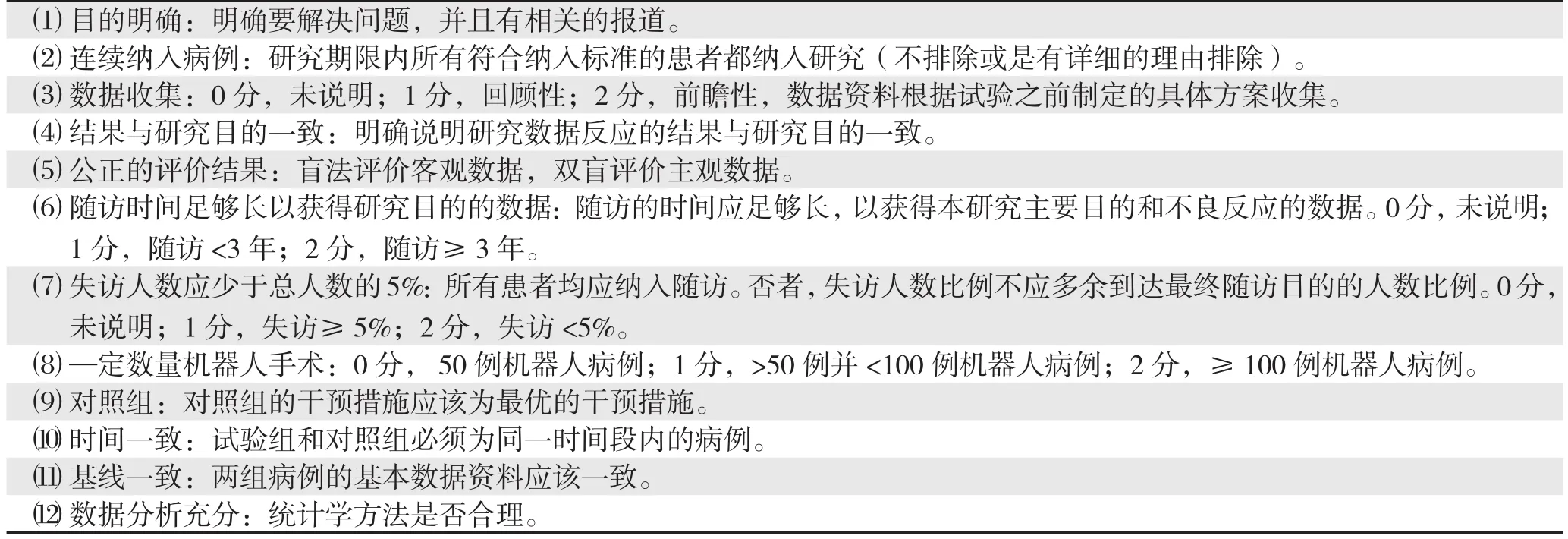
表1 MINORS评分标准Table 1 MINORS criteria
1.5 统计学处理
采用RevMan 5.2软件进行Meta分析,计量资料采用OR值,计数资料采用加权均数差(WMD)进行疗效分析。各效应量之间以95%CI参数估计。各研究间的异质性采用χ2检验和I2值进行评价,若出现异质性(I2>50%,P<0.05),采用随机效应模型;无异质性时(I2<50%,P≥0.05),采用固定效应模型,P<0.05时差异有统计学意义。
2 结 果
2.1 检索结果
初步检索文献33 400篇,阅读标题排除33 292篇。阅读摘要,71篇因缺乏病例对照或为综述、述评、病例报告被排除。阅读全文,2篇因缺乏有效数据,18篇因病例重复被排除。最终,纳入NRCT文献17篇,中文文献3篇,英文文献14篇,共5 787例患者,RG组1 676例,LG组4 111例(图1)。纳入文献的基本特征见表2,纳入文献的质量评分见表3。
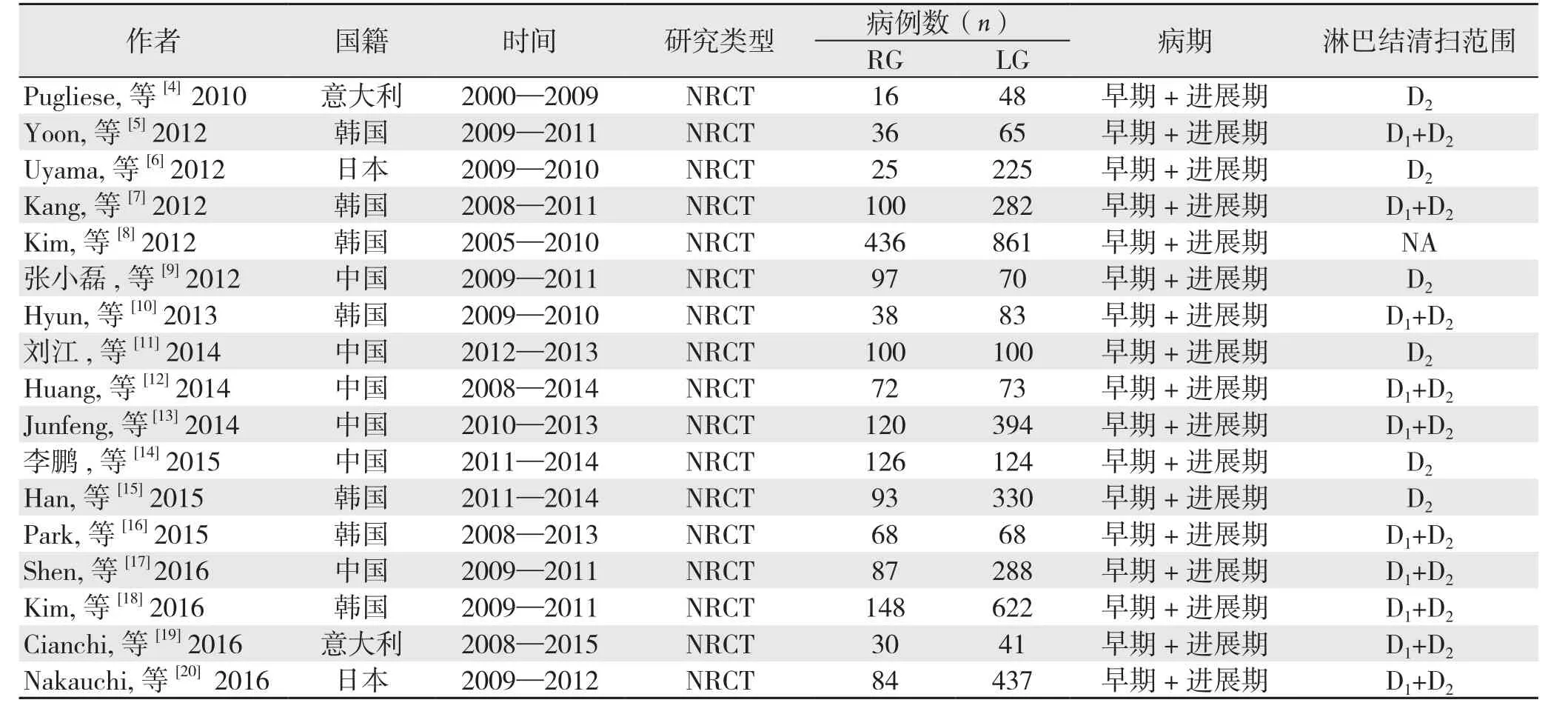
表2 纳入文献的基本特征Table 2 Characteristics of the included studies
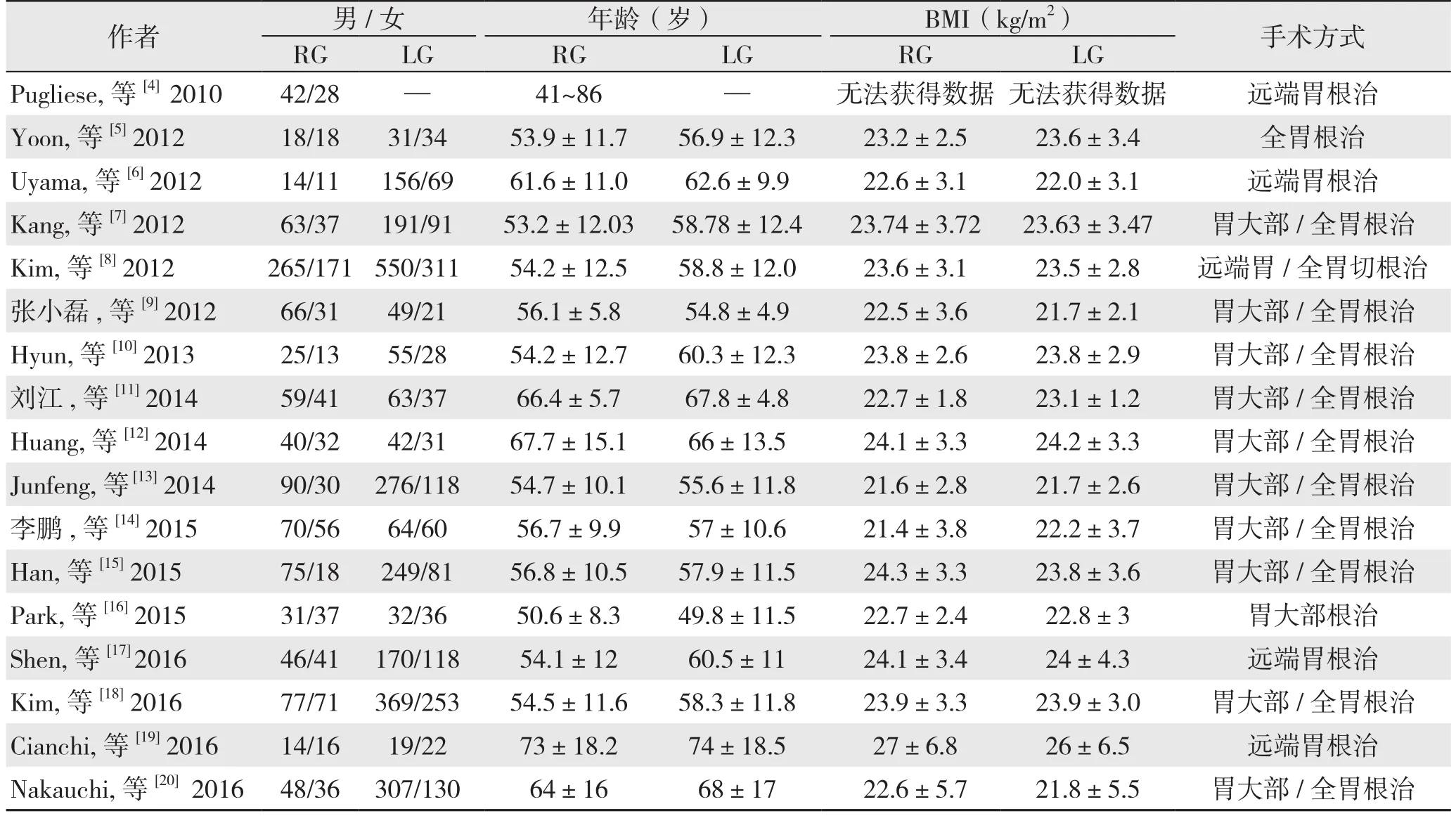
表2 纳入文献的基本特征(续)Table 2 Characteristics of the included studies (continued)

表3 纳入文献的质量评分Table 3 Quality assessment scoring of the included studies
2.2 Meta分析结果
2.2.1 手术时间 16篇文献[4-19]报道了手术时间,同质性检验I2=89%,P<0.05,采用随机效应模型分析,结果显示RG组手术时间明显长于LG组(WMD=43.51,95%CI=34.14~52.88,P<0.05)(图2)。
2.2.2 术中出血量 13 篇文献[4,6-14,16-17,19]报道了术中出血量,同质性检验I2=95%,P<0.05,采用随机效应模型分析,结果显示RG组术中出血量明显 少 于 LG组(WMD=-30.17,95%CI=-42.83~-17.51,P<0.05)(图 3)。
2.2.3 淋巴结清扫数目14篇文献[4-6,8-15,17-19]报道了淋巴结清扫数目,同质性检验I2=88%,P<0.05,采用随机效应模型分析,结果显示RG组淋巴结清扫数目多于LG组(WMD=1.95,95%CI=0.07~3.84,P<0.05)(图 4)。
2.2.4 术后首次进食时间 9 篇文献[4,6,8-9,13-15,17,19]报道了术后首次进食时间,同质性检验I2=1%,P<0.05,采用固定效应模型分析,结果显示RG组术后首次进食时间明显短于LG组(WMD=-0.22,95%CI=-0.32~-0.12,P<0.05)(图 5)。

图2 手术时间比较Figure 2 Comparison of operative time
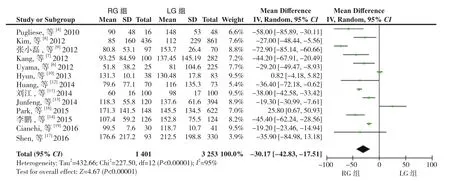
图3 术中出血量比较Figure 3 Comparison of intraoperative blood loss

图4 淋巴结清扫数目比较Figure 4 Comparison of number of resected lymph nodes
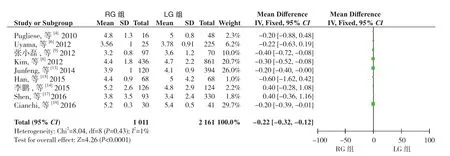
图5 术后首次进食时间比较Figure 5 Comparison of time to first postoperative food intake
2.2.5 近端切缘距离9 篇文献[5,8-11,13,15,17-18]报道了近端切缘距离,同质性检验I2=4%,P>0.05,采用固定效应模型分析,结果显示两组近端切缘距离无差异(WMD=1.09,95%CI=-0.43~2.61,P>0.05)(图 6)。

图6 近端切缘距离比较Figure 6 Comparison of proximal margin distance
2.2.6 远端切缘距离9篇文献[5,8-11,13,15,17-18]报道了远端切缘距离,同质性检验I2=78%,P>0.05,采用随机效应模型分析,结果显示两组远端切缘距离无差异(WMD=0.06,95%CI=-0.43~0.55,P>0.05)(图 7)。
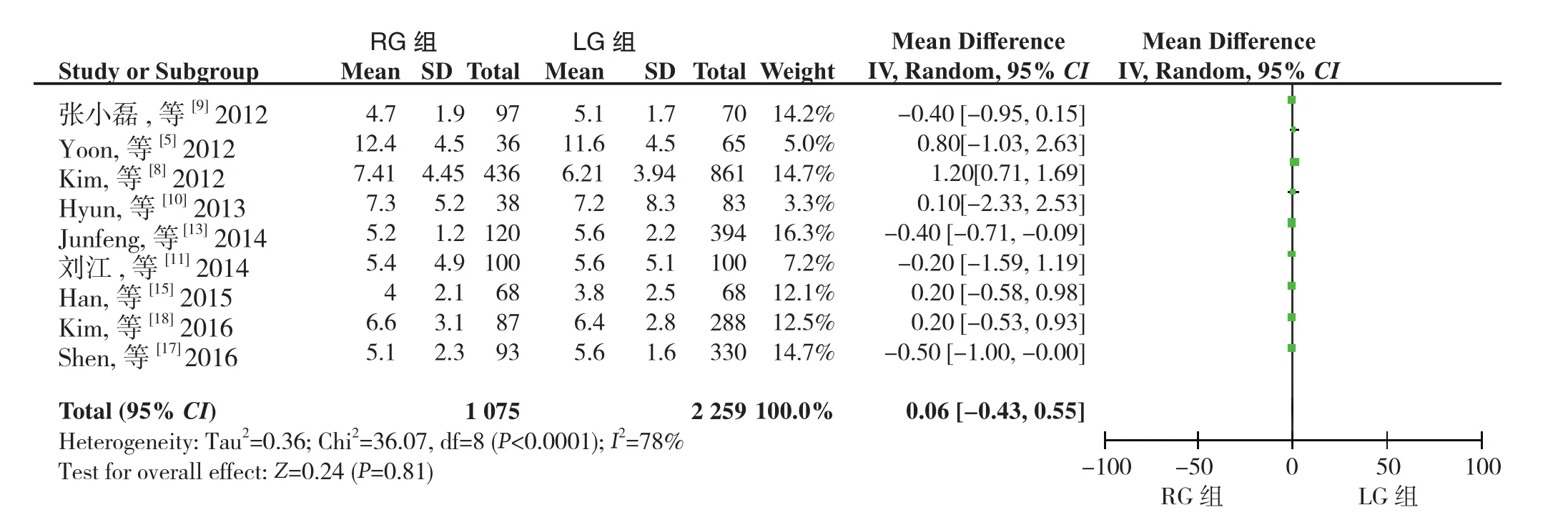
图7 远端切缘距离比较Figure 7 Comparison of distal margin distance
2.2.7 R0切除率 17篇文献[4-20]报道了R0切除率,同质性检验I2=0%,P>0.05,采用固定效应模型分析,结果显示两组R0切除率无差异(OR=1.38,95%CI=0.22~8.64,P>0.05)(图 8)。
2.2.8 术后首次通气时间 9 篇文献[4-5,9,11,13-14,17-19]报道了术后首次通气时间,同质性检验I2=74%,P>0.05,采用随机效应模型分析,结果显示两组术后首次通气时间无差异(WMD=-0.12,95%CI=-0.30~0.06,P>0.05)(图 9)。
2.2.9 术后住院时间 15篇文献[4-9,11-19]报道了术后住院时间,同质性检验I2=88%,P>0.05,采用随机效应模型分析,结果显示两组术后住院时间无差异(WMD=-0.60,95%CI=-1.25~0.06,P>0.05)(图 10)。
2.2.10 并发症发生率 17篇文献[4-20]报道了并发症发生率,同质性检验I2=0%,P>0.05,采用固定效应模型分析,结果显示两组并发症发生率无差异(OR=0.95,95%CI=0.78~1.16,P>0.05)(图 11)。
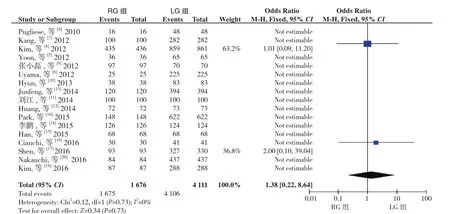
图8 R0切除率比较Figure 8 Comparison of R0 resection rate

图9 术后首次通气时间比较Figure 9 Comparison of time to first postoperative gas passage

图10 术后住院时间比较Figure 10 Comparison of length of postoperative hospital stay

图11 并发症发生率比较Figure 11 Comparison of incidence of postoperative complications
2.2.11 病死率 9 篇文献[4,8,12-14,16,18-20]报道了病死率,同质性检验I2=0%,P>0.05,采用固定效应模型分析,结果显示两组病死率无差异(OR=1.04,95%CI=0.62~1.77,P>0.05)(图 12)。
2.2.12 中转率 3 篇文献[4,11,16]报道了中转率,同质性检验I2=81%,P>0.05,采用随机效应模型分析,结果显示两组中转率无差异(OR=2.63,95%CI=0.25~27.65,P>0.05)(图 13)。
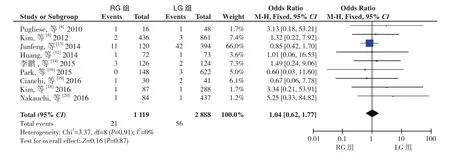
图12 病死率比较Figure 12 Comparison of mortality rate

图13 中转率比较Figure 13 Comparison of conversion rate
2.2.13 生存率3篇文献[4,13,20]报道了3年生存率,同质性检验I2=0%,P>0.05,采用固定效应模型分析,结果显示两组3年生存率无差异(OR=0.86,95%CI=0.60~1.23,P>0.05)(图 14)。

图14 3年生存率比较Figure 14 Comparison of 3-year survival rate
2.3 亚组分析
根据研究者所属国家和文献发表的时间不同,对所纳入文献的指标进行亚组分析。结果显示,RG与LG两种手术方式的淋巴结清扫数目在西方国家亚组(WMD=1.37,95%CI=-12.94~15.68,P=0.85)与2010—2013年亚组(WMD=0.74,95%CI=-2.18~3.67,P=0.62)无明显差异,相应指标的结果并未发生明显的改变(表4)。
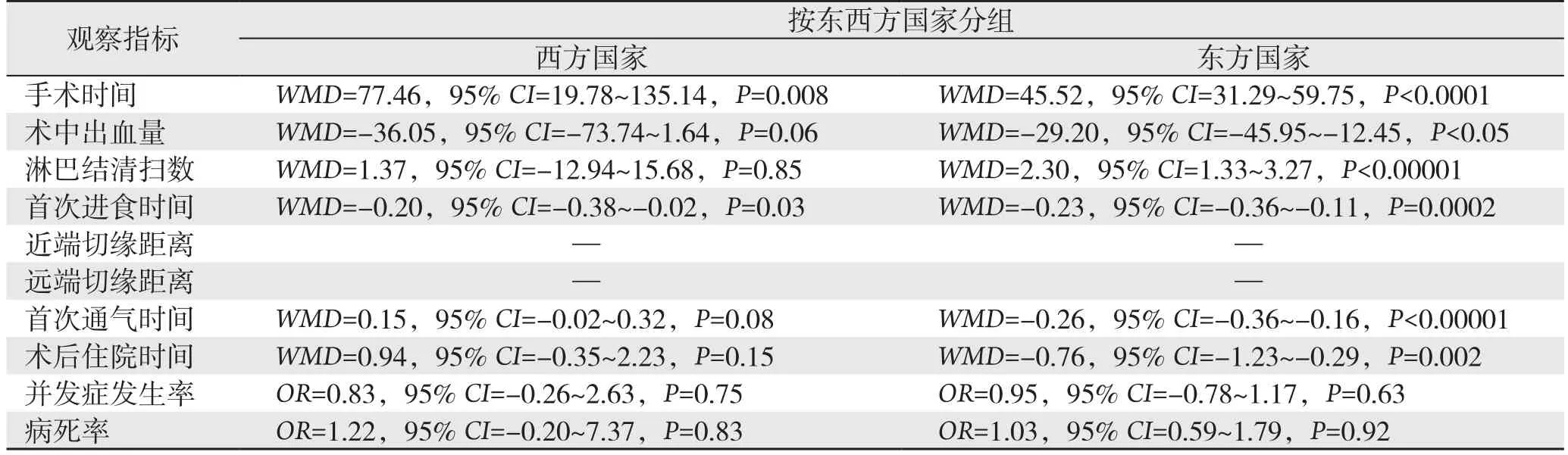
表4 亚组分析Table 4 Subgroup analysis
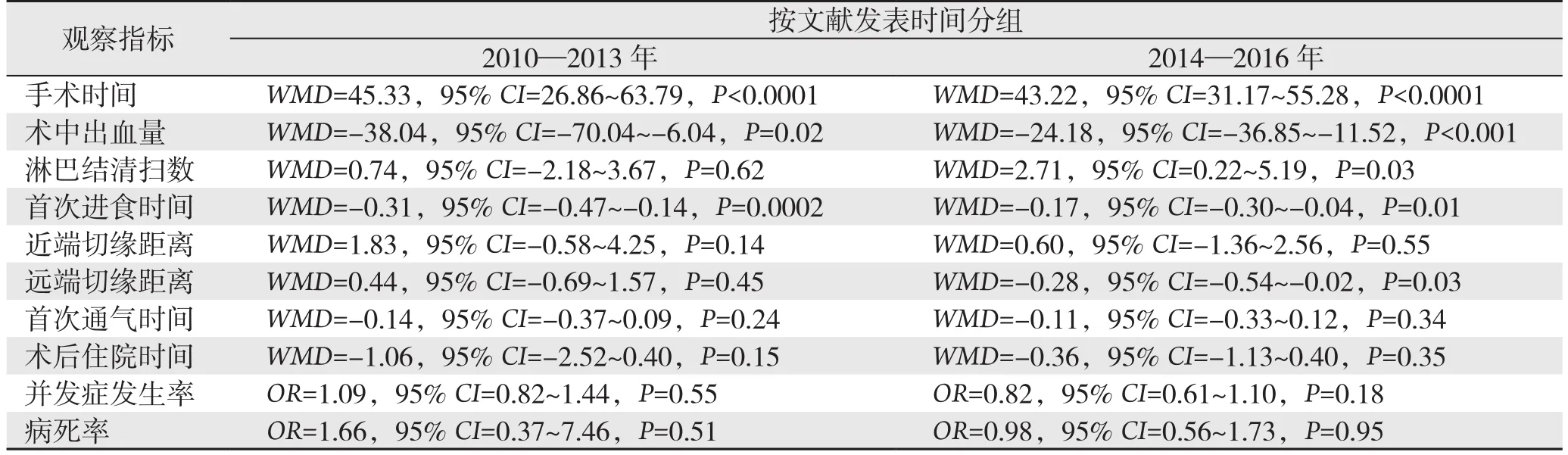
表4 亚组分析(续)Table 4 Subgroup analysis (continued)
2.4 异质性及敏感性分析
当I2>50%且P<0.05,即认为有实质异质性。研究结果显示远端切缘距离、术后首次通气时间、术后住院时间以及中转率存在异质性(I2>50%,P>0.0 5),而手术时间、术中出血量、淋巴结清扫数目、术后首次进食时间存在实质异质性(I2>50%,P<0.05)。根据MINORS评分选取17分以上的高质量文献进行敏感性分析,结果显示淋巴结清扫数目无明显差异(WMD=1.87,95%CI=-1.24~3.97,P>0.05),余结果未变。
2.5 发表偏倚分析
采用Egger检验对各研究间的手术时间和术中出血量的发表偏倚进行分析。Egger检验结果显示手术时间(P=0.81)、术中出血量(P=0.35)在各研究间无明显发表偏倚。
3 讨 论
我国于2008年由北京解放军总医院率先引入达芬奇机器人,于2009年6月和2010年3月分别由杜晓辉等[22]和余佩武等[23]成功完成了首例达芬奇机器人低位直肠癌前切除术及胃癌根治术。目前达芬奇机器人已经广泛应用于普通外科等[17]。根据本研究对RG与LG胃癌治疗的对比分析,发现两者疗效存在差异。
本Meta分析结果显示,RG的手术时间比LG长。主要原因为机器人手术系统在手术初始阶段需要组装机器,Jiménez-Rodríguez等[24]报道RG平均准备时间为(62.9±24.6)min,但是随着经验的积累其准备时间会逐渐缩短,Huang等[12]报道具备25例手术操作经验后准备时间可减少到30 min,Kang[7]也报道RG经验丰富组比缺乏经验组平均手术时间明显缩短。其次,机器人手术是一门新兴的微创技术,对其熟练掌握需要一个学习过程。但是,RG的学习曲线明显较LG短,杜晓辉等[25]和Huang等[12]分别报道LG手术学习曲线为30~50例,而外科医生行RG手术10~20例后其手术时间将达到稳定水平。Hyun等[10]将LG组与具备了20例RG手术经验组进行了对比,发现两组手术时间并无明显差异。Huang等[12]对LG与RG学习曲线中、后段作了比较,发现不论何种阶段,LG均比RG的手术时间长。因此,在度过学习曲线后,RG术中所用时间将比LG短。
本Meta分析结果显示,RG的术中出血量比LG少,且RG的淋巴结清扫数目多于LG。胃周组织结构复杂,血管、淋巴管丰富,在行LG胃周组织分离、淋巴结彻底清扫的过程中,容易导致出血,从而影响操作视野和术者对组织结构的辨认。然而,达芬奇机器人所具备的优势解决了这些难题[4-20],如:⑴ 抖动过滤,机械臂消除人手自然震颤,提高操作的稳定性;⑵ 高清三维画面,3D立体图像将手术视野放大10~15倍,更清楚的显露胃周细小血管及组织结构层次,使胃周血管脉络化更安全,提高操作的精确度;⑶ 机械臂具备7个自由活动度仿真机械腕,极大地提高了操作的灵活性和在狭小空间操作的能力;⑷ 术者单独控制机械臂,避免扶镜手与术者配合不默契的问题;⑸ 术者采取坐姿,增加了身体舒适度,提高术者操作时的注意力;⑹ 术者远程操控,避免与患者直接接触;⑺ 消化道重建实现全腔镜下体内吻合,对于肥胖、桶状胸、食管离断平面高、肋弓夹角小、腹壁前后径宽等患者,全腔镜下体内吻合具有相当大的优势。这些特点无疑提高了操作的精准度及稳定性、降低了失误率、实现了真正的微创。
对于早期胃癌,淋巴结清扫数目既反映了手术根治程度,也影响患者的预后。对于中晚期胃癌,D2淋巴结清扫术仍是其治疗的标准术式。然而,LG行D2淋巴结清扫却存在一定的难度。纳入的文献中,有6篇国内外的研究[8-9,13,17-19]结果显示RG组比LG组清扫的淋巴结数目多,而其余研究的结果显示两者淋巴结清扫数目无明显差异[4-6,10-12,14-15]。纳入的研究[4-20]中,RG手术淋巴结清扫数目约为23.1~44.3个,均能达到D2淋巴结清扫的范围。这就说明了RG能够达到,甚至超过LG的治疗效果。
本Meta分析结果显示,RG比LG的术后首次进食时间更早。Kim等[8]和张小磊等[9]研究的结果表明两者存在明显差异,其余研究显示两者无明显差异。其原因可能为[8-9]:⑴ RG操作时机械臂动作稳定、灵活,避免了对组织的过度牵拉、分离和对血管的误伤,对患者的创伤小;⑵ 采用加速康复外科理念对围手术期进行管理,张小磊[9]在研究中采用这一方法对患者进行管理后,发现RG组患者术后下床时间、术后首次排气及进食时间均早于LG组。
除此之外,本Meta分析结果显示RG组与LG组其余数据对比均无明显差异。但是远端切缘距离、中转率、术后住院时间、术后首次排气时间存在异质性,其原因可能为:⑴ 纳入研究的术者可能是处于不同RG学习阶段,各指标的异质性较大;⑵ 纳入的研究的肿瘤部位、大小、分期存在差异;⑶ 围手术期处理及手术方式的选择不同,也可能造成结果的差异。但是,Abraham等[26]表示当比较手术短期效果时,合并高质量非随机对照试验,其结果同样具有说服力。对高质量的文献进行分析后,发现两组淋巴结清扫数目差异不明显(WMD=1.87,95%CI=-1.24,3.97,P>0.05),其余结果未发生改变,说明本系统分析结果较为可靠。
笔者根据研究者所属国家和文献发表的时间不同,对所纳入文献的指标进行亚组分析。结果显示相应指标的结果并未发生明显的改变,但其中RG与LG两种手术方式的淋巴结清扫数目在西方国家亚组与2010—2013年亚组无明显差异,其原因可能为,一方面纳入的西方国家的文献数量较少,从而对结果存在一定的影响;另一方面,相比2013年以前而言,2013年以后RG淋巴结清扫数目比LG明显增多,可能与达芬奇机器人手术系统技术的不断进步和术者对其操作熟练度的提升相关。术后首次通气时间和术后住院时间中“东方国家”亚组结果显示RG的相应时间明显短于LG,其可能与采用加速康复外科理念对围手术期进行管理相关。
随着RG经验不断积累,我国的余佩武等[27]在《2015年机器人胃癌手术专家共识》中总结,RG已经用于根治分期为III期的胃癌,这标志着RG手术在我国的应用又上了一个台阶。然而RG手术机械臂操作没有触觉反馈、套管孔之间的距离不足可能导致机械臂互相干扰、患者无法变换体位、费用昂贵等不足,也限制了其推广使用[4-20]。
本Meta分析的优点是:⑴ 纳入了最新的文献,排除了病例重复的研究;⑵ 纳入的文献相对较多,增加了RG的病例数;⑶ 对3年生存率等远期生存资料进行了系统分析。本Meta分析不足之处为:⑴ 纳入的文献均为NCRT、回顾性研究,缺乏高质量的随机对照实验,部分文献病例数较少,存在一定的发表偏倚,可能会降低分析效果;⑵ 未对复发率、住院费用等进行分析。
综上所述,RG治疗胃癌安全可行,可取得比传统LG更好的治疗效果。随着经验的积累,其应用前景将更加广阔。未来还需要大规模、多样本、多中心的临床随机对照实验来进行更为严密的系统分析,以期为临床治疗提供更为可靠的证据。
[1] Kitano S, Iso Y, Moriyama M, et al. Laparoscopy-assisted Billroth I gastrectomy[J]. Surg Laparosc Endosc, 1994, 4(2):146–148.
[2] Yasunaga H, Horiguchi H, Kuwabara K, et al. Outcomes after laparoscopic or open distal gastrectomy for early-stage gastric cancer: a propensity-matched analysis [J]. Ann Surg, 2013,257(4):640–646. doi: 10.1097/SLA.0b013e31826fd541.
[3] Hashizume M, Shimada M, Tomikawa M, et al. Early experiences of endoscopic procedures in general surgery assisted by a computerenhanced surgical system [J]. Surg Endosc, 2002, 16(8):1187–1191.
[4] Pugliese R, Maggioni D, Sansonna F, et al. Subtotal gastrectomy with D2 dissection by minimally invasive surgery for distal adenocarcinoma of the stomach: results and 5-year survival[J]. Surg Endosc, 2010, 24(10):2594–2602. doi: 10.1007/s00464–010–1014–1.
[5] Yoon HM, Kim YW, Lee JH, et al. Robot-assisted total gastrectomy is comparable with laparoscopically assisted total gastrectomy for early gastric cancer[J]. Surg Endosc, 2012, 26(5):1377–1381. doi:10.1007/s00464–011–2043–0.
[6] Uyama I, Kanaya S, Ishida Y, et al. Novel integrated robotic approach for suprapancreatic D2 nodal dissection for treating gastric cancer: technique and initial experience[J].World J Surg,2012, 36(2):331–337. doi: 10.1007/s00268–011–1352–8.
[7] Kang BH, Xuan Y, Hur H, et al. Comparison of Surgical Outcomes between Robotic and Laparoscopic Gastrectomy for Gastric Cancer:The Learning Curve of Robotic Surgery[J]. J Gastric Cancer, 2012,12(3):156–163. doi: 10.5230/jgc.2012.12.3.156.
[8] Kim KM, An JY, Kim HI, et al. Major early complications following open, laparoscopic and robotic gastrectomy[J]. Br J Surg,2012, 99(12):1681–1687. doi: 10.1002/bjs.8924.
[9] 张小磊, 江志伟, 赵坤. 手术机器人系统与腹腔镜辅助胃癌切除术的临床疗效对比[J]. 中华胃肠外科杂志, 2012, 15(8):804–806.doi:10.3760/cma.j.issn.1671–0274.2012.08.016.Zhang XL, Jiang ZW, Zhao K. Comparative study on clinical efficacy of robot-assisted and laparoscopic gastrectomy for gastric cancer[J]. Chinese Journal of Gastrointestinal Surgery, 2012,15(8):804–806. doi:10.3760/cma.j.issn.1671–0274.2012.08.016.
[10] Hyun MH, Lee CH, Kwon YJ, et al. Robot versus laparoscopic gastrectomy for cancer by an experienced surgeon: comparisons of surgery, complications, and surgical stress[J]. Ann Surg Oncol,2013, 20(4):1258–1265. doi: 10.1245/s10434–012–2679–6.
[11] 刘江, 阮虎, 赵坤, 等. 达芬奇机器人与腹腔镜行胃癌根治术的对照研究[J]. 中华胃肠外科杂志, 2014, 17(5):461–464. doi:10.3760/cma.j.issn.1671–0274.2014.05.013.Liu J, Ruan H, Zhao K, et al. Comparative study on da Vince robotic and laparoscopic radical gastrectomy for gastric cancer[J].Chinese Journal of Gastrointestinal Surgery, 2014, 17(5):461–464.doi:10.3760/cma.j.issn.1671–0274.2014.05.013.
[12] Huang KH, Lan YT, Fang WL, et al. Comparison of the operative outcomes and learning curves between laparoscopic and robotic gastrectomy for gastric cancer[J]. PLoS One, 2014, 9(10):e111499.doi: 10.1371/journal.pone.0111499.
[13] Junfeng Z, Yan S, Bo T, Yingxue H, et al. Robotic gastrectomy versus laparoscopic gastrectomy for gastric cancer: comparison of surgical performance and short-term outcomes[J]. Surg Endosc,2014, 28(6):1779–1787. doi: 10.1007/s00464–013–3385–6.
[14] 李鹏, 李冰, 刘洪一, 等. 达芬奇机器人手术系统在胃癌中的应用[J]. 临床与病理杂志, 2015, 35(6):1103–1106. doi:10.3978/j.issn.2095–6959.2015.06.045.Li P, Li B, Liu HY, et al. Application of the Da Vinci robot operation system in gastric cancer[J]. International Journal of Pathology and Clinical Medicine, 2015, 35(6):1103–1106. doi:10.3978/j.issn.2095–6959.2015.06.045.
[15] Han DS, Suh YS, Ahn HS, et al. Comparison of Surgical Outcomes of Robot-Assisted and Laparoscopy-Assisted Pylorus-Preserving Gastrectomy for Gastric Cancer: A Propensity Score Matching Analysis[J]. Ann Surg Oncol, 2015, 22(7):2323–2328. doi: 10.1245/s10434–014–4204–6.
[16] Park JY, Ryu KW, Reim D, et al. Robot-assisted gastrectomy for early gastric cancer: is it beneficial in viscerally obese patients compared to laparoscopic gastrectomy?[J]. World J Surg, 2015,39(7):1789–1797. doi: 10.1007/s00268–015–2998–4.
[17] Shen W, Xi H, Wei B, et al. Robotic versus laparoscopic gastrectomy for gastric cancer: comparison of short-term surgical outcomes[J]. Surg Endosc, 2016, 30(2):574–580. doi: 10.1007/s00464–015–4241–7.
[18] Kim YW, Reim D, Park JY, et al. Role of robot-assisted distal gastrectomy compared to laparoscopy-assisted distal gastrectomy in suprapancreatic nodal dissection for gastric cancer[J]. Surg Endosc,2016, 30(4):1547–1552. doi: 10.1007/s00464–015–4372–x.
[19] Cianchi F, Indennitate G, Trallori G, et al. Robotic vs laparoscopic distal gastrectomy with D2 lymphadenectomy for gastric cancer: a retrospective comparative mono-institutional study[J]. BMC Surg,2016, 16(1):65. doi: 10.1186/s12893–016–0180–z.
[20] Nakauchi M, Suda K, Susumu S, et al. Comparison of the longterm outcomes of robotic radical gastrectomy for gastric cancer and conventional laparoscopic approach: a single institutional retrospective cohort study[J]. Surg Endosc, 2016, 30(12):5444–5452.
[21] Slim K, Nini E, Forestier D, et al. Methodological index for nonrandomized studies (minors): development and validation of a new instrument[J]. ANZ J Surg, 2003, 73(9):712–716.
[22] 杜晓辉, 沈笛, 夏绍友, 等. 应用达芬奇机器人手术系统治疗低位直肠癌[J]. 中华消化外科杂志, 2010, 9(2):116–118. doi:10.3760/cma.j.issn.1673–9752.2010.02.013.Du XH, Shen D, Xia SY, et al. Application of Da Vinci surgical system in the treatment of low rectal cancer[J]. Chinese Journal of Digestive Surgery, 2010, 9(2):116–118. doi:10.3760/cma.j.issn.1673–9752.2010.02.013.
[23] 余佩武, 唐波. 达芬奇机器人辅助胃癌根治术的相关问题探讨[J]. 中华普外科手术学杂志: 电子版, 2010, 4(3):250–253.doi:10.3969/cma.j.issn.1674–3946.2010.03.005.Yu PW, Tang B. Investigation of correlative issues of Da Vinic robot-assisted laparoscopic radical gastrectomy[J].Chinese Journal of Operative Procedures of General Surgery:Electronic Version, 2010, 4(3):250–253. doi:10.3969/cma.j.issn.1674–3946.2010.03.005.
[24] Jiménez-Rodríguez RM, Díaz-Pavón JM, de la Portilla de Juan F,et al. Learning curve for robotic-assisted laparoscopic rectal cancer surgery[J]. Int J Colorectal Dis, 2013, 28(6):815–821. doi: 10.1007/s00384–012–1620–6.
[25] 杜晓辉, 方国吉, 宁宁, 等. 腹腔镜直肠癌全直肠系膜切除术的学习曲线研究[J]. 中华腔镜外科杂志:电子版, 2013, 6(1):12–14.doi:10.3877/cma.j.issn.1674–6899.2013.01.004.Du XH, Fang GJ, Ning N, et al. Study on learning curve of laparoscopic total mesorectal excision for rectal cancer[J]. Chinese Journal of Laparoscopic Surgery: Electronic Edition, 2013, 6(1):12–14. doi:10.3877/cma.j.issn.1674–6899.2013.01.004.
[26] Abraham NS, Byrne CJ, Young JM, et al. Meta-analysis of welldesigned nonrandomized comparative studies of surgical procedures is as good as randomized controlled trials[J]. J Clin Epidemiol,2010, 63(3):238–245. doi: 10.1016/j.jclinepi.2009.04.005.
[27] 中国研究型医院学会机器人与腹腔镜外科专业委员会. 机器人胃癌手术专家共识(2015版)[J]. 中华消化外科杂志, 2016,15(1):7–11. doi:10.3760/cma.j.issn.1673–9752.2016.01.002.Robotic and Laparoscopic Surgery Committee of Chinese Research Hospital Association. Expert consensus on robotic surgery in gastric cancer (2015 edition)[J]. Chinese Journal of Digestive Surgery,2016, 15(1):7–11. doi:10.3760/cma.j.issn.1673–9752.2016.01.002.
