钛基材料表面等离子喷涂技术处理对人牙周膜干细胞生长的影响*
2017-03-13蔡洪桢贺慧霞王飞翔张绍清杨伟峰
蔡洪桢 贺慧霞 王飞翔 张绍清 杨伟峰
钛基材料表面等离子喷涂技术处理对人牙周膜干细胞生长的影响*
蔡洪桢 贺慧霞 王飞翔 张绍清 杨伟峰
目的:对比观察钛基材料表面经等离子喷涂技术改性的钽、钛涂层对其生物特性的影响。方法:厚度为1mm的钛板,经喷砂、等离子钽喷涂和等离子钛喷涂表面改性,制备成 直径1.5cm样品。分为钽涂层试件、钛涂层试件和喷砂钛试件共三组,样品无菌处理后,分别接种分离纯化的人牙周膜干细胞培养3天,扫描电镜观察各组材料表面细胞粘附和生长情况并拍片,采用Image J图形软件分析材料表面细胞被覆面积占比,评价材料的生物相容性。结果:与无细胞空白对照组比较,钽涂层、钛涂层及喷砂钛各组试件表面均有细胞粘附生长,但粘附细胞形态、数量、增殖及细胞状态有所不同。钽涂层试件组材料表面细胞在低倍镜下观察呈片状生长,突起链接形成雪花样,平均密度高于喷砂钛和钛涂层试件组,高倍镜见细胞在材料表面伸展充分,分泌基质样颗粒,并伸出伪足进入材料微孔内,Image J图像分析细胞面积平均百分比为33.05±1.48,显著高于喷砂钛试件组;钛涂层试件组材料表面也有细胞粘附生长,细胞形态与钽涂层试件组无明显差别,但细胞面积平均百分比为21.92±1.39,虽不及钽涂层试件组但明显多于喷砂钛试件组14.86±1.13;方差齐性检验显示钛涂层试件组与另两组试件的组间有差异(P<0.05),喷砂钛与钽涂层试件组间具有显著性差异(P<0.01)。三者占比面积结果显示:钽涂层试件组>钛涂层试件组>喷砂钛试件组。结论:等离子喷涂表面改性促进了钛基材料表面生物活性;等离子钽喷涂表面改性 较钛涂层及钛喷砂处理具有更好的生物相容性。
钽涂层;钛涂层;喷砂钛;等离子喷涂;人牙周膜干细胞
人工种植体与骨组织的结合能力与种植体表面的生物活性密切相关,而种植体表面生物活性与其表面材料种类、结构和生物特性有关[1-3],后者对早期蛋白质吸附起关键作用,对细胞粘附、增殖和分化影响很大,同时制约种植体-骨结合的早期效果[4-9]。在材料表面接种细胞,观察其生长情况及形态特征,可反映材料表面的生物相容性,是材料生物相容性体外研究的常用方法之一[10,11],细胞粘附是细胞与材料接触后的首步反应,影响随后的细胞行为,对细胞增殖、分化等起重要的调控作用[12,13]。本研究将体外培养并纯化的人牙周膜干细胞(human Periodontal ligament stem cells ,hPDLSCs)接种于经等离子喷涂技术制备的钛基涂层表面,观察在不同材料表面生长的hPDLSCs的形态及粘附、增殖情况,并分析材料表面细胞被覆面积占比,旨在探讨钛基材料表面经钽、钛等离子喷涂改性对其生物相容性的影响,为下一步实验提供依据。
1.实验材料与方法
1.1实验时间及地点 实验于2016年期间在解放军总医院口腔医学研究所完成细胞培养接种至固定,送中国中医科学院医学实验中心研究室脱水干燥喷金并SEM扫描。
1.2实验试件、试剂及仪器 试件:直径为15mm厚度为1mm的钛涂层、钽涂层和喷 砂钛试件(如图1)依次用丙酮、乙醇 和蒸馏水超声清洗各两次,每次30min ,干燥后包装,60Co照射30min 消毒灭菌,备用。

图1 试件图片(φ1.5cm)
试剂及仪器:胎牛血清、DMEM培养基、双抗、胰蛋白酶均购自Hyclone公司。PBS液自配,配 方:NaCl 0.8g,KCl 0.2g,Na2HPO4 1.44g,KH2PO4 0.24g,均取自实验室储存柜,溶于1L双蒸水中,调PH值至7.2,过滤分装,高温高压灭菌备用。2.5%戊二醛,SEM超高分辨率场发射扫描电镜(S-3400,日本),倒置相差显微镜(Leica:德国),图像采集系统(OLYMPUS,日本),超声清洗机(昆山超声仪器有限公司),电子天平、磁力搅拌器及无菌细胞培养室标配(超净台,离心机,培养箱等)。
1.3细胞培养、实验分组及方法
1.3.1 hPDLCs培养、hPDLSCs分离纯化hPDLCs取因阻生18-25岁拔除的健康第三磨牙,参照文献[14,15]采用组织块法原代培养,简述如下:无菌条件下刮取根中三分之一牙周膜,剪碎,离心弃上清液,置T25培养瓶,加含20%胎牛血清的DMEM培养基,在37℃、5%CO2、饱和湿度条件下培养,待细胞汇合达80%时,用0.25%的胰蛋白酶消化传代,然后用有限稀释法克隆化培养分离牙周膜干细胞并扩增[16,17]。
1.3.2实验分组 以钽涂层试件和钛涂层试件为实验组,喷砂钛试件为对照组,3组样品各取10个,每组随机取9个用于本实验,其中2个作为无细胞对照组,仅加培养基,另7个作为实验组,表面接种hPDLSCs,继续培养分组检测。
1.3.3制备扫描电镜样本 将材料灭菌处理后按分组置12孔培养板中,将第6代hPDLSCs调整细胞密度为2×105/ml,轻轻吹打混匀后用微量加样器接种到各试验组材料表面,阴性对照组仅加完全培养基,每个样本接种100ul小心移至培养箱中培养4h,每孔再添加2ml完全培养基继续培养,培养3天取材制作扫描电镜标本。方法是PBS、双蒸水漂洗后,加2.5%戊二醛置于4℃冰箱固定4h以上,弃戊二醛,用50%、70%、90%和100%乙醇梯度脱水,临界点干燥1min,喷金,分别于扫描电镜下观察,并拍照。
1.3.4 图像分析 对扫描电镜所采集的相片运用ImageJ图像分析仪进行分析,得到每组材料表面无细胞区占比面积,取平均值。方法是:每样品随机选6个视野分别在扫描电镜下拍照,用ImageJ图像分析软件对所采集到的图像进行转换、降噪处理,进行二值化图像分割,计算机数据处理,得出测定结果。评价方法:(1)计算材料和细胞之间细胞空白带的面积,数据用均值加减标准差表示。(2)根据国际及我国医疗器械生物学评价标准[18],细胞生长形态与细胞毒性程度的关系:1级,细胞形态正常,呈梭形或不规则三角形,贴壁生长良好,少量细胞皱缩(<10%);2级,细胞贴壁生长好,但可见少数细胞圆缩,偶见悬浮细胞,部分细胞皱缩(<50%);3级,细胞贴壁不佳,可见死细胞,大量细胞皱缩(<90%);4级,细胞基本不贴壁,90%以上为死细胞,大量细胞死亡(细胞存活率低于10%)。
1.4统计学分析 实验结果用SPSS22.0 for Windows ImageJ图文软件对所拍摄的细胞图形进行统计分析,计算不同材料组间的无细胞带占比面积均值加减标准差表示,对实验结果采用单因素方差分析,P<0.01具有统计学意义,P<0.01为差异有显著性意义。
2.结果
2.1 hPDLSCs倒置相差显微镜下观察 第3d原代培养瓶镜下见组织块周边有细胞爬出,8d时见hPDLCs多呈不规则纺棰形或长梭形,放射状排列,胞突细长,胞体丰满,彼此间成星网状形连接排列,胞浆均匀、丰富(图2);分离扩增的hPDLSCs在镜下呈梭形或三角形或多角形,排列呈旋涡状,细胞之间排列紧密(图3)。

图2 原代培养的hPDLCs (×40)

图3 第4代hPDLSCs (×40)
2.2 细胞-材料扫描电镜观察 各无细胞材料组在扫描电镜下见:喷砂钛试件组表面粗糙,高倍镜下有羽片状突起和多孔状结构,孔隙大小不等,钛涂层试件组材料表面较为致密,呈熔融状,表面呈不规则圆形熔岩样突起,高倍镜下突起大小形状不等,有长短不一裂隙状孔隙;钽涂层试件组表面呈致密熔融状,纹理更为细密、均匀,高倍镜下见表面呈层状或片状或球状突起,表面有大小不等微孔或裂隙状孔。涂层试件未见缺失、脱落和断裂现象(图4)。各接种细胞试验组材料表面均有细胞粘附、伸展,但粘附细胞形态、数量、增殖及细胞状态有差异:喷砂钛试件组细胞与材料表面的粘附多为带状或聚拢的球状,细胞粘附较为稀少,可见少量松散的丝状伪足,分布不均匀(图5),细胞生长形态评价标准为2至3级;钛涂层试件组材料表面的细胞片状粘附,部分细胞已经产生板状伪足,细胞粘附性增强,表面细胞的平铺与伸展充分,并且细胞形态趋于一致,分布较均匀(图6),细胞生长形态评价标准为2级;钽涂层试件组材料表面细胞低倍镜下见呈雪片状粘附,突起链接形成网状,细胞总体分布均匀,数量明显高于喷砂钛试件组,高倍镜见细胞在材料表面伸展充分,分泌基质样颗粒,并伸出伪足进入材料微孔内,有促进细胞的粘附与生长的潜能,粘附面积最大,表面细胞的平铺与伸展显著,相互融合连接成片,形成细胞间连结,相比另外两组试件明显增加了与材料的粘附接触及相互作用,材料表面细胞伸展和粘附完全,更有利于细胞的增殖,呈现出最佳的功能状态(图7),细胞生长形态评价标准为1级。对比分析结果表明钽涂层组试件材料更具良好的生物相容性,牙周膜细胞在三种试件材料表面的粘附及增殖比较结果:钽涂层试件组>钛涂层试组件>喷砂钛试件组。

图4 扫描电镜下各组材料表面形貌

图5 电镜下对照组喷砂钛片表面接种hPDLSCs图像

图6 电镜下实验组钛涂层表面接种hPDLSC 图像

图7电镜下实验组钽涂层表面接种hPDLSC图像
2.3 细胞在材料表面占比面积分析 采用ImageJ图文软件,对扫描电镜所采集的细胞-材料图像每个试件随机选10个视野进行细胞带面积计算(图8,9),均值结果见表1:视野内喷砂钛、钛涂层、钽涂层试件表面细胞面积占所测面积比例依次依次增高(见表1),平均值分别为:14.86士1.13、21.92士1.39和33.05士1.48。通过组间均数两两比较得出:钛涂层试件组与另两组材料的组间有差异(P<0.05),喷砂钛试件组与钽涂层试件组间具有显著性差异(P<0.01),具有显著统计学意义。所检样品细胞带面积占比结果显示:钽涂层表面细胞面积最高,钛涂层次之,喷砂钛不及前两者,说明钽涂层材料更有利于细胞粘附和增殖。
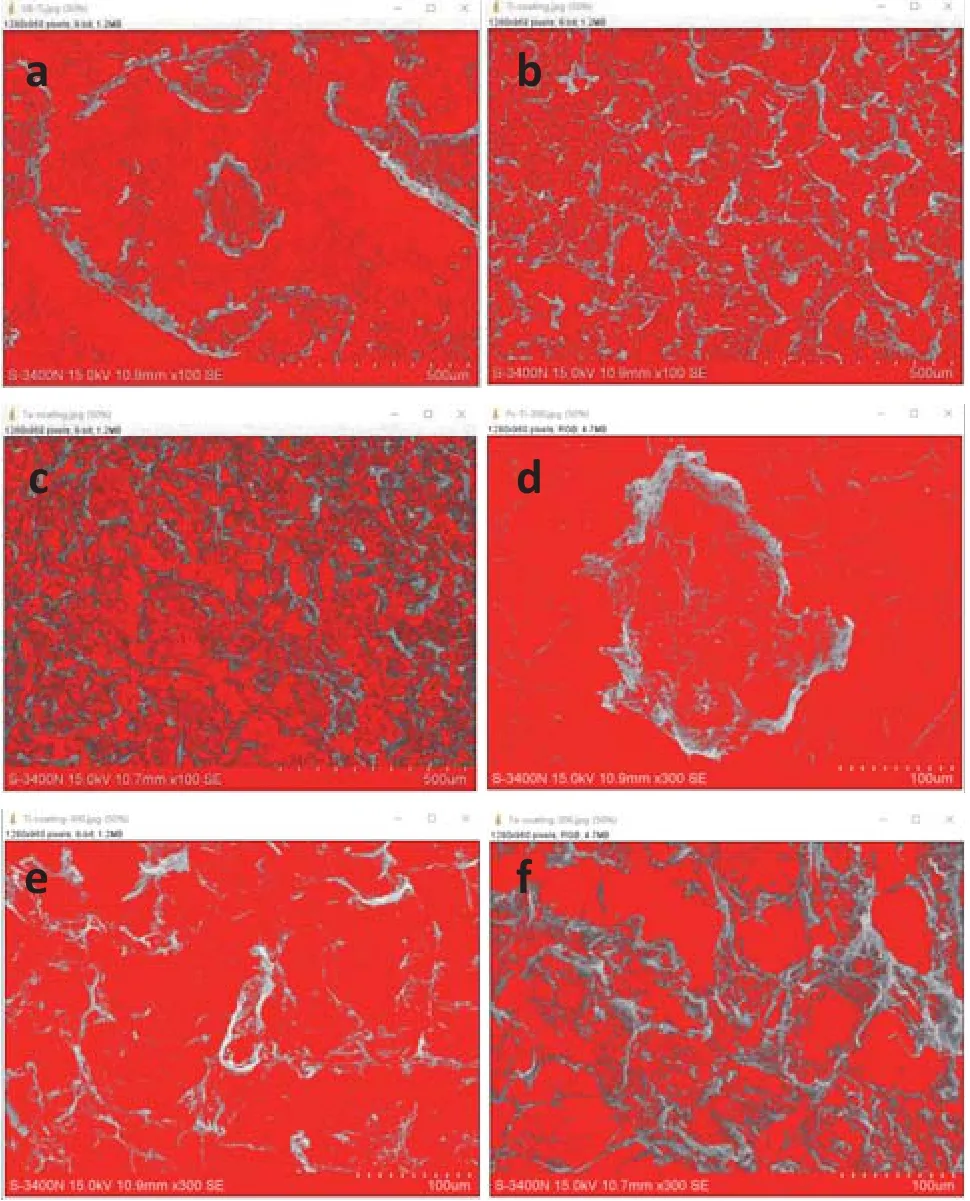
图8 各组材料表面细胞占比面积分析(红色为无细胞带)
3.讨论
材料表面特性可直接影响细胞的生物学行为,因此,研究材料表面对细胞的反应可作为体外评价材料表面生物学特性的主要方法之一,对促进材料表面技术的改进有重要意义。已有研究[18,19]表明金属钽具有良好的理化特性和生物相容性,但钽涂层作为一种在组织结构、化学构成上均可能与以往的生物钽材料存在差异,为研究其是否仍具备医用生物材料需要的良好生物相容性,赵冰净等[20-23]研究发现不同的材料表面处理可以影响骨整合,同时影响细胞与种植体的界面反应,进而影响种植体周围骨组织形成的质量和速度;有学者用钽、钛等金属做体外材料生物相容性实验,结果发现钽涂层良好的生物相容性优于钛及其他金属生物材料[24,25],本研究在经不同处理的钛材料试件表面进行人牙周膜干细胞培养,通过电镜扫描,从细胞形态学进行分析对比,并采用ImageJ图像分析软件对所拍摄的相片进行无细胞带面积计算,得到的实验结果与上述各研究趋于一致。ImageJ图像分析软件是美国国家心理健康研究所开发的科学图像分析工具,医学领域主要用其来进行计数细胞数、分析电泳图谱,特点是操作简易、效果显见且免费而被生物学、检验医学、地质学、金相学等多种研究领域广泛应用[26]。
表1 三组材料表面细胞占比面积(n=6,)

表1 三组材料表面细胞占比面积(n=6,)
注:通过均数间的两两比较,钛涂层组与另两组的组间有差异(P<0.05),喷砂钛与钽涂层组间具有显著性差异(P<0.01)。
喷砂钛 钛涂层 钽涂层Count Area(%) Count Area(%) Count Area(%) 1 2518 17.33±1.28 3886 25.79±1.47 6175 38.01±1.67 2 1609 11.39±1.07 2864 19.06±1.36 4784 28.96±1.37 3 971 10.64±0.06 1326 14.99±1.22 1904 24.82±1.27 4 1067 10.44±0.07 1923 14.13±1.28 2456 22.60±1.31 5 2566 19.82±1.29 4649 31.51±1.58 7825 46.78±1.88 6 2244 15.07±1.16 3664 24.41±1.46 6959 43.12±1.79 7 1716 19.33±1.25 3275 23.56±1.42 5 728 37.06±1.65 1787 14.86±1.13 3084 21.92±1.39 5119 34.48±1.48
种植体与骨组织界面的形成结构跟细胞的形态密切相连,对细胞的支持和保护有重大影响,是细胞的行为、活动、识别、粘附、生长分化等的基础,因而研究种植材料表面处理形态对骨整合的影响可以从细胞水平做起[27],可以通过体外材料表面接种、培养细胞,并观察细胞形态变化和细胞在材料表面黏附增殖情况,来检测细胞毒性程度,因此研究材料表面改性后形态特征对骨整合的影响也可以从细胞水平开始做起,有研究通过细胞毒性试验发现钽涂层材料毒性等级为0级,适于细胞黏附、增殖[28,29],本实验通过在钽涂层、钛涂层和喷砂钛试件表面人牙周膜干细胞培养后的细胞形态在扫描电镜观察下进行观察拍片并进行分析对比,结果发现:在相同实验条件下,不同表面处理对细胞形态及粘附增殖有所不同,钽涂层试件材料表面对人牙周膜干细胞形态的影响最小,试件表面的细胞空白带面积最小,细胞粘附最多,形态最好,钽涂层试件表面的细胞粘附和增殖能力优于钛涂层试件和显著优于喷砂钛试件,本次体外材料细胞共培养实验说明钽涂层材料具有更加良好的生物相容性,可为后续细胞增殖分化奠定基础,与Balla VK 等[30,31]的研究结果相似。
本实验选择目前临床应用成熟产品喷砂钛材料试件作为对照组,首次与钛基钽涂层试件和钛涂层试件两实验组表面培养细胞的形态及粘附增殖差异进行组间两两比较。采用同一种纯钛材料,分别经表面喷砂制成喷砂钛试件与等离子喷涂处理技术制作成实验材料钽涂层试件和钛涂层试件,在同一条件下接种在实验组和对照组材料表面接种细胞,采用同一个检测系统、以相同测试方法和标准进行检测,以求最大限度消除实验的误差。本研究是在体外进行的细胞实验,虽然能为体内实验提供实验依据,但体外实验环境毕竟不等同于体内实际环境,两者千差万别,体外细胞相容性好虽必要但还不能充分证明材料适用于体内,所以下一步还应进行相关体内实验,观察材料在体内的生物相容性情况,为后续实验提供数据和材料准备,为新型人工牙种植体材料开发利用提供实验依据。
综上所述,人牙周膜干细胞能在喷砂钛试件、经等离子喷涂改性的钛涂层试件和钽涂层试件三组材料表面粘附、增殖,材料细胞毒性等级低,经过分析对比,发现不同材料及表征是影响hPDLSCs早期粘附和增殖的主要因素之一,钽涂层试件材料表面的hPDLSCs形态更良好,并可分泌大量细胞基质样颗粒,粘附更佳,更能维持hPDLSCs良好的功能活性,说明钽涂层试件材料表征更优,具有更好的生物相容性,可为后续实验提供有效的实验数据和依据。
[1] Collignon H, Davicco MJ, Barlet JP. Isolation of cells from ovine fetal long bone and chacterization of their osteoblastic activities during in vitro mineralization [J].Arch Physiol Biochem,1997,105(2):158-166
[2] Marinucci L, BalIoniS,Becchetti E, et al.Effect of titanium surface roughness on human osteoblast proliferation_ and gene expression in vitro[J].Int J Oral Maxillofac Implants,2006,21(5):719-725
[3] 蔡洪桢,贺慧霞.人工种植体表面改性方法研究进展[J].中华老年口腔医学杂志,2016,14(4):237-241
[4] Bigerelle M,Anselme K,Noël B,et al.Improvement in the morphology of Ti-based surfaces: a new process to increase in vitro human osteoblastre sponse [J] . Biomateria is,2002,23(7):1563-1577
[5] Postiglione L,Di Domenico G,Ramaglia L,et al.Behavior of SaOS一2 cells cultured on different titanium surfaces[J].Dent Res,2003,82(9):692-699
[6] Mustafa K, Rubinstein J, Lopez BS,et al.Production of transforming growth factor beta1 and prostaglandin E2 by osteoblast-like cells cultured on titanium surfaces blasted with TiO2 particles[J].Clin Oral Implants Res.2003,14(1):50-56
[7] Han Y,Yan Y,Lu C,et al.Bioactivity and osteoblast response of the micro-arc oxidized zirconia films[J].J Biomed Mater Res A,2009,88(1):117-127
[8] Pan J, Liao H, Leygraf C,et al.Variatin of oxide films on titanium nduced by osteoblast-like cell culture and the influence of an H202 pretreatment[J].J Biomed Mater Res,1998,40(2):244-256
[9] Moroni A,Caja VL,Egger EL,et al.Histomorphometry of hydroxyapatite coated and uncoated porous titanium bone implants[J].Biomaterials,1994,15(11): 926-930
[10] Balto HA.Attachment and morphological behavior of human periodontal ligament fibroblasts to mineral trioxide aggregate: a scanning electron microscope study[J].J Endod,2004,30(1):25-29
[11] Camilleri J,Montesin FE,Papaioannou S,et al.Biocompatibility of two commercial forms of mineral trioxide aggregate[J].Int Endod,2004, 37(10): 699-704
[12] Dalby M, Di Silvio L, Harper EJ,et al.In vitro adhesion and biocompatability of osteoblast-like cells to poly (methylmethacrylate) and poly (ethylmethacrylate) bone cements[J].J Mater Sci Mater Med,2002,13(3):311-314
[13] Grigoriou V, Shapiro IM, Cavalcanti-Adam EA,et al. Apoptosis and survival of osteoblast-like cells are regulated by surface attachment[J].J Biol Chem,2005,280(3):1733-1739
[14] 司徒镇强,吴军正.细胞培养[M].第2版,西安:世界图书出版公司,2007:58-59
[15] 黄南楠,梁焕友,唐 倩,等.组织块法培养原代人PDLCs技术的新探讨[J/CD].中华口腔医学研究杂志:电子版,2009,3(1):10-16
[16] 封 艳,牛巧丽,尹宏斌,等.有限稀释克隆法培养分离人牙周膜干细胞实验研究[J].新疆医科大学学报,2014,37(8):898-994
[17] Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,10-16;364(9429):149-155
[18] 中华人民共和国国家质量监督检验检疫总局.GB/T 16886.5-2003.医疗器械生物学评价第5部分:体外细胞毒性试验[S].北京:中国标准出版社,2003
[19] Cohen R.A porous tantalum trabecular metal:basic science[J]. Am J Orthop (Belle Mead NJ),2002,31(4):216-217
[20] Bobyn JD,Poggie RA,Krygier JJ,et a1.Clinical validation of a structural porous tantalum biomaterial for adult reconstruct ion[J].J Bone Joint Surg Am,2004,86-A Suppl 2:123-129
[21] 赵冰净,赵 悦,曲 烁,等.钛表面不同处理对成骨细胞生长影响的实验研究[J].口腔颌面修复学杂志,2009,10(5):265-268
[22] Chen J,Zhang F,Shi Y,et a1.Preparation of hydroxyapatitecontaining titania film on the surface of pure titanium by micro-arc oxidationtechnique[J].Sheng Wu Yi Xue Gong Cheng Xue Za Zhi,2008,25(1):127-130
[23] Keller JC,Schneider GB,Stanford CM,et a1.Effects of implant microtopography on osteoblast cell attachment[J]. Implant Dent,2003,12(2):175-181
[24] Rosa AL,Beloti MM.Rat bone marrow cell response to titanium and titanium alloy with different surface roughn ess[J].Clin Oral Implants Res,2003,14(1):43-48
[25] Li Y,Wei S,Cheng X,et a1.Corrosion behavior and surfaceCharacterization of tantalum implanted Ti Ni alloy[J]. Surf Coat Technol,2008,2(23):17-22
[26] Balla VK,Bodhak S,Bose S,et a1.Porous tantalum structures fo r bone implants: fabrication, mechanical and in vitro biological properties[J]. Acta Biomater,2010,6(8):3349-3359
[27] Sole A,Mas J,Esteve J.A new method based on image analysis for determing cyanobacterial biomass by CLSM in stratied benthic sediments[J].Ultramicroscopy, 2007,107:669-673
[28] 赵震锦,张 羽中,张 扬,等.表面粗糙度对种植体钛片表面成骨细胞的影响[J].解剖科学进展,2008,14(2):178-182
[29] 李 矛,段永宏,尹大宇,等.等离子喷涂钽涂层人工假体生物相容性研究[J].中国矫形外科杂志,2011,19(4):320-324
[30] 段永宏.钽涂层人工假体界面特性及生物学特性的研究[D].西安:第四军医大学,2011
[31] Zhang Y M,Bataillon—Linez P,Huang P,et a1.Surface analyses of micro—arc oxidized and hydrothermally treated titanium and effect on osteoblast behavior[J]. J Biomed Mater Res A,2004,68(2):383-391
[32] Balla VK,Banerjee S,Bose S,et a1.Direct laser processing of a tantalum coating on titanium for bone replacement structures [J].Acta Biomater, 2010,6(6):2329-2334
The plasma spraying technology on titanium bases surface treatment on the effects of the human periodontal ligament stem cell growth
CAI Hong-zhen,HE Hui-xia,WANG Fei-xiang,ZHANG Shao-qing,YANG Wei-feng.
(Department of Stomatology,Chinese PLA General Hospital and Chinese PLA Medical School,Beijing 100853,China)
Objective: To compare the eff ects of tantalum and titanium coating on the biological properties of titanium based materials. Methods: The titanium plates, 1 mm thickness, have been modifi ed by sandblasting, plasma spraying on the surface, and preparation the specimen into 1.5 cm diameter disc .It is divided into three parts: tantalum coating specimen, titanium coated specimen and sandblasting titanium sample,. Moreover, we select 7 samples from each sets and aseptic technique, then respectively inoculated the human Periodontal ligament stem cells for 3 days. Scanning electron microscope display the adhering and growing conditions of the cells on all those materials, and analysis the material area covered by cells( by SPSS22.0 Image J), then evaluate the biocompatibility of the material. Results: Comparing with the cell-free controlling groups, the experimental group s all own the growth and adhesion of cells, but their morphology, quantity and velocity of proliferation of cells are diff erent. At the low magnifi cation, the cells on tantalum coating surface protuberant link snow pattern formation, the numberis signifi cantly higher than sandblasting titanium group. At the high magnifi cation, the cells on tantalum coating surface stretch in the material surface, and secrete matrix sample particles, moreover, they extended pseudopodia into the microporous material. The mean values about the area percentage of cells is 33.05±1.48, signifi cantly higher than that of sand blasting titanium group; Titanium material surface coating group also has the growth of the cells, and the cells morphology show no signifi cant diff erence with tantalum coating group, but the area percentage of cells is 21.92±1.39, relatively less than tantalum coating group, but more than sandblasting titanium group. F test show that titanium coating group and the other 2 groups are diff erent(P<0.05), sandblasting titanium and tantalum coating has a signifi cant diff erence between groups (P<0.01). according to the results: tantalum coating group>titanium coating group >sandblasting titanium group. Conclusion: Plasma spraying and surface modifi cation could promote the biocompatibility of titanium base material. Plasma spraying tantalum coating surface modifi cation has better biocompatibility than titanium coating and sandblasting processing.
tantalum coating; titanium coating;sandblasting titanium; plasma-spraying technique; human periodontal ligament stem cells
R781.4
A
1672-2973(2017)01-0027-06
2016-07-26)
国家高技术研究发展计划(863计划) (项目编号: 2015AA033502)全军后勤科研计划重大项目(项目编号:AWS14C007)
蔡洪桢 解放军总医院口腔医学研究所 硕士生 北京 100853
贺慧霞 通讯作者 解放军总医院口腔科 主任医师 副教授 北京 100853
王飞翔 解放军总医院口腔医学研究所 硕士生 北京 100853
张绍清 解放军总医院口腔医学研究所 硕士生 北京 100853
杨伟峰 中国中医科学院医学实验研究室 副教授 北京 100700
