口腔鳞癌患者外周血及肿瘤微环境中Th17细胞水平研究
2017-03-13任仪鹏步荣发史悦怡
任仪鹏 步荣发 张 蕾 史悦怡
口腔鳞癌患者外周血及肿瘤微环境中Th17细胞水平研究
任仪鹏 步荣发 张 蕾 史悦怡
目的:探索口腔鳞状细胞癌(oral squamous cell carcinoma)患者外周血及肿瘤微环境中的Th17水平是否存在异常情况。以此为切入点寻找控制肿瘤的靶点,为开发新的免疫疗法打下基础。方法:采用流式细胞术检测并比较了OSCC患者和对照组外周血中Th17的水平,并检测了肿瘤组织中Th17的水平。结果:1.OSCC患者外周血中Th17细胞含量高于正常对照组;2.肿瘤局部微环境中存在Th17细胞的浸润。结论:1.OSCC患者外周血存在Th17的水平升高;2.OSCC微环境中存在Th17的浸润现象,提示Th17在OSCC的发生发展中具有重要意义,可能成为免疫治疗的新靶点。
Th17;OSCC;肿瘤微环境
头颈肿瘤中95%是鳞状细胞癌。而口腔鳞状细胞癌(OSCC)又在其中占有大约四分之一。虽然放化疗方法都有进步,但是最近40年OSCC的5年生存率无较大改善。已有的研究成果发现机体免疫系统对头颈部鳞癌的影响很大[1,2],其疾病进展机制中很重要的一项就是对抗肿瘤免疫的免疫耐受以及免疫逃逸能力[3,4]。
Th17是近年发现的区别于Th1和Th2的新的辅助性T亚群[5]。既往研究发现Th17参与组织炎症,通过诱导以下一些因子的释放如IL-8,-6,COX-2,MMP-1,-3,CXCL1 NOS-2,从而参与血管发生、肿瘤侵袭和转移。因此,Th17和肿瘤免疫之间必然存在着重要的联系。所以研究Th17在肿瘤进展和致病中的作用是很有必要的。但目前对于Th17与口腔鳞状细胞癌之间的关系研究非常少,本研究的目的就在于初步探索OSCC患者外周血及肿瘤组织内的Th17水平,为明确OSCC患者免疫状态异常状况,寻找干预方法打下基础。
1.材料和方法
1.1材料
1.1.1血液标本全部血液标本取自解放军总医院口腔颌面外科的住院口腔鳞癌患者。所有患者手术前均未行放射治疗、化学治疗、生物治疗及中西医结合治疗。对照组来自输血中心健康献血者。两组各8例,全部为舌癌患者,平均年龄64.25岁,两组性别、年龄无统计学差异(P>0.05)。
1.1.2组织标本 全部组织标本取自解放军总医院口腔颌面外科的住院口腔鳞癌患者手术切除的肿瘤组织中心部位共8例,所有肿瘤组织经病理学确诊为鳞状细胞癌。所有患者手术前均未行放射治疗、化学治疗、生物治疗及中西医结合治疗。
1.1.3抗 体 IL-17A ALEXA 647、CD4 PERCP、FOXP3 PE、CD25 APC均购自美国BD公司产品。
1.2.方法
1.2.1标本处理 空腹采取静脉血5ml,保存于NH抗凝管,颠倒混匀六次,带回实验室立即进行处理,术后如病理诊断为鳞状细胞癌则纳入统计范 围。
12.2组织样本 所有组织标本取出后迅速放在含有10%新生小牛血清的1640培养基内,带回实验室立即按下列步骤处理:(1)取下标本后立即送实验室进行细胞分离。将手术中取得的组织块用PBS冲洗,洗去残余的血液;(2)然后用剪刀剪成0.1-0.2mc直径大小;(3)用混合的消化酶溶液(包含0.1%Ⅳ型胶原酶、0.002%I型DNA酶和0.01%V型透明质酸酶,Sigma)在37℃温度下消化2小时;(4)200目的消毒滤网过滤;(5)用75%和100%fiacl液进行密度梯度离心(1500r/min×15min),离心后收集75%和100%fiacl液交界界面上的细胞,即为淋巴细胞;(6) PBS洗涤,1000r/min×10min离心后去上清,共2次,收集沉淀细胞待用。
1.2.3流式细胞术检测 采用两步法标记,按照实验设计分别依次加入相应抗体进行标记。组织样本处理时提取组织浸润淋巴细胞后进行细胞计数,设定每管2×105个细胞进行检测,添加抗体的步骤顺序同血液标本。
1.2.4结果判定 本研究中,每一个样本收集分析2×105个细胞,采用CellQuest分析软件对结果进行分析并作图。
1.3统计学分析 所有数据使用chiss2004软件统计分析。实验结果用x±s表示,两组间均数比较用t检验,采用直线相关分析量指标的相关性,P<0.05差异具有统计学意义。
2.结果
2.1 OSCC患者外周血中Th17细胞含量高于正常对照组 为了明确OSCC患者体内免疫环境中是否存在Th17的异常,首先分析了OSCC患者外周血中Th17含量并与正常人做对比。流式数据分析中以CD4+T细胞含量为100%进行,CD4+IL-17+细胞代表Th17细胞,结果显示OSCC患者外周血中的Th17细胞占CD4+细胞的百分比为1.98%±0.472%,高于正常对照的0.41%±0.14%,且P<0.01(图1)。

图1 外周血中Th17细胞含量OSCC患者高于正常对照P<0.01
2.2 肿瘤局部微环境中存在Th17细胞的浸润 为了明确OSCC患者肿瘤微环境中是否存在Th17的浸润,采用流式细胞术检测了OSCC组织内Th17的含量,以CD4+T细胞含量为100%进行流式分析,以CD4+IL-17+代表Th17细胞,发现OSCC肿瘤组织内存在Th17细胞浸润的现象。以CD4+T细胞为100%,Th17细胞的百分含量达到8.259%±6.25%(图2)。
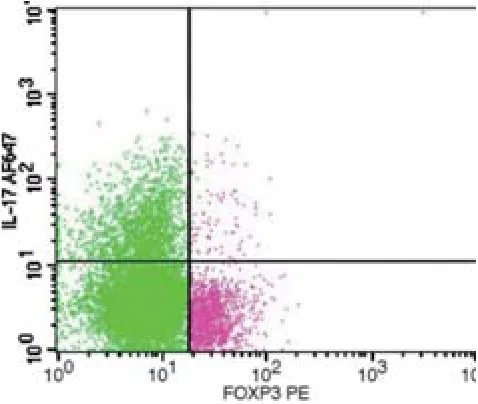
图2 OSCC肿瘤组织浸润CD4+T淋巴细胞中Th17含量
3.讨论
CD4+T细胞在抗肿瘤免疫反应中起到关键作用,这些细胞既包含了辅助性的T细胞亚群,也包括了调节性T细胞亚群,还有NK细胞及CD8+T细胞等等类型。目前对于实体肿瘤的免疫治疗主要集中在提高肿瘤微环境中的NK细胞、CD8+T细胞并且效果有限。越来越多的研究提示我们CD4+T细胞的获得性免疫反应在抗肿瘤免疫中也起到了重要作用。而其中Th17是近年来新发现的辅助性T细胞亚群,虽然在实体瘤中的效应仍存在争议,但是在很多研究中其表现出来的抗肿瘤作用却是不容忽视的。既往研究已经发现多种肿瘤患者外周免疫环境存在明显异常。而且已经有研究针对头颈部鳞癌进行了研究,并且发现外周血中存在Th17的明显异常[6]。但是针对口腔鳞状细胞癌的研究还很少。
首先我们利用流式细胞术检测了OSCC患者外周血中Th17细胞的含量,发现OSCC患者外周血Th17含量明显高于正常对照组。这表明OSCC患者外周免疫环境中的确存在Th17含量的异常,这与在其它恶性肿瘤研究中的发现结果类似[7,8]。以往研究已经发现多种肿瘤患者外周血中IL-1β、IL-6和TGF-β等细胞因子升高,这些细胞因子就是Th17分化的重要诱导因素,所以我们猜测OSCC外周血Th17的增多可能与此因素有关。
另外外周增多的Th17会对肿瘤局部微环境产生什么影响呢?我们分析有可能的影响是:已知Th17细胞表达高水平的CXCR4和CCR6[9,10],而肿瘤微环境中常高表达CCL20、CXCL12[11,12]等趋化因子及受体,而这些趋化因子和受体的相互作用可能就是趋化外周血Th17到肿瘤局部的因素。Kesselring[6]等人的研究就证明了外周Th17细胞可以迁移向肿瘤,并且这种迁移是CCR6/CCL20驱动的,不仅因为Th17表达的CCR6给了它们对CCL20产生反应并向目标部位移动的能力,而且Th17本身也表达CCL20,再通过自身促进其他Th17的迁移[13]形成一个正向循环,导致Th17在肿瘤局部的增多。
因此我们继续检测了肿瘤微环境中的Th17水平,发现OSCC肿瘤微环境中的确存在Th17的浸润。分析原因,除去外周血中Th17升高的因素外,还有一个可能的原因就是以往研究已经发现多种肿瘤细胞及基质细胞存在高水平的IL-1β、IL-6和TGF-β表达,这为Th17的分化提供良好的环境,能够原位诱导Th17的分化[7,8,14]。这很可能就是Th17升高的另一个机制。
因此,OSCC患者外周血增多的Th17可能来源于细胞因子环境的改变,并且可以选择性的迁移和滞留在肿瘤微环境中从而影响肿瘤的发展。但是究竟是肿瘤的发生发展促进了外周Th17的分化,还是整体免疫环境中Th17的异常促进了肿瘤的发生还需要进一步研究。并且Th17含量在肿瘤不同进展阶段的含量是否相同也还需要进一步确认。但有一点可以肯定的就是Th17的异常必然是和OSCC的发生发展相联系的。这也为我们寻找口腔鳞癌治疗靶点提供了新的方向。
[1] Loose D, Van de Wiele C. The immune system and cancer[J]. Cancer Biother Radiopharm, 2009,24(3): 369-376
[2] 任仪鹏,步荣发,张 蕾,等. 肿瘤微环境中的相关免疫细胞[J].中华老年口腔医学杂志, 2011, 9(6):361-364
[3] Leibowitz MS,Nayak JV,Ferris RL. Head and neck cancer immunotherapy: clinical evaluation[J]. Curr Oncol Rep,2008,10(2):162-169
[4] Topping KP,Fletcher LM,Agada FO,et al. Head and neck tumour immunology: basic concepts and new clinical implications[J]. J Laryngol Otol,2009, 123(1): 9-18
[5] Fietta P,Delsante G. The effector T helper cell triade[J]. Riv Biol,2009, 102(1): 61-74
[6] Kesselring R,Thiel A,Pries R,et al. Human Th17 cells can be induced through head and neck cancer and have a functional impact on HNSCC development[J]. Br J Cancer,2010, 103(8): 1245-1254
[7] Miyahara Y,Odunsi K,Chen W,et al. Generation and regulation of human CD4+ L-17-producing T cells in ovarian cancer[J]. Proc Natl Acad Sci USA,2008,105(40):15505-15510
[8] Zhang B,Rong G,Wei H,et al. The prevalence of Th17 cells in patients with gastric cancer[J]. Biochem Biophys ResCommun,2008, 374(3): 533-553
[9] Kryczek I,Bruce AT,Gudjonsson JE,et al. Induction of IL-17+ T cell trafficking and development by IFN-gamma: mechanism and pathological relevance in psoriasis[J]. J Immunol,2008, 181(7): 4733-4741
[10] Martin-Orozco N,Dong C. The IL-17/IL-23 axis of inflammation in cancer: friend or foe? [J]. Curr Opin Investig Drugs,2009,10(6): 543-549
[11] Aspord C,Pedroza-Gonzalez A,Gallegos M,et al. Breast cancer instructs dendritic cells to prime interleukin 13-secreting CD4+ T cells that facilitate tumor development[J]. J Exp Med, 2007, 204(5): 1037-1047
[12] Ghadjar P,Rubie C,Aebersold DM,et al. The chemokine CCL20 and its receptor CCR6 in human malignancy with focus on colorectal cancer[J]. Int J Cancer, 2009,125(4): 741-745
[13] Yamazaki T,Yang XO,Chung Y,et al. CCR6 regulates the migration of inflammatory and regulatory T cells[J]. J Immunol,2008, 181(12): 8391-8401
[14] Kryczek I,Wei S,Zou L,et al. Cutting edge: Th17 and regulatory T cell dynamics and the regulation by IL-2 in the tumor microenvironment[J]. Vol 178,2007:6730-6733
Study of Th17 in peripheral blood and tumor microenvironment of patients with oral squamous cell carcinoma
REN Yi-peng, BU Rong-fa, ZHANG Lei, SHI Yue-yi (Department of Oral and Maxillofacial Surgery, The Chinese PLA General Hospital. Beijing 100853,China)
Objective: To investigate if there are any abnormal in the Th17 level of OSCC patients in peripheral blood and tumor microenvironment. Methods: The fl ow cytometry was used to compare the Th17 level between OSCC patients and normal control group in peripheral blood. Th17 levels in tumor tissue was also detected.Results: 1.The level of Th17 cells in the peripheral blood of OSCC patients were higher than that in the normal control group; 2.Th17 cells infi ltration were found in the local tumor microenvironment of OSCC. Conclusions; 1.Th17 levels of peripheral blood and tumor microenvironment were increased in OSCC patients; 2.Th17 infiltration could been detected in OSCC tumor micro environment, which suggested that Th17 might play an important role in the occurrence and development of OSCC. A new direction of immune therapy might be found.
Th17; OSCC; tumor microenvironment
R782
A[文章编号]1672-2973(2017)01-0005-04
2016-07-04)
任仪鹏 解放军总医院口腔颌面外科 主治医师 北京100853
步荣发 通讯作者 解放军总医院口腔颌面外科 主任医师教授 北京 100853
张 蕾 解放军总医院口腔颌面外科 副主任医师 北京100853
史悦怡 解放军总医院口腔颌面外科 硕士生 北京 100853
