脑源性神经营养因子对左旋多巴诱发的帕金森病异动症大鼠行为的影响及其作用机制
2017-03-08甄体丽赵君焱舒海洋黄译腺包仕尧刘春风罗蔚锋
甄体丽,赵君焱,舒海洋,黄译腺,包仕尧,刘春风,罗蔚锋
·论著·
脑源性神经营养因子对左旋多巴诱发的帕金森病异动症大鼠行为的影响及其作用机制
甄体丽,赵君焱,舒海洋,黄译腺,包仕尧,刘春风,罗蔚锋
目的 探讨脑源性神经营养因子(BDNF)对左旋多巴(L-DOPA)诱发异动症大鼠行为的影响及其作用机制。方法 建立单侧毁损帕金森病(PD)大鼠模型,随机分为L-DOPA组、L-DOPA+BDNF组、BDNF组及生理盐水组。L-DOPA组及L-DOPA+BDNF组腹腔注射L-DOPA 25 mg/kg+苄丝肼6.25 mg/kg,BDNF组及生理盐水组腹腔注射等体积的生理盐水,2次/d,连续注射21 d。L-DOPA+BDNF组及BDNF组大鼠右侧纹状体立体定位注射BDNF(1 μg/4 μl),L-DOPA组及生理盐水组大鼠右侧纹状体立体定位注射生理盐水(4 μl)。L-DOPA组和L-DOPA+BDNF组大鼠在纹状体注射后继续腹腔注射L-DOPA 7 d。在第2、11、21、23和29 d进行进行异常不自主运动(AIM)评分及跨步实验。应用Western blot技术检测大鼠脑纹状体组织TrkB 磷酸化水平。结果 生理盐水组及BDNF组大鼠未出现不自主运动。L-DOPA组和L-DOPA+BDNF组第2、11、21 d的AIM评分差异无统计学意义。与L-DOPA组比较,L-DOPA+BDNF组大鼠第23 d的肢体、轴性、口舌AIM评分及29 d的轴性、口舌AIM评分均显著降低(均P<0.05)。生理盐水组和BDNF组大鼠各时间点注射前后左前肢跨步数无改变。与注射前比较,L-DOPA组及L-DOPA+BDNF组大鼠各时间点注射后左前肢跨步数均显著增加(均P<0.05)。4组大鼠的左前肢跨步数在治疗过程中均呈下降趋势。与L-DOPA组和生理盐水组相比,L-DOPA+BDNF组和BDNF组的毁损侧纹状体pTrkB蛋白表达水平增加(均P<0.05)。BDNF组和L-DOPA+BDNF组两组之间及L-DOPA组和生理盐水组两组间的pTrkB蛋白表达水平差异无统计学意义。各组间健全侧纹状体的pTrkB蛋白表达水平差异无统计学意义。4组间TrkB水平差异无统计学意义。结论 外源给予BDNF能够改善L-DOPA诱导的异常不自主运动,并且不影响L-DOPA抗PD的运动疗效,其机制可能与激活BDNF-TrkB信号通路有关。
帕金森病;异动症;脑源性神经营养因子
左旋多巴(L-DOPA)替代治疗是改善帕金森病(PD)临床症状最有效的方法,异动症是PD中晚期L-DOPA替代治疗的常见运动并发症之一。N-甲基-D-天冬氨酸受体拮抗剂——金刚烷胺是目前临床上最常用于治疗轻度异动症的药物,但对中-重度异动症的疗效往往不尽人意。服用金刚烷胺所造成的口干、便秘等不良反应发生率较高,给其长期应用带来了一定的限制。于是,寻找新型有效缓解异动症的药物是该领域的研究热点之一。脑源性神经营养因子(BDNF)广泛分布在各脑区,调控神经系统的神经营养发育等,与神经系统疾病有密切关联。研究[1]发现,在PD动物模型中,BDNF蛋白以及其mRNA的表达水平均是下降的,BDNF的特异性受体——酪氨酸激酶受体B(TrkB)表达降低,并且给予BDNF治疗之后可以减少神经毒素导致的黑质多巴胺能神经元的丢失[2]。具有met/met等位基因的PD患者脑内释放的BDNF较少,患异动症的风险增加[3]。由此可见,BDNF在PD发展过程中及L-DOPA诱导的异动症的发生发展中均有着重要的作用。本实验目的在于评价纹状体内注射BDNF对于L-DOPA诱导的异动症的作用影响,并进一步探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取体质量180~220 g的健康雄性SD大鼠60只,由苏州大学动物实验中心提供。
1.1.2 常用药品及试剂 6-羟基多巴胺(6-OHDA)、L-DOPA、苄丝肼(Sigma公司,美国),BDNF(R&D 公司,美国),阿扑吗啡(TOCRIS公司,英国),小鼠抗大鼠β-肌动蛋白(β-actin)抗体(深圳碧云天公司),兔抗大鼠P-TrkB抗体、兔抗大鼠TrkB抗体(Cell Signaling Technology,美国)。
1.2 方法
1.2.1 模型制备及用药方法 参考郑伟新等[4]实验方法,采用6-OHDA毁损右内侧前脑束制备偏侧大鼠PD模型。2周后,对大鼠颈部皮下注射阿扑吗啡(0.5 mg/kg)诱导旋转行为,向毁损对侧旋转圈数≥210圈/30 min为制模成功。本实验成功建模40只PD大鼠,随机分为L-DOPA组、L-DOPA+BDNF组、BDNF组及生理盐水组,每组10只。L-DOPA组及L-DOPA+BDNF组腹腔注射L-DOPA 25 mg/kg+苄丝肼6.25 mg/kg,BDNF组及生理盐水组腹腔注射等体积的生理盐水,2次/d,连续注射21 d。在第22 d,L-DOPA+BDNF组及BDNF组大鼠右侧纹状体立体定位注射BDNF(1 μg/4 μl,1次),L-DOPA组及生理盐水组大鼠右侧纹状体立体定位注射生理盐水(1 μg/4 μl,1次)。L-DOPA组和L-DOPA+BDNF组大鼠在纹状体注射后继续腹腔注射L-DOPA 7 d。
1.2.2 行为学测试方法 在第2、11、21、23和29 d对大鼠进行行为学测试。行为学测定包括:(1)异常不自主运动(AIM)评分:每只大鼠在注射后每隔20 min进行1次AIM评分,每次评分观察时间为1 min,共进行9次。内容包括:①轴性不自主运动:躯体和头颈不自主向毁损对侧扭转;②肢体不自主运动:毁损对侧前肢不自主地拍打;③口舌不自主运动:口舌不自主地向毁损对侧舔食。根据严重程度分为:①0分:无异常不自主运动;②1分:偶尔有异常不自主运动;③2分:异常不自主运动经常出现;④3分:持续的异常不自主运动,但给予刺激后异常不自主运动停止;⑤4分:持续的异常不自主运动,给予刺激后也不能停止。(2)跨步实验:于注射前及注射后30 min对大鼠进行跨步实验,以评价其左前肢功能。实验者左手固定大鼠后肢及后半身,右手固定右前肢并使左前肢着地,沿大鼠左前肢方向水平迅速移动大鼠,5 s内移动90 cm。重复实验5次的平均值为该大鼠左前肢跨步数。
1.2.3 大鼠纹状体组织TrkB表达的检测 每组取5只大鼠,于行为学测试结束后麻醉,断头取脑,并在冰上操作分离取出双侧纹状体组织,置于组织裂解液中并超声混匀,4℃ 12 000 r/min(半径为65 mm),离心30 min。弃沉淀,用BCA法测定蛋白浓度,取上清按3∶l加上样缓冲液,100℃煮沸5 min使蛋白变性。根据所测蛋白浓度调整蛋白上样量后进行SDS聚丙烯酰胺凝胶电泳,将蛋白转移到聚偏二氟乙烯膜上,5%脱脂奶粉封闭l h,加入兔抗大鼠P-TrkB/TrkB(1∶500)或鼠抗β-actin(1∶5000)抗体,4℃孵育过夜。TBST缓冲液洗膜3次/10 min,分别加入相应二抗(山羊抗兔1∶1000,山羊抗鼠1∶2000)抗体在室温环境下孵育1 h。洗膜3次/10 min后,采用ECL化学发光法显影检测pTrkB/TrkB蛋白水平。

2 结 果
2.1 各组间AIM评分的比较 见表1。生理盐水组及BDNF组大鼠未出现不自主运动。L-DOPA组和L-DOPA+BDNF组第2、11、21 d的AIM评分差异无统计学意义(均P>0.05)。与L-DOPA组比较,L-DOPA+BDNF组大鼠第23 d的肢体、轴性、口舌AIM评分及29 d的轴性、口舌AIM评分均显著降低(均P<0.05)。
2.2 各组间跨步实验结果的比较 见表2。与注射L-DOPA前比较,L-DOPA组及L-DOPA+BDNF组大鼠各时间点注射L-DOPA后左前肢跨步数均显著增加(均P<0.05)。生理盐水组和BDNF组大鼠各时间点注射前后左前肢跨步数无改变。各组大鼠的左前肢跨步数在整个实验过程中均呈下降趋势,与第2 d的左前肢跨步数相比,各组大鼠第29 d的跨步数均明显减少(均P<0.05)。
2.3 各组间纹状体组织TrkB蛋白磷酸化水平的比较 见表3。与L-DOPA组和生理盐水组相比,L-DOPA+BDNF组毁损侧纹状体pTrkB蛋白表达水平增加(P<0.05);与生理盐水组和L-DOPA组对比,BDNF组毁损侧纹状体pTrkB蛋白的表达水平增加(P<0.05);BDNF组和L-DOPA+BDNF组两组之间毁损侧纹状体pTrkB蛋白表达水平差异无统计学意义;L-DOPA组和生理盐水组两组间毁损侧纹状体pTrkB蛋白表达水平差异无统计学意义。各组健全侧纹状体的毁损侧纹状体pTrkB蛋白表达水平差异无统计学意义。各组TrkB水平差异无统计学意义。

表1 各组间AIM评分的比较(x±s,分)组别例数时间点第2d第11d第21d第23d第29dL-DOPA组10 轴性不自主运动8.54±2.8015.28±6.3816.50±5.5318.11±4.3816.60±5.29 肢体不自主运动9.36±2.9014.28±4.2618.80±4.4118.42±4.2719.30±4.36 口舌不自主运动6.18±2.6212.42±5.6017.60±4.2917.48±4.0517.01±2.54L-DOPA+BDNF组10 轴性不自主运动8.33±3.9215.37±4.0915.91±3.7511.33±2.62*12.11±2.06* 肢体不自主运动9.25±3.2913.86±3.5217.58±4.7313.50±2.21*18.55±4.76 口舌不自主运动5.16±2.7612.33±4.2416.50±6.0213.60±1.80*13.08±2.20* 注:与L-DOPA组比较*P<0.01

表2 各组大鼠左前肢跨步数的比较(x±s,步)组别例数第2d第11d第21d第23d第29dL-DOPA组10 注射前8.05±0.637.43±0.756.48±0.566.64±0.786.50±0.48# 注射后10.50±0.75*9.01±0.68*9.05±0.55*8.25±0.77*8.69±0.76*L-DOPA+BDNF组10 注射前8.00±0.657.25±0.577.22±0.557.05±0.357.05±0.38# 注射后9.75±0.67*9.30±0.68*9.20±0.45*8.98±0.32*8.20±0.35*BDNF组10 注射前8.86±1.357.00±0.937.16±0.687.00±0.976.8±0.48# 注射后9.16±1.337.26±0.357.02±0.886.90±0.857.14±0.79生理盐水组10 注射前8.02±0.926.40±0.887.05±0.776.94±0.386.74±0.25# 注射后7.59±0.896.70±0.796.80±0.596.70±0.556.80±0.61 注:与注射前比较*P<0.05;与第2d比较#P<0.05
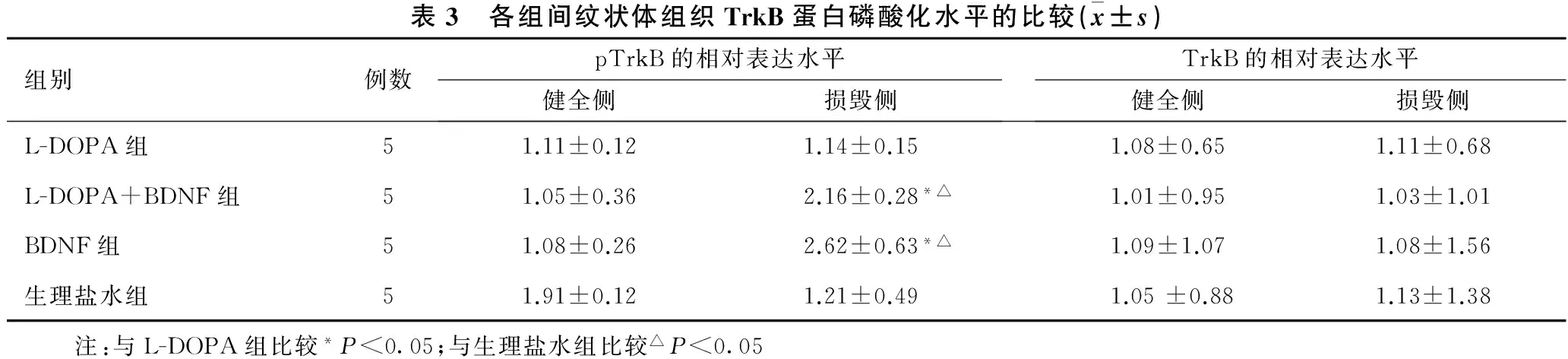
表3 各组间纹状体组织TrkB蛋白磷酸化水平的比较(x±s)组别例数pTrkB的相对表达水平健全侧损毁侧TrkB的相对表达水平健全侧损毁侧L-DOPA组51.11±0.121.14±0.151.08±0.651.11±0.68L-DOPA+BDNF组51.05±0.362.16±0.28*△1.01±0.951.03±1.01BDNF组51.08±0.262.62±0.63*△1.09±1.071.08±1.56生理盐水组51.91±0.121.21±0.491.05±0.881.13±1.38 注:与L-DOPA组比较*P<0.05;与生理盐水组比较△P<0.05
3 讨 论
神经营养因子家族包括神经生长因子、神经营养因子3、神经营养因子4/5和神经营养因子6等,BDNF是神经营养因子家族中的一员。自从BDNF被发现以来,BDNF神经功能一直是热点研究问题,包括胚胎时期的神经再生、神经环路以及突触的发生和生长[5-7];成人时期BDNF的神经维持功能,对突触可塑性的调控功能的研究[8-10]。BDNF有促进神经再生、改善突触可塑性作用,其在Alzheimer’s病、孤独症等神经疾病治疗中皆有重要作用。同时BDNF对于运动障碍疾病PD和亨廷顿病也具有保护作用,可以减少毒性作用引起的黑质神经元丢失[11]。
有研究[2]发现,PD 动物模型中,BDNF的蛋白以及mRNA的表达水平均是下降的,给予BDNF治疗之后可以减少神经毒素导致的黑质多巴胺能神经元的丢失。且有报道[3]称,具有met/met等位基因的PD患者脑内释放的BDNF较少,患异动症的风险增加。由此可见,BDNF在PD发展过程中及L-DOPA诱导的异动症的发生发展中均有着重要作用。本研究主要观察BDNF对L-DOPA诱导的异动症的作用。异动症的主要表现形式为AIM,本研究通过对AIM评分来评判异动症的严重程度。本研究显示,L-DOPA组和L-DOPA+BDNF组第2、11、21 d的AIM评分差异无统计学意义。与L-DOPA组比较,L-DOPA+BDNF组大鼠第23 d的肢体、轴性、口舌AIM评分及29 d的轴性、口舌AIM评分均显著降低(均P<0.05),提示BDNF能缓解异常不自主运动的行为,并且在轴性、口舌、肢体不同方面均有改善异动症行为作用。
本研究采用跨步数检测评价异动症大鼠的前肢运动功能,与注射前比较,L-DOPA组及L-DOPA+BDNF组大鼠各时间点注射后左前肢跨步数均显著增加(均P<0.05)。提示L-DOPA可以改善左前肢的运动功能。相关动物实验[11]显示,BDNF能够保护神经毒性引起的黑质多巴胺能神经元的减少。但本研究发现,各组大鼠的左前肢的跨步数均随着治疗时间的延长呈减少趋势。说明大鼠的运动迟缓功能在加重,考虑多巴胺能神经元损毁较重,BDNF的注射位置在纹状体,且治疗时间在6-OHDA毒性发生5周后,故BDNF没有发挥其神经毒性对抗作用。
神经元的内质网内合成BDNF前体(pro-BDNF),在相关酶的作用下发生折叠后被分泌到细胞外,pro-BDNF被剪切成为BDNF后发挥其神经营养因子的作用。TrkB是BDNF的特异性高亲和力功能受体。BDNF结合到TrkB受体胞外区,诱导TrkB受体二聚化激活膜内区的酪氨酸激酶而自我磷酸化,进而激活下游的信号通路,通过PI3K/Akt、Ras/MEK/MAPK等信号通路促进神经元生长、调控神经发育等[12]。本研究发现,L-DOPA+BDNF组和BDNF组大鼠毁损侧纹状体注射BDNF后pTrkB水平增加,提示外源性给予纹状体BDNF活化了BDNF-TrkB 信号通路,可能进一步激活了其下游信号通路并参与调控缓解L-DOPA诱导的异动行为。突触可塑性的改变在L-DOPA诱导的异动症的发生发展过程中有着重要作用[13],BDNF-TrkB 信号通路激活下游相关蛋白及信号通路可以调控突触可塑性[14]。但BDNF缓解L-DOPA诱导的异动症的具体机制仍需进一步探索。
综上所述,纹状体注射外源性BDNF 能够改善L-DOPA诱导的异动行为,并且不影响L-DOPA抗PD的运动疗效,这一作用可能与其激活BDNF-TrkB 信号通路并调控下游信号通路有关。这一实验结果说明BDNF/TrkB信号通路在异动症的发生发展中扮演着相关角色,BDNF及其神经营养家族在治疗运动障碍性疾病及其并发症的治疗中可能起到某些作用,需要进一步的探索研究。
[1]Zhu G, Li J, He L, et al. MPTP-induced changes in hippocampal synaptic plasticity and memory are prevented by memantine through the BDNF-TrkB pathway[J]. Br J Pharmacol, 2015, 172: 2354.
[2]Levivier M,Przedborski S,Bencsics C,et al.Intrastriatal implantation of fibroblasts genetically engineered to produce brain-derived neurotrophic factor prevents degeneration of dopaminergic neurons in a rat model of Parkinson’s disease[J].J Neurosci,1995,15:7810.
[3]Cheshire P, Bertram K, Ling H, et al. Influence of single nucleotide polymorphisms in COMT, MAO-A and BDNF genes on dyskinesias and levodopa use in Parkinson’s disease[J]. Neurodegener Dis, 2014, 13: 24.
[4]郑伟新,张旺明,罗敏捷,等.脚桥被盖核深部电刺激对帕金森病模型大鼠步态的改善作用[J].中华神经医学杂志,2013,12:570.
[5]Cohen-Cory S, Kidane AH, Shirkey NJ, et al. Brain-derived neurotrophic factor and the development of structural neuronal connectivity[J]. Dev Neurobiol, 2010, 70: 271.
[6]Nikolakopoulou AM, Meynard MM, Marshak S, et al. Synaptic maturation of the Xenopus retinotectal system: effects of brain-derived neurotrophic factor on synapse ultrastructure[J]. J Comp Neurol, 2010, 518: 972.
[7]Wright MA, Ribera AB. Brain-derived neurotrophic factor mediates non-cell-autonomous regulation of sensory neuron position and identity[J]. J Neurosci, 2010, 30: 14513.
[8]Inagaki T, Begum T, Reza F, et al. Brain-derived neurotrophic factor-mediated retrograde signaling required for the induction of long-term potentiation at inhibitory synapses of visual cortical pyramidal neurons[J]. Neurosci Res, 2008, 61: 192.
[9]Pang PT, Lu B. Regulation of late-phase LTP and long-term memory in normal and aging hippocampus: role of secreted proteins tPA and BDNF[J]. Ageing Res Rev, 2004, 3: 407.
[10]Tanaka J, Horiike Y, Matsuzaki M, et al. Protein synthesis and neurotrophin-dependent structural plasticity of single dendritic spines[J]. Science, 2008, 319: 1683.
[11]Volpe BT, Wildmann J, Altar CA. Brain-derived neurotrophic factor prevents the loss of nigral neurons induced by excitotoxic striatal-pallidal lesions[J]. Neuroscience, 1998, 83: 741.
[12]Cowley S, Paterson H, Kemp P, et al. Activation of MAP kinase kinase is necessary and sufficient for PC12 differentiation and for transformation of NIH 3T3 cells[J]. Cell, 1994, 77: 841.
[13]Ghiglieri V, Bagetta V, Pendolino V, et al. Corticostriatal plastic changes in experimental L-DOPA-Induced dyskinesia[J]. Parkinsons Dis, 2012,2012: 358176.
[14]Huang EJ, Reichardt LF. Trk receptors: Roles in neuronal signal transduction[J]. Annu Rev Biochem, 2003, 72: 609.
Effects of brain-derived neurotrophic factor on the behavior of rats with L-DOPA induced dyskinesia and its mechanism
ZHENTi-li,ZHAOJun-yan,SHUHai-yang,etal.
DepartmentofNeurology,SecondAffiliatedHospitalofSoochowUniversity,Suzhou215000,China
Objective To observe brain-derived neurotrophic factor (BDNF) on the behavior of rats with L-DOPA induced dyskinesia and investigating its mechanism.Methods Hemi-parkinsonian rat models were established by stereotaxically injection of 6-hydroxy dopamine(6-OHDA) in the right medial forebrain bundle. The Parkinson’s disease model rats were randomly divided into four groups: L-DOPA group ,L-DOPA+BDNF group, BDNF group and normal saline group. L-DOPA group and L-DOPA + BDNF group were injected with L-DOPA 25 mg / kg + benserazide 6.25 mg / kg, BDNF group and saline group were injected the same volume of saline. All rats received intraperitoneal injections twice daily and continued for 21 days. At 2,11,21,23 and 29 days, abnormal involuntary movement (AIM) score and stepped experiment were detected. The TrkB protein phosphorylation levels of rat striatum tissue were detected by western blot.Results There was no involuntary movement in normal saline group and BDNF group. There was no statistical significance of the differences of AIM scores between L-DOPA group and L-DOPA+BDNF group at 2 d,11 d,21 d. Compared with L-DOPA group, the body, axial and tongue AIM scores at 23 d and the axial, tongue AIM scores at 29 d were significantly decreased in rats of L-DOPA+BDNF group (allP<0.05). There was no change of left forelimb step number in normal saline group and BDNF group after injection. Compared with before injection, the left forelimb step numbers of L-DOPA group and L-DOPA+ BDNF group were significantly increased at each time point after injection (allP<0.05). The left forelimb step numbers of 4 groups showed a downtrend in the treatment. Compared with L-DOPA group and normal saline group, the pTrkB protein levels in damaged striatum tissues were increased in L-DOPA+BDNF group and BDNF group (allP<0.05). There was no significant difference of pTrkB protein levels in damaged striatum tissues between BDNF group and L-DOPA+ BDNF group and also between L-DOPA group and normal saline group. There was no significant difference of pTrkB protein levels in sound striatum among the 4 groups . There was no significant difference of TrkB protein levels among the 4 groups. Conclusion Exogenous administration of BDNF can alleviate abnormal involtmtary movements induced by L-DOPA without disturbing the efficacy of L-DOPA, which may be associated with activation of BDNF-TrkB signaling pathways.
Parkinson’s disease;L-DOPA induced dyskinesia;brain-derived neurotrophic factor
国家自然科学基金(81200970)
215000苏州大学附属第二医院神经内科
罗蔚锋
R742.5
A
1004-1648(2017)01-0045-05
2016-03-22
2016-08-14)
