不同亚型帕金森病患者多导睡眠图的临床观察
2017-03-08潘燕王红杰朱志华
潘燕,王红杰,朱志华
·论著·
不同亚型帕金森病患者多导睡眠图的临床观察
潘燕,王红杰,朱志华
目的 评价不同亚型原发性帕金森病(PD)患者多导睡眠图(PSG)的变化指标,分析PD患者睡眠障碍的临床特点。方法 选取原发性PD患者90例[震颤为主型40例,姿势异常步态障碍(PIGD)为主型50例]以及50名健康对照者,进行全夜PSG监测,并对结果进行比较。 结果 与震颤为主型相比,PIGD为主型总睡眠时间、卧床时间、睡眠中觉醒次数及睡眠效率明显下降,快速眼动(REM)睡眠时间明显减少,差异有统计学意义(均P<0.05);睡眠潜伏期、S1(min)、 S1(%)、 S2(min)、 S2(%)、 S3+S4(min)、 S3+S4(%)差异无统计学意义(均P>0.05)。与对照组相比,震颤为主型总睡眠时间、卧床时间明显下降,差异有统计学意义(均P<0.05);睡眠中觉醒次数、睡眠效率、REM睡眠时间、睡眠潜伏期、S1(min)、 S1(%)、 S2(min)、 S2(%)、 S3+S4(min)、 S3+S4(%),差异无统计学意义(均P>0.05)。结合视频监测录像观察,PIGD 为主型原发性 PD患者70%出现REM睡眠行为障碍(RBD)异常,而震颤为主型原发性PD患者2.5%出现RBD异常。 结论 PIGD 为主型较震颤为主型原发性PD患者更易出现睡眠障碍及RBD异常表现,可能与PD不同亚型的临床异质性相关。
帕金森病;姿势异常步态障碍;震颤;多导睡眠图
帕金森病(PD)是黑质-纹状体通路变性的疾病,常见于中老年人,由于黑质纹状体内的多巴胺能神经元变性,同时残存神经元细胞合成多巴胺的能力下降,这样最终引起PD的发生[1]。PD的非运动症状日益受到关注[2]。近来有研究[3]发现,在PD发病早期及应用多巴胺类药物治疗之前,非运动症状对于患者生活质量的影响较运动症状更大。目前,越来越多的人关注其运动功能障碍异质性的表现,而非运动方面的症状却很少述及。睡眠障碍是PD最常见的导致其失去生活能力的非运动方面的并发症之一[4]。 近年来临床上越来越多地发现PD患者常合并睡眠障碍,至少存在于60%的 PD患者中,甚至有时可作为疾病的首发症状出现,严重影响患者的生活质量[5]。 目前涉及PD不同临床亚型与睡眠障碍的研究较少,本研究对PD睡眠障碍采用量化指标系统评价,以探讨不同临床亚型PD患者的睡眠障碍的临床特点,并进一步指导治疗。
1 对象与方法
1.1 对象 选取我院PD专病门诊和住院的原发性PD患者共90例,男50例,女40例;年龄48~82岁,平均(65.23±7.85)岁;病程5月~30年,平均(4.52±4.03)年。震颤为主40例(男22例,女18例),姿势异常步态障碍(PIGD)为主50例(男28例,女22例)。选取50名门诊健康体检者为对照组,男26名,女24名;年龄42~78岁,平均(60.14±5.63)岁。纳入标准为英国协会(UKPDS)的诊断标准[6],呈缓慢发病,具有静止性震颤、肌肉强直和运动迟缓等3项症状中至少2项,左旋多巴治疗试验反应阳性;尽量排除帕金森综合征和帕金森叠加综合征,排除其他神经系统疾病、精神疾病、心血管疾病;疼痛性疾病、酒精成瘾者及服用镇静催眠药史,排除痴呆不能进行评分者(MMSE:文盲≤17分,小学≤20分,中学≤22分,大学以上≤23分)。所有纳入的震颤为主和PIGD为主的PD患者,均为服用美多芭片250 mg,每日三次(排除不同剂量的多巴胺能制剂对睡眠的影响)。
1.2 方法
1.2.1 分组方法 采用 Jankovic等[7]的分组方法,将PD患者按其运动障碍分为两亚型:震颤为主型为统一PD评定量表-运动检查(UPDRSⅢ)中平均震颤得分/姿势异常及步态障碍得分≥1.5;PIGD为主型为UPDRSⅢ中平均震颤得分/PIGD得分≤1.0。1.2.2 多导睡眠图(PSG)监测 所有受试者均经连续两晚睡眠监测,取第二晚所得数据用于参数分析。PSG监测采用美国 Nicolet Uhrasom PSG监测仪:包括EEG、眼电图、下颏EMG、双下肢EMG、ECG、鼾音、口鼻气流、胸部和腹部运动。参考 AASM Manual for scoring Sleep, 2007 标准进行睡眠分期。通过结合视频监测录像观察患者有无睡眠运动障碍,并结合睡眠分期以确定性质。睡眠结构分期标准:(1)清醒:在每一版(30 s的时段内)的EEG出现低幅快活动或者8~12 Hz 的α节律,同时可有扫视性的快速眼动、眨眼,下颌肌电显示肌张力很高,而缺乏睡眠EEG的特征;(2)Ⅰ期睡眠(S1):在每一版(30 s的时段内)的EEG出现低波幅混合频率脑电活动,以3~7 Hz为主,α活动少于 50%,有较慢的眼球运动,有时出现标志性顶尖波;(3)Ⅱ期睡眠(S2):每一版(30 s的时段内)的EEG以睡眠纺锤和K-复合波及指数小于20%的δ波为特征; (4)Ⅲ期睡眠(S3):每一版(30 s的时段内)的EEG中出现高波幅(>75 V)的δ波指数为20%~50%;(5)Ⅳ期睡眠(S4):每一版(30 s的时段内)的EEG出现高波幅δ波指数>50%;(6)快速眼动(REM)睡眠:每一版(30 s的时段内)的EEG表现为类似于Ⅰ期睡眠的相对低幅的混合频率脑电活动,下颌肌电显示肌张力消失,眼电图可出现周期性地锯齿样的快速眼动波。睡眠生理参数: (1)卧床时间:从关灯上床到早上起床的时间减去夜间离开床的时间。总睡眠时间(TST):在记录过程中真正的睡眠时间的总和。睡眠效率(SE):总睡眠时间与卧床时间的比值。(2)睡眠潜伏期(SL):从关灯上床到出现第一个任何睡眠时段的时间。(3)REM睡眠潜伏期(REM-SL ):从睡眠开始到出现第1个快速眼动睡眠期的时间。(4)觉醒次数:从入睡到睡眠结束期间清醒的次数,要求持续时间>15 s。(5) S1-S4 期睡眠和REM的比例:为各期睡眠时间与总睡眠时间的比值。(6)慢波睡眠(SWS):指 S3+S4 期的睡眠总和,又称深度睡眠。

2 结 果
2.1 PIGD为主型与震颤为主型的比较 见表1。与震颤为主型相比,PIGD为主型总睡眠时间、卧床时间、睡眠中觉醒次数及睡眠效率明显下降,REM睡眠时间减少,差异有统计学意义(均P<0.05);而睡眠潜伏期、S1(min)、 S1(%)、 S2(min)、 S2(%)、 S3+S4(min)、 S3+S4(%),差异无统计学意义(均P>0.05)。
2.2 震颤为主型与对照组的比较 见表1。与对照组相比,震颤为主型原发性总睡眠时间、卧床时间明显下降,差异有统计学意义(均P<0.05);睡眠中觉醒次数、睡眠效率、REM睡眠时间、睡眠潜伏期、S1(min)、 S1(%)、 S2(min)、 S2(%)、 S3+S4(min)、 S3+S4(%),差异无统计学意义(均P>0.05,表 1)。
2.3 发生REM睡眠行为障碍(RBD)的情况 结合视频监测录像观察,35例(70%)PIGD为主型原发性PD患者出现RBD,表现为梦魇(56.3%)、喊叫(28.8%)、攻击性动作(18.4%)。而震颤为主型原发性PD患者中仅2.5%(1/40)出现RBD,表现为梦魇。
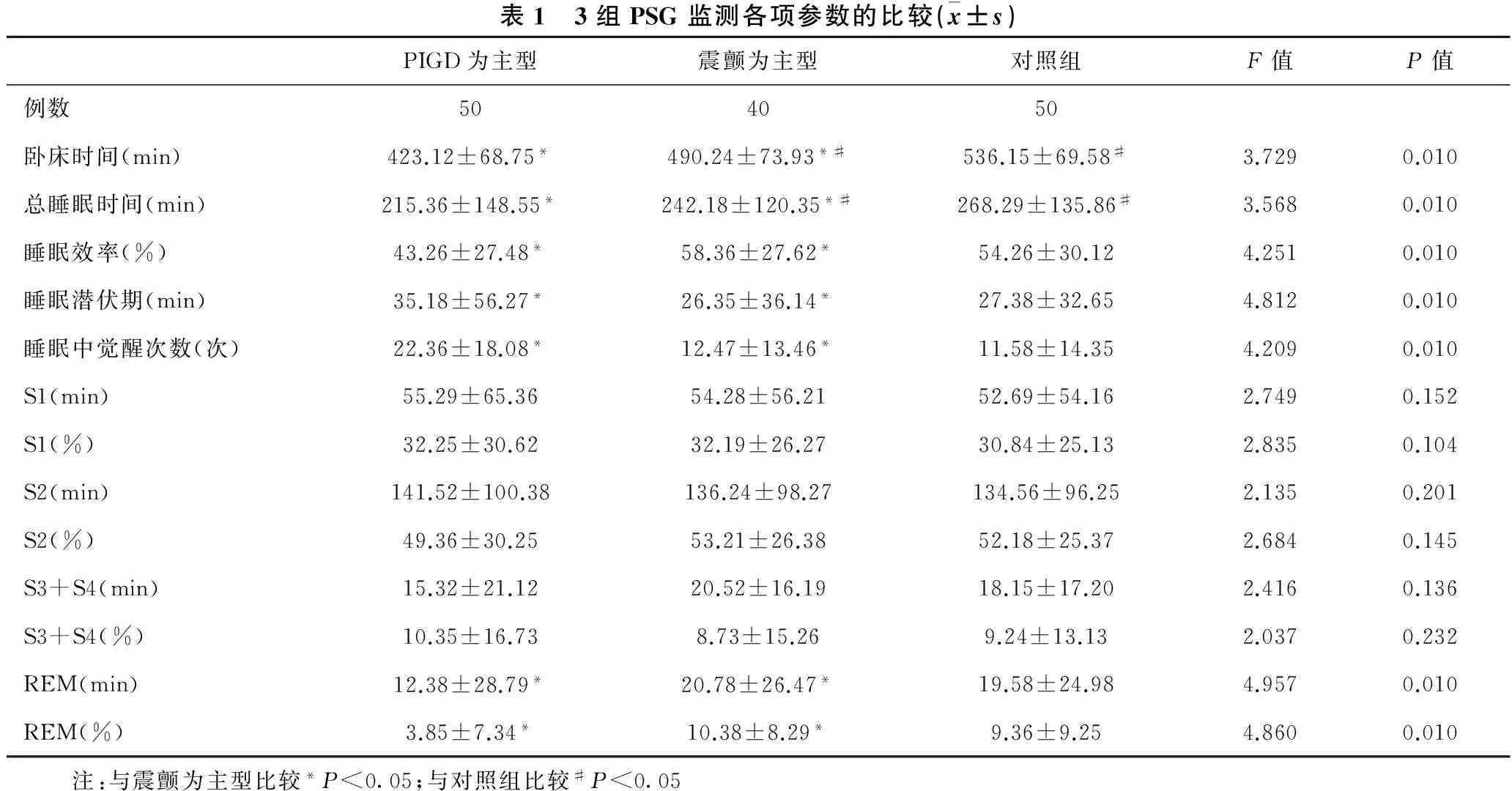
表1 3组PSG监测各项参数的比较(x±s)PIGD为主型震颤为主型对照组F值P值例数504050卧床时间(min)423.12±68.75*490.24±73.93*#536.15±69.58#3.7290.010总睡眠时间(min)215.36±148.55*242.18±120.35*#268.29±135.86#3.5680.010睡眠效率(%)43.26±27.48*58.36±27.62*54.26±30.124.2510.010睡眠潜伏期(min)35.18±56.27*26.35±36.14*27.38±32.654.8120.010睡眠中觉醒次数(次)22.36±18.08*12.47±13.46*11.58±14.354.2090.010S1(min)55.29±65.3654.28±56.2152.69±54.162.7490.152S1(%)32.25±30.6232.19±26.2730.84±25.132.8350.104S2(min)141.52±100.38136.24±98.27134.56±96.252.1350.201S2(%)49.36±30.2553.21±26.3852.18±25.372.6840.145S3+S4(min)15.32±21.1220.52±16.1918.15±17.202.4160.136S3+S4(%)10.35±16.738.73±15.269.24±13.132.0370.232REM(min)12.38±28.79*20.78±26.47*19.58±24.984.9570.010REM(%)3.85±7.34*10.38±8.29*9.36±9.254.8600.010 注:与震颤为主型比较*P<0.05;与对照组比较#P<0.05
3 讨 论
PD主要临床表现为静止性震颤、肌强直、运动迟缓及姿势步态异常四大主征。按其运动障碍的不同表现,将PD患者分为震颤为主型和 PIGD为主型[7]。 由于PD临床表现复杂多样,其四主征的出现存在不均衡性,且不同运动障碍亚型的PD病情进展快慢也明显不同,PIGD为主型PD运动功能恶化进展迅速,对左旋多巴反应差,且生活质量明显降低[8]。
国外也有研究[9]表明运动迟缓与肌体强直的进展速度基本相似,但震颤无规律可循,因此推测两者是完全不同的病理生理过程。 此外,PIGD为主型对左旋多巴反应差,可能造成多巴胺能制剂用量增加。大剂量多巴胺能制剂则导致睡眠破碎或延长睡眠潜伏期及片段睡眠和入睡困难,出现总睡眠时间减少,睡眠效率下降[10]。 另有研究[11]表明 PIGD为主型更易伴发情感、智能障碍,而情感障碍如抑郁又是导致睡眠质量下降的影响因素之一[12],从而影响睡眠质量。
RBD首次在人类中被描述是在1986年,指的是REM正常EEG活动的抑制和肌肉张力消失时,出现与梦境相关的暴力等异常行为,有时可能会伤及他人或自身,PSG检查显示REM睡眠期肌肉有失张力表现。Kumru等[13]研究发现在出现RBD的PD患者中,几乎没有震颤为主型的PD患者,且RBD较PD症状提前出现,多发生在50岁以后出现PD症状的患者。 另外,Postuma 等[14]研究也表明伴有RBD的PD患者在运动症状方面有其特异的表现:震颤减少、跌倒频发、对药物剂量呈现低反应性,表明RBD是以非震颤为主的PD又一个临床异质性的体现。本研究发现,在PSG 监测中通过结合视频监测录像观察,PIGD 为主型原发性PD患者70%(35/50)出现RBD异常,表现为梦魇56.3%,喊叫28.8%,攻击性动作18.4%。而震颤为主型原发性PD患者2.5%(1/40)出现RBD期异常,表现为梦魇。PD不同临床亚型的异质性对睡眠障碍等非运动症状产生影响的机制目前还不太清楚,可能与其不同的神经病理改变相关。 睡眠和觉醒依赖递质系统调节,如黑质-纹状体多巴胺系统与行为觉醒有关,去甲肾上腺素、乙酰胆碱与脑电觉醒有关。PIGD为主型PD 中红核、黑质存在更为明显的多巴胺能神经元脱失,导致脑内递质失衡,从而影响正常睡眠-觉醒周期,且睡眠障碍的程度随疾病的进展渐趋加重。另外,国外也有研究[15]认为PIGD为主型纹状体5-羟色胺含量降低是情感智能障碍的病理生理基础,从而间接影响睡眠质量。 因此PIGD为主型PD与震颤为主型PD可能由于存在不同的生化基础,从而导致其更易出现睡眠障碍等PD非运动症状。
本研究结合PSG监测,发现PIGD为主型原发性PD患者总睡眠时间、卧床时间、睡眠中觉醒次数及睡眠效率明显下降,REM睡眠时间减少,差异有统计学意义;而睡眠潜伏期、S1(min)、 S1(%)、 S2(min)、 S2(%)、 S3+S4(min)、 S3+S4(%),差异无统计学意义。震颤为主型PD患者较对照组相比,总睡眠时间、卧床时间明显下降,差异有统计学意义(P<0.05);睡眠中觉醒次数、睡眠效率、REM睡眠时间、睡眠潜伏期、S1(min)、 S1(%)、 S2(min)、 S2(%)、 S3+S4(min)、 S3+S4(%),差异无统计学意义。本研究不仅证实了PD患者睡眠障碍如入睡困难、RBD、片段睡眠等在PD患者临床表现中是很常见的症状,而且发现睡眠障碍与PD患者的不同临床亚型相关,且排除了多巴胺能制剂对睡眠的影响,这是PD异质性在非运动症状方面的差异性的又一个证据,同时为PD的个体化治疗提供临床依据,可能改善PD患者的预后。
目前,研究PD合并睡眠障碍的电生理方面较多,PSG已广泛用于睡眠医学研究,但在研究设计(如样本量、PSG监测时长、研究环境)、患者筛选及分组、对照选择等方面仍存在较多问题[16],在很大程度上导致人们对研究成果的质疑。为了得出更加准确客观的研究结果,可以通过记录PSG监测具体时段、PD患者分类细化、进行前瞻性研究、DNA采样研究、建立标准化指南等手段加深对未知问题的探讨与解读[17]。
[1]Thomas B, Beal MF.Parkinson’s disease [J]. Hum Mol Genet, 2009, 16:183.
[2]庄海,徐武华,邹海强.帕金森病非运动症状临床诊治的新进展[J].中华神经医学杂志,2011,10:1294.
[3]Muller B, Assmus J, Herlofson K, et al. Importance of motor vs. non-motor symptoms for health-related quality of life in early Parkinson’s disease[J]. Parkinsonism Relat Disord, 2013, 19:1027.
[4]Salawu FK, Danburam A, Olokoba AB. Non-motor symptoms of Parkinson’s disease:diagnosis and management[J]. Niger J Med, 2010, 19: 126.
[5]Forsaa EB,Larsen JP,Wentzel-Larsen T,et al.A 12-year population-based study of psychosis disease[J].Ach Neurol,2010,67:996.
[6]Hushes AJ, Daniel SE, KiIford L, et al. Accuracy of clinical diagnosis of idiop-athic Parkinson’s disease:aclinical-pathological study of 100 cases[J]. Neurol Neurosurg Psychiatry, 1992, 55: 181.
[7]Jankovic J, Mc Dermott M, Carter J, et al. Variable expression of Parkinson’s disease[J]. Abaseline analysis of the DATATOP cohort.Neurology, 1990, 40: 1521-.
[8]Hariz GM, Forsgren L. Activities of daily living and quality of life in persons with newly diagnosed Parkinson’s disease according to subtype of disease,and incomparison to healthy controls[J]. Acta Neurol Scand, 2011, 123: 20.
[9]Schrag A, Dodel R, Spottke A, et al. Rate of clinical progression in Parkinson’s disease[J]. Mov Disord, 2007, 22: 938.
[10]Kaynak D, Kiziltan G, Kaynak H, et al. Sleep and Sleepiness in patients with Parkinson’s disease before and after dopaminergic treatment[J]. Neurology, 2005, 12: 199.
[11]Reijnders SAM, Ehrt U, Lousberg R. The association between motor subtypes and psychopath hology in Parkinson’s disease[J]. Parkinsonism Rela Disord, 2009, 15: 379.
[12]Oliver R, Jens K, Annika S, et al. Frequency of dementia et al.depression et al.and other neuropsy chiatric symptoms in 1,449 outpatients with Parkinson’s disease[J]. Neurol, 2010, 257: 1073.
[13]Kumru H, Santamaria J, Tolosa E, et al. Relation between subtype of Parkinson’s disease and REM sleep behavior disorder[J]. Sleep Medicine, 2007, 56: 779.
[14]Postuma RB, Gagnon JF, Vendettb M, et al. REM sleep behavior disorder in Parkinson’s disease is associated with specific motor features[J]. Neurol Neurosurg Psychiatry, 2008, 79: 1117.
[15]Politis M, Wu K, Loane C, et al. Depressive symptoms in PD correlate with higher 5-HTT binding in rapres and limbic structures[J]. Neurology, 2010, 75: 1920.
[16]Peeraully T, Yong MH, Chokroverty S, et al. Sleep and Parkinson'isease:a review of case-control polysomnography studies[J]. Movisord, 2012, 27: 1729.
[17]刘晓楠,靳峥. 帕金森病睡眠障碍的多导睡眠监测研究进展[J].中华神经医学杂志,2015,14:302.
Clinical observation of polysomnographic in patients with different subtypes of Parkinson’s disease
PANYan,WANGHong-jie,ZHUZhi-hua.
DepartmentofNeurolog,theFifthAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830011,China
Objective To evaluate the changes parameters of polysomnographic (PSG) with different subtypes of primary Parkinson’s disease (PD) and analyze the clinical characteristics of sleep disorders in PD patients.Methods Ninety patients with primary PD [tremor-predominant PD group (n=40), postural instability gait disorder (PIGD)-predominant PD group (n=50)] and 50 healthy controls were detected by full night PSG monitoring. And the results were compared.Results Compared with tremor-predominant PD group, the total sleep time, bed time, sleep wake-up times, sleep efficiency and rapid eye movement (REM) sleep time of PIGD-predominant PD group were significantly lower (allP<0.05), however, the sleep latency, S1 (min), S1 (%), S2 (min), S2 (%), S3+S4(min), S3+S4 (%) had no statistical significance (allP>0.05). Compared with the controls, the total sleep time and bed time of tremor-predominant PD group were significantly lower (allP<0.05), however, the sleep wake-up times, sleep efficiency, REM sleep time, sleep latency, S1 (min), S1 (%), S2 (min), S2 (%), S3 + S4 (min), S3 + S4 (%) had no statistical significance (allP>0.05). Combined with video surveillance video observation,the abnormality of REM sleep behavior disorder (RBD) was 70% with PIGD-predominant PD group, in which the abnormality of tremor-predominant PD group was 2.5%. Conclusions The PIGD-predominant PD patients are more likely to appear sleep disorders and RBD than tremor-predominant PD patients. It may be related to clinical heterogeneity of different PD subtypes.
Parkinson’s disease; postural instability gait disorders; tremor; polysomnographic
830011 乌鲁木齐,新疆医科大学第五附属医院神经内科(潘燕,朱志华);新疆民政康复医院妇科(王红杰)
R742.5
A
1004-1648(2017)01-0036-04
2016-01-09
2016-03-13)
