组学方法在植物保卫细胞研究中的应用
2017-03-08吴天文王俊斌李明陈小强曹高燚谢晓东通信作者
吴天文,王俊斌,李明,陈小强,曹高燚,谢晓东,通信作者
保卫细胞是植物表皮上一类特化的细胞,通过其围成的气孔,控制植物体水分散失和气体的交换。环境变化、病菌侵染等外界环境因子都会引起气孔开度或气孔发育的变化[1-3]。对保卫细胞应答反应的生理研究方法包括测定气体蒸腾量、红外热成像测定叶片温度变化、测定气孔开度和保卫细胞原生质体的离子跨膜运输等,相关研究报道较多[4-5]。前人对保卫细胞应答环境的分子机理研究,主要是利用正向遗传学和反向遗传学的方法鉴定与气孔信号转导相关的基因。以脱落酸(ABA)信号转导途径为例,从ABA受体PYR/PYL/RCAR基因的鉴定,到第二信使参与ABA信号转导的调节,包括活性氧(ROS)、一氧化氮(NO)、磷脂酸(PA)、三磷酸磷脂酰肌醇(PIP3)、三磷酸肌醇(IP3)、六磷酸肌醇(IP6)、鞘脂类物质和钙离子等,再到慢型阴离子通道(SLAC1)和钾离子通道(KAT)蛋白的鉴定,主要都是通过突变体、构建过表达株系、添加合成或运输抑制剂,从组织和个体水平来观察其与正常材料的差别来确定其功能[6]。
为解析保卫细胞的功能,研究建立了保卫细胞的分离和纯化方法。包括通过显微操作进行物理分离[7],以及采用化学方法获得游离原生质体,并进行离心纯化得到高纯度的保卫细胞原生质体[8-9]。此外,随着高通量测序技术的不断发展[10],质谱分析技术的不断进步[11],推动了从转录组、蛋白组和代谢组等组学水平鉴定保卫细胞的信号通路元件,高通量发掘重要候选基因、蛋白质或代谢物的研究。本文主要就近年来双子叶植物保卫细胞分离技术和组学方法在保卫细胞机理方面的研究进展进行综述,为进一步的研究提供参考。
1 保卫细胞分离方法的研究
依据现有研究报道,高等植物保卫细胞分离方法可分为两大类:一是显微操作分离法,包括激光捕获显微切割法和人工显微分离法。Aubry等[12]利用激光捕获切割法分离了C3植物醉蝶花(Tareneya hassleriana)和C4植物白花菜(Gynandropsis gynandra)叶片中的保卫细胞、叶肉细胞和维管束细胞,并分析不同类型细胞的转录组差异。Bates等[7]首次利用解剖刀在显微镜下成功分离出冷冻干燥叶片表皮中的保卫细胞,并成功提取出RNA。但是激光捕获切割法和人工显微分离法在保卫细胞研究中应用比较有限,原因在于这两种方法对材料准备、设备和操作技术的要求都比较高,且分离的细胞量有限,不利于后期研究和技术方法的推广。二是游离原生质体法。Zeiger等[13]采用二段酶处理法首次分离了洋葱和烟草的保卫细胞原生质。Nisita等[14]进一步研究了此法对基因表达的影响,认为酶解时间的长短不影响保卫细胞原生质体的纯度和产量,但影响RNA的提取量,RNA质量随着酶解时间的延长而下降,且转录抑制剂的使用能减少胁迫基因的表达。该方法也在鸭跖草、玉米和拟南芥等植物物种中获得成功[8,15-17]。这些研究均利用不同原生质体沉降系数的差异进行酶解产物的分离纯化。
另外,也可以采用流式细胞仪分离原生质体悬浮液中的保卫细胞。流式细胞术(FCM)是采用激光束激发单行流动的细胞,并对其散射光和携带的荧光进行探测,从而完成细胞分析和分选[18]。Adrian等[9]用荧光蛋白标记了调控拟南芥气孔发育的转录因子SPCH、MUTE和FAMA,获得了转基因拟南芥植株,再利用流式细胞仪分选酶解分离法获取的原生质体悬浮液,成功分离到不同发育时期的保卫细胞原生质体。不同的分离技术方法各有其优缺点,表1为保卫细胞不同分离方法的比较分析。
2 保卫细胞的组学研究
2.1 保卫细胞转录组研究
转录组广义上指某一生理条件下,组织或细胞内所有转录产物的集合,包括编码蛋白质的信使RNA、核糖体RNA、转运RNA和其他非编码RNA。一般所说的转录组测序主要针对的是mRNA,近年来随着技术的进步和研究的深入,非编码RNA的研究也日益受到关注。用于转录组研究的技术主要有3种,包括基于杂交技术的DNA微阵列和DNA宏阵列、基于标签技术的SAGE和MPSS、基于直接测序的高通量测序技术[19]。保卫细胞的转录组研究通常采用基因芯片和高通量测序。随着高通量测序技术的发展和价格的下降,其在保卫细胞转录组研究中的报道也愈来愈多。
为系统解析保卫细胞应答ABA信号的机制,采用转录组分析技术鉴定了大量重要候选基因。Leonhardt等[20]以拟南芥保卫细胞原生质体为材料,通过基因芯片检测技术鉴定出1 309个基因应答ABA信号,其中64个基因在保卫细胞中的表达量明显高于叶肉细胞,并对一个新鉴定的信号组分AtP2C-HA进行了功能验证。通过对ABA应答基因的启动子进行分析,发现了诸多ABA应答元件。Zhu等[21]以只含保卫细胞的拟南芥表皮条为材料,发现1 173个受ABA调控的保卫细胞基因,其中近300个基因在以前的转录组研究中未被发现,鉴定了一个保卫细胞中受ABA诱导的基因的特有顺式作用元件。
气孔是控制CO2吸收和水分散失的通道,光合作用与气孔功能密切相关。为验证光合作用糖信号促进气孔开放的假说,对蔗糖处理的保卫细胞进行了基因芯片分析,发现440个对蔗糖处理响应的基因,验证了50个对蔗糖高度响应的基因,其中12个基因在叶片导度、水分利用效率和气孔发育方面有重要作用,其中At4g17770、At1g65370和At1g15440基因在各项试验检测中发现与气孔功能密切相关[7]。为解析C3植物和C4植物保卫细胞光合作用CO2固定机制的差异,对C3植物醉蝶花(Tareneya hassleriana)和 C4植物白花菜(Gynandropsis gynandra)保卫细胞进行了转录组分析。结果发现,两个物种中有60%的基因与拟南芥保卫细胞中基因在功能上是保守的。在C3和C4植物中,多数离子和二氧化碳信号通路基因在转录水平上无显著变化,而C4循环核心基因在C4植物保卫细胞中的表达水平显著高于C3植物中的同源基因,这可能与小分子有机酸参与气孔开度调控有关。C4植物中,参与C4循环和卡尔文循环的基因表达模式主要有两种,从维管束鞘细胞、叶肉细胞到保卫细胞,基因的表达水平持续下降。叶肉细胞中的基因表达水平高于保卫细胞和维管束鞘细胞[12]。
调控气孔不同发育阶段的bHLH转录因子基因SPCH、MUTE和FAMA,是通过气孔发育突变体的鉴定获得。保卫细胞转录组研究能鉴定大量与这些基因相近功能的基因。构建这3个bHLH转录因子基因启动子分别驱动荧光标记基因的转基因系,通过流式细胞仪分离处于不同发育阶段的拟南芥保卫细胞,进行转录组测序和基因芯片分析。结果发现了一系列与上述3个基因功能相似的基因,拟分生细胞表现出了全能性细胞的特性(pluripotency),气孔系谱细胞(stomatal lineage cells)与茎尖和根尖分生组织细胞有很大的功能相关性[9]。
2.2 保卫细胞蛋白组研究
蛋白质是生物体功能的重要物质基础,蛋白组是生物体表型的重要分子基础。近年来,双向凝胶电泳、生物质谱、同位素标签等技术的发展,推动了蛋白组学研究的进步,采用不同蛋白组学方法在保卫细胞中鉴定出一系列新的信号组分。
利用双向凝胶电泳、二维液相色谱技术和基质辅助激光解析电离技术(MALDI),已从拟南芥保卫细胞中分离出1 734种蛋白质,其中336种没有在Leonhardt等的表达谱数据中出现,而鉴定的52种信号蛋白中,只有2种被认为是与保卫细胞功能有关[20]。为验证所筛选到的信号组分的功能,对在保卫细胞中冗余表达的TGG1蛋白进行了鉴定,证实其为气孔ABA信号通路的新组分[22]。
利用同位素亲和标签(ICAT)技术,鉴定了欧洲油菜保卫细胞原生质体中与ABA与MeJA信号转导相关的氧化还原蛋白,通过饱和差异凝胶电泳和质谱分析,发现了保卫细胞中有65个氧化还原蛋白可能与ABA信号有关,118个氧化还原蛋白与MeJA信号有关,其中2个蛋白SnRK2激酶和异丙基苹果酸脱氢酶已证明参与气孔运动的调控[23]。利用原理相似的半胱氨酸串联质谱标签(cysTMT)技术,在富含保卫细胞的油菜表皮中鉴定到80个硫氧还蛋白靶标蛋白质,参与光合作用、胁迫应答、代谢和细胞信号等多种生理过程,深化了对气孔功能机制的理解[24]。
利用相对和绝对定量同位素标记(iTRAQ)技术,在油菜的保卫细胞和叶肉细胞进行蛋白质组比对分析,检测到427个蛋白质,其中74个在保卫细胞中表达量较高,在Leonhardt等的试验中检测到110个蛋白,其中72%的基因和蛋白在两个试验中表达模式相近[25]。对拟南芥野生型植株Col-0和突变体gpa1-4(G蛋白α亚基)的保卫细胞进行了ABA处理,结果发现:无ABA处理,Col-0和突变体gpa1-4有18个蛋白的表达不同;而ABA处理后,Col-0有2个蛋白表达受影响,突变体GPA1中则有6个蛋白表达受影响[26]。利用该技术分析了油菜保卫细胞在ABA和MeJA处理下的蛋白组数据,发现了431个蛋白与应答ABA相关,而84个蛋白与应答MeJA相关[26-27]。
不同蛋白质组学方法的工作原理不同,因此筛选的差异蛋白具有一定的偏好性,通过综合使用不同的组学方法,有望鉴定出不同理化特征的保卫细胞功能蛋白,构建更趋精细的基因调控网络。保卫细胞组学研究框架图及近年来的研究热点如图1所示。

图1 保卫细胞组学研究框架图
2.3 保卫细胞代谢组研究
代谢组学研究细胞中由特定生命过程产生的全部化学指纹,特别是小分子代谢物(相对分子质量小于1 000)。其分析方法主要有核磁共振技术(NMR)、气相色谱-质谱(GC-MS)联用技术和液相色谱-质谱(LC-MS)联用技术等[28]。
以ABA处理的拟南芥保卫细胞原生质体为材料,通过液相色谱-多重反应监测质谱(liquid chromatography-multiple reaction monitoring mass spectrometry,LC-MRM-MS),检测到 85个与 ABA信号相关的小分子代谢物,gpa1拟南芥突变体保卫细胞代谢物对ABA的应答效应较野生型小,野生型保卫细胞激素相关代谢物对ABA有应答,表明ABA信号位于这些代谢物上游[29]。为解析保卫细胞和叶肉细胞的功能差异,分析了油菜保卫细胞和叶肉细胞原生质体应答碳酸氢盐反应的代谢组数据。结果表明两种类型的细胞对碳酸氢根离子应答的代谢组存在显著不同,叶肉细胞中氨基酸、苯丙酯类、氧化还原代谢物、生长素和细胞分裂素类物质较高,而碳代谢、氮代谢和防卫反应相关代谢物在保卫细胞中含量较高[30]。为解析保卫细胞应答CO2机理,采用LC-MS,LC-MRM-MS和超高液相色谱-基质辅助激光解吸电离-四级杆飞行时间-质谱技术(UHPLC-MALDI-QTOFMS),在油菜保卫细胞中检测到358个对CO2响应的代谢物。CO2增加会导致ROS等代谢物含量上升,发现CO2通过茉莉酸介导气孔关闭过程[31]。
3 讨论和展望
保卫细胞在逆境胁迫下,发生膨压改变,导致气孔开度变化,影响植物的光合作用和蒸腾作用等生物学过程[32]。长期逆境胁迫,还会导致气孔发育的改变[33]。通过正向遗传学和反向遗传学方法,目前已鉴定了保卫细胞逆境应答信号通路中的重要信号元件[34],和气孔发育不同阶段的重要调控因子[35]。目前大多数保卫细胞的研究以叶片或者叶片下表皮为材料,表皮细胞、叶肉细胞和表皮毛等细胞与保卫细胞有功能的异质性,因而对组织或器官的研究,不能反映特定类型细胞的功能特性。为进一步解析保卫细胞运动和发育,已有研究对保卫细胞进行分离,分离的保卫细胞一部分用于电生理、少量基因的表达鉴定研究,还有一部分用于组学研究。保卫细胞内的基因组作为遗传物质,转录后的转录组、翻译后的蛋白质组以及细胞内代谢产物的代谢组之间相互作用,决定了保卫细胞在逆境条件下的表型。相对于普通遗传学和生理学研究,采用组学的技术方法能够从整体水平了解保卫细胞运动和发育过程中的基因、蛋白质、小分子代谢物的变化,全面系统解析保卫细胞的功能机制。通过组学方法研究得到的参与保卫细胞代谢的基因、蛋白质和代谢物如表2所示。
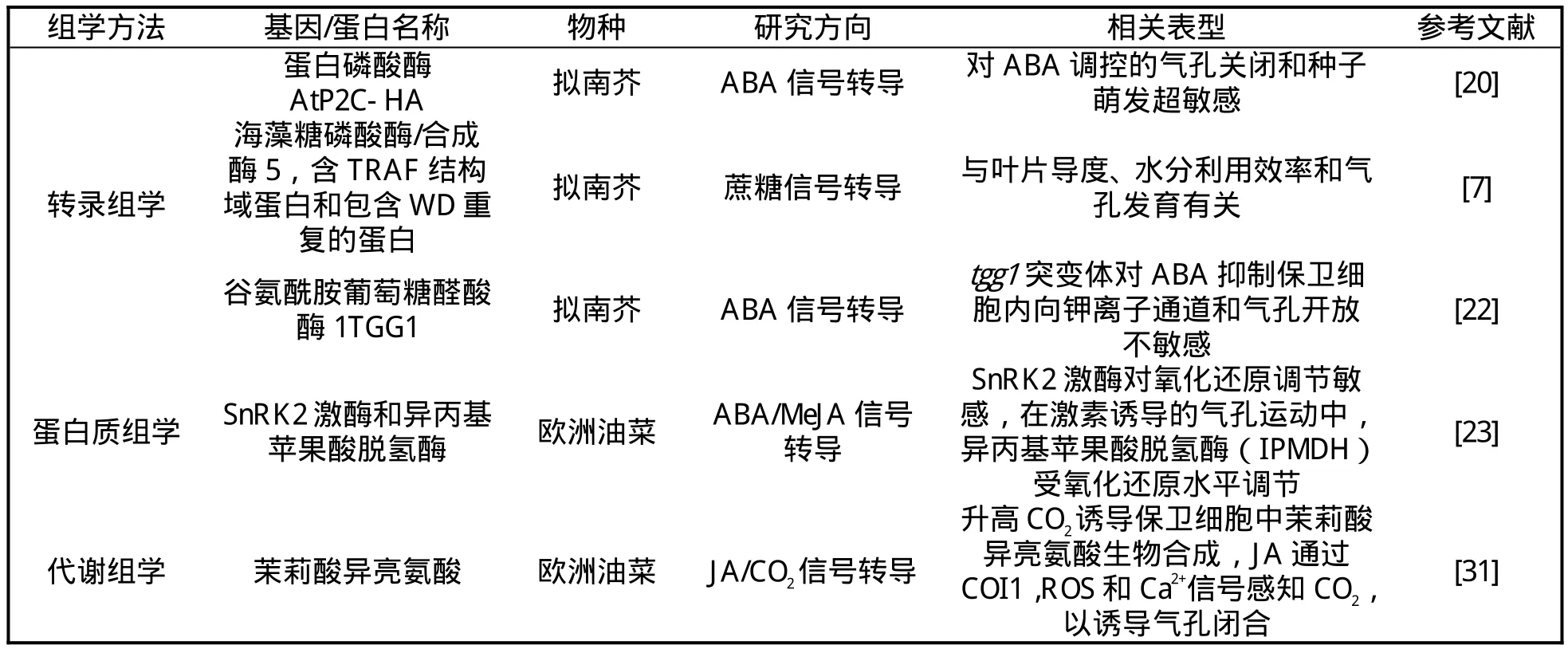
表2 组学方法鉴定的参与保卫细胞机制的基因、蛋白和代谢物
但是采用组学方法研究保卫细胞功能的机理还存在一些问题有待解决。一是组学研究通常需要大量高质量的保卫细胞,对保卫细胞分离技术的要求较高。近年来,单细胞扩增技术的发展大大减少了对细胞量的要求,推进了基因组和转录组研究,但是蛋白组和代谢组的研究仍然需要大量高质量的单一类型细胞,单细胞水平的蛋白组和代谢组方法学研究是基础研究的热点。此外,不同的保卫细胞分离处理方法对后期的研究存在影响,要根据研究需要合理确定。二是组学研究产生大量数据,对这些数据如何解读分析,组学数据与常规遗传学方法获得数据的融合,都需要生物信息学的发展来解决。进行多组学联合分析,可以大大减少误差,有利于挑选出有用信息。三是当前相关研究大多以拟南芥或油菜等双子叶植物的肾形保卫细胞为主,这些物种的表皮细胞类型较少,采用酶解密度梯度离心法可获取大量纯度较高的保卫细胞原生质体。而主要农作物的保卫细胞多为哑铃形,且保卫细胞外有大小相近的副卫细胞,表皮中还有表皮毛、硅化细胞、栓化细胞和边刺等多种其他类型细胞,保卫细胞不易从其他细胞中分离出来;另外禾谷类作物的角质层较厚,不利于酶解溶液对细胞壁的解离。分离哑铃形保卫细胞存在较大困难,单子叶植物保卫细胞机理研究仍有待深入。保卫细胞组学研究的发展,对于揭示植物细胞信号转导通路、抗逆生理基础、细胞命运决定机制以及改良作物的抗逆能力均有重要意义。
[1]Hetherington A M.Guard cell signaling[J].Cell,2001,107(6):711-714.
[2]Kim T H,Bohmer M,Hu H,et al.Guard cell signal transduction network:Advances in understanding abscisic acid,CO2,and Ca2+signaling[J].Annual Review of Plant Biology,2010,61(1):561-591.
[3]Acharya B R,Assmann S M.Hormone interactions in stomatal function[J].Plant Molecular Biology,2009,69(4):451-462.
[4]Wang J,Guo Y,Ding B,et al.Screening of stomatal mutants inArabidopsis,using a novel controlled environmental infrared imaging system[J].Plant Growth Regulation,2016,79(2):157-165.
[5]魏琳,张卫国,任柏林,等.小麦离体表皮上气孔对若干关键生理因子的应答反应[J].植物生理学报,2015,51(5):649-654.
[6]陈德龙,叶映微,刘丽红,等.植物保卫细胞的激素信号转导网络研究进展[J].核农学报,2016,30(1):65-71.
[7]Bates G W,Rosenthal D M,Sun J,et al.A Comparative study of theArabidopsis thalianaguard-cell transcriptome and its modulation by sucrose[J].Plos One,2012,7(11):e49641.
[8]Pandey S,Wang X S,Assmann S M.Preparation and applications ofArabidopsis thalianaguard cell protoplasts[J].New Phytologist,2002,153(3):517-526.
[9]Adrian J,Chang J,Ballenger C E,et al.Transcriptome dynamics of the stomatal lineage:Birth,amplification,and termination of a self-renewing population[J].Developmental Cell,2015,33(1):107-118.
[10]陈怡.高通量测序技术及其发展[J].科学中国人,2016(17):25.
[11]陈焕文,胡斌,张燮.复杂样品质谱分析技术的原理与应用[J].分析化学,2010,38(8):1069-1088.
[12]Aubry S,Aresheva O,Reyna-Liorens I,et al.A specific transcriptome signature for guard cells from the C4plant Gynandropsis gynandra[J].Plant Physiology,2016,170(3):1345-1357.
[13]Zeiger E,Helper P K.Production of guard cell protoplasts from onion and tobacco[J].Plant Physiology,1976,58(4):492-498.
[14]Nisita O,Shweta P,Maeli M.Guard cell purification and RNA isolation suitable for high-throughput transcriptional analysis of cell-type responses to biotic stresses[J].Molecular Plant-Microbe Interactions,2013,26(8):844-849.
[15]Fitzsimons P J,Weyers J D B.Separation and purification of protoplast types fromCommelina communisL.leaf epidermis[J].Journal of Experimental Botany,1983,34(1):55-66.
[16]Kruse T,Tallman G,Zeiger E.Isolation of guard cell protoplasts from mechanically prepared epidermis ofVicia fabaleaves[J].Plant Physiology,1989,90(4):1382-1386.
[17]Zhu M,Jeon B W,Geng S,et al.Preparation of epidermal peels and guard cell protoplasts for cellular,electrophysiological,and-omics assays of guard cell function,plant signal transduction[M].New York:Springer Press,2016.
[18]赵书涛,武晓东,王策,等.流式细胞仪的原理、应用及最新进展[J].现代生物医学进展,2011,11(22):4378-4381.
[19]王继玥,余庭跃,张采波.玉米转录组学研究进展[J].华北农学报,2014(S1):10-15.
[20]Leonhardt N,Kwak J M,Robert N,et al.Microarray expression analyses ofArabidopsisguard cells and isolation of a recessive ABA hypersensitive protein phosphatase 2C mutant[J].Plant Cell,2004,16(3):596-615.
[21]Wang R S,Pandey S,Li S,et al.Common and unique elements of the ABA-regulated transcriptome ofArabidopsis guard cells[J].Bmc Genomics,2011,12(1):1-24.
[22]Zhao Z,Zhang W,Stanley B A,et al.Functional proteomics ofArabidopsis thalianaguard cells uncovers new stomatal signaling pathways[J].Plant Cell,2008,20(12):3210-3226.
[23]Zhu M,Zhu N,Song W Y,et al.Thiol-based redox proteins in abscisic acid and methyl jasmonate signaling inBrassica napusguard cells[J].Plant Journal for Cell&and Molecula Biology,2014,78(3):491-515.
[24]Zhang T,Zhu M,Zhu N,et al.Identification of thioredoxin targets in guard cell enriched epidermal peels using cysTMT proteomics[J].Journal of Proteomics,2015,133:48-53.
[25]Zhu M,Simons B,Zhu N,et al.Analysis of abscisic acid responsive proteins inBrassica napusguard cells by multiplexed isobaric tagging[J].Journal of Proteomics,2009,73(4):790-805.
[26]Zhao Z,Stanley B A,Zhang W,et al.ABA-regulated G protein signaling inArabidopsisguard cells:A proteomic perspective[J].Journal of Proteome Research,2010,9(4):1637-1647.
[27]Zhu M,Dai S,Zhu N,et al.Methyl jasmonate responsive proteins inBrassica napusguard cells revealed by iTRAQ-basedquantitativeproteomics[J].Journalof Proteom Research,2012,11(7):3728-3742.
[28]王斯婷,李晓娜,王皎,等.代谢组学及其分析技术[J].药物分析杂志,2010(9):1792-1799.
[29]Jin X,Wang R S,Zhu M,et al.Abscisic acid-responsive guard cell metabolomes ofArabidopsiswild-type and gpa1 G-protein mutants[J].The Plant Cell,2013,25(12):4789-4811.
[30]Misra B B,Armas E D,Tong Z,et al.Metabolomic responses ofguard cells and mesophyllcells to bicarbonate[J].Plos One,2015,10(12):e0144206.
[31]Geng S,Misra B B,Armas E D,et al.Jasmonate-mediated stomatalclosure under elevated CO2revealed by time-resolved metabolomics[J].Plant Journal,2016,88(6):947-962.
[32]Schroeder J I,Allen G J,Hugouvieux V,et al.Guard cell signal transduction[J].Annual Review of Plant Biology,2001,52(4):627-658.
[33]Casson S A,Hetherington A M.Environmental regulation of stomatal development[J].Current Opinion in Plant Biology,2010,13(1):90-95.
[34]Murata Y,Mori I C,Munemasa S.Diverse stomatal signaling and the signal integration mechanism[J].Annual Review of Plant Biology,2015,66(66):369.
[35]刘婧,王宝山,谢先芝.植物气孔发育及其调控研究[J].遗传,2011,33(2):131-137.
