拟南芥生物钟突变体lhy、cca1营养生长时相转变
2017-03-08郭蕊傅钰龙鸿
郭蕊,傅钰,龙鸿
高等植物生长发育是一个持续的过程,其胚后发育主要经历了营养生长阶段和生殖生长阶段。营养生长是促成高等植物早期形态的必经阶段,由幼龄期和成熟期构成[1]。从幼龄期过渡到成熟期就发生了营养生长时相转变(vegetative phase change,VPC),经历这个转变后,植物才具有开花能力,从而进入生殖生长时期,完成整个生活史[2]。
高等植物VPC过程会伴随着营养生长状态的变化。模式植物拟南芥的研究表明,幼龄期的叶片边缘光滑,叶片近圆形,叶基角较小,只有近轴面表皮毛;而成熟期的叶片边缘出现锯齿,叶片近匙形,叶片基角增大,近轴面和远轴面均具有表皮毛[2]。对VPC的相关分子研究表明,MicroRNA(miRNA) precursormiR156在VPC中发挥重要作用,幼龄期表达量高,成熟期表达量低[3-5]。
植物通过内在的“钟”来应答夜长及其调控,以保证其在24 h的节律中生长发育,即所谓的生物钟[6]。LATE ELONGATED HYPOCOTYL(LHY)、CIRCADIAN CLOCK ASSOCIATED1(CCA1)和TIMING OF CABEXPRESSION1(TOC1)3个基因构成了生物钟的一个反馈环,其中LHY结合CCA1负调控TOC1表达,TOC1则正向调控LHY和CCA1表达[7]。VPC与植物自身的生物节律联系紧密,但是生物钟相关基因对VPC的影响还不清楚。本研究通过观察研究拟南芥lhy、cca1突变体的VPC过程,探讨LHY、CCA1基因对VPC的影响,为生物节律与VPC之间的关联提供试验依据。解析VPC的分子机制,对于果树生产上尽早结束幼龄期(童期)而进入成熟期,开花结果,使得果农及早受益,具有重要的理论指导意义。
1 材料与方法
1.1 材料
拟南芥Col-0生态型的种子由作物遗传改良国家重点实验室须健教授课题组惠赠,WT-Col背景下的lhy(CS811112)、cca1(SALK_067780)突变体的种子购自美国俄亥俄州立大学的Arabidopsis Biological Resource Center(ABRC)。
1.2 方法
1.2.1 种植
种子在4℃条件下处理2~3 d,打破休眠并春化,然后点种至塑料盆中,并贴好标签,盖上保鲜膜,7d后揭膜。培养条件为V营养土∶V蛭石=1∶1,并高温灭菌,用蒸馏水充分浸泡,每3 d浇水一次。培养条件为:22℃,光照培养16 h,暗培养8 h,相对湿度 60%,光照强度 180 μmol/(m2·s)。
1.2.2 形态观察
待种子长出子叶后,开始观察野生型Col-0及突变体lhy、cca1的表型。抽薹前,每天统计其莲座叶总数,最早出现远轴面表皮毛时的叶序数及莲座叶数,并观察其叶片形态变化;抽薹后,将所有莲座叶片摘下,拍照并使用DWRuler测量其叶片近轴面右侧与叶柄之间形成的叶片基角。
1.2.3 制作石蜡切片
待拟南芥长出真叶时,开始取材,按照李和平等[8]的方法进行操作,材料置于FAA固定液中固定至少24 h;梯度乙醇脱水,石蜡包埋,爱氏苏木精染色,LEICA2235轮转切片机切片,厚度为8µm,LEICA DM4000B显微镜观察,LEICA DFC450相机拍照保存。
1.2.4 荧光定量PCR
利用荧光定量PCR做基因miR156表达分析,内参基因为Actin-2。使用实时荧光定量PCR仪(BIO-RAD CFX96)和北京全式金荧光定量试剂盒(TransStartTM Top Green qPCR SuperMix)进行实验。miR156扩增采用颈环法,引物序列:Actin2-F:5′-GCTGAGAGATTCAGA TGCCCA-3′,Actin2-R:5′-GTGGATTCCAGCAGCTTCCAT ACT-3′;miR156-F:5′-CATCTTGTA GATCTC TGAAGTTGG ACT-3′,miR156-R:5′-GAGATT GAGACATAGA GAACGAAGACA-3′。
2 结果与分析
2.1 突变体的叶形与最早远轴面表皮毛出现的叶序数
通过对野生型Col-0和lhy、cca1突变体的叶形变化的观察比较了解其VPC特征。结果显示,野生型Col-0莲座叶叶片总数近为10片,前4片叶近圆形,后期叶片则呈渐长的匙形,远轴面表皮毛为第6片(第15天时)(图1-A);突变体lhy的莲座叶总数近为12片,前4片莲座叶接近圆形,后期的叶片呈渐长的匙形,远轴面表皮毛最早出现在第7片莲座叶上(第16天时)(图1-B);突变体cca1的莲座叶叶片总数近为13片,前4片莲座叶接近圆形,后期的叶片呈渐长的匙形,出现远轴面表皮毛也为第7片(第16天时)(图1-C),表明野生型Col-0和突变体lhy、cca1分别在第6、第7、7片叶时发生VPC,且突变体出现的远轴面表皮毛的时间都晚于野生型,说明lhy、cca1突变体的VPC被延迟。

图1 野生型Col-0与lhy、cca1突变体的生长发育情况及叶形图
2.2 突变体的叶片基角
在植物营养生长时期,叶片基角随着VPC的发生而产生变化。通过测量野生型Col-0和lhy、cca1突变体莲座叶的叶片基角,分别选取莲座叶的第3、6、9片的叶片基角来比较野生型和突变体的差异。结果表明,野生型Col-0和lhy、cca1突变体莲座叶的叶片基角都呈增大趋势,但是lhy、cca1突变体的叶片基角总体变化不大。在第6片莲座叶时,野生型Col-0的叶片基角为127.12°,而lhy、cca1突变体叶片基角分别为121.4°、123.52°,突变体的叶片基角都比野生型的要小,说明突变体VPC的发生时间要比野生型晚,延迟了VPC(表1)。
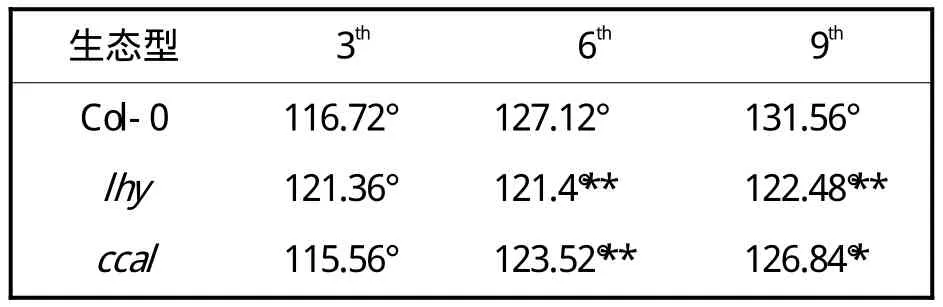
表1 野生型与突变体叶片基角的比较
2.3 茎顶端分生组织的结构特征
伴随着VPC的发生,茎顶端分生组织(shoot apical meristem,SAM)也会呈现不同的变化。结果显示,Col-0在生长第5 d时,SAM生长锥纵切面呈平坦状,细胞尚未分化(图2A),在生长第10 d时,生长锥纵切面稍有凸起,SAM的原套细胞为单层(图2B),在生长第15天时,生长锥明显凸起,原体和髓分生组织细胞分裂,数目增多(图2C),在第19天,生长锥继续生长、发育,凸起增高(图2D),在第23天时,花原基出现(图2E);lhy、cca1突变体在生长第5天时,SAM纵切面也为平坦状,细胞无分化(图2F和图2K),在生长第10天和第15天时,生长锥纵切面也开始凸起,但茎尖分生组织原套细胞为单层或双层,细胞分裂数目增多但比野生型的少(图2G、图2H和图2L、图2M),在生长第19天时,生长锥纵切面凸起较为明显,原套、原体和髓分生组织均分化、发育(图2I和图2N),在生长第25天时,植株分化出12、13片叶,花芽发育(图2J和图2O)。根据野生型和突变体茎顶端生长锥明显凸起且分化的时间,判定突变体VPC延迟,与形态学观察结果一致。
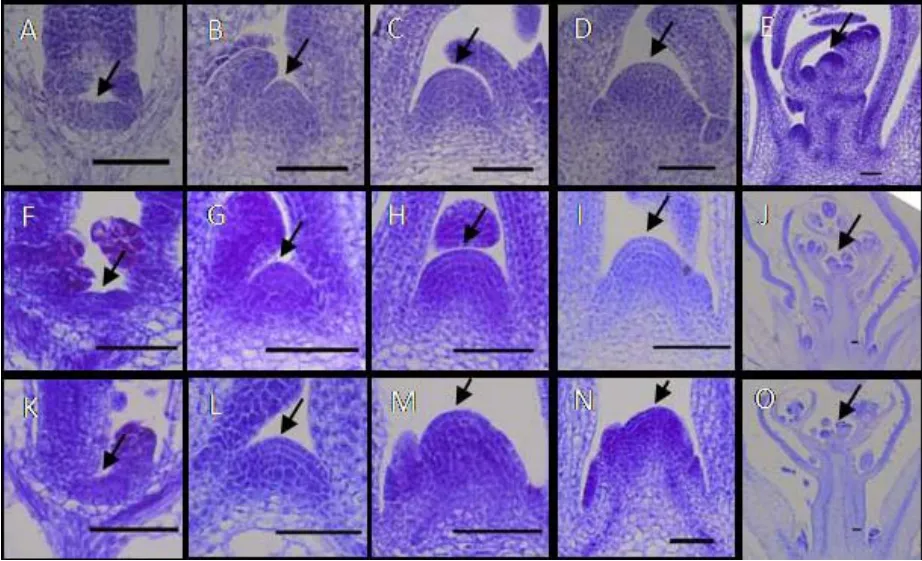
图2 野生型Col-0和lhy、cca1突变体茎顶端分生组织结构
2.4 荧光定量PCR
miR156的检测结果显示,随着植株生长发育的进程,野生型和突变体植株中的miR156表达均呈下降趋势(图3)。在第11天时,miR156在突变体lhy、cca1中的表达量均比野生型的低;Col-0植株在生长第15天时,miR156的表达量下降最快,比第11天时测定的量下降1倍多,在此时发生VPC;而在第15天时,突变体植株降低的少,说明突变体VPC发生时间在第15天和第19天之间。这些结果表明突变体相对于野生型Col-0延迟了VPC,与本研究中的其他试验(包括表型及茎尖解剖观察)结果相符。
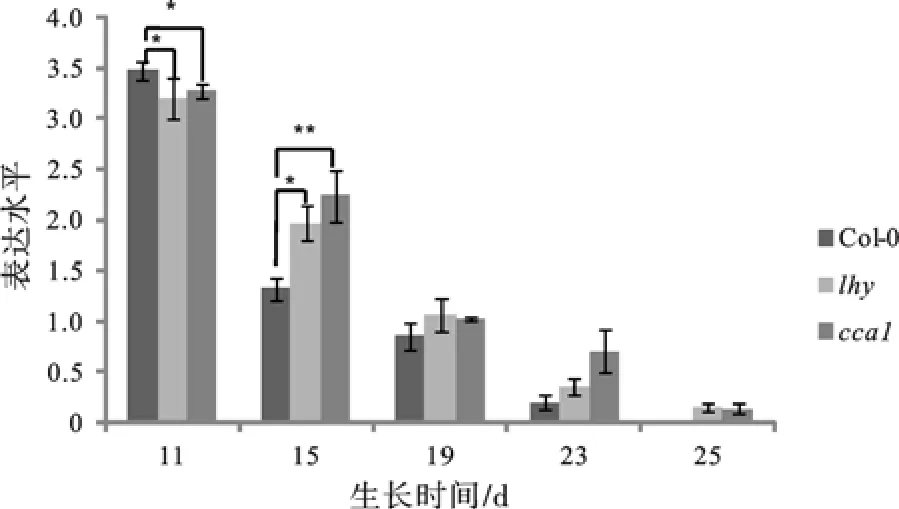
图3 Col-0与lhy、cca1不同发育过程中Q-PCR检测miR156表达
3 讨论
植物在生长发育过程中,不同的时期表现出不同的表型特征。植物生长发育过程中离不开VPC的关键作用,但是生物钟相关基因是如何影响VPC的,目前还尚未知晓。
在表型观察、解剖结构和分子水平上的试验结果表明,突变体lhy、cca1推迟了VPC发生的时间。野生型Col-0和突变体lhy、cca1分别在第6和第7、7片叶时发生VPC,突变体的VPC被延迟。此外,卢阳等[9]研究表明,突变体mgo3(CS8324)的莲座叶数目减少推迟了VPC的发生;而突变体amp1-1(SALK_034207)的莲座叶数目增多并未提前发生VPC,切除第1、2片真叶推迟了Col-0的VPC发生。本研究中,lhy和cca1突变体的莲座叶叶片总数都表现为增多,但其VPC延迟;推测突变体幼龄期产生的真叶受LHY、CCA1基因突变影响较大,数量较少,造成VPC发生延迟。在植株正常生长发育过程中伴随着叶片基角的变化,通过测量生长发育良好的野生型Col-0和lhy、cca1突变体莲座叶的叶片基角,结果也表明,突变体的叶片基角都比野生型的小,说明突变体由于发生基因突变导致了VPC的发生时间要比野生型晚,延迟了VPC。通过对野生型Col-0和生物钟相关突变体lhy、cca1的茎顶端分生组织的发育过程观察,能够清楚地了解其VPC的变化特征。结果表明,野生型Col-0在第15天左右发生VPC,而突变体lhy、cca1在第16天左右,比野生型发生的时间延后,说明突变体的VPC被推迟。通过观察SAM的发育变化,可以看到突变体SAM的原套、原体和髓分生组织发育延迟,且这种变化伴随着miR156表达量的改变。miR156检测结果也显示,野生型Col-0在第15天发生VPC,而突变体很可能在第16天发生,VPC延后,这也可以说明突变体的VPC被延迟。
研究表明,生物钟是复杂的计时系统,生成内源性周期近为24 h的节律,控制着动物睡眠或苏醒和植物的叶片运动、开花时间等活动。单一突变lhy与cca1,生物钟依然运转,说明LHY、CCA1是在生物振荡组件中发挥重要作用的必需组件。在LHY和CCA1中的紧密联系表明了它们具有功能冗余作用,在缺少CCA1时,LHY也能保持植物自身的节律[10],但同时缺少LHY和CCA1时,植物自身生物钟则不能维持[11]。生物钟调控了包括开花在内的许多生物学过程[12],lhy和cca1突变体VPC延迟的表型可能与其生物钟属性相关联。随着生长发育进程的推进,基因表达在24 h之间循环。可以推测,生物钟基因可能参与植物发育时相转变的网络调控,维持植物正常生长发育。
[1]Huijser P,Schmid M.The control of developmental phase transitions in plants[J].Development,2011,138(19):4117-4129.
[2]Poethig R S.The past,present and future of vegetative phase change[J].Plant Physio,2010,154(2):541-544.
[3]Wu G,Poethig R S.Temporal regulation of shoot development inArabidopsis thalianabymiR156and its targetSPL3[J].Development,2006,133:3539-3547.
[4]Chuck G,Cigan A M,Saeteurn K,et al.The heterochronic maize mutantCorngrass1results from overexpression of a tandem microRNA[J].Nat Genet.,2007,39:544-549.
[5]Wu G,Park M Y,Conway S R,et al.The sequential action ofmiR156andmiR172regulates developmental timing in Arabidopsis[J].Cell,2009,138:750-759.
[6]瞿礼嘉,邓兴旺.植物发育的机制[M].北京:高等教育出版社,2006.
[7]Mishra P,Panigrahi K C.GIGANTEA-an emerging story[J].Front Plant Sci,2015,6:8.
[8]李和平,龙鸿.植物显微技术[M].2版.北京:科学出版社,2009.
[9]卢阳,龙鸿.拟南芥叶片数目变化突变体对营养生长时相转变的影响[J].植物学报,2015,50(3):331-337.
[10]Matsushika A,Makino S,Kojima M,et al.The APRR1/TOC1quintet implicated in circadian rhythms of Arabidopsis thaliana:II.Characterization withCCA1-overexpressing plants[J].Plant Cell Physiol,2002,43:118-122.
[11]Rachel M G,Elaine M T.The role ofCCA1andLHYin the plant circadian clock[J].Developmental Cell,2002,2(5):516-518.
[12]Hara M,Kamada H,Mizoguchi T.CO-EXPRESSED WITH CLOCK GENES LHY AND CCA1 1(CEC1)is regulated byLHYandCCA1and plays a key role in phase setting ofGIinArabidopsis thaliana[J].Plant Biotechnology,2014,31:35-41.
