EZR、NF2基因在胃癌细胞中的表达※
2017-03-08朱雪玲沈国平巩海凤李正娥王荣华马荣华李筱月苏占海
朱雪玲,沈国平,巩海凤,李正娥,王荣华,马荣华,李筱月,苏占海#
(1.青海大学研究生院;2.青海大学医学院基础医学部;3.青海红十字医院;4.青海大学附属医院消毒供应中心;5.青海省人民医院,青海 810001)
EZR基因的编码产物为埃兹(Ezrin)蛋白,该蛋白在正常胃粘膜及肾脏、肠组织中均有表达[1],常定位于细胞皱褶、细胞伪足、微绒毛、卵裂沟及收缩环[2],与细胞骨架重组,细胞生存、粘附、迁移及侵袭有关[3]。当细胞粘附、迁移及侵袭能力改变时,可导致肿瘤的发生[4]。有研究表明,Ezrin蛋白在乳腺癌、前列腺癌、骨肉瘤、横纹肌肉瘤及胰腺癌中高表达[5]。NF2基因又称神经纤维瘤Ⅱ型基因,是一个抑癌基因,其编码产物为默林(Merlin)蛋白,该蛋白有十多个亚型,以Merlin-1和Merlin-2为主,其中Merlin-1的氨基端和羧基端可形成首尾相连的结构,具有肿瘤抑制作用[6-7]。有研究表明,NF2基因突变或缺失会导致神经纤维瘤、脑膜瘤、室管膜瘤、双侧前庭神经瘤等多种中枢神经系统肿瘤的发生[8]。此外,NF2基因突变还与肺癌、间皮瘤、黑色素瘤、肾透明细胞癌等非神经系统肿瘤的发生有关[9-12]。有研究表明,不同肿瘤组织中Merlin蛋白表达量的变化是不同的,如在非小细胞肺癌、原发性肝癌中Merlin蛋白高表达[13-14],而在乳腺癌、多形性胶质细胞瘤中低表达[15-16]。目前关于EZR基因在胃癌中表达量变化的研究结果并不一致,张俊会和张汀荣采用原位杂交、免疫组化法分别检测胃癌中ezrin mRNA及蛋白的表达,结果显示胃癌中ezrin表达减低[17-18],而马洪宇等的研究认为胃癌中其表达增加[19-20]。有关NF2基因在胃癌中表达的研究较少,主要采用免疫组化法进行检测,尚未有在转录水平检测胃癌中NF2基因表达的报道。本研究采用RT-PCR、Western blot法从转录水平和翻译水平检测EZR、NF2基因在胃癌细胞BGC-823和正常胃粘膜细胞GES-1中的表达,探讨EZR、NF2基因的表达与胃癌发生的关系。
1 材料与方法
1.1 研究对象
以购自武汉普诺赛生命科技有限公司的正常胃粘膜细胞株GES-1作对照组细胞株、胃癌细胞株BGC-823作实验组细胞株。
1.2 试剂与仪器
1640培养基(Hyclone,美国);Hepes缓冲液、青霉素/链霉素双抗、1×PBS缓冲液、0.25%胰酶-EDTA消化液、Tween 20(北京索莱宝,中国);胎牛血清(Thermo,美国);组织/细胞总RNA提取试剂盒、反转录试剂盒、2×Taq PCR MasterMix、6×DNA Loding Buffer(北京天根,中国);50×TAE缓冲液、琼脂糖(上海生工,中国);总蛋白提取试剂盒(南京凯基,中国);Briford法蛋白定量试剂盒、丙烯酰胺/双丙烯酰胺凝胶(SDS-PAGE)试剂盒、SDS-PAGE电泳液、Western转膜液、ECL发光液、辣根过氧化物酶标记的山羊抗兔的二抗(上海碧云天,中国);5×蛋白上样缓冲液(北京普利莱,中国);脱脂奶粉(内蒙古伊利,中国);兔抗人merlin、ezrin、β-actin单抗(abcam,美国)。细胞培养箱、Nano Drop 2000(Gene Company,美国);低温冷冻离心机(eppendrof,德国);DYY-7C型电泳仪(北京六一,中国);琼脂糖凝胶电泳成像仪(Azure biosystem,美国);TY-80型脱色摇床(江苏金坛,中国);酶标仪、普通PCR扩增仪、SDS-PAGE电泳槽、Western转膜仪(Bio Rad,美国);Fusion Solo化学发光成像系统(Vilber,法国)。
1.3 实验方法
1.3.1 细胞培养
1.3.2 细胞中总RNA的提取及cDNA模板制备
取富集度达80%的正常胃粘膜细胞GES-1和胃癌细胞BGC-823,去除旧的培养基,以1×PBS缓冲液洗涤细胞2次,加入2 mL 0.25%胰酶-EDTA消化液,消化3 min左右,加入10 mL完全培养基终止消化,轻柔吹打细胞使其均匀悬浮,取3 mL细胞悬液分两次于1.5 mL无RNA酶的离心管中离心(4℃,1000r/min)5 min,除培养基,加入1.5 mL 1×PBS缓冲液冲洗细胞两次,以去除残余的培养基。按组织/细胞总RNA提取试剂盒的操作步骤提取两株细胞中的总RNA。利用Nano Drop 2000测定RNA的浓度及纯度(A260/280在1.8~2.0之间提示RNA的纯度较高)。同时,通过1%琼脂糖凝胶电泳检测RNA的完整性。RNA完整验证图见图1。将纯度较高、完整性良好的RNA反转录为cDNA,于-20 ℃保存。

图1RNA完整性验证图
Figure1RNAintegrityverification
1.3.3 目的基因的PCR扩增
根据实验内容确认内参基因β-actin上游引物序列为5′-TCTACAATGAGCTGCGTGTGG-3′,下游引物序列为5′-GGAACCGCTCATTGCCAATG-3′,目的片段大小为496 bp[21]。EZR基因的上游引物序列为5′-TAGAGGCTGACCGTATGGCT-3′,下游引物序列为5′-TGTGCTGCCACTCTTCAACTT-3′,扩增片段大小为178 bp[22]。NF2基因上游引物序列为5′-CCCCAGTGTTCACAAGCG-3′,下游引物序列为5′-CAGTCTGTTCTCAGGGTCATA-3′,目的片段大小为289 bp[22]。引物由上海生工生物有限公司合成。PCR反应条件为95 ℃预变性3 min,95 ℃ 30 s,Tm 45 s,72 ℃ 45 s,35个循环,72 ℃延伸7 min(NF2、EZR基因的Tm为56℃,内参基因β-actin的Tm为58℃)。PCR反应体系见表1。以2 %琼脂糖凝胶电泳检测PCR产物,凝胶成像系统记录结果,应用Fusion软件测定各组目的基因及内参基因PCR电泳图的灰度值。
表1 PCR反应体系
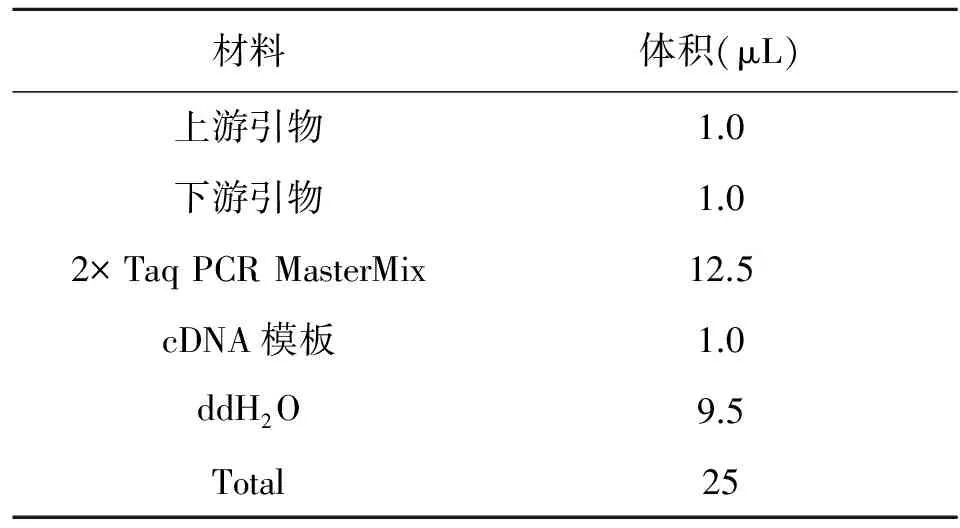
Table 1 The PCR reaction system
1.3.4 细胞中总蛋白的提取及蛋白定量检测
按照每1 mL Lysis Buffer中加入10 μL磷酸酶抑制剂、1 μL蛋白酶抑制剂、10 μL 100 mM苯甲基磺酰氟(PMSF)的比例配制4 mL裂解液,混匀,置冰上备用。弃去富集度为80%的正常胃粘膜细胞GES-1、胃癌细胞BGC-823中的旧培养基,用预冷的1×PBS缓冲液洗涤细胞2次,向各培养瓶中加入2 mL裂解液,置于脱色摇床上震荡30 s后,置冰上静置4 min,重复5次,使细胞充分裂解,将所得液体和沉淀移入预冷的2 mL离心管中离心(4℃,12000r/min)10 min,吸取得到的上清液即为细胞总蛋白。采用Briford法测定蛋白样品的浓度后,分装保存于-80 ℃冰箱。
1.3.5 Western blot蛋白表达检测
1.4 统计学方法
2 结果
2.1 转录水平目的基因表达的检测
以反转录所得的cDNA为模板,进行PCR扩增,用2%的琼脂糖凝胶电泳检测目的基因及内参基因的扩增情况。目的基因及内参基因扩增条带清晰,目的条带大小吻合,提示扩增成功,见图2。灰度值分析结果显示,转录水平EZR基因在胃癌细胞BGC-823中的表达量为1.46±0.39,正常胃粘膜细胞GES-1中的表达量为0.69±0.28,EZR基因在BGC-823、GES-1中的表达量存在差异(P<0.05),EZR基因在BGC-823中的表达量高于GES-1。NF2基因在BGC-823中的表达量为1.46±0.48,GES-1中的表达量为0.65±0.25,该基因在两株细胞中的表达量存在差异(P<0.05),其在BGC-823中表达量较GES-1中的表达量高,见表2。
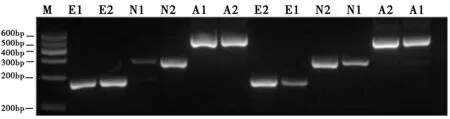
(M:Marker;E:EZR;N:NF2;A:Actin;1:GES-1;2:BGC-823)
图2BGC-823和GES-1中EZR/NF2mRNA的表达图
Figure2TheexpressionofEZR/NF2mRNAinBGC-823andGES-1cells
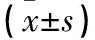

Table 2 The expression of EZR/NF2 mRNA in BGC-823 and GES-1 cells(±s)
2.2 翻译水平目的基因表达的检测
Western blot结果显示,Ezrin蛋白和Merlin蛋白在胃癌细胞BGC-823和正常胃粘膜细胞GES-1中均有表达,见图3。灰度值分析结果显示,Ezrin蛋白在BGC-823中的表达量为1.48±0.29,在GES-1为0.77±0.13,Ezrin蛋白在BGC-823和GES-1中的表达量存在差异(P<0.05),其在BGC-823中的表达量比在GES-1中的表达量高。Merlin蛋白在胃癌细胞BGC-823中的表达量为1.43±0.41,在正常胃粘膜细胞GES-1中的表达量为0.70±0.16,Merlin蛋白在BGC-823和GES-1中的表达量存在差异(P<0.05),其在BGC-823中的表达量高于GES-1中的表达量,见表3。
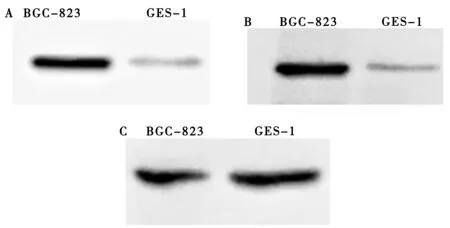
A:Ezrin B:Merlin C:Actin
图3BGC-823和GES-1中ezrin/merlin蛋白的表达图
Figure3TheexpressionofEzrin/MerlinproteininBGC-823andGES-1cells
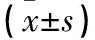

Table 3 The expression of Ezrin/Merlin protein in BGC-823 and GES-1 cells(±s)
3 讨论
本研究结果显示,EZR基因在胃癌细胞及正常胃粘膜细胞均有表达,且在胃癌细胞中的表达量增加,这与史荣亮等人在5株不同胃癌细胞株及胃癌组织中的研究结果一致[19-20,23],提示ezrin表达与胃癌的发生有关。但与张俊会和张汀荣的研究结果不一致,提示Ezrin的表达虽然与胃癌发生有关,但其在胃癌中的表达量不一定增加,胃癌的发生可能还与Ezrin生物学活性的增强有关,具体机制需进一步研究。
抑癌基因NF2位于22号染色体,其编码产物Merlin与4.1蛋白家族的其他成员Ezrin、根蛋白(Radxin)、膜突蛋白(Moesin)具有相似的结构,不同的是Merlin的羧基末端不具有与肌动蛋白(F-actin)相结合的区域,而在其氨基末端存在与actin结合的结构域,可与其他4.1蛋白家族成员结合调节其活性[24]。此外Merlin蛋白还可通过与cdc42、Rac1、PI3K等分子相互作用调节PI3K/mTOR/Akt、Hippo等信号途径,从而调节细胞的生存、增殖能力,发挥其肿瘤抑制作用[25]。有研究表明Merlin的高表达与原发性肝癌、非小细胞肺癌、子宫颈鳞状细胞癌、胰腺癌等肿瘤的发生有关[13-14,21,26]。本研究在转录、翻译水平检测胃癌细胞中Merlin的表达,结果显示,Merlin在胃癌细胞中的表达高于正常胃粘膜细胞,与前期我们采用免疫组化法检测青海藏族胃癌组织中Merlin蛋白表达的结果相同,提示Merlin的表达与胃癌的发生有关。此外我们前期的研究表明,Merlin蛋白在青海藏族胃癌中表达量的变化与胃癌的分化程度、组织学分型、有无淋巴结转移有关,本研究的结论是在细胞水平上得出的,并未分析Merlin的表达与胃癌临床病理特征的关系,要将研究结果推广还需大量收集胃癌组织结合临床病理资料进行进一步分析,为胃癌的早期诊断及预后评价提供可靠依据。
[1]Kawaguchi K,Yoshida S,Hatano R,et al.Pathophysiological roles of ezrin/radxin/moesin proteins[J].Biol and Pharm Bull,2017,40(4):381-390.
[2]Wakayama T,Nakata H,Kurobo M,et al.Expression,location,and binding activity of ezrin/radxin/moesin proteins in the mouse tissues[J].Histochem Cytochem,2009,57(4):351-362.
[3]Pore D,Gupta N.The ezrin-radxin-moesin family of proteins in the regulation of B-cell immune response[J].Crit Rev Immunol,2015,35(1):15-31.
[4]Andrew B,Gladden,Alan M,et al.The NF2 tumor suppressor,Merlin,regulates epidermal development through the establishment of a junction polarity comply[J].Dev Cell,2010,19(5):727-739.
[5]Clucas J,Valderrama.F.ERM proteins in cancer progression[J].Cell Sci,2015,128(6):267-275.
[6]Bianchi AB,Hera T,Ramesh V,et al.Mutation in transcript isoform of the neurofibromatosis 2 gene in multiple human tumor types[J].Nat Genet,1994,6(2):185-192.
[7]Sherman L,Xu HM,Geist RT,et al.Interdomain binding mediates tumor growth suppression by the NF2 gene product[J].Oncogene,1997,15(20):2505-2509.
[8]Ahronowitz I,Xin W,Kiely R,et al.Mutational specturum of the NF2 gene:a meta analysis of 12 years of research and diagnose laboratory findings[J].Hum Mutat,2007,28(1):1-12.
[9]Yoo NJ,Park SW,Lee SH.Mutational analysis of tumor suppressor gene NF2 in common solider cancers and acute leukemia[J].Pathology,2012,44(1):29-32.
[10]Bianchi AB,Mitsunaga SI,Cheng JQ,et al.High frequency of inactivating mutation in the neurofibromatosis type 2 gene(NF2)in primary malignant mesotheliomas[J].Pro Natl Acad Sci,1995,92(24):10854-10858.
[11]Murray LB,Lau YK,Yu Q.Merlin is a negative regulator of human melanoma growth[J].PLoS One,2012,7(8):e43295.
[12]Dalgliesh GL,Furge K,Greenman C,et al.Systematic sequencing of renal carcinoma reveals inactivation of histone modifying genes[J].Nature,2010,463(7279):360-363.
[13]胡剑鹏,王理,喻风雷.Merlin蛋白在非小细胞肺癌中的表达及临床意义[J].中南大学学报(医学版),2011,36(6):565-569.
[14]赵璋,吕婷霞,张宁,等.NF2/Merlin在原发性肝癌中的表达及临床意义的研究[J].临床和实验医学杂志,2015,14(7):535-538.
[15]韩琳琳,侯玲,宋金莲,等.NF2基因甲基化及其mRNA表达与乳腺癌发病的关系(英文)[J].现代生物医学进展,2009,9(24):4708-4711.
[16]Lau KY,Murry LB,Houshmandi SS,et al.Merlin is a potent inhibitor of glioma growth[J].Cancer Res,2008,68(14):5733-5742.
[17]张俊会.胃癌中ezrin基因的表达及其CpG岛甲基化检测[D].兰州大学,2007.
[18]张汀荣.胃癌组织中Ezrin表达及其意义[J].实用临床医药杂志,2013,17(5):33-35.
[19]马洪宇,郭文伟,栗敏,等.Ezrin蛋白在胃癌组织中的表达及其意义[J].医药论坛杂志,2010,31(1):83-84.
[20]徐丽,崔雪花,于开文,等.Ezrin蛋白在胃癌组织中的表达及其意义[J].延边大学医学学报,2012,35(3):160-162.
[21]林玲.Ezrin和Moesin在宫颈鳞癌组织和SiHa细胞表达的研究[D].福建医科大学,2008.
[22]钟莉娉.Dadixin和Merlin在子宫颈鳞状细胞癌组织的表达及临床意义[D].福建医科大学,2009.
[23]史荣亮,李建芳,翟颖,等.肿瘤转移相关基因ezrin在胃癌中的表达及意义[J].中华胃肠外科杂志,2006,9(5):433-435.
[24]Xu HM,Gutmann DH.Merlin differentially associates with the microtubule and actin cytoskeleton[J].Neuroscience Research,1998,51(3):403-415.
[25]Petrill AM,Fernandez Valle C.Role of Merlin/NF2 inactivation in tumor biology[J].Oncogene,2016,35(5):537-548.
[26]陶可涛,周家华,郑杰.ezrin和Merlin基因在胰腺癌细胞中的表达及意义[J].东南大学学报,2009,28(4):307-311.
