慢性低氧暴露对血小板活化及其分泌的炎性因子水平的影响※
2017-03-08尚春香乌仁塔娜南星梅格日力
尚春香,乌仁塔娜,南星梅,格日力
(青海大学高原医学研究中心)
对低氧信号通路的相关研究发现,低氧与炎症密切相关,低氧可以诱导炎症发生,同时炎症可以加重缺氧。近年来的研究显示,低氧可以通过诱导血小板活化参与一些疾病的发生和发展,但目前尚不明确低氧诱导的炎性疾病是否与血小板相关。本研究拟通过观察慢性低氧暴露对血小板活化及其分泌的炎性因子水平的影响,探讨血小板分泌的炎性因子是否与高海拔低氧诱导的炎症损伤相关。
1 资料与方法
1.1 一般资料
1.1.1 实验动物及分组
将60只清洁级雄性SD大鼠(180~200g,6周龄,北京维通利华实验动物技术有限公司)随机平均分为三组,平原组(北京,海拔50m),中度海拔组(西宁,海拔2260m),特高海拔组(低压氧舱模拟,海拔5000m)。中度海拔组和特高海拔组大鼠从北京空运至西宁的当天分别放置在动物饲养中心和低压氧舱室(模拟海拔5000m),两组大鼠饲养30天后,所有大鼠称重后在氯胺酮麻醉状态下从腹主动脉取血行血气分析、全血细胞计数检测;分离富血小板血浆(PRP)和制备血小板悬液。平原组大鼠在北京大学生命科学院生理实验室称重麻醉后从腹主动脉取血行血气分析、全血细胞计数检测;分离PRP。
1.1.2 主要试剂与仪器
低压氧舱室(贵州风雷航空机械有限公司,型号:DYC-3000,体积:8m×3m×3m),BC-2300全自动血细胞分析仪(深圳迈瑞生物医疗电子有限公司),全自动酶标酶标仪、流式细胞仪(FACScan型美国Dickinson公司)。PE-CD62p抗体(Bioledgend)、PerCP-CD61(Novus)、ADP(Sigma)、p-select检测ELISA试剂盒,CD40检测ELISA试剂盒,CD40L检测ELISA试剂盒,PAF检测ELISA试剂盒,HIF-1a检测ELISA试剂盒(购自南京建成生物工程研究所)。
1.2 实验方法
1.2.1 血气和全血细胞分析
三组大鼠分别称重后,在氯胺酮麻醉状态下用动脉血气针从腹主动脉抽取2 mL动脉血立即行血气分析,之后用EDTA抗凝管采集2 mL动脉血在1 h内完成全血细胞分析。
1.2.2 血小板相关炎性因子测定
1.2.3 血小板悬液制备
1.2.4 流式细胞仪检测
血小板表面CD62P的阳性率:Falcon试管中加入PE-CD62P抗体和PerCP-CD61抗体各20 μL,然后加入血小板悬液100 μL和血小板激动剂二磷酸腺苷(ADP,10μmol/L)避光孵育15 min,之后加入1 mL PBS溶液洗涤、离心(1500r/min)5 min,弃去上清液,加入500 μL PBS,半小时内用流式细胞仪检测,在CD61 vs SSC 点图中设门,找到 CD61 阳性的血小板群门,门内收集10 000个细胞,结果以血小板CD62P阳性百分率表示。
1.3 统计学方法
2 结果
2.1 三组大鼠一般状态观察
平原组和中海拔组大鼠进食和活动正常,状态良好,高海拔组大鼠进入低压氧舱后进食和活动量减少,体重增长速度与其他两组相比有所下降,但统计学无差异。
2.2 三组不同海拔大鼠血细胞分析和血气分析
三组不同海拔大鼠中性粒细胞计数无统计学差异,特高海拔组和中海拔组大鼠的RBC、Hb、HCT、MPV和PDW均高于平原组(P<0.05),且计数随着海拔高度的升高而升高,特高海拔组和中海拔组与平原组比较有统计学差异(P<0.05)。PLT计数随着海拔高度的升高而下降,特高海拔组和中海拔组与平原组比较有统计学差异(P<0.05)。血气分析结果显示,三组大鼠的PaO2和Sa02值随着海拔高度升高而下降,特高海拔组和中海拔组大鼠的PaO2和Sa02值与平原组比较有统计学差异(P<0.05)。详细数据见表1。
Table 1 Total blood cell count and arterial blood gas analysis among 3 groups of different altitude rats(±s)
2.3 平原组和特高海拔组大鼠PRP中血小板分泌的炎性因子检测
特高海拔大鼠PAF、p-select、CD40、CD40L和HIF-1a的表达水平均高于平原组,有统计学差异(P<0.05)。详细数据见表2。
Table 2 The express of HIF-1a and platelet derived inflammation factor in 2 groups of different altitude rats′ PRP(±s)
2.4 中海拔组和特高海拔组大鼠血小板活性比较
特高海拔大鼠血小板CD62P阳性率在给予激活剂ADP之前(14.96±0.95VS 7.75±1.29)和之后(10.31±1.38VS 20.25±2.39)都高于中海拔组,差异有统计学意义(P<0.05)。见图1。
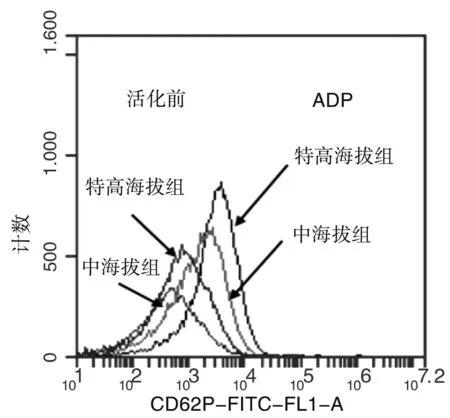
Figure1TheexpressionpositiverateofCD62Pbetween2groupsofdifferentaltituderats
3 讨论
高原低氧环境对人体多系统多脏器造成损伤致各种高原性疾病,包括心血管、中枢神经和呼吸系统的疾病,近年来的研究发现高原低氧环境还可以引起急慢性炎症反应。刘厚东等[1]的研究显示,急进高原人群由于低氧暴露后可以引起白细胞和中性粒细胞增加,血液中IL-1、IL-6、TNF-a和PAF等炎性介质含量增加,而机体这种炎性改变可以导致胃肠道粘膜屏障的损伤,出现胃黏膜出血、糜烂和溃疡形成。而李木成等[2]的研究显示,急进高原发生高原肺水肿的患者,体内细胞由于严重缺氧发生变性产生自身抗原,刺激机体产生大量IgG、IgM并激活补体,促使肥大细胞释放大量组胺导致高原肺水肿的发生。这些研究提示,低氧致机体的防御功能损伤,使炎性免疫疾病发生。近年来的研究发现,血小板在炎症和免疫反应中也发挥着重要作用,与炎症性肠病、动脉粥样硬化症和疟疾感染等发生相关[3-5]。渠晶等[6]的研究显示,体内活化状态的血小板表面CD40L与内皮细胞炎性因子释放相关,并参与动脉粥样硬化的发生发展过程。患有炎症性肠病的患者体内血小板活化标志物P-select和CD40L表达水平显著增高,同时血浆内PF4、sCD40L和β-TG的表达均增高。而高原低氧环境对血小板活化也有影响。TarunTyagi等[7]的研究显示,高海拔急性低氧可以引起血小板数目减少、血小板活性增强,从而导致静脉血栓发生。T.Lehmann等[8]的研究发现,血小板活化与高原肺水肿的发生相关。Inder Singh[9]的研究显示,高原肺动脉高压患者体内血小板活性增强,血小板聚集功能较平原组居住高海拔地区无肺动脉高压者明显增强,而且发生肺动脉高压患者的血小板数目升高。这些研究说明高原低氧环境可以诱导血小板活性增高,诱发高原急慢性疾病的发生,但血小板活化后是否参与了高原低氧环境导致的炎症性疾病目前鲜有研究。因此,我们的研究对比了不同海拔条件下血小板活化程度及血小板分泌的炎性因子表达水平。
本研究结果显示,三组不同海拔高度大鼠Hb比较有统计学差异,特高海拔组明显高于中海拔组和平原组。此外,血气分析提示Sa02随着海拔高度的升高明显下降,说明特高海拔组大鼠模型构建成功,可适用于本研究。不同海拔组大鼠血小板计数有统计学差异,血小板计数随着海拔高度增高而下降,特高海拔组和中海拔组分别与平原组大鼠比较有统计学差异,而且特高海拔组与中海拔组比较也有统计学差异,这和既往研究结果一致[10]。此外,MPV和PDW三组比较有差异,其中特高海拔组、中海拔组与平原组比较有统计学差异,而特高海拔组与中海拔组比较均无差异。
通常情况下血小板处于静止的状态,血小板活化后具有释放大量促炎作用蛋白分子(P-select、CD40L、CD40、PAF、IL-1β等炎性介质)的特性,这些物质参与血小板-内皮细胞和血小板-中性粒细胞反应从而促使炎性疾病的发生和发展。P-select(CD62P)是血小板胞内a颗粒的膜糖蛋白,静止期的血小板不表达CD62P,血小板活化后CD62P暴露于血小板膜表面。因此,CD62P被认为是血小板活化的标记物。我们用流式细胞仪检测了特高海拔组和中海拔组大鼠血小板CD62P的阳性表达率,特高海拔组大鼠CD62P的表达明显高于中海拔组,差异有统计学意义,说明低氧可以诱导血小板活化且随着海拔的升高被活化程度越明显。CD62P可以与单核细胞及中性粒细胞上相应的受体PSGL-1相互作用,使血小板聚集在这些细胞周围并粘附至血管内皮细胞触发一系列促炎反应[11]。临床上P-select和可溶性P-select可以作为脓毒血症早期识别的生物标志物[12]。而CD40L-CD40介导的血管壁炎症反应在心血管疾病中发挥着重要作用。健康人血小板在体外经诱导活化后,CD40L的表达增加,并与内皮细胞表面的CD40结合后促使内皮细胞表达相关炎性因子[13]。PAF是一种强效的内源性磷酯类介质,在内毒素血症、过敏性哮喘和急性炎症等疾病的病理生理过程中发挥着重要作用。本研究对比了特高海拔组大鼠和平原组大鼠PRP中P-select和CD40L、CD40、PAF的表达水平,结果显示特高海拔组大鼠PRP中上述炎性因子表达水平均高于平原组大鼠,且有统计学差异。既往研究也显示低氧环境可以诱导P-select和CD40L、CD40、PAF的表达水平增高[14-17],这与我们的研究结果一致。尽管目前结果不能确定血小板分泌的炎性因子具体参与了哪种高海拔低压低氧环境诱导的炎性疾病,但是我们的研究结果首次提示血小板活化可能参与了高海拔低压低氧导致的炎性疾病。
总之,高原低氧环境可以诱导血小板活化,而活化的血小板可以分泌一些炎症介质,这些炎症介质有可能参与了与低氧相关的炎性疾病的发生和发展,这为我们今后治疗与低氧相关的炎性疾病提供了新的思路,抗血小板药物在治疗这类疾病时可能会发挥特殊的作用。
[1]刘厚东,郑必海,孙泽平,等.急进高原个体机体炎性改变及其胃肠黏膜屏障损伤情况分析[J].现代医药卫生,2011,27(20):3071-3073.
[2]李木成,王鹿朝,刘斌,等.高原肺水肿患者血液中体液免疫物质的含量变化及其意义[J].解放军医学杂志,1997,22(3):201-202.
[3]Gerdes N,Seijkens T,Lievens D,et al.Platelet CD40 exacerbates atherosclerosis by transcellular activation of endothelial cells and leukocytes[J].Arterioscler ThrombVascBiol,2016,36(3):482-490.
[4]MenchénL,Marín-JiménezI,Arias-SalgadoEG,et al.Matrix metalloproteinase9 is involved in Crohn′s disease associatedplatelet hyperactivation through the release of soluble CD40 ligand[J].Gut,2009,58(7):920-928.
[5]McMorran BJ,Marshall VM,de Graaf C,et al.Platelets kill intraerythrocytic malarial parasites and mediate survival to infection[J].Science,2009,323(5915):797-800.
[6]渠晶,赵爱平,丁卜同,等.体内活化血小板表达CD40L及其对内皮细胞表达炎性因子的影响[J].山东大学学报,2014,52(7):75-78.
[7]TarunTyagi,Shadab Ahmad,Neha Gupta,et al.Altered expression of platelet proteins and calpain activity mediate hypoxia-induced prothrombotic phenotype[J].Blood,2014,123(8):1250-1260.
[8]Lehmann T,Mairbäurl H,Pleisch B,et al.Platelet count and function at high altitude and in high-altitude pulmonary edema[J].J ApplPhysiol,2006,100(2):690-694.
[9]Singh I,Chohan IS.Blood coagulation changes at high altitude predisposing to pulmonary hypertension[J].Br Heart J,1972,34(6):611-617.
[10]Nakanishi K,Tajima F,Nakata Y,et al.Hypercoagulable state in a hypobaric,hypoxic environment causes non-bacterial thrombotic endocarditis in rats[J].J Pathol,181(3),338-346.
[11]Van Gils JM,Zwaginga JJ,Hordijk PL.Molecular and functional interactions among monocytes,platelets,and endothelial cells and their relevance for cardiovascular diseases[J].J LeukocBiol,2009,85(2):195-204.
[12]Adamzik M,Görlinger K,Peters J,et al.Whole blood impedance aggregometry as a biomarker for the diagnosis and prognosis of severe sepsis[J].Crit Care,2012,16(5):2-12.
[13]Henn V,Slupsky J R,Gräfe M.CD40 ligand on activated platelets triggers an inflammatory reaction of endothelialcells[J].Nature,1998,391(6667):591-594.
[14]Bhogal RH,Weston CJ,Curbishley SM,et al.Activation of CD40 with platelet derived CD154 promotes reactive oxygen species dependent death of human hepatocytes during hypoxia and reoxygenation[J].PloS one,2012,7(1):1-10.
[15]ChakrabartiS,RizviM,PathakD,et al.Hypoxia influences CD40-CD40L mediated inflammation in endothelial and monocytic cells[J].Immunology letters,2009,122(2):170-184.
[16]郑必海,李素芝,闫春城.高原急性缺氧致急性胃肠道黏膜损伤及其机制探讨[J].华南国防医学杂志,2011(25):4-7.
[17]Grissom CK,Zimmerman GA,Whatley RE.Endothelial Selectins in Acute MountainSickness and High-Altitude PulmonaryEdema[J].Chest,1997,112(6):1572-1578
