多房棘球蚴表面抗原EMY162的原核表达及抗体制备※
2017-03-08李润乐刘川川杨全余
冯 琳,李润乐,刘川川,廖 瑜,杨全余*,汤 锋,3**
(1.青海大学医学院高原医学研究中心,青海 西宁 810001;2.青海大学医学院临床医学系,青海 西宁 810001;3.青海大学高原人畜共患病研究所,青海 西宁 810001)
泡型包虫病又称多房棘球蚴病(Alveolar Echinocococosis,AE)。由于多房棘球蚴生长缓慢,且成浸润性生长,感染后一般潜伏期较长。目前尚缺乏有效的针对泡型包虫病行之有效的早期诊断方法,包虫病的诊断依然依赖B超、CT等影像学方法,往往经影像学确诊的病人已经进入晚期。并且目前对于多房棘球蚴病灶边缘带的判断并无明确界定[1],即便进行临床手术也只能依据影像学所显示的病灶“解剖学边界”实施病灶切除,造成部分病灶切除后病情仍会反复[2]。
EMY162是由日本学者Katoh等首次发现并命名[3],后续研究证实EMY162表达于绦虫的四个阶段(原头节、续绦、幼虫和成虫)的虫体蛋白[4]。基于上述内容本课题采用基于PAS(PCR-based Accurate Synthesis)的方法合成目的基因EMY162,并将其克隆入表达载体pCzn1后,将获得的重组质粒pCzn1-EMY162克隆入Arctic Express,经IPTG诱导蛋白表达后利用亲和层析(Ni 柱)获得目的蛋白后将纯化的目的蛋白EMY162免疫新西兰白兔,亲和纯化获得多克隆抗体并对该抗体进行了效价与纯度的考察。
1 材料与方法
1.1 材料
pCzn 1载体、Arctic Express菌株(由钟鼎生物保种);限制性内切酶Nde Ⅰ、Xba Ⅰ、T4 DNA连接酶(购自Takara公司);质粒提取试剂盒、DNA纯化回收试剂盒和琼脂糖凝胶电泳材料、蛋白胨、酵母粉、氯化钠、氨苄青霉素、异丙基硫代半乳糖苷、卡那霉素(上海生物工程技术服务有限责任公司);Ni-IDA-Sepharose(南京金斯瑞生物科技有限公司,CL-6B);Protein Marker(Thermo 公司);Acr、Bis、Tris和弗氏佐剂(购自 Sigma 公司);SDS、TEMED(购自 BIO-RAD 公司);封闭液、包被液、显色液、Tyrptone、Yeast Extract(购自 OXOID 公司)[5]。
1.2 方法
1.2.1 pCzn1-EMY162质粒构建
参照前期实验方法[5],将OptimumTM Codon软件用于大肠杆菌密码子偏爱性优化,以获得更适合大肠杆菌表达系统的碱基序列,并添加限制性内切酶Nde Ⅰ和Xba Ⅰ酶切位点,酶切位点及pCzn1-EMY162基因序列如下:
CATATGGAAGAGGTTGGTGTAGACCCGGAACT
GATTGCGAAACTGACGAAGAAATTACAGACGACTCT
CCCGGAACATTTTCGCTGGATTCATGTAGGCTCCCG
TAGCCTGGAACTGGGCTGGAATGCGACAGGTCTGGC
CAACCTCCATGCGGATCATATTAAACTGACCGCGAAT
CTGTACACCACATACGTGAGCTTTCGCTATCGCAACG
TGCCGATTGAACGCCAAAAACTCACCCTGGAGGGCT
TGAAACCATCAACCTTCTATGAGGTCGTGGTTCAAGC
AGATCGCGCCGGCGGTTTCGCCTTGATTTTTGCAATG
GCTGGCCTTCTGCTGCTGACGTAATCTAGA
1.2.2 pCzn 1-EMY162重组菌Arctic Express(DE3)大肠杆菌表达载体构建
1.2.3 EMY162包涵体蛋白的复性及Ni柱亲和纯化
将发酵液离心,收集菌体加入裂解液后超声破碎(4℃,12500r/min)、离心(20min)后弃上清夜,沉淀加入包涵体洗涤液清洗后加入溶解缓冲液后透析[5]。溶解后的包涵体用Ni-IDA-Sepharose亲和层析柱收集EMY162蛋白[6-8]。
1.2.4 动物免疫
每年的四五月份,成群结队的飞鱼便会迫不及待地来到靠近陆地、岛礁的地方,寻找适合产卵的场所。而漂浮在岸边的棕榈叶,对于它们来说是再合适不过的产卵地(海藻丛生的海域,也是飞鱼喜欢的产卵地点)。
1.2.5 抗体纯化与效价测定
将蛋白EMY162通过偶联琼脂糖介质制备亲和纯化层析柱,EMY162抗血清与PBS等体积混合后缓慢上样,待抗体结合后洗脱抗体(甘氨酸缓冲液),将抗体放入透析袋后立即置于PBS(4℃)透析过夜后,通过电泳测定其纯度、BCA测定其浓度、ELISA测定其效价[8-10]。
1.2.6 统计学处理
实验结果选用SPSS 20.0软件进行分析,计量资料以均数±标准差表示。组间比较采用单因素方差分析,实验组与对照组间比较用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒pCzn1-EMY162的测序及对比
重组质粒pCzn1-EMY162阳性克隆测序结果(图1A)与预期序列于NCBI数据库BLASTN软件进行比对,发现测序结果与预期目的序列相一致,吻合度达到100%(图1B)。
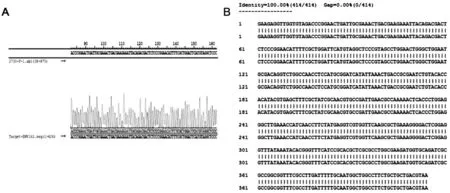
A:重组质粒pCzn1-EMY162测序测序结果;B:重组质粒pCzn1-EMY162比对结果
图1重组质粒pCzn1-EMY162测序及比对结果图
Figure1Recombinantplasmidpczn1-EMY162sequencingandcomparisonresults
2.2 重组质粒EMY162酶切鉴定
重组质粒pCzn1-EMY162经限制性内切酶Nde Ⅰ/Xba Ⅰ酶切后产物用1%琼脂糖凝胶电泳分析。结果显示,750 bp处有目的条带,与EMY162序列长度一致(图2)。本研究结果表明:pCzn1-EMY162目的序列已成功插入原核表达载体Arctic Express中。
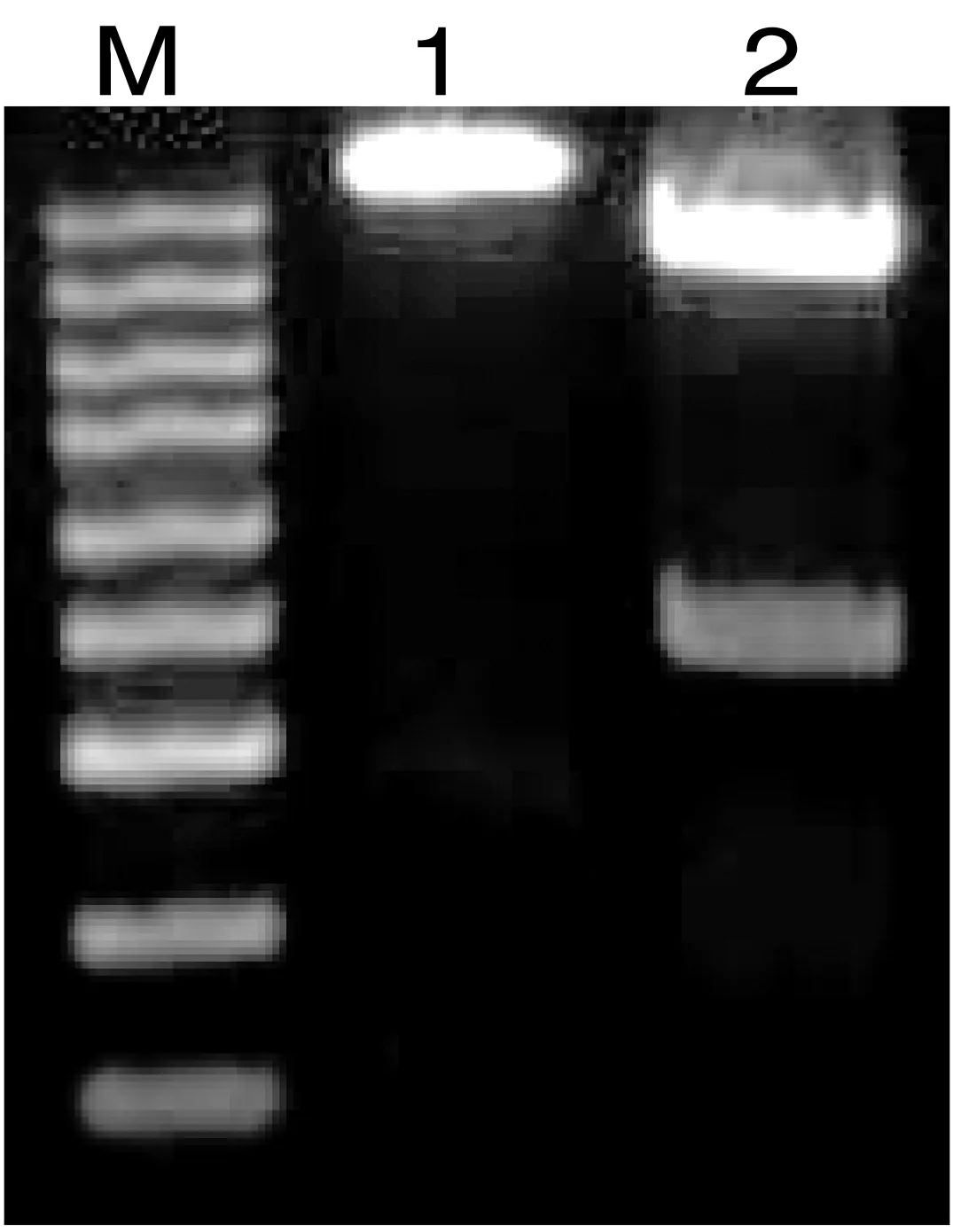
Marke:100,250,500,750,1000,1500,2000,3000,5000;基因名称:EMY162(OD260/OD280:1.83)
酶切鉴定:Nde Ⅰ/Xba Ⅰ;M:Marker;Line1:酶切前质粒;Line2:酶切后质粒
图2重组质粒pCzn1-EMY162双酶切鉴定图谱
Figure2Double-enzymedigestedrecombinantplasmidpCzn1-EMY162
2.3 EMY162蛋白表达部位鉴定
工程菌经IPTG诱导后(15℃,37℃),菌体用PBS混悬超声破碎上清液(可溶蛋白),沉淀用8 M尿素混悬超声破碎收集上清液(包涵体蛋白),经SDS PAGE鉴定表达部位,结果如图3所示,经IPTG诱导可以产生13 KD的目的蛋白(泳道2),可在EMY162包涵体部位13KD见明显条带,在15 ℃、37 ℃下表达EMY162(均以包涵体形式表达,游道4、6),并且在37 ℃下诱导蛋白质产量高于15 ℃诱导,故将其发酵温度定为37 ℃。
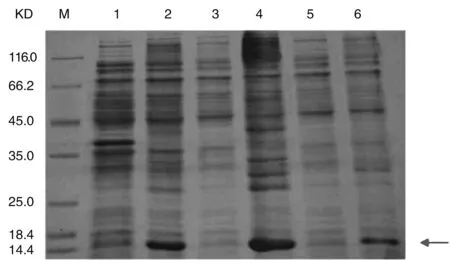
泳道M:标记蛋白;泳道1:未经IPTG诱导;泳道2:经IPTG诱导;泳道3:使用0.5 mmol/LIPTG在37 ℃诱导后菌液上清部分;泳道4:使用0.5 mmol/LIPTG在37 ℃诱导后菌液沉淀部分;泳道5:使用0.5 mmol/LIPTG在15 ℃诱导后菌液上清部分;泳道6:使用0.5 mmol/LIPTG在15 ℃诱导后菌液沉淀部分
图3SDS-PAGE鉴定EMY162蛋白表达部位鉴定图
Figure3SDS-PAGEofEMY162-Hisexpressionformanalysis
2.4 蛋白纯化分析
包涵体经过变性、复性,使目标蛋白重新正确折叠并融合,随后通过Ni柱亲和纯化、复性后,获得纯化后的目的蛋白EMY162,经12% SDS-PAGE考察蛋白纯度。结果如图4所示,纯化后的蛋白EMY162在16KD左右有阳性单一条带,并未发现杂蛋白条带。质谱检测结果(图5)示,重组表达EMY162蛋白质的分子量为16826.67,与预期结果相一致。综上,表明EMY162原核重组表达经以上分离纯化后达到电泳纯。
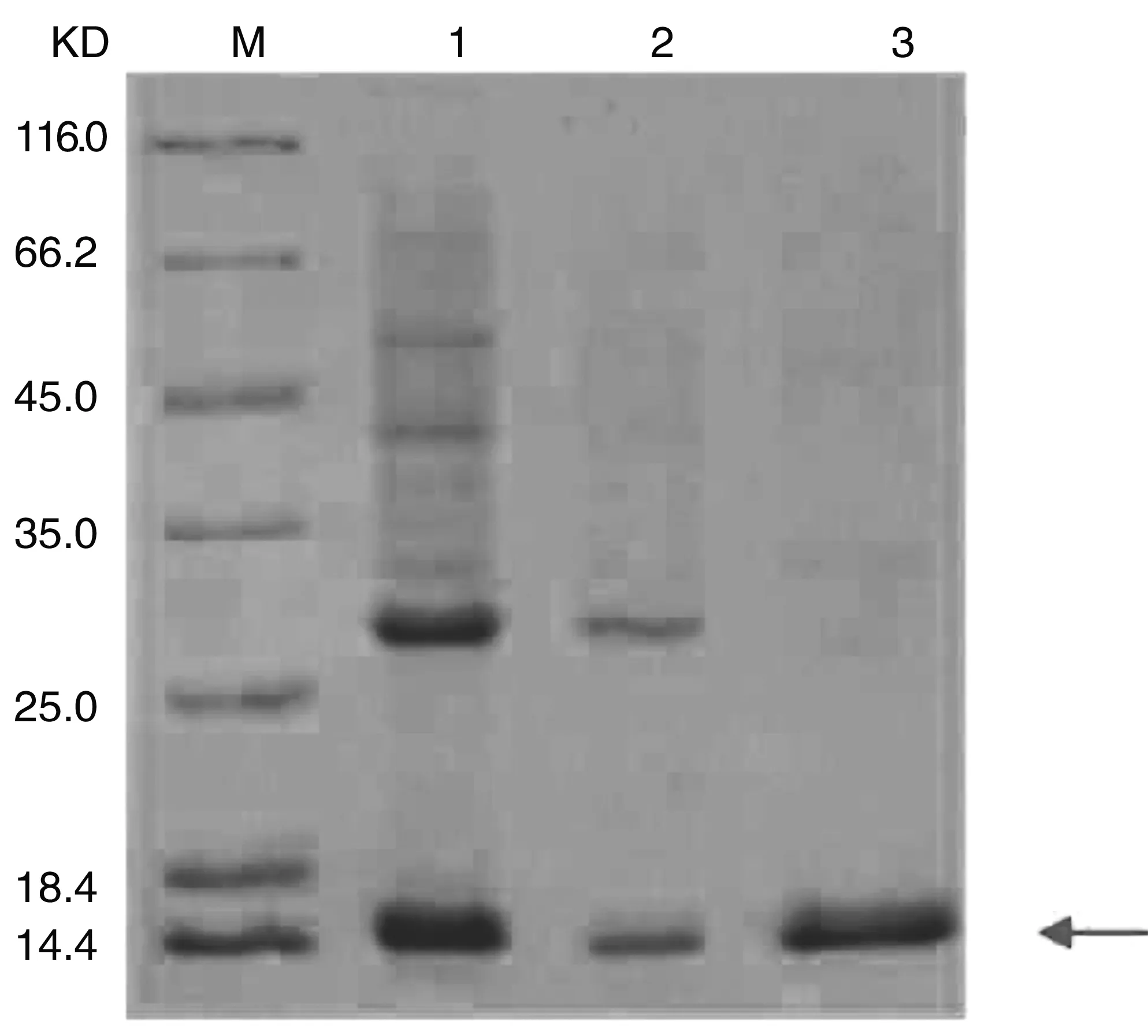
泳道M:标记蛋白;泳道1:未纯化蛋白;泳道2:洗脱液中的蛋白;泳道3:纯化蛋白
图4EMY162融合蛋白纯化电泳图
Figure4SDS-PAGEofEMY162-Hisfusionproteinpurification
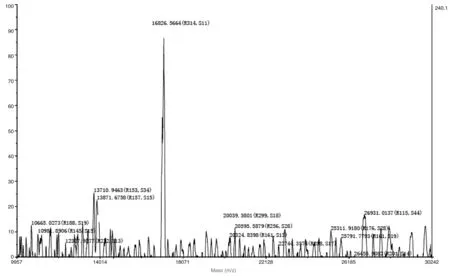
图5 EMY162质谱分析图
2.5 兔多克隆抗体效价测定
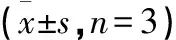

Table 1 ELISA detection of changes in antibody level after 4 times of immunizations(±s,n=3)
*:P<0.01 V.S.空白血清.
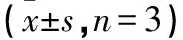

Table 2 Resultsfor Antibody indirect ELISA(±s,n=3)
续表:

EMY162纯化抗体DilutionOD450nm1:640002.842±0.115∗1:1280002.068±0.048∗1:2560001.299±0.025∗1:5120000.757±0.094∗对照血清0.109±0.021F 1006.230P <0.001
P<0.01 V.S.对照血清.
2.6 抗体纯度鉴定
将所获得蛋白EMY162经琼脂糖介质偶联制备成抗原亲和纯化层析柱后,通过SDS-PAGE电泳观察纯化蛋白程度(图7)示,55KD及25KD为抗体重链与轻链,未发现杂蛋白。提示:获得了纯度较高的多克隆抗体。
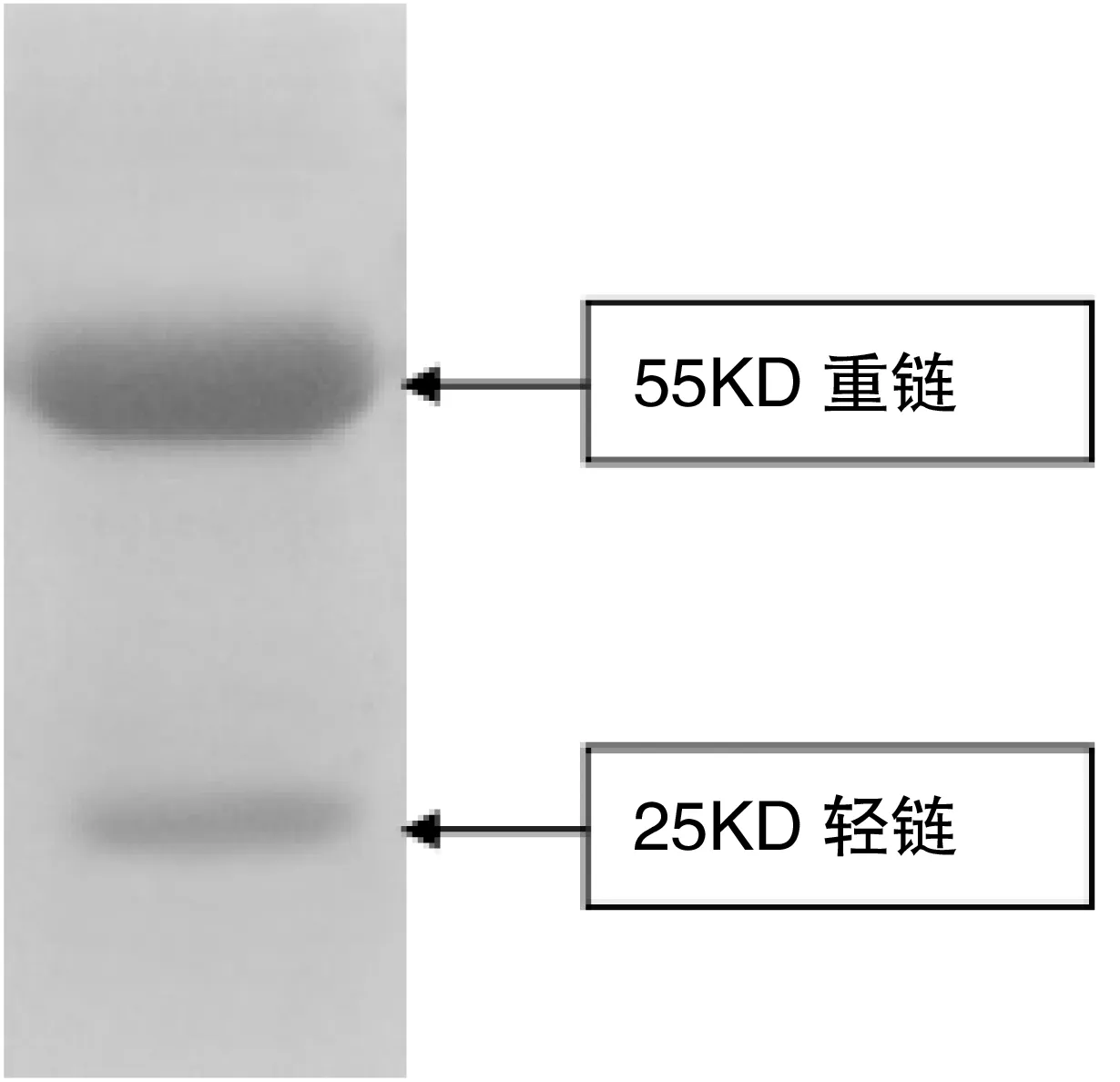
图6纯化后抗体鉴定图
Figure6Identificationofantibodiesafterpurification
3 讨论
大肠杆菌的表达是最典型的原核表达系统,在大肠杆菌中表达真核生物基因具有不可预测性[12,13],有研究结果表明将外源蛋白核酸序列进行大肠杆菌密码子优化后可以增加外源蛋白表达产量[8,14],鉴于遗传密码子的偏爱性原则,本课题首先采用生物信息学软件OptimumTM Codon,根据NCBI公布的MEY162蛋白序列进行遗传密码子的优化,并将优化后的EMY162序列导入载体pCzn1以达到高效表达的目的。研究结果显示,优化后的pCzn1-EMY162转化入大肠杆菌表达菌株DE3后经IPTG诱导,获得了高产量的EMY162重组蛋白,与已有报道相一致。
外源蛋白在大肠杆菌中的表达分为胞外分泌表达、周质分泌表达和胞质表达[5,11]。本实验取菌体用PBS混悬超声破碎上清液,用8 M尿素混悬沉淀超声破碎并收集上清液,经SDS PAGE鉴定表达部位证实外源蛋白EMY162在包涵体中表达。大肠杆菌是最常用的外源蛋白表达系统,但目前发现外源蛋白在大肠杆菌表达中多以不可溶的包涵体蛋白形式存在,这是因为包涵体蛋白更易得到无活性的蛋白,并且为得到最后有活性的蛋白做好了基础,不过这需要经过复杂的变复性过程。但相对于可溶蛋白而言,包涵体表达也具很多优势,比如包涵体蛋白利于纯化、产量高,且目标蛋白不易降解等。研究发现最适合大肠杆菌生长的温度一般为37 ℃~39 ℃,在此温度下目的蛋白较其他温度来说更易以包涵体形式存在,低温条件一般约为8 ℃~10 ℃,外源蛋白以可溶蛋白表达比例较高。本实验采用15 ℃和37 ℃的温度对大肠杆菌进行诱导培养,目的为观察所导入的目的蛋白是以包涵体形式还是以可溶蛋白形式存在。经SDS-PAGE电泳证明,15 ℃和37 ℃所表达的目的蛋白均以包涵体形式存在,并且37 ℃诱导蛋白质产量明显高于15 ℃诱导,因此将大肠杆菌发酵温度定为37 ℃。
多克隆抗体是通过抗原刺激机体,以此来产生免疫学的一系列反应,该反应是由机体的浆细胞参与完成,浆细胞可合成并分泌与抗原有特异性结合能力的免疫球蛋白[16]。本实验将提取纯化后的目的蛋白EMY162作为抗原免疫新西兰白兔,使机体产生免疫反应,得到所需抗体。免疫完成后采血检测,以间接ELISA法检测抗体效价,结果表明通过免疫制备得到的多克隆抗体效价较高。并且通过BCA蛋白浓度测定,均证实多克隆抗体制备成功,此研究为后续临床病理“边缘带”的确定及发病机制研究提供了有利的工具。
目前WHO对于泡型包虫病“边缘带”的界定及分期依照肿瘤的PNM评分原则,多层螺旋CT(MSCT)灌注成像[17]、18F-FDG PET/CT[20]和核磁共振[18,19]等影像学检查方法及不同的序列对于泡型包虫病边缘带的界定尚存在诸多争议,病理学对于“边缘带”的界定依旧参考肿瘤边缘带炎性细胞浸润的特点来划分,尚缺乏临床实验基础,这也是泡型包虫病病人常见术后复发的重要原因之一。由于寄生虫感染特征及致病的机制较肿瘤有较大差异,外源分泌型蛋白对于多房棘球蚴感染造成的损伤还缺乏相关的理论依据,目前多数学者认为多房棘球蚴感染所造成的嗜酸性粒细胞聚集是由病原体及相关分泌蛋白所引起。 日本学者Katoh Y等研究发现,EMY162蛋白质以分泌蛋白形式存在并且在多房棘球蚴原头蚴、续绦、幼虫和成虫阶段都有高表达。本课题组选用EMY162蛋白为抗原制备抗体,旨在在后续研究中通过免疫组化法对多房棘球蚴感染病灶进行研究,进一步明确其病理特征。
本实验成功建立了多房棘球蚴抗原EMY162原核表达系统载体,并获得高纯度蛋白后免疫新西兰白兔,得到高纯度、高效价多克隆抗体。
[1]Geramizadeh B,Baghernezhad M.Hepatic Alveolar Hydatid Cyst:A Brief Review of Published Cases from Iran in the Last 20 Years[J].Hepatitis Monthly,2016,16(10):e38920.
[2]Kantarci M,Bayraktutan U,Karabulut N,et al.Alveolar echinococcosis:spectrum of findings at cross-sectional imaging[J].Radiographics A Review Publication of the Radiological Society of North America Inc,2012,32(7):2053.
[3]Katoh Y,Kouguchi H,Matsumoto J,et al.Characterization of emY162 encoding an immunogenic protein cloned from an adult worm-specific cDNA library of Echinococcus multilocularis[J].Biochimica Et Biophysica Acta General Subjects,2008,1780(1):1-6.
[4]Kouguchi H,Matsumoto J,Katoh Y,et al.The vaccination potential of EMY162 antigen against Echinococcus multilocularis infection[J].Biochemical & Biophysical Research Communications,2007,363(4):915-920.
[5]李润乐,康明,汤锋,等.肝片吸虫鞘脂激活蛋白样蛋白2(FhSAP-2)的原核表达及分离纯化[J].青海医学院学报,2014,35(1):46-51.
[6]孙楠.茶树核糖体失活蛋白抗病毒功能研究[D].河南:信阳师范学院,2014.
[7]马宁.一个新的冷诱导茶树CBF基因的克隆与功能分析[D].河南:信阳师范学院,2015.
[8]宋愈佳.刺参半胱氨酸蛋白酶抑制剂特性及其在自溶中的变化规律研究[D].辽宁:大连工业大学,2015.
[9]郑金鼎.艾滋病合并隐球菌病或合并马尔尼菲青霉菌病的研究[D].湖北:武汉大学,2015.
[10]孙影.柞蚕空胴病病原菌基因组、侵染后柞蚕蛋白质组及柞蚕免疫Toll通路研究[D].辽宁:沈阳农业大学,2016.
[11]李润乐.新型肝片吸虫多表位疫苗的研究[D].青海:青海大学,2015.
[12]MF-M,Danon T,Christian T,et al.Genes adopt non-optimal codon usage to generate cell cycle-dependent oscillations in protein levels[J].Molecular Systems Biology,2012,8(1):572.
[13]Yang H,Liu L,Shin HD,et al.Comparative analysis of heterologous expression,biochemical characterization optimal production of an alkaline α-amylase from alkaliphilic Alkalimonas amylolytica in Escherichia coli and Pichia pastoris[J].Biotechnology Progress,2013,29(1):39-47.
[14]赵洋,杨阳,刘振,等.茶树密码子用法分析[J].茶叶科学,2011,31(4):319-25.
[15]何艳嫦,钟俊东.兔抗人血清制备与效价的鉴定[J] .国际检验医学杂志,2011,32(18):2109-2110.
[16]姚冰,刘文亚,王静,等.肝脏泡状棘球蚴病边缘区域的MSCT灌注成像研究[J] .新疆医科大学学报,2010,33(4):375-378.
[17]李肖红.肝泡型包虫病边界的~(18)F-FDG生物学特征与临床研究[D].新疆:新疆医科大学,2015.
[18]马娟,王金英,王俭,等.磁共振扩散加权成像ADC、EADC脑泡型包虫病边缘带定量分析[J].新疆医科大学学报,2015,31(11):1347-1350.
[19]康琦,刘海霞,鲍海华.DWI及ADC值测量在肝泡型包虫病诊断中的应用新进展[J].医学影像学杂志,2015,9:1667-16679.
