二甲双胍对人肺腺癌A549细胞增殖影响及其机制
2017-03-08兰光友邓述恺
刘 单,兰光友,邓述恺
(1.西南医科大学附属医院呼吸内一科,四川 泸州 646000;2.自贡市第一人民医院呼吸内科,四川 自贡 643000)
肺癌是目前最常见的恶性肿瘤之一,随着抗肿瘤药物不断更新,找到疗效较好、安全性高、不良反应轻的抗肿瘤药物,将为肺癌患者提供新的希望。二甲双胍过去主要用于2型糖尿病的降糖治疗。近年来,相关基础研究[1]表明:二甲双胍可能通过LKB1-AMPK-mTOR通路、降低宿主胰岛素水平、诱导细胞周期停滞、抑制肿瘤新生血管的生成和炎症反应、抑制氧自由基的生成、抑制肿瘤干细胞等抑制肿瘤细胞生长,也可通过增强放化疗的敏感性、诱导自噬、激活免疫系统、抑制UPR等途径发挥抗肿瘤作用。本实验将初步探讨二甲双胍抗肺癌的可能机制,为今后的实验及临床提供理论依据。
1 资料与方法
1.1 材料与试剂 人肺腺癌A549细胞(西南医科大学附属医院中心实验室);二甲双胍原药粉剂(美国Sigma公司);RPMI-1640培养基、MTT试剂盒、环氧化酶-2(cyclooxygenase-2,COX-2)、血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白酶联免疫吸附试验(ELISA)试剂盒(北京索莱宝科技有限公司);HyClone胎牛血清(上海拜力生物工程有限公司);CO2恒温孵育箱(美国Napco公司);酶标仪(美国BioTek公司);倒置相差显微镜(日本Olympus公司)。
1.2 实验方法
1.2.1 A549细胞培养 将A549细胞加于体积分数10%胎牛血清的RPMI-1640培养基中,于37 ℃、体积分数5% CO2恒温孵育箱中生长,贴壁85%时按13传代,选取2~4代用于实验。
1.2.2 MTT法检测不同浓度、不同时间下二甲双胍作用A549细胞的增殖抑制率 将A549细胞接种96孔板,按每孔4×104·mL-1计数,待细胞生长贴壁后,按100 μL二甲双胍且浓度为2.5、5.0、10.0、20.0、40.0 mmol·L-1分别作用A549细胞(5个实验组),每个浓度设置6个复孔,同时设置对照组(加无血清培养基100 μL),分别作用24、48、72 h后每组各孔加入10 μL MTT溶液培养4 h,弃上清,每组各孔加入100 μL Formanzan溶解液,再培养4 h,在检测仪490 nm处测定各孔吸光度(OD)值,记录结果,根据公式计算出细胞生长抑制率。计算公式:抑制率=[1-(实验组OD值 /对照组OD值)] ×100%。上述实验重复3次。
1.2.3 ELISA检测COX-2及VEGF蛋白的表达 采用100 μL二甲双胍且浓度依次为2.5、5.0、10.0、20.0、40.0 mmol·L-1(实验组),干预已贴壁生长的A549细胞,每个浓度设置6个复孔,同时设置标准品组(标准品)、空白孔(蒸馏水);干预72 h(最佳抑制时间)后,收集细胞,浓度约为106·mL-1。分别按照说明加样,各孔加入50 μL酶标试剂,再孵育、洗涤、显色,最后终止。采用酶标仪在450 nm波长测定每个孔的OD值。测量OD值:波长调至450 nm,以空白孔凋零,测每孔的吸光度OD值,试验重复3次。

2 结果
2.1 二甲双胍对A549细胞生长抑制的影响 不同浓度二甲双胍(2.5、5.0、10.0、20.0、40.0 mmol·L-1)作用A549细胞24、48及72 h后,OD值随浓度的增加而降低,而细胞生长抑制率随浓度增加而增加,但24 h差异无统计学意义(P>0.05);48 h及72 h差异有统计学意义(P<0.05),各组间比较差异具有统计学意义(P<0.05),72 h抑制率更强。见表1。
2.2 各组细胞上清液中COX-2、VEGF水平的比较 二甲双胍干预A549细胞72 h后,各实验组(浓度分别为2.5、5.0、10.0、20.0、40.0 mmol·L-1)均可见A549细胞上清液中COX-2、VEGF的水平下降,各组间比较差异均有统计学意义(P<0.05)。见表2。

表1 各组OD值及抑制率的比较
注:48、72 h时各组两两比较,P均<0.05;5个实验组中同一组不同时间点比较,P均<0.05
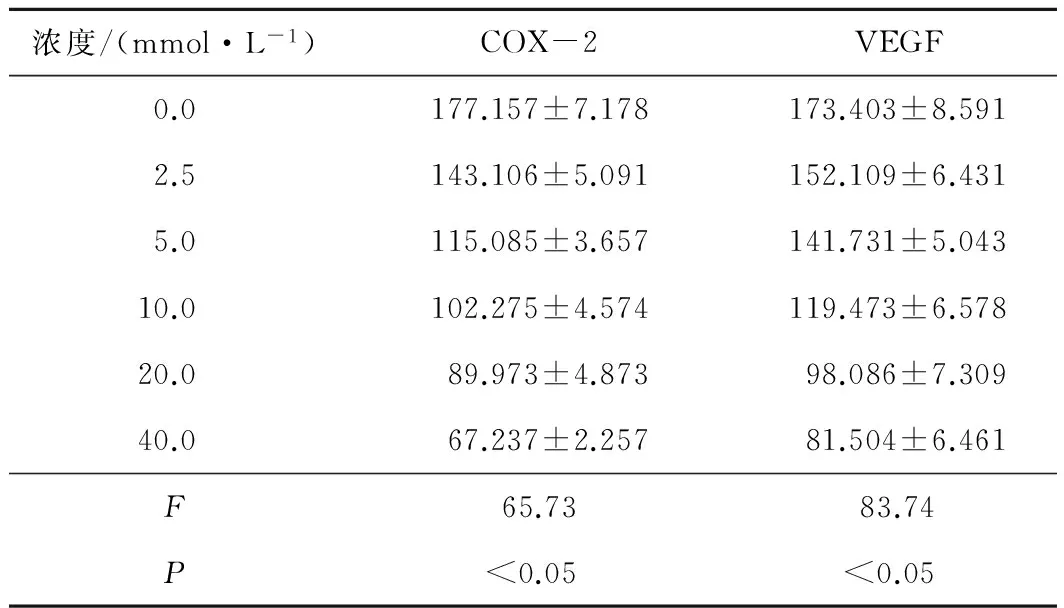
表2 各组细胞上清液中COX-2、VEGF水平的比较 ng·mL-1
注:各组两两比较,P均<0.05
3 讨论
二甲双胍主要用于2型糖尿病的治疗,其机制一方面通过抑制肝脏糖异生、提高外周组织对胰岛素的敏感性及增加对葡萄糖的摄取和利用而降低血糖;另一方面因其不增加体重、改善血脂谱、降低小细胞聚集、增加纤溶活性等功效用于延缓和改善糖尿病血管并发症。近年来,作为“老药新用”的典范,越来越多研究显示,二甲双胍能抑制2型糖尿病患者患食管癌[2]、胃癌[3]、肝癌[4]、胰腺癌[5]、乳腺癌[6]等多种恶性肿瘤的风险。相关基础研究[7-8]表明二甲双胍能通过激活AMPK途径、诱导细胞周期停滞、降低胰岛素及胰岛素样生长因子-1、增加放化疗及靶向治疗效果等途径发挥抗肿瘤作用。
本实验采用MTT检测不同浓度二甲双胍分别作用A549细胞24 h、48 h、72 h后的增殖抑制率,发现:除24 h外,二甲双胍对A549细胞具有增殖抑制作用,且抑制作用与作用浓度及时间有关联,这一结论也与Guo等[9]的研究结果相吻合。本实验中24 h各组增值抑制率差异不具有统计学意义,其可能原因与二甲双胍干预时间过短或选择浓度过低有关。
COX-2又称诱导型环氧化酶,在大多细胞中不表达或少量表达,传统研究主要集中在炎症反应方面,当人体受到外伤或感染等刺激后产生,从而促进白三烯、羟基环氧素等炎性介质及大量炎症细胞、炎症因子共同参与炎性反应。现代医学认为慢性炎症与许多包括肺癌在内的肿瘤的发生发展密切相关,这是肿瘤的又一大特征[10]。COX-2在肿瘤发生、增长及转移过程中起着重要的作用,研究显示COX-2能够降低凋亡相关基因BCL-2的表达,以促进其磷酸化,抑制肺癌细胞凋亡,且可促进survivin蛋白泛素化,促进肺癌细胞产生凋亡耐受[11]。此外,COX-2还能促进肿瘤新生血管的形成[12]。相关研究表明,COX-2高表达的肿瘤细胞能够增强肿瘤细胞血管的生存能力、转移能力以及促进血管内皮细胞的迁移[13]。
VEGF是血管内皮细胞特异性肝素结合生长因子,可在体内诱导血管新生,是目前已知的最强的促血管形成因子之一,肿瘤的生长、浸润和转移离不开新生毛细血管的形成,VEGF能够作用于血管内皮细胞,促进细胞分裂和毛细血管出芽生长,为肿瘤的增殖和转移提供相对有利的微环境[14]。徐建平等[15]发现,VEGF参与了非小细胞肺癌的发生发展,病理分期越晚,分化越低,其阳性率越高,其可作为非小细胞肺癌预后的标志物。那么VEGF和COX-2在某些信号通路方面可能存在联系,发挥相互协同作用,从而促进肿瘤的发生发展。
在我们的实验中,选取二甲双胍对A549细胞抑制作用最强的时间点72 h为时间点,并通过ELISA法检测A549细胞上清液中COX-2及VEGF的表达水平,结果显示各实验组COX-2及VEGF的蛋白表达水平随细胞增殖抑制率的下降而降低。总之,二甲双胍可能通过下调COX-2及VEGF的表达发挥抑制A549细胞生长的作用。
[1] 冯瑾,陈光侠,费素娟.二甲双胍抗肿瘤机制的研究进展[J].实用药物与临床,2016,19(10):1310-1315.
[2] FUJIHARA S,KATO K,MORISHITA A,et al.Antidiabetic drug metformin inhibits esophageal adenocarcinoma cell proliferation invitro and vivo[J].Int J Oncol,2015,46(5):2172-2180.
[3] CHEN G,FENG W,ZHANG S,et al.Metformin inhibits gastric cancer via the inhibition of HIF1 alpha/PKM2 signaling[J].Am J Cancer Res,2015,5(4):1423-1434.
[4] DEPERALTA DK,WEI L,GHOSHAL S,et al.Metformin prevents hepatocellular carcinoma development by suppressing hepatic progenitor cell activation in a rat model of cirrhosis[J].Cancer,2016,122(8):1216-1227.
[5] KATO K,IWAMA H,YAMASHITA T,et al.The anti-diabetic drug metformin inhibits pancreatic cancer cell proliferation in vitro and in vivo:study of the microRNAs associated with the antitumor effect of metformin[J].Oncol Rep,2016,35(3):1582-1592.
[6] LI NS,ZOU JR,LIN H,et al.LKB1/AMPK inhibits TGF-betal production and the TGF-beta signaling pathway in breast cancer cells[J].Tumour Biol,2016,37(6):8249-8258.
[7] ZHANG Y,STORR SJ,JOHNSON K,et al.Involvement of metformin and AMPK in the radioresponse and prognosis of luminal versus basal-like breast cancer treated with radiotherapy[J].Oncotarget,2014,5(24):12936-12949.
[8] KATO K,GONG J,IWAMA H,et al.The antidiabetic drug metformin inhibits gastric cancer cell proliferation in vitro and in vivo[J].Mol Cancer Ther,2012,11(3):549-560.
[9] GUO Q,LIU Z,JIANG L,et al.Metformin inhibits growth of human non-small cell lung cancer cells via liver kinase B-1-independent activation of adenosine monophosphate-activated protein kinase[J].MoI Med Rep,2016,13(3):2590-2596.
[10]宋雅姝,王晶.炎症与肺癌的相关性研究[J].中国临床医生杂志,2017,45(4):16-18.
[11]HO MY,HUNG SW,LIANG CM,et al.Recombinant viral capsid protein VP1 suppresses lung cancer metastasis by inhibiting COX-2/PGE2 and MIG-7[J].Oncotarget,2014,5(11):3931-3943.
[12]王云,朱星枚.NF-κB和Cox-2对结肠腺瘤性息肉及癌变患者新生血管的影响[J].中国肿瘤临床与康复,2017,24(6):685-688.
[13]SEEBACHER W,FAIST J,PRESSER A,et al.Synthesis of new 4-phenylpyrimidine-2(1 H)-thiones and their potency to inhibit COX-1 and COX-2[J].Eur J Med Chem,2015,101(17):552-559.
[14]BEKES I,FRIEDL T W, KÖHLER T,et al.Does VEGF facilitate local tumor growth and spread into the abdominal cavity by suppressing endothelial cell adhesion,thus increasing vascular peritoneal permeability followed by ascites production in ovarian cancer[J].Mol Cancer,2016,15(1):1-13.
[15]徐建平,赵洁婷,叶伟,等.HGF、c-MET及VEGF在非小细胞肺癌中的表达及意义[J].实用癌症杂志,2017,32(4)528-535.
