扶正抑瘤方对H22原位肝癌小鼠CD4+CD25+调节性T淋巴细胞表达的影响
2017-03-08陈旭征曹治云郑良朴章尤权陈惠云王少珍林佳佳
陈旭征,曹治云,林 薇,郑良朴,章尤权,陈惠云,王少珍,林佳佳,杜 建
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建中医药大学附属第二人民医院,福建 福州 350003; 3.福建中医药大学药学院,福建 福州 350122)
肿瘤的复发转移与机体内T淋巴细胞介导的肿瘤免疫逃逸密切相关,而CD4+CD25+调节性T淋巴细胞(regulatory T cells, Tregs)介导的免疫抑制在其中又发挥关键作用[1]。扶正抑瘤方在临床上主要用于术后放化疗期间或晚期不能手术的正气虚弱的消化道肿瘤患者的辅助治疗,能显著提高肿瘤患者的细胞免疫功能[2]。然而其调节免疫的作用机制仍不明确。本文从CD4+CD25+Tregs角度出发,研究扶正抑瘤方对CD4+CD25+Tregs数量和功能的影响,进一步探明该方调节肿瘤机体免疫功能的作用机制,对提高我国肝癌的治疗水平有重要的社会价值。
1 材料与方法
1.1 实验药材 黄芪、灵芝、女贞子、淮山购于福建同春药业有限公司,经中药鉴定教研室鉴定后,按照2211的质量配比, 加入适量生理盐水浸泡,文火煎煮2次取滤液。按照动物与人体间等效剂量公式[3]换算20 g小鼠的给药剂量为18 g·kg-1·d-1。
1.2 试剂和仪器 小鼠PE-Cy5 rat anti-mouse CD3、PE rat anti-mouse CD4、FITC rat anti-mouse CD8、APC rat anti-mouse CD25(美国BD公司);叉头样转录因子3(forkhead box p3, Foxp3)和诱导的T细胞共刺激分子(inducible T-cell co-stimulator, ICOS)抗体及二抗(美国ABclonal公司);RPMI-1640培养基、胎牛血清、胰蛋白酶(美国Hyclone公司);NC膜(美国Millipore公司),CO2培养箱(德国Heraeus公司);倒置显微镜(日本Nikon公司);垂直电泳仪(美国Bio-rad公司);流式细胞仪(美国BD公司)。
1.3 实验动物和细胞 24只SPF级雄性6周龄、体质量16~18 g的BALB/c小鼠购自上海灵畅生物科技有限公司(合格证号:2013001815382);小鼠肝癌H22细胞株购自中国科学院上海生命科学研究院,采用含有体积分数10%胎牛血清的RPMI-1640培养基培养。
1.4 建立小鼠肝癌原位模型并分组 将对数生长期的H22肝癌细胞接种到BALB/c小鼠的腹腔内并传代,将传代3次后的腹水小鼠做为瘤源动物。抽取腹水,调整浓度为2×107·mL-1,接种于小鼠皮下,每只100 μL,待成瘤后将瘤体剪成0.5 mm3大小,植入小鼠肝左叶,建立小鼠肝癌原位模型。将模型小鼠随机分为2组:模型组和药物组,其中药物组灌胃扶正抑瘤方18 g·kg-1·d-1,模型组灌胃等体积生理盐水。空白组不造模,灌胃等体积生理盐水。每组8只,连续给药2周,并监测小鼠进食量和体质量变化情况。2周后眼球摘除取血,肝素钠抗凝,检测外周血CD3+、CD4+、CD8+T淋巴细胞及CD4+CD25+Tregs的百分比;游标卡尺测量瘤体大小,并计算抑瘤率。瘤体大小的计算公式:体积=(短径2×长径)/2;抑瘤率的计算公式:抑瘤率(%)=(模型组平均肿瘤体积-给药组平均肿瘤体积)/模型组平均肿瘤体积×100%。
1.5 外周血CD3+、CD4+、CD8+T淋巴细胞及CD4+CD25+Tregs检测 EDTA抗凝小鼠血100 μL,加入PE-Cy5 免抗鼠CD3、PE免抗鼠CD4、FITC免抗鼠CD8和APC免抗鼠CD25各10 μL,充分混匀,室温避光孵育30 min,PBS洗涤1次,流式细胞仪检测各T淋巴细胞亚群含量。1.6 HE染色 将肿瘤组织固定在质量分数4%多聚甲醛溶液24 h,石蜡包埋、脱水、切片,HE染色,中性树胶封片,显微镜下观察肿瘤细胞形态。
1.7 Western blot检测肿瘤组织中ICOS、Foxp3蛋白 提取细胞总蛋白并检测蛋白浓度,对蛋白样品进行SDS-PAGE凝胶电泳并转至NC膜上,封闭后放入ICOS、Foxp3一抗稀释液中4 ℃下孵育过夜,再将膜放入二抗稀释液室温下继续孵育1 h,TBST洗涤,ECL显色,拍照分析。

2 结果
2.1 小鼠一般情况检查 给药期间3组小鼠均无死亡,体质量和进食量亦无显著性差异。解剖后模型组中有4只小鼠出现血性腹水,药物组有2只出现血性腹水。
2.2 肝脏大体观及病理检查 模型组和药物组的肝左叶均有明显凸起的白色肿块,成瘤率100%。模型组中有4只小鼠肝脏呈现灰白色,质地硬;药物组小鼠肝脏颜色趋于正常。HE染色可见空白组肝细胞形态均一,以中央静脉为中心,向周围呈放射状排列;模型组则见大小不一、形态各异、核异型性明显的细胞呈团块聚集或弥漫散在分布,周围血管丰富,中心可见坏死区。可见肝癌原位模型建立成功。见图1。
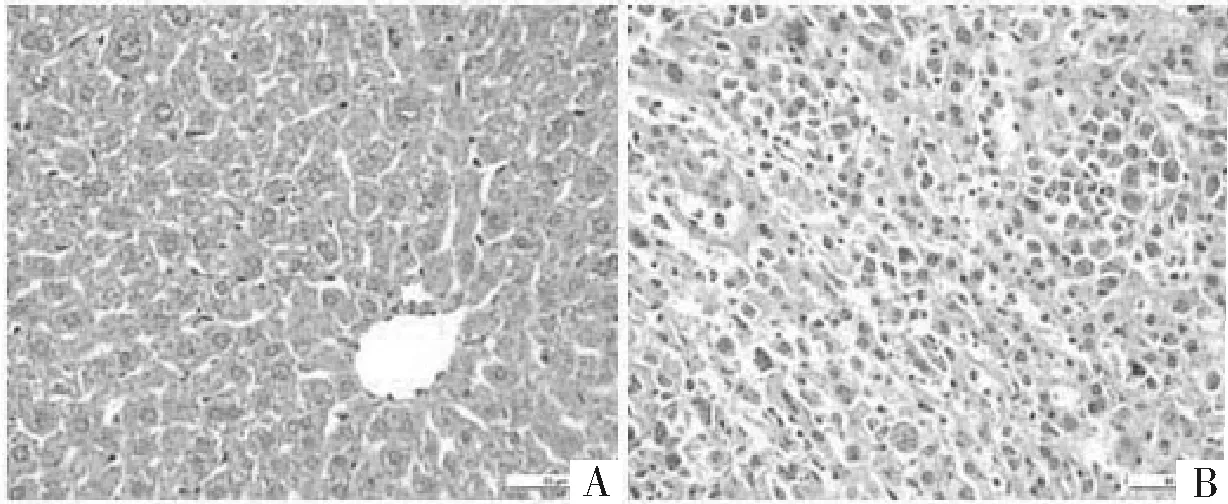
图1 正常肝组织(A)和肝癌组织(B)镜下图片(HE,×400)
2.3 各组瘤体大小的比较 模型组的瘤体体积明显大于药物组(P<0.05),抑瘤率达62.56%。见表1。

表1 2组肿瘤体积比较
2.4 各组T淋巴细胞亚群的比较 模型组CD3+、CD4+T淋巴细胞较空白组明显减低(P分别为0.005、0.003),CD4+CD25+Tregs较空白组明显升高(P<0.001)。给药后CD3+、CD4+T淋巴细胞明显升高(P分别为0.039、0.049),CD4+CD25+Tregs明显下降(P=0.001)。见表2。
2.5 2组ICOS和FOXP3蛋白表达的比较 药物组ICOS和Foxp3的蛋白表达较模型组明显减低(P<0.05)。见图2、表3。
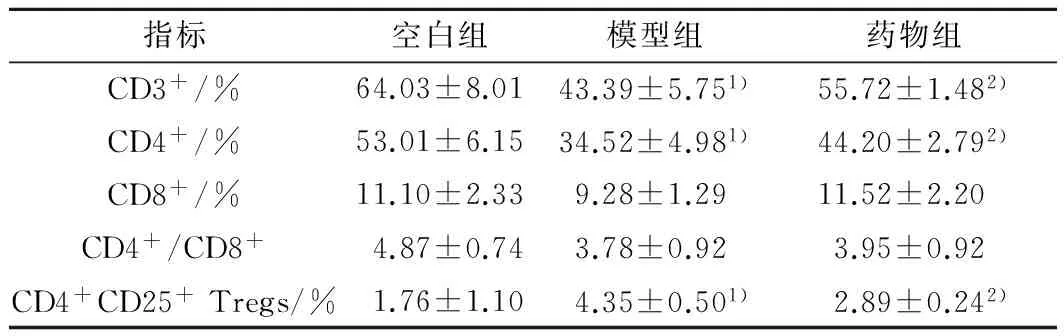
表2 各组T淋巴细胞亚群的比较
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05
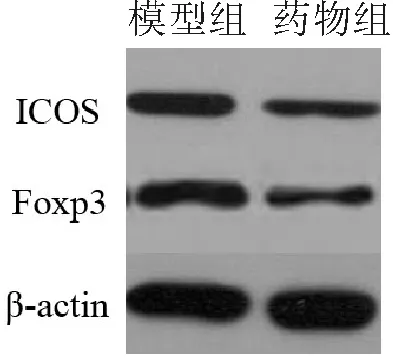
图2 2组肝癌组织ICOS、Foxp3蛋白表达的比较
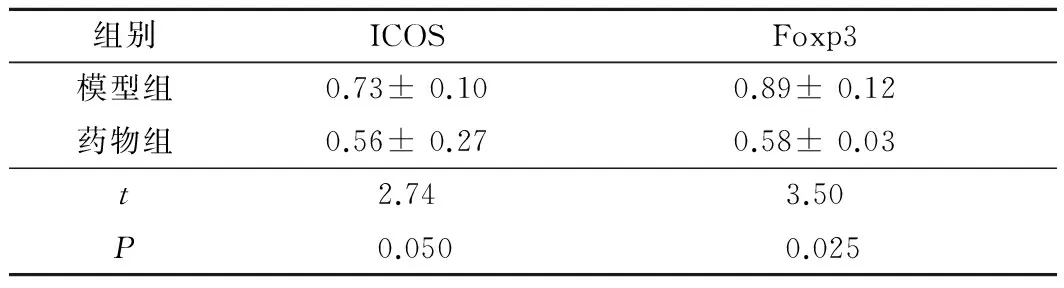
组别ICOSFoxp3模型组0.73±0.100.89±0.12药物组0.56±0.270.58±0.03t2.743.50P0.0500.025
3 讨论
扶正抑瘤方以黄芪为君,益气升阳、固表止汗;以灵芝为臣,益精血、扶正气,辅佐君药增强疗效;女贞、山药同为佐使,滋补肝肾、健脾养阴。四药相合,健脾补肺滋肾养肝,补虚损不忘健脾气,先后天之本并补,提高正气御邪之力。研究[2-3]表明,手术后联合扶正抑瘤方治疗肝癌患者,其累计生存率和24个月的复发率均优于单纯手术组,NK细胞活性及CD4+/CD8+的比值也较单纯手术组有明显升高,可见扶正抑瘤方可显著升高肝癌患者的细胞免疫功能,降低肿瘤复发和转移率。基础实验也证实扶正抑瘤方能显著提高荷瘤小鼠化疗后CD3+、CD4+T淋巴细胞的表达,明显提高外周血NK细胞的百分比及细胞因子IL-2及TNF-α的表达水平[4]。本文研究发现,扶正抑瘤方显著提高原位肝癌小鼠机体CD3+和CD4+T淋巴细胞的比例,抑制移植瘤体生长,这与我们之前对皮下肝癌移植瘤小鼠的研究结果一致,进一步明确扶正抑瘤方具有提高肝癌机体细胞免疫功能的作用。
CD4+CD25+Tregs是一类具有免疫抑制和免疫无能的T淋巴细胞亚群。在肿瘤微环境中,其能够分泌IL-10和TGF-β等免疫抑制因子,抑制IL-2的产生,下调MHC Ⅱ类分子的表达,降低抗原特异性T淋巴细胞的免疫应答[5],降低树突状细胞的抗原递呈能力[6];还可以通过表达颗粒酶B、穿孔素等物质溶解自然杀伤细胞和细胞毒性T淋巴细胞等免疫效应细胞[7]。可见CD4+CD25+Tregs影响了肿瘤微环境中多种免疫效应细胞的抗肿瘤活性。目前已证实CD4+CD25+Tregs在多种肿瘤患者外周血和肿瘤局部都明显增多,如结直肠癌[8-9]、胃癌[10]、胰腺癌[11]、肝癌[12]等,其数量的增多预示着患者的预后不佳。因此清除肿瘤患者体内CD4+CD25+Tregs的数量成为肿瘤免疫治疗的新途径。本研究发现原位肝癌小鼠外周血中CD4+CD25+Tregs含量较正常小鼠明显增加,提示肝癌小鼠的机体免疫处于抑制状态,而扶正抑瘤方能显著降低原位肝癌小鼠外周血中CD4+CD25+Tregs的含量,可见扶正抑瘤方有清除CD4+CD25+Tregs的数量,提高肝癌机体免疫的作用。
然而研究[13]发现减低CD4+CD25+Tregs的数量对增强机体抗肿瘤活性的作用是短暂的,解除对CD4+CD25+Tregs的调控后,其数量很快又会恢复,因此在清除CD4+CD25+Tregs数量的同时还应封闭CD4+CD25+Tregs的功能,降低其免疫抑制活性。Foxp3是CD4+CD25+Tregs的特异性标志物,对CD4+CD25+Tregs的发育和功能起决定性调控作用[14]。而ICOS是CD4+CD25+Tregs表面参与肿瘤免疫逃逸的重要分子之一。有研究[15]表明,肿瘤微环境中的CD4+CD25+Tregs高表达ICOS分子,而高表达ICOS的CD4+CD25+Tregs比低表达ICOS的CD4+CD25+Tregs更具有免疫抑制活性。因此检测肿瘤微环境中Foxp3和ICOS表达水平,可以考察扶正抑瘤方对CD4+CD25+Tregs功能的调控作用。结果发现扶正抑瘤方下调了肿瘤组织Foxp3和ICOS的蛋白水平,提示扶正抑瘤方可能具有下调CD4+CD25+Tregs免疫抑制活性,增强机体免疫效应的作用。
综上所述,扶正抑瘤方不仅减低了原位肝癌小鼠体内CD4+CD25+Tregs的数量,还封闭了其免疫抑制功能,这可是其提高原位肝癌小鼠细胞免疫功能的原因之一。
[1] SHIMIZU J, YAMAZAKI S, SAKAGUCHI S.Induction of tumor immunity by removing CD25+CD4+T cells:a common basis between tumor immunity and autoimmunity[J].J Immunol, 1999, 163(10):5211-5218.
[2] 陈立武,林晶,陈文,等.中药治疗原发性肝癌Ⅲ期围手术期患者42例[J].中国中西医结合杂志,2005,25(9):832-834.
[3] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[4] CAO Z, LIAO L, CHEN X, et al.Enhancement of antitumor activity of low-dose 5-fluorouracil by combination with Fuzheng-Yiliu granules in hepatoma 22 tumor-bearing mice[J].Integr Cancer Ther, 2013, 12(2):174-181.
[5] JONULEIT H, SCHMITT E, KAKIRMAN H, et al.Infectious tolerance:human CD25+regulatory T cells convey suppressor activity to conventional CD4+T helper cells[J].J Exp Med, 2002, 196(2):255-260.
[6] LIANG B, WORKMAN C, LEE J, et al.Regulatory T cells inhibit dendritic cells by lymphocyte activation gene-3 engagement of MHC class II[J].J Immunol, 2008, 180(9):5916-5926.
[7] WHITESIDE TL.Immune modulation of T-cell and NK (natural killer) cell activities by TEXs (tumour-derived exosomes) [J].Biochem Soc Trans, 2013, 41(1):245-251.
[8] SOMASUNDARAM R, JACOB L, SWOBODA R, et al.Inhibition of cytolytic T lymphocyte proliferation by autologous CD4+/CD25+regulatory T cells in a colorectal carcinoma patient is mediated by transforming growth factor-beta[J].Cancer Res, 2002, 62(18):5267-5272.
[9] 张勤英,朱凡,王毓明.结直肠癌患者外周血CD4+CD25high调节性T细胞的作用[J].肿瘤基础与临床,2012,25(1):14-17.[10]ICHIHARA F, KONO K, TAKAHASHI A, et al.Increased populations of regulatory T cells in peripheral blood and tumor-infiltrating lymphocytes in patients with gastric and esophageal cancers[J].Clin Cancer Res, 2003, 9(12):4404-4408.
[11]VIEHL CT, MOORE TT, LIYANAGE UK, et al.Depletion of CD4+CD25+regulatory T cells promotes a tumor-specific immune response in pancreas cancer-bearing mice[J].Ann Surg Oncol, 2006, 13(9):1252-1258.
[12]HUANG Y, WANG F, WANG Y, et al.Intrahepatic interleukin-17+T cells and FoxP3+regulatory T cells cooperate to promote development and affect the prognosis of hepatocellular carcinoma[J].J Gastroenterol Hepatol, 2014, 29(4):851-859.
[13]COLOMBO MP, PICONESE S.Regulatory-T-cell inhibition versus depletion:the right choice in cancer immunotherapy[J].Nat Rev Cancer, 2007, 7(11):880-887.
[14]SAMSTEIN RM, ARVEY A, JOSEFOWICZ SZ, et al.Foxp3 exploits a pre-existent enhancer landscape for regulatory T cell lineage specification[J].Cell, 2012, 151(2):153-166.
[15]STRAUSS L,BERGMANN C,SZCZEPANSKI MJ,et al.Expression of ICOS on human melanoma-infiltrating CD4+CD25highFoxp3+T regulatory cells:implications and impact on tumor-mediated immune suppression[J].J Immunol, 2008, 180(5):2967-2980.
