C-MYC和MXI1在晚期肺腺癌组织中的表达及其临床意义
2017-03-08郜娜娜贺新爱许林平
郜娜娜,贺新爱,马 馨,许林平
(1.焦作市第二人民医院肿瘤内科,河南 焦作 454000;2.郑州大学附属肿瘤医院 科研外事办公室,河南 郑州 450008)
肺癌是最常见的恶性肿瘤之一,也是恶性肿瘤患者死亡的主要原因。在许多国家和地区肺癌发病率、死亡率都已上升为恶性肿瘤的首位[1-2]。C-MYC蛋白是最早发现与肿瘤细胞增殖活性相关的原癌基因产物之一,在人类许多肿瘤中高表达[3]。C-MYC蛋白本身并不会发生同源二聚作用,也不结合DNA,但其能够与Max形成异源二聚体,能与DNA上的E-box结合,进而激活靶基因的转录,导致细胞生长、抑制细胞分化和凋亡等改变[4-6]。而MXI1是C-MYC的拮抗蛋白,一般来讲,MYC/Max和MXI1/Max二聚体的比例决定基因启动子的活性,如以MYC/Max二聚体占主导,则主要表现为刺激细胞增殖;如以MXI1/Max二聚体占主导,则主要表现为抑制细胞生长,诱导细胞分化[7]。本研究拟通过检测晚期肺腺癌组织中C-MYC和MXI1的表达情况,评价两者表达状况与临床病理特征的关系,并进行统计学分析和生存状况分析,旨在初步探讨C-MYC和MXI1在晚期肺腺癌患者治疗预后评估中的作用。
1 材料与方法
1.1 临床资料 选取焦作市第二人民医院病理科2011年1月至2013年1月收治的100例晚期肺腺癌病变标本,其中男72例,女28例;年龄35~73岁,中位年龄55岁。见表1。

表1 100例晚期肺腺癌患者基本资料
1.2 主要试剂与实验方法 C-MYC兔抗人多克隆抗体和MXI1兔抗人多克隆抗体均购自美国Santa Cruz公司,工作浓度为1200;免疫组化S-P通用试剂盒和DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。石蜡标本常规脱蜡后用体积分数3% H2O2室温下孵育20 min,封闭内源性过氧化物酶,微波抗原修复,山羊血清封闭,分别加入C-MYC抗体和MXI1抗体4 ℃孵育过夜,再分别加入生物素标记的羊抗兔二抗37 ℃孵育30 min,辣根过氧化物酶标记链酶卵白素37 ℃孵育30 min,最后用DAB显色,苏木精对比显色,乙醇脱水,二甲苯透明,中性树胶封片。各步骤之间每次均用PBS缓冲液洗涤3次,每次5 min。用PBS代替一抗作为阴性对照。
1.3 免疫组化结果判定 C-MYC和MXI1均以细胞浆或细胞核内出现棕黄色颗粒为阳性染色。于显微镜400倍视野下随机选取5个有代表性的不同区域,根据阳性细胞在全部组织细胞中所占比例及阳性细胞染色强度判断每个视野的结果[8-9]。阳性细胞计数:≤10%,0分;>10%~25%,1分;>25%~50%,2分;>50%~75%,3分;>75%,4分。染色强度分类:未着色,0分;淡黄色1分;黄色或深黄色,2分;褐或棕褐色,3分。两者计分相乘得到该视野的最终得分。最后该切片根据得分分为以下4个等级:0~1分(-)、2~4分(+)、5~7分(++)、≥8分(+++)。(-)为阴性,(+)为弱阳性表达,(++)、(+++)为强阳性表达,后两者均记为阳性。
1.4 统计学处理 采用SPSS 17.0进行统计学分析,计数资料用百分数表示,统计分析用χ2检验;蛋白表达指标之间的相关关系采用Spearman等级相关检验;生存分析用Kaplan-Meier法,2组之间生存时间比较用log rank检验,检验水准α=0.05。
2 结果
2.1 C-MYC和MXI1蛋白在晚期肺腺癌组织中的表达 C-MYC和MXI1阳性表达均主要位于细胞浆,部分位于细胞核,呈棕黄色颗粒状。晚期肺腺癌组织中C-MYC和MXI1阳性表达率分别为60.00%(60/100)和55.00%(55/100)。见图1。
2.2 晚期肺腺癌组织中C-MYC蛋白的表达与临床病理参数之间的关系 C-MYC蛋白表达与患者年龄、性别、ECOG评分、吸烟状态、CEA、NSE、CYFRA21-1、CA125、中性粒细胞/淋巴细胞比例均无明显关系(P>0.05)。见表2。

图1 C-MYC(A)和MXI1(B)在晚期肺腺癌组织中的阳性表达情况(IHC,×400)

n(%)
2.3 晚期肺腺癌组织中MXI1蛋白的表达与临床病理特征之间的关系 MXI1蛋白表达与患者年龄、性别、ECOG评分、吸烟状态、CEA、NSE、CYFRA21-1、CA125、中性粒细胞/淋巴细胞比例均无明显关系(P>0.05)。见表3。
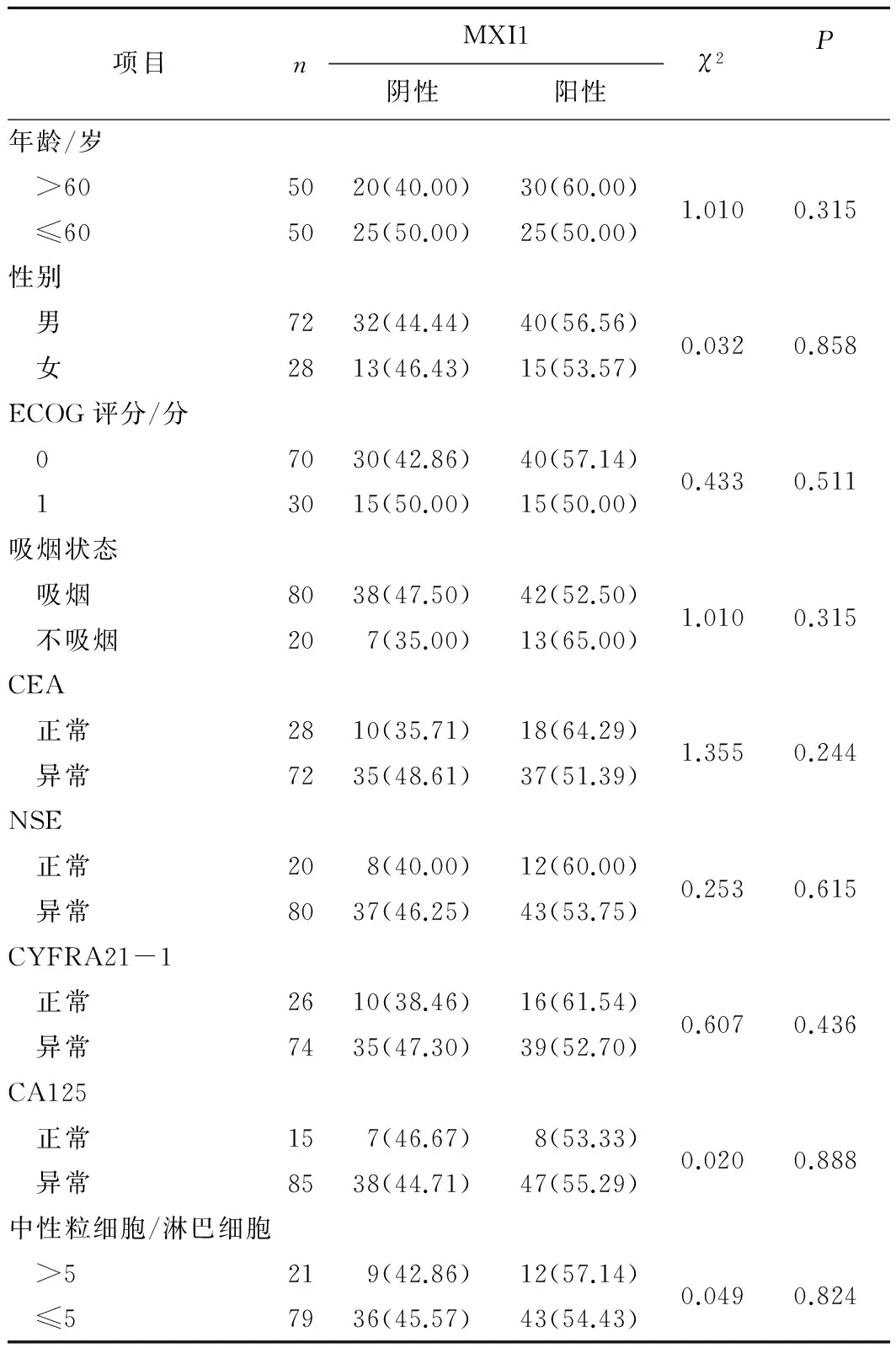
表3 MXI1蛋白的表达与临床病理参数的关系 n(%)
2.4 晚期肺腺癌组织中C-MYC和MXI1表达的相关性 在100例晚期肺腺癌组织中,C-MYC和MXI1同时表达阳性者24例,同时表达阴性者16例,C-MYC阳性而MXI1阴性者28例,C-MYC阴性而MXI1阳性者32例,Spearman等级相关性分析显示C-MYC、MXI1表达呈负相关(r=-0.206,P<0.05)。见表4。
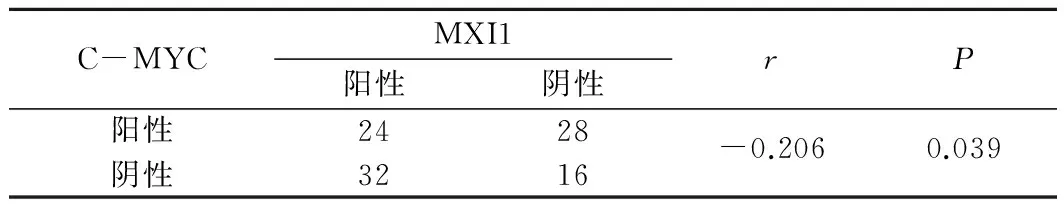
表4 晚期肺腺癌组织中C-MYC和MXI1表达的相关性 n
2.5 晚期肺腺癌患者C-MYC、MXI1表达与其中位生存时间的关系 应用Kaplan-Meier法对100例晚期肺腺癌患者进行生存分析,所有患者的中位生存时间是19.11个月,应用log rank法对2组之间患者进行生存时间比较,结果显示C-MYC阴性患者比C-MYC阳性患者具有较长的生存时间(21.00个月vs15.00个月),差异有统计学意义(χ2=10.890,P=0.001);而MXI1阳性患者比MXI1阴性组的患者具有较长的生存时间(21.00个月vs13.00个月),差异有统计学意义(χ2=15.080,P=0.001)。见图2、3。
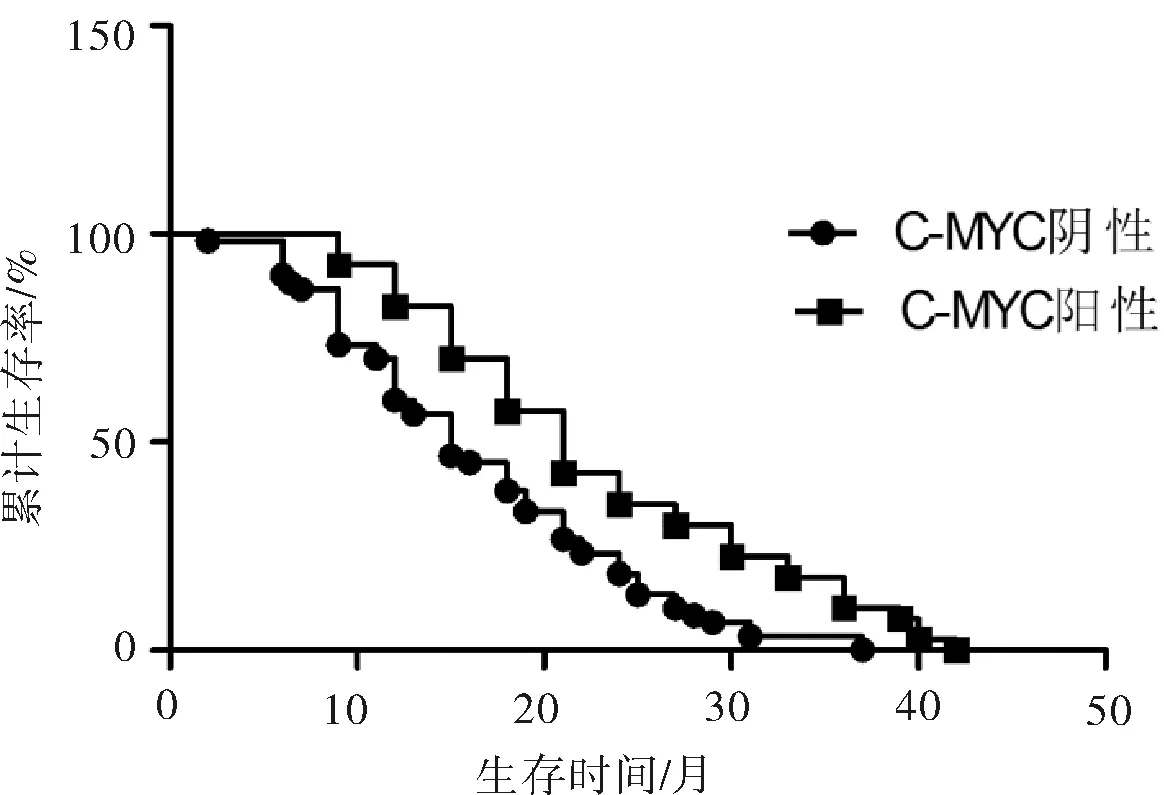
图2 C-MYC阳性患者和C-MYC阴性患者生存时间比较
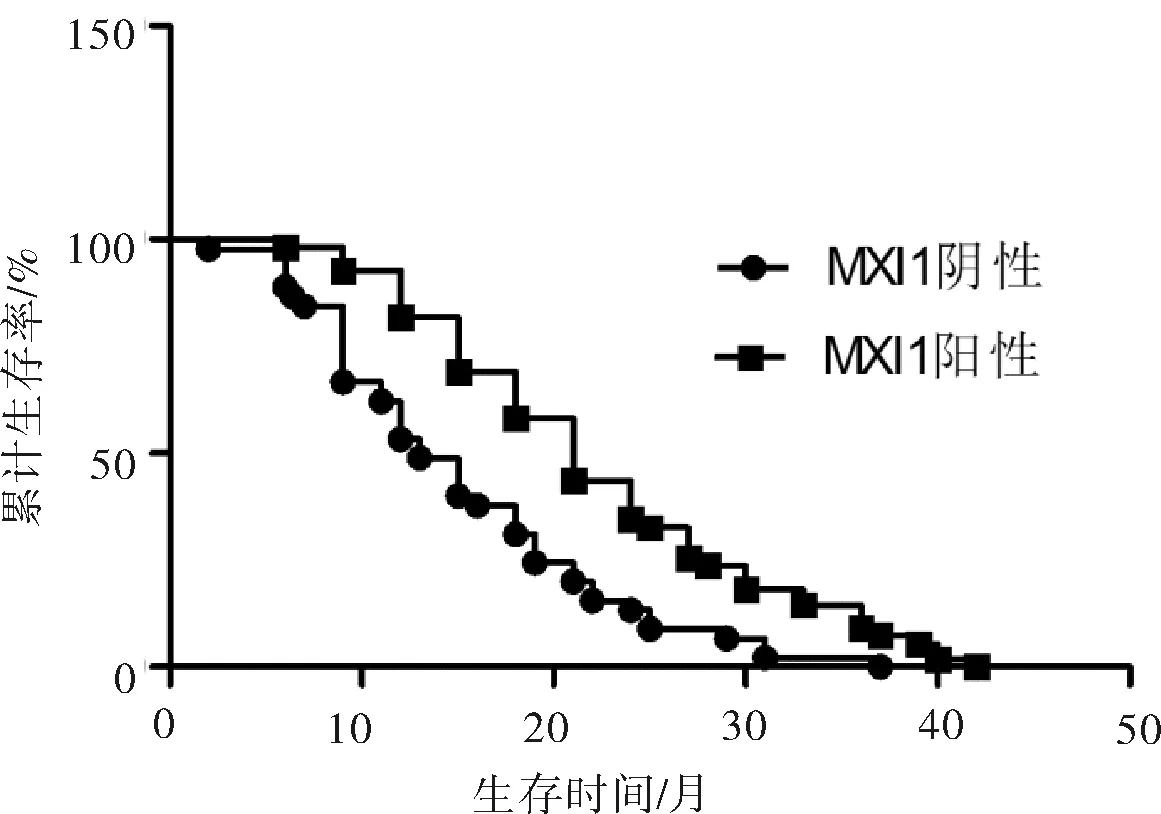
图3 MXI1阳性患者和MXI1阴性患者生存时间比较
3 讨论
C-MYC蛋白是最早发现与肿瘤细胞增殖活性相关的原癌基因产物之一,在人类许多肿瘤中高度表达[3]。C-MYC蛋白是一种多功能蛋白,有广泛的生物学功能,一方面参与细胞增殖、分化和细胞周期的调节,另一方面亦能启动凋亡和衰老程序[10]。在本研究中我们发现在晚期肺腺癌组织中C-MYC阳性表达率为60.00%,且其表达与患者的临床病理特征无明显关系,提示C-MYC表达在晚期肺腺癌中是普遍的现象。我们进一步对100例晚期肺腺癌患者进行了生存分析,所有患者的中位生存时间是19.11个月,应用log rank法对2组患者进行生存时间比较,结果显示C-MYC阴性患者比C-MYC阳性患者具有较长的生存时间。这可以直接说明C-MYC高表达可以影响患者的生存时间。从而可以说明C-MYC蛋白的高表达可能对晚期肺腺癌的预后有一定的影响,C-MYC可以作为晚期肺腺癌预后不良的标志。而Mad(包括MXI1、MAD1等)是C-MYC的拮抗蛋白,一般来讲,MYC/Max和MAD/Max二聚体的比例决定基因启动子的活性,如以MYC/Max二聚体占主导,则主要表现为刺激细胞增殖,如以MAD/Max二聚体占主导,则主要表现为抑制细胞生长,诱导细胞分化[7]。我们的研究发现在晚期肺腺癌组织中MXI1阳性表达率为55.00%,且其表达与患者的临床病理特征无明显关系,提示MXI1的表达亦在晚期肺腺癌中是普遍的现象。同样应用log rank法对2组之间患者进行生存时间比较,结果显示MXI1阳性患者比MXI1阴性患者具有较长的生存时间。这可以直接说明MXI1低表达可以影响患者的生存时间。从而可以说明MXI1蛋白的低表达可能对晚期肺腺癌的预后有一定的影响,MXI1可以作为晚期肺腺癌预后不良的标志。
本组数据显示C-MYC高表达的患者、MXI1低表达的患者预后较差,提示2种蛋白存在相关性,我们通过Spearman等级相关性分析显示C-MYC、MXI1表达呈负相关。这可能是癌基因C-MYC高表达和抑癌基因MXI1的低表达可以促进肿瘤细胞的增殖,抑制肿瘤细胞的凋亡等,从而促进晚期肺腺癌的发生和发展,影响了晚期肺腺癌患者的预后。我们前期的研究亦发现C-MYC和MXI1的异常表达与乳腺癌患者的发生、发展密切相关[9-11]。在此基础上我们进行了本研究,且研究结果相同,提示两者的异常表达在晚期肺腺癌患者的发生和演化中起到重要作用,为晚期肺腺癌的预后评估提供了新的指标。
[1] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[2] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2015[J].CA Cancer J Clin,2015,65(1):5-29.
[3] BEROUKHIM R, MERMEL CH, PORTER D, et al. The landscape of somatic copy-number alteration across human cancers[J]. Nature,2010,463(7283):899-905.
[4] FOLLIS AV, HAMMOUDEH DI, DAAB AT, et al. Small-molecule perturbation of competing interactions between c-MYC and Max[J]. Bioorg Med Chem Lett,2009,19(3):807-810.
[5] PARK S, CHUNG S, KIM KM, et al. Determination of binding constant of transcription factor myc-max/max-max and E-box DNA: the effect of inhibitors on the binding[J]. Biochim Biophys Acta,2004,1670(3):217-228.
[6] MUSTATA G, FOLLIS AV, HAMMOUDEH DI, et al. Discovery of novel Myc-Max heterodimer disruptors with a three-dimensional pharmacophore model[J]. J Med Chem,2009,52(5):1247-1250.
[7] SHIMIZU E, SHIRASAWA H, KODAMA K, et al. Expression, regulation and polymorphism of the mxi1 genes[J]. Gene,1996,176(1/2):45-48.
[8] 张真,张小涛,于兰,等. 乳腺癌CD44v6和Survivin的表达与临床预后的相关性研究[J]. 中国肿瘤临床,2011,38(14):835-838.
[9] 许林平,李威,马杰,等. 乳癌组织中C-MYC和MXI1的表达[J]. 郑州大学学报(医学版),2014,49(2):223-226.
[10]ALLDAY MJ. How does Epstein-Barr virus (EBV) complement the activation of Myc in the pathogenesis of Burkitt's lymphoma[J].Semin Cancer Biol,2009,19(6):366-376.
[11]XU LP, SUN Y, LI W, et al. MYC and MXI1 protein expression: potential prognostic significance in women with breast cancer in China[J]. Oncol Res Treat,2014,37(3):118-123.
