微小RNA对心力衰竭患者早期诊断价值的Meta分析
2017-03-07陈君张振海姜婷李春雨王魏魏毕超赵鹏程张劲松孟洁郝瑜陈彦
陈君 张振海 姜婷 李春雨 王魏魏 毕超 赵鹏程 张劲松孟洁 郝瑜 陈彦,
微小RNA(miRNA)是一种小分子非编码RNA,可以通过抑制翻译,诱导降解的方式参与多种基因调控的表达,近些年受到研究者的广泛关注。心力衰竭被定义为一种心脏结构或功能异常所致的临床综合征,患者具有典型的特征(如气短、踝部水肿和疲乏),伴有颈静脉压升高,肺部湿啰音和外周性水肿等体征,可导致患者静息或应激状态下心输出量减少或心腔内压力升高[1]。心衰为各种心脏疾病严重和终末阶段,发病率高。是当今最重要的心血管病之一。此外,许多病理疾病状态都可能发展成为心力衰竭,如心肌梗死、心肌肥大、心肌炎等[2]。目前,心力衰竭的诊断主要依靠患者的症状、超声心动图、心动图、BNP等综合诊断。然而近年来许多研究报道表明miRNA参与心血管系统多种疾病的发生发展。探讨miRNA在心力衰竭中的可能的调控机制和在心力衰竭中的表达水平有助于今后对心力衰竭的临床诊断提供新的思路。笔者采用Meta分析法汇总分析miRNAs对心力衰竭患者的诊断价值。
一、资料与方法
1.一般资料:研究类型为随机对照试验(RCT)[2]:纳入标准[3]:(1)研究对象符合纽约心脏协会(NYHE)心衰患者及健康者对照。(2)年龄≥18周岁且≤90周岁。(3)以灵敏度(SEN)、特异度(SPE)作为主要指标的文献,能够提取真阳性(TP)、真阴性(TN)、假阳性(TN)、假阴性(FN)等相关数据。(4)文献能获取全文且原始数据具体完整。(5)相同作者发表的类似文章,选取纳入病例量较大的。排除标准:(1)非随机对照研究。(2)其他生物类型的研究文献。(3)重复或低质量文献。(4)文献类型为综述、个案报道或meta分析等。(5)不能获得全文的文献。
2.方法:(1)测量指标:采用灵敏度(Sen)、特异度(Spe)、诊断优势比(DOR)、受试者工作特征曲红(ROC)下面积(AUC)作为评价指标。(2)网络检索:检索 PubMed、Medline、Web of science、CoChrane library、中国期刊全网全文数据库(CNKI)、万方数据库等,截止时间为2015年12月,检索词包括“MiRNAs”、“microRNA”或“微小 RNA”和“HF”、“Heart Failure”、“心力衰竭”,同时手工检索相关杂志并在参考文献中追踪简阅相关文献,以免遗漏。(3)文献筛查和资料提取:由两位独立评价者按照纳入和排除标准筛选文献,而后进一步查找并阅读全文复筛。完成交叉核对,意见不一致时通过专家讨论解决,提取内容包括:一般资料(文题、作者姓名、发表日期和文献来源等),患者基本信息(数量、平均年龄、性别及检测指标等),研究的miRNAs种类,对照的生物标志物,测量指标包括灵敏度、特异度、真阳性数、假阳性数、真阴性数、假阴性数等。(4)质量评价:对于纳入文献的全文,按照Cochrane Handbook随机对照试验质量评价的标准,从分配序列的产生、隐藏分组、盲发、失访4个方面对每篇文献的质量进行评价,将每个方面按是、否和不清楚分为三级。
3.统计学分析:利用Meta Disc软件进行统计分析和数据处理。用计算Cochran-Q统计量与I2值对灵敏度、特异度、诊断优势比进行异质性检验,Q值服从X2分布,若检验结果为P>0.10或I2<50%时,表明多个研究具有同质性;若多个研究结果为P≤0.10或I2>50%时,表明存在显著异质性。如果各研究之间无异质性,则进行效应量的合并,反之则用随机效应模型来合并。比较参数的差异和分析是否有统计学意义。
二、结果
1.纳入文献基本情况:最初检出文献1 772篇,剔除重复文献203篇,对筛选后的文章阅读摘要后排除1 241篇,初步纳入328篇。阅读全文后根据纳入排除标准剔除文献520篇,最终纳入8个研究[4-11],共624例受试者。
2.总miRNAs:8个研究共牵涉及19种 miRNA,用于诊断结果的Spearman相关系数=-0.072(P>0.05),提示在8项研究的结果中不存在阈值效应,Q检验提示入选研究之间不存在出阈值效应以外的其他异质性来源,灵敏度、特异度及其可信区间(CI)以及 SROC分别为 0.75(0.72~0.78),0.67(0.63~0.70)和0.7818。见图1~2。
3.亚组分析:共有 5篇研究[6-10]报道了 miRNA423-5p,各研究之间异质性明显(P<0.10),进行异质性来源分析,计算灵敏度对数与(1-特异度)对数的Spearman相关系数=-0.103(P>0.05),提示不存在阈值效应,根据树状图可得知异质性来源主要来源于Ellis KL[8]的研究,剔除后异质性为0,计算其合并灵敏度、特异度、诊断性OR及其95%CI和ROC为0.83(0.75,0.88)、0.71(0.62,0.79)、13.69(4.31,43.52)、0.8933。见图3~5。
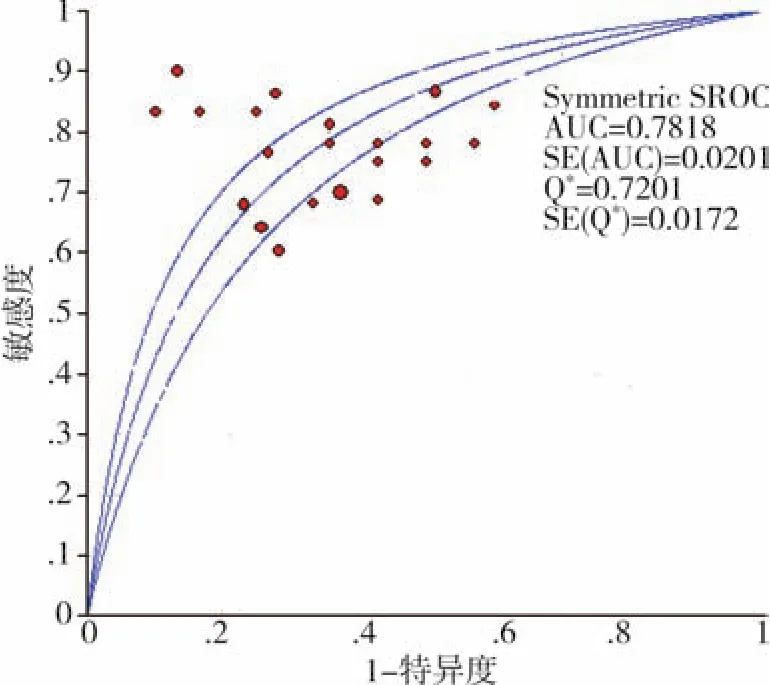
图1 总miRNAs的SROC
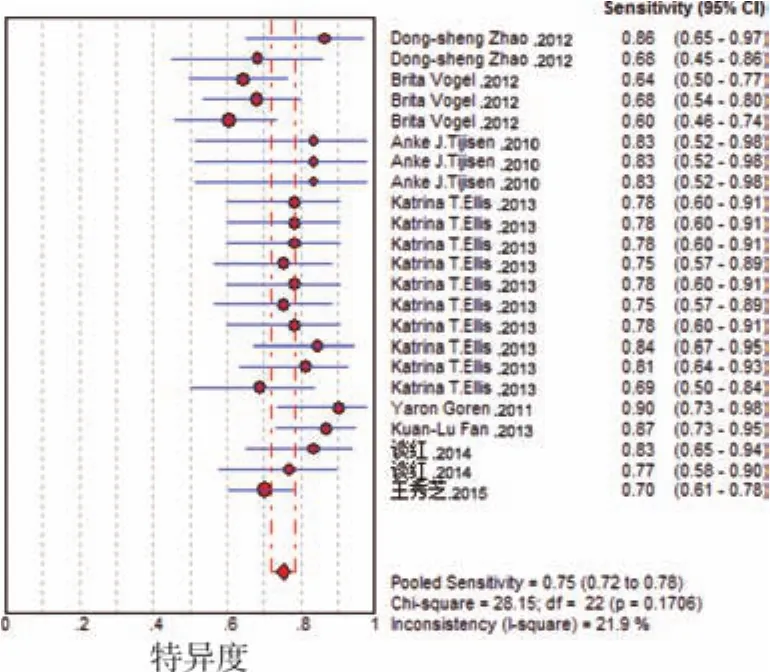
图2 总miRNA的敏感度及特异度
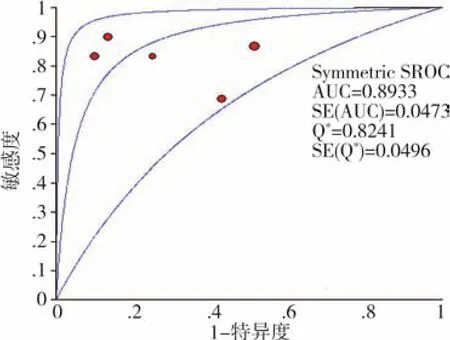
图3 miRNA423-5p的SROC
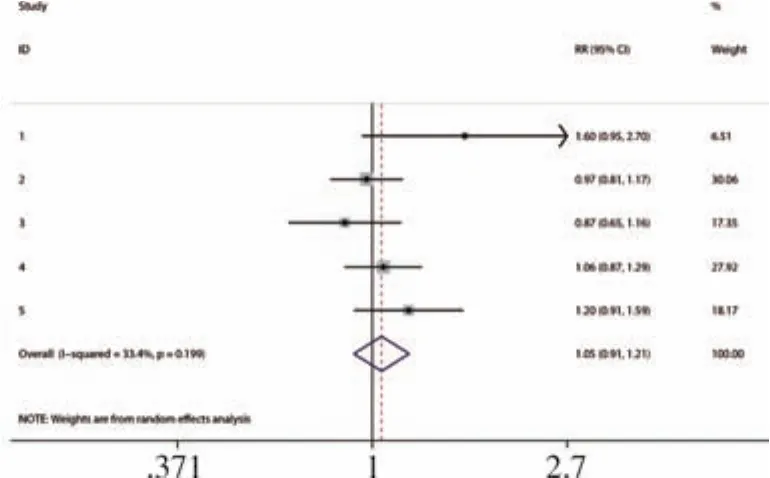
图4 miRNA对心力衰竭诊断的影响
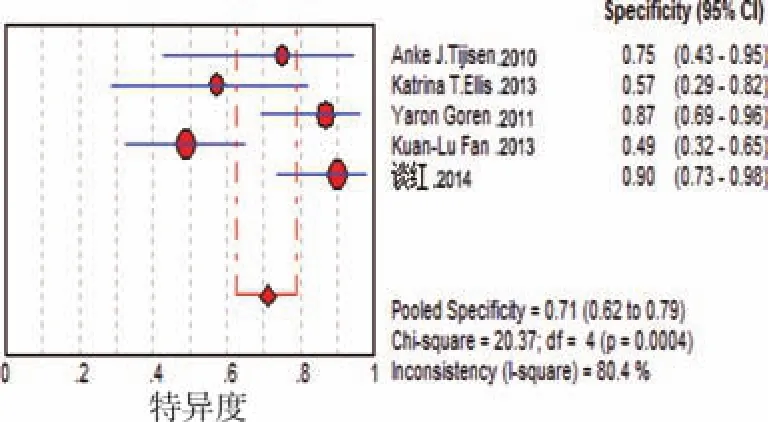
图5 miRNA4234-P的敏感度及特异度
三、讨论
心力衰竭是一种造成死亡和残疾的全球性的心血管疾病,多见于老年人。同时心力衰竭是有多种临床症状的复杂进行性疾病,其原因是由于病变的心脏不能提供维持器官代谢需要的血流量。许多病理疾病状态都能发展成为心力衰竭。miRNA在心力衰竭诊断中的作用也日渐重要。笔者通过系统检索关于miRNAs诊断心力衰竭的研究,最终纳入8项研究,涉及miRNAs一共19种,其中研究较多的有1种,为miRNA423-5p。
关于miRNAs的诊断价值。就灵敏度而言,本文得到的总miRNA、miRNA-423-5p分别为0.75和0.83,可以看出miRNA-423-5p诊断心力衰竭的灵敏度较高。从特异度来讲,本文得到的总miRNA及miRNA-423-5p分别为0.67和0.71,可以看出miRNA423-5p诊断心力衰竭的特异度较高。
目前,miRNA在诊断心力衰竭的作用更加重要,Watson等[13]选择 miR-30c,-146a,-221,-328,-375等 5种 miRNA对非心力衰竭和心力衰竭患者的表达量进行分析。由于表达量在非心力衰竭及心力衰竭患者中的表达量有差异,发现与单纯使用BNP作为诊断标准比较,BNP联合miRNA能够显著区分出非心力衰竭患者及心力衰竭患者。Ellis[14]也发现 4种 miRNA(miR-103,miR-142-3p,miR-30b,miR-342-3p)联合脑钠肽前体(NT-proBNP)水平分析能提高其诊断价值。本研究中,关于miRNAs和传统生物标志物的相关性,本文纳入的8项研究中有4篇提到了pro-BNP,其中5篇提到了BNP,表明新型标志物miRNAs和传统标志物存在较强的相关性。目前miRNA作为一种新型标志物,miRNA中的一种或多种联合BNP诊断使用能够显著提高心力衰竭诊断的特异性,同时能够明显减少诊出时间,虽然目前miRNA作用机制已经明确,但是我们能掌握的只是很小的一部分,大量miRNA的调控机制仍未清楚,尚停留在表达水平的检测阶段,真正把miRNA作为诊断方法还需要进一步的探索,但是miRNA在心力衰竭疾病的探索为以后开发新的分子水平的诊断方法提供了新的思路。
本系统评价仍有一些不足:首先miRNA检验心力衰竭的研究近年来才刚刚起步,相关报道较少,虽然尽可能采取多种途径广泛收集国内外文献,但由于本文只检索了中、英文文献,所以部分国家及地区的文献不能纳入,从而造成了一些文献的缺失,研究纳入的心力衰竭患者严重程度及miRNAs的检测仪器及方法不同将会影响Meta分析结果。未来需要大量研究来为其进入临床应用提供理论基础。
1 Ponikowski P,Voors AA,Anker SD,et al.2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure:The Task Force for the diagnosis and treatmentof acute and chronic heart failure of the European Society of Cardiology(ESC)Developed with the special contribution of the Heart Failure Association(HFA)of the ESC[J].Eur Heart J,2016,37(27):2129-2200.
2 Johnson FL.Pathophysiology and etiology of heart failure[J].Cardiol Clin,2014,32(1):9-19.
3 POISE Study Group,Devereaux PJ,Yang H,et al.Effects of extended-release metoprolol succinate in patients undergoing noncardiac surgery(POISE trial):a randomised controlled trial[J].Lancet,2008,371(9627):1839-1847.
4 梁健球.关于心肌梗死后心力衰竭患者血浆中miRNA表达及基于ECHO的心肌能量消耗的研究[D].广州:南方医科大学,2013.
5 Zhao DS,Chen Y,Jiang H,et al.Serum miR-210 and miR-30a expressions tend to revert to fetal levels in Chinese adult patients with chronic heart failure[J].Cardiovasc Pathol,2013,22(6):444-450.
6 Vogel B,Keller A,Frese KS,etal.MultivariatemiRNA signatures as biomarkers for non-ischaemic systolic heart failure[J].Eur Heart J,2013,34(36):2812-2823.
7 Tijsen AJ,Creemers EE,Moerland PD,et al.MiR423-5p as a circulating biomarker for heart failure[J].Circ Res,2010,106(6):1035-1039.
8 Ellis KL,Cameron VA,Troughton RW,et al.CirculatingmicroRNAs as candidate markers to distinguish heart failure in breathless patients[J].Eur JHeart Fail,2013,15(10):1138-1147.
9 Goren Y,Kushnir M,Zafrir B,et al.Serum levels ofmicroRNAs in patients with heart failure[J].Eur J Heart Fail,2012,14(2):147-154.
10 Fan KL,Zhang HF,Shen J,et al.Circulating microRNAs levels in Chinese heart failure patients caused by dilated cardiomyopathy[J].Indian Heart J,2013,65(1):12-16.
11 谈红,李艳敏,张红明,等.慢性充血性心力衰竭患者血浆miR-423-5p和miR-210-3p的表达变化[J].临床心血管病杂志,2014,30(12):1081-1085.
12 王秀芝,徐东杰.血清微小RNA-21-5p表达量预测急性心力衰竭患者近期预后的价值[J].江苏医药,2015,41(16):1931-1933.
13 Watson CJ,Gupta SK,O’Connell E,et al.MicroRNA signatures differentiate preserved from reduce ejection fraction heart failure[J].Eur JHeart Fail,2015,17(4):405-415.
14 Ellis KL,Cameron VA,Troughton RW,etal.CirculatingmicroRNAs as candidate markers to distinguish heart failure in breathless patients[J].Eur JHeart Fail,2013,15(10):1138-1147.
