重楼皂苷抑制卵巢癌细胞增殖和转移、诱导其凋亡分子机制研究
2017-03-04刘宗谕王碧航范丽梅
刘宗谕,李 丹,王碧航,范丽梅*
(1.吉林大学白求恩医学部临床医学院,吉林 长春130021;2.吉林大学第二医院,吉林 长春130041)
重楼皂苷抑制卵巢癌细胞增殖和转移、诱导其凋亡分子机制研究
刘宗谕1,李 丹2,王碧航2,范丽梅2*
(1.吉林大学白求恩医学部临床医学院,吉林 长春130021;2.吉林大学第二医院,吉林 长春130041)
卵巢癌近年来在妇科门诊和病房中发病率逐渐增多,属于女性生殖器官常见的恶性肿瘤之一,病死率极高,严重危害了患者身体健康和生存质量。目前国内对卵巢恶性肿瘤的治疗主要还是以化疗、手术切除为主,研究显示,化疗的药物治疗效果和所用剂量呈正比[1]。但是,长期化疗,剂量在体内不断累积会导致较严重的不良反应,严重的患者可出现过敏性休克、心血管系统和骨髓造血系统均受到严重影响,一般不良反应即脱发、骨骼肌肉酸痛以及胃肠道反应等[2]。因此,临床许多专家学者对于卵巢癌治疗手段已经从传统方法逐渐研究、实验、开拓到使用天然物质中提取无副作用或者不良反应很轻微的有效成分来对抗恶性肿瘤,本文主要探讨从天然中药材中提取的物质作用于卵巢癌细胞的机制,分析其对抗恶性肿瘤的临床效果,总结其浓度与癌细胞作用时间的相关性,现报道如下。
1 资料与方法
1.1 一般资料
本次实验所用的实验材料有人乳头状浆液性卵巢癌细胞,来自于我省肿瘤医院研究所提供[3];实验药品有重楼皂苷Ⅰ粉剂(中国药品生物制品检定所生产,批号111590-200402)。用DMSO(二甲基亚砜)助溶,配成高浓度原液(100 μg/μL),-20~20℃保存。工作液浓度按实验需要临用前用RPMI1640培养液配制,其中DMSO终浓度小于0.5%;实验试剂HyClon RPMI1640培养基;HyClon胎牛血清;Cell Counting Kit-8(日本同仁化学研究所生产;Cycle Test PlusrTM DNA Reagent Kit (Becton Dickinson公司);FITC Annexin V Apoptosis Detection kit(BD Pharmingen公司);Hoechst33258染色试剂(碧云天生物技术有限公司);实验设备与仪器是奥林帕斯倒置显微镜(日本Olympus IMT-2-21);全自动细胞计数仪(美国Bioscience Nexcelom公司);酶标仪(美国Thermo公司);流式细胞仪(BD FRCS Calihur);荧光显微镜(尼康Ti一E倒置显微镜)[4]。
1.2 方法
将重楼皂苷按照不同浓度分为4组,每组浓度间隔为1 μg/ml,接种到平板中,细胞需在常温下保存,在CO2分压为5%的培养箱中进行细胞培养,根据细胞增殖抑制率公式计算细胞增殖抑制率;细胞周期在重楼皂苷影响的实验方法也是建立4个不同的浓度梯度,间隔同上,记录24 h、48 h、72 h三个时间点的数值,将30万细胞为单位接种到1640培养液中,在CO2分压为5%的培养箱中进行细胞培养,24 h后将细胞收集并且逐渐加入70%的酒精来将细胞进行固定,固定好后置入冰箱备用,冰箱温度为4℃,待第二天取出固定好的细胞100 μl,离心5 min,去除上清液和酒精;浓度梯度分组同上,采用PI染色法染色,在光镜下检测凋亡细胞,接种培养基的细胞单位为50万,同样条件下培养细胞,收集3 h和6 h的细胞。
1.3 统计学分析
采用SPSS 17.0对所得资料进行统计学分析,计量资料采用单因素方差分析,各组比较P<0.05表示有显著统计学意义。
2 结果
各时间点细胞增殖抑制曲线所得重楼皂苷I的半数抑制浓度(IC50):24 h、48 h、72 h、分别为3.38 μg/mL、1.29 μg/mL、1.17 μg/mL,集中在1-3.5 μg/mL之间;当重楼皂苷作用于卵巢癌细胞不同时相的结果间比较,有统计学差异,详见表1、表2、表3。
重楼皂苷Ⅰ作用癌细胞3 h便可以诱导其进行早期凋亡,6 h后可显著诱导,凋亡率分别为30.67%和38.72%,两组比较有显著统计学差异(P<0.01),高浓度组即3 μg/ml组的凋亡率则有所下降。

表1 不同浓度梯度的重楼皂苷Ⅰ对卵巢癌细胞24 h 周期性影响分析
注:与对照组比较P<0.05

表2 不同浓度梯度的重楼皂苷Ⅰ对卵巢癌细胞48 h 周期性影响分析
注:与对照组比较P<0.05
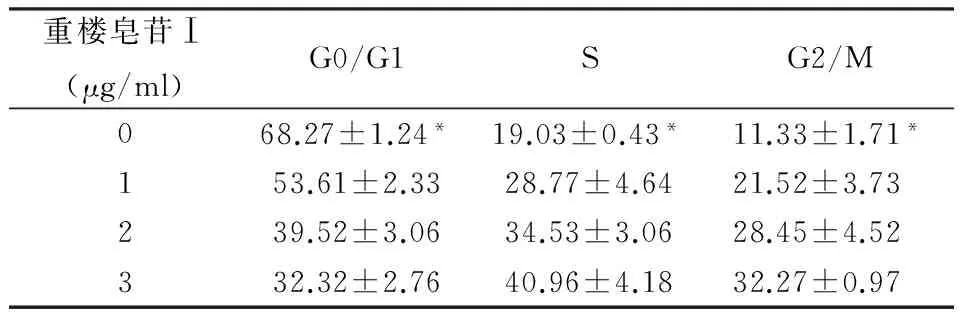
表3 不同浓度梯度的重楼皂苷Ⅰ对卵巢癌细胞72 h 周期性影响分析
注:与对照组比较P<0.05
3 讨论
重楼属于百合科或七叶一枝花根茎,中医认为其药效具有清热解毒[5]、消肿止痛、凉肝定惊的功效,西医范畴解释其具有免疫调节、止血抗肿瘤等药效作用。甾体皂苷是重楼的主要化学成分,所占比例为80%[6],是抗癌细胞的有效成分,近年来已经有许多学者经过实验证实了重楼皂苷及其提取物有对抗恶性肿瘤的作用[7]。国外学者报道了关于15种中药的乙醇提取物和水的提取物对癌细胞的抗肿瘤包括了肝癌细胞、胃癌细胞、结肠癌细胞以及食管腺癌细胞[8],胃癌细胞体外的抑制作用较为明显,通过小鼠模型的实验证明了无论体外还是体内,重楼皂苷均有很强的抗肺癌作用。
本研究是提取了重楼皂苷Ⅰ,分析其对卵巢癌细胞的抗癌作用效果,按照不同浓度梯度进行实验分组,结果显示出重楼皂苷提取物对卵巢癌细胞的抑制作用较为明显,而当提取物剂量较低时,抑制的效果较差,在浓度剂量为1 μg/ml的时候,抑制率显著增加,并随浓度升高而升高,二者存在显著的剂量-效应关系,这与以往报道相一致[9]。传统的抗肿瘤药物多为周期特异性,机理主要是干扰细胞的有丝分裂和增殖,达到抑制肿瘤生长的目的,文献报道表示[10],重楼提取液对人的结肠癌细胞增殖作用24 h以后,S期的分布比例上升,而G0/G1期比例下降、G2/M期的细胞分布增加,这一现象说明了重楼提取液可能是抑制了癌细胞的蛋白质和DNA的合成达到抑制生长和增殖的目的[11],当作用了48 h以后,G0/G1期细胞比例开始显著减少,S期和G2/M期的细胞分布是增加状态,这一结果说明了期干扰DNA合成是在前期。诱导细胞凋亡也是抗肿瘤的机制之一,国外学者研究发现[12],重楼皂苷Ⅰ作用于卵巢癌的裸鼠模型时,主要以线粒体途径来完成诱导细胞凋亡,从而达到抑制癌性生长的目的,本次试验结果和裸鼠实验结果相一致[13],但是本次结果发现浓度较高时,细胞的凋亡率并不高,这可能与细胞直接杀伤有关[15]。
综上所述,重楼皂苷Ⅰ对卵巢癌细胞的生长有显著的抑制作用,各浓度梯度效果不同,可以通过诱导细胞凋亡对抗癌细胞的生长,为临床治疗提供科学的理论依据。
[1]张晓洁,查岭生,陈小静,等.一株产重楼皂甙内生细菌的分离与鉴定[J].微生物学通报,2006,33(5):84.
[2]张嘉玲,郑长军,杨瑞琦,等.重楼皂苷Ⅶ联合顺铂通过内质网应激诱导卵巢癌细胞凋亡[J].中国实验诊断学,2015,(1):6.
[3]陈 军,王碧航,张嘉玲,等.重楼皂苷Ⅶ联合二氧化硅纳米复合体对裸鼠卵巢癌的抑制及抗氧化作用[J].中华医学杂志,2015,95(29):2393.
[4]杨瑞琦,戚 洁,张嘉玲,等.重楼皂苷Ⅶ与二氧化硅纳米复合体对卵巢癌耐药性的体外影响[J].中华医学杂志,2015,95(23):1859.
[5]罗 敏,顾琳慧,冯建国,等.重楼皂苷Ⅰ作用于人卵巢癌细胞株体外生物学效应研究[J].实用肿瘤学杂志,2012,26(4):293.
[6]顾琳慧.重楼皂苷I对高转移人卵巢癌细胞体外生长抑制及抗转移功能研究[D].浙江中医药大学,2011.
[7]Al Sawah E,Marchion DC,Xiong Y,et al.The Chinese herb polyphyllin D sensitizes ovarian cancer cells to cisplatin-induced growth arrest[J].J Cancer Res Clin Oncol,2015,141(2):237.
[8]Yang,Mei,Zou,Juan,Zhu,Hongmei,et al.Paris saponin II inhibits human ovarian cancer cell-induced angiogenesis by modulating NF-kappa B signaling[J].Oncology reports,2015,33(5):2190.
[9]Linhui Gu,Jianguo Feng,Haiyan Xu,et al.Polyphyllin I inhibits proliferation and metastasis of ovarian cancer cell line HO-8910PM in vitro[J].中医杂志(英文版),2013,33(3):325.
[10]郑 彬,王穗暖,屈洪涛,等.重楼皂苷Ⅰ与重楼皂苷Ⅱ对胶质瘤细胞U251的抑制作用及其机制研究[J].中华神经医学杂志,2013,12(12):1220.
[11]张嘉玲,郑长军,杨瑞琦,等.重楼皂苷Ⅶ联合顺铂通过内质网应激诱导卵巢癌细胞凋亡[J].中国实验诊断学,2015,19(1):6.
[12]陈 清,夏亚飞,阎 姝,等.HPLC比较醇提重楼及其颗粒中重楼皂苷Ⅰ,Ⅱ的含量[J].中国实验方剂学杂志,2012,18(6):78.
[13]王 震,李亚荣,郝 杰,等.重楼皂苷Ⅶ对耐顺铂人肺腺癌A549/DDP细胞增殖的抑制作用[J].中国老年学杂志,2013,33(1):145.
[14]Yin X,Qu C,Li Z,et al.Simultaneous determination and pharmacokinetic study of polyphyllin I,polyphyllin II,polyphyllin VI and polyphyllin VII in beagle dog plasma after oral administration of Rhizoma Paridis extracts by LC-MS-MS[J].Biomed Chromatogr,2013,27(3):343.
[15]Wu S,Gao W,Qiu F,et al.Simultaneous quantification of Polyphyllin D and Paris H,two potential antitumor active components in Paris polyphylla by liquid chromatography-tandem mass spectrometry and the application to pharmacokinetics in rats[J].J Chromatogr B Analyt Technol Biomed Life Sci,2012,905:54.
吉林省产业技术与开发项目(2013C026-4)
1007-4287(2017)02-0317-03
2016-09-28)
*通讯作者
