探讨键合表阿霉素纳米胶束对肝癌Walker-256细胞周期的影响
2017-03-04宋晓斌李晨玉方晓白宋金明刘铜军饶艳伟
宋晓斌,李晨玉,方晓白,张 鑫,宋金明,刘铜军,饶艳伟,杨 威
(1.吉林省人民医院 急诊外科,吉林 长春130021;2.吉林大学第一医院;3.吉林大学中日联谊医院)
探讨键合表阿霉素纳米胶束对肝癌Walker-256细胞周期的影响
宋晓斌1,李晨玉1,方晓白1,张 鑫1,宋金明1,刘铜军3,饶艳伟1,杨 威2*
(1.吉林省人民医院 急诊外科,吉林 长春130021;2.吉林大学第一医院;3.吉林大学中日联谊医院)
原发性肝癌是我国最常见的恶性肿瘤之一,早期诊断困难,手术切除率低,临床治疗以化学疗法为主。传统的小分子化疗药物缺乏对肿瘤组织的特异性,间断性的冲击化疗在杀死肿瘤细胞的同时,也会对正常组织产生毒副作用,并易导致肿瘤细胞耐药性的产生,远期疗效并不满意[1]。因此,以提高药效和降低药物副作用为目的的纳米靶向控释系统应用在肝癌化学疗法中逐渐成为国内外学者研究的热点。
表阿霉素(EPI)是蒽环类抗癌抗生素的新成员,目前在临床上已逐渐代替阿霉素(ADM),成为肝癌、胃癌、乳腺癌、胰腺癌等多种恶性肿瘤的一线用药。Cyclin1是P53基因的一个靶向转录因子,Cyclin1启动子中包含两个P53结合位点[2],当发生基因损伤时,P53激活,Cyclin G1表达增高,抑制细胞发生增殖。Cyclin G被认为是在细胞周期G2/M期起主要调节作用[3]。
所以,本研究设想以EPI为前体药物,采用透析法制备化学键合的载表阿霉素纳米胶束(EPI-NPs),研究EPI-NPs对Walker-256细胞的增殖相关蛋白的作用机制。
1 材料与方法
1.1 药品及主要试剂 表阿霉素(EPI)原药购于浙江海正制药有限公司,空白及键合表阿霉素纳米胶束于中国科学院长春应用化学研究所制备,Cyclin G1蛋白抗体(美国 Abcam公司)。肝癌Walker-256细胞株购自北京医科院肿瘤研究所。
1.2 细胞培养
Walker-256细胞株为液氮冷冻保存,实验复苏Walker-256细胞株,加入DMEM培养液,以2×104/cm2的密度接种于25 cm2培养瓶中,置于37℃,5%CO2的恒温培养环境中培养,Walker-256细胞为贴壁生长细胞。细胞传代采用0.4%胰酶消化,正常组给予更换培养液;空白键束组给予更换含0.5 μg/ml的空白键束培养液;EPI组给予更换含5 μg/ml的EPI培养液;EPI-NPs组为更换含5 μg/mlEPI-NPs培养液,进行72小时培养,之后进行相关分子生物学检测。
1.3 MTT法检测胃癌细胞存活率 按使用说明书用MTT法(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)检测细胞增殖能力。全自动酶标仪(波长492 nm)测定各孔OD值,计算细胞增殖率。
1.4 流式细胞术检测细胞周期 取对数生长期的Walker-256细胞,消化后以5×105接种于50 cm2培养瓶,分别按前述方式加入5 μg/ml的EPI和EPI-NPs,以及0.5 μg/ml的PEG-b-P(LA-co-DHP/NPC)空白胶束,对照组加入等体积DMEM培养液。72 h后,分别用胰酶消化,收集细胞2×106个,1 000 rpm离心5 min,弃去培养液。按照试剂盒说明书处理后,混匀后上流式细胞仪做单参数分析。实验数据用累积曲线分割法计算各期细胞所占比例。
1.5 Western Blot检测肝癌Walker-256细胞中Cyclin G1蛋白表达 提取细胞总蛋白,Bio-Rad法测定蛋白含量,测定样品的蛋白浓度。用Image J图像处理软件计算各条豆类灰度值,分析Cyclin G1蛋白的表达情况。目的蛋白与内参照β-肌动蛋白(β-actin)灰度值的比值进行表述。

2 结果
2.1MTT法检肝癌Walker-256细胞的增殖率
细胞增殖率显示:与正常组相比,空白键束组没有明显的改变,但是在EPI组和EPI-NPs组的Walker-256细胞增殖率显著降低,有显著的统计学意义(P<0.01)。与EPI组相比,EPI-NPs组的Walker-256细胞增殖率降低,有统计学意义(P<0.05),见图1。

**P<0.01:与对照组相比,有显著的统计学意义;#P<0.05:与EPI组相比,有统计学意义。
图1 MTT检测肝癌Walker-256细胞增殖率
2.2 流式细胞术检测肝癌Walker-256细胞经EPI-NPs处理后细胞周期的改变
流式细胞术结果显示:发现Walker-256细胞在对照组和空白键束组没有明显的区别;EPI组和EPI-NPs组细胞停滞于G2/M期的细胞数均明显高于对照组(P<0.05);与EPI组相比,EPI-NPs组的G2/M期的细胞数明显增高(P<0.01),见表1。

表1 流式细胞术检测肝癌细胞细胞 周期分布
**P<0.01:与对照组相比,有显著的统计学意义;#P<0.05:与EPI组相比,有统计学意义。
2.3 Western Blot检测肝癌Walker-256细胞Cyclin G1蛋白表达
与正常组相比,空白键束组的组中Cyclin G1表达没有明显变化,而EPI组和EPI-NPs组中的Cyclin G1蛋白表达明显降低,有显著统计学意义(P<0.01)。与空白键束组相比,EPI组和EPI-NPs组中的Cyclin G1表达也明显降低(P<0.01)。与EPI组相比,EPI-NPs组中的Cyclin G1明显降低,有统计学意义(P<0.05),见图2。
3 讨论
原发性肝癌是我国最常见的恶性肿瘤之一,早期诊断困难,手术切除率低,临床治疗以化学疗法为主。传统的小分子化疗药物缺乏对肿瘤组织的特异性,间断性的冲击化疗在杀死肿瘤细胞的同时,也会对正常组织产生毒副作用,并易导致肿瘤细胞耐药性的产生,远期疗效并不满意。本研究以提高药效和降低药物副作用为目的采用EPI-NPs治疗肝癌。前期研究结果表明了EPI-NPs在肝癌Walker-256细胞中有良好的缓释性,其释放速率随着PH的降低而升高,且其随着作用时间的增加,而表现出了良好的细胞毒性。介于其良好的缓释性和细胞毒性,我们进步探讨其在肝癌细胞中的作用机制。首先我们检测细胞的增值率,发现在培养72 h后,EPI-NPs组的细胞增殖率的抑制作用明显比EPI组高,这说明在肝癌的化疗过程中EPI-NPs有很高的抑制作用。在细胞周期中,G2/M期是细胞增殖的重要阶段,是细胞周期的两个调节点之一。表阿霉素的主要作用机制即是在DNA复制过程中诱导TOPOⅡ抑制剂,DNA断裂物复合物的形成,诱导细胞凋亡并使细胞阻滞于G2/M期[4]。我们通过流式细胞术检测细胞周期,发现了细胞绝大多数都被抑制在G2/M,且EPI-NPs组与EPI组相比,抑制数明显增高。所以,我们进一步的怀疑了EPI-NPs是否通过影响细胞周期性蛋白来调控细胞的转归。
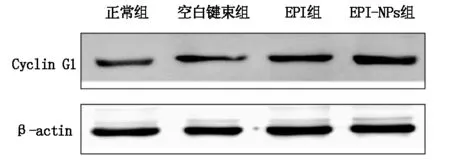
图2 Western Blot检测肝癌Walker-256
现阶段认为Cyclin1蛋白是P53基因的靶向转录因子,Cyclin1启动子中有两个P53结合位点[2],当细胞发生基因损伤时,P53被激活,Cyclin G1表达增高,抑制细胞发生增殖。在我们的前期的研究发现,经过EPI-NPs处理的肝癌细胞中P53是被激活的。为了验证EPI-NPs是否通过影响细胞周期性蛋白来调控细胞转归的,我们通过Western Blot法检测了细胞周期性相关蛋白Cyclin G1的表达,研究结果与我们预期一致,在EPI-NPs组中Cyclin G1蛋白高表达,而且其表达水平明显高于EPI组。所以,这充分的说明了EPI-NPs通过影响细胞周期性相关蛋白Cyclin G1来改变细胞的增值率的。在Xiaoming Zhao[5]等的研究结果中证明了Cyclin G1和MEF2D可以通过miR-122的作用下调了肺癌细胞的生存率。这进一步说明了Cyclin G1对细胞的增值的影响。
总之,本研究证明了EPI-NPs能增加肝癌Walker-256细胞的增值抑制作用,其主要通过改变细胞周期的G2/M的来实现的,可能通过P53/Cyclin G1细胞途径来实现的。
[1]Nori A,KoPecek J.Intracellular targeting of polymer-bound drugs for cancer chemotherapy[J].Adv Drug Deliv Rev,2005,57(4):609.
[2]Thomas M,Deiters A .MicroRNA miR-122 as a therapeutic target for oligonucleotides and small molecules[J].Curr Med Chem,2009,20:3629.
[3]Jiang L,Liu R,Wang Y,et al.The role of Cyclin G1 in cellular proliferation and apoptosis of human epithelial ovarian cancer[J].J Mol Histol,2015,46(3):291.
[4]Zimmermann M,Arachchige-Don AS,Donaldson MS,et al.Elevated Cyclin G2 expression intersects with DNA damage checkpoint signaling and is required for a potent G2/M checkpoint arrest response to doxorubicin[J].J Biol Chem,2012,287(27):22838.
[5]Zhao X,Liu M,Li D.Oleanolic acid suppresses the proliferation of lung carcinoma cells by miR-122/Cyclin G1/MEF2D axis[J].Mol Cell Biochem,2015,400(1-2):1.
吉林省科技厅资助项目(No.20130206033SF)
1007-4287(2017)02-0313-03
宋晓斌,男,副主任医师,博士研究生;杨威,女,副主任医师,博士研究生。
2016-10-16)
*通讯作者
