甘露消毒丹及其拆方对感染肠道病毒71型细胞miR-146a和Toll样受体4 mRNA表达的影响
2017-03-03艾碧琛何宜荣曹蓉何栋赵国荣贺又舜
艾碧琛,何宜荣,曹蓉,何栋,赵国荣,贺又舜
1.湖南中医药大学中医学院,湖南 长沙 410208;2.湖南中医药大学研究生院 湖南 长沙 410208
甘露消毒丹及其拆方对感染肠道病毒71型细胞miR-146a和Toll样受体4 mRNA表达的影响
艾碧琛1,何宜荣1,曹蓉1,何栋2,赵国荣1,贺又舜1
1.湖南中医药大学中医学院,湖南 长沙 410208;2.湖南中医药大学研究生院 湖南 长沙 410208
目的探讨甘露消毒丹及其拆方对肠道病毒71型(EV71)感染后免疫及炎症反应的调节作用。方法运用细胞培养技术,设甘露消毒丹组(甘全方组)、清残方组、利残方组、病毒唑组、正常组、模型组,进行病毒毒力和药物细胞毒性测定后,以药物作用于EV71感染后的RD细胞,24 h后RT-PCR检测各组细胞miR-146a、Toll样受体4(TLR4)mRNA表达。结果与正常组比较,模型组miR-146a mRNA表达降低,TLR4 mRNA表达升高;与模型组比较,甘全方组、清残方组、利残方组miR-146a mRNA表达升高、TLR4 mRNA表达降低,病毒唑组与模型组比较差异不明显;与甘全方组比较,清残方组miR-146a、TLR4 mRNA表达降低,利残方组miR-146a mRNA表达升高、TLR4 mRNA表达降低;与清残方组比较,利残方组miR-146a mRNA表达升高,TLR4 mRNA表达无明显差异。结论甘露消毒丹可能通过调节miR-146a、TLR4 mRNA表达从而影响EV71感染所致免疫反应,其中清残方与利残方可能存在互相拮抗效应。
甘露消毒丹;拆方;肠道病毒71型;miRNA-146a;Toll样受体4
手足口病是由多种肠道病毒引起的一种婴幼儿和儿童常见传染病,近年手足口病的发病率及病死率有增高趋势[1]。肠道病毒71型(EV71)及柯萨奇病毒A组16型(CoxAl6)为手足口病最主要的致病病毒,其中重症手足口病病情进展快,死亡率较高,多由EV71感染引起,致死原因主要为脑干脑炎及神经源性肺水肿。目前缺乏特异高效的抗手足口病病毒药物,对手足口病尚无特异性治疗方法,主要以对症治疗为主,疗效并不理想。中医学者大多认为手足口病属中医学“湿温”“时疫”“春温”等范畴,提出用卫气营血辨证或三焦辨证进行辨治,其中湿热困阻中焦或毒在气分时,甘露消毒丹为临床常用选方之一[2-3]。但甘露消毒丹治疗手足口病的作用机制尚不十分明确。前期研究发现,甘露消毒丹能影响EV71复制的多个环节而发挥直接抗病毒作用[4-5]。本研究以在免疫调节、炎症反应及抗病毒中发挥重要作用的miR-146a和Toll样受体4(TLR4)mRNA为切入点,探讨甘露消毒丹对EV71感染免疫与炎症反应的调节作用;同时,进行拆方研究,希望有助于阐释方中有效组分或功能团的配伍机理,全面阐释其多靶点治疗作用,或可助于科学简化处方行为要素。
1 实验材料
1.1 细胞
人恶性胚胎横纹肌瘤细胞(RD细胞),美国ATCC公司,DMEM培养液(含10%牛血清)培养,连续传代3次。细胞维持液为含1%双抗(青霉素、链霉素)、2%新生牛血清的DMEM,消化液为0.25%胰蛋白酶溶液。
1.2 病毒
EV71病毒,武汉大学基础医学院医学病毒学研究所提供。EV71接种于单层RD细胞上,加维持液后置于35 ℃、5%CO2培养箱培养,待出现75%以上的病变时收获,冻融3次后吹打离心,4000 r/min离心10 min,取上清液,分装后-80 ℃冰箱冻存备用。
1.3 药物及制备
甘露消毒丹(以下简称“甘全方”,剂量参照《方剂学》[6]记载):滑石15 g,茵陈11 g,黄芩10 g,石菖蒲6 g,木通5 g,川贝母5 g,藿香4 g,豆蔻4 g,连翘4 g,射干4 g,薄荷4 g。甘露消毒丹清热解毒残方(以下简称“清残方”):黄芩10 g,薄荷4 g,连翘4 g,川贝母5 g,射干4 g。甘露消毒丹化浊利湿残方(以下简称“利残方”):滑石15 g,茵陈11 g,木通5 g,豆蔻4 g,石菖蒲6 g,藿香4 g。上述饮片由湖南中医药大学附属第一医院药剂科提供,湖南中医药大学潘清平教授鉴定均为正品。中药常规煎煮法煎煮2次,合并药液,制备成含原药材0.25 g/mL的药液,滤纸过滤后再以0.22 μm微孔滤膜过滤。病毒唑注射液,规格100 mg/mL,江苏苏星制药有限公司,批号0110409,以蒸馏水配制成3 mg/mL溶液。
1.4 主要试剂与仪器
DMEM培养基,美国HyClone公司,批号SH30243.01B;胎牛血清,美国HyClone公司,批号SV30087.02;胰蛋白酶消化液,美国Sigma公司,批号11476232;二甲基亚砜(DMSO),上海生工生物工程公司,批号2924B239;四甲基偶氮唑蓝(MTT),上海生工生物工程公司,批号TB0799;DnaseI,上海生工生物技术有限公司;SYBR®PremixExTaq™,宝生物工程(大连)有限公司;Revert Aid First Strand cDNA Synthesis Kit,加拿大Fermentas公司;RT-PCR试剂盒,上海生工生物技术有限公司;Trizol,Invitrogen公司;引物由宝生物工程(大连)有限公司代为设计、合成。生物安全柜(Haier公司),超微量紫外分光光度计(Thermo Fisher公司),Centrifuge5415R高速冷冻离心机(Eppendorf公司),荧光倒置显微镜(Olympus公司),7900HT荧光定量PCR仪(ABI公司),凝胶成像分析系统(赛百奥科技有限公司)。
2 实验方法
2.1 病毒毒力测定
计算半数组织培养感染量TCID50(Reed-Muench法),采用100TCID50进行本实验[4-5]。
2.2 药物细胞毒性测定
MTT法计算其细胞存活率(以不同浓度药物的OD值计算),以细胞存活率(%)为纵坐标、药物浓度为横坐标(g/mL)绘制非线性回归曲线。以90%细胞存活率浓度为各药的实验浓度[4-5]。
2.3 药物干预实验
取RD细胞接种于无菌6孔细胞板,100 μL/孔,置于35 ℃、5%CO2培养箱培养24 h,待细胞长成单层后吸弃培养液,每孔接种病毒液50 μL,轻混,待吸附1.5 h后吸弃病毒液,将90%细胞存活率的甘全方、清残方、利残方、病毒唑药液50 μL与50 μL维持液混合,分别加到RD细胞上,各设4复孔。另每孔均设模型组、正常组,正常组孔内加维持液100 μL,模型组孔内接种病毒液50 μL,吸附1.5 h后吸弃病毒液,加入维持液100 μL。24 h后收集细胞,加入Trizol,待RT-PCR检测miRNA-146a、TLR4 mRNA的相对表达。
2.4 RT-PCR检测细胞miRNA-146a、TLR4 mRNA表达
采用Trizol法分别提取甘全方组、清残方组、利残方组、病毒唑组、模型组、正常组细胞总RNA,将所提取的总RNA用超微量紫外分光光度计分别测定酶标仪波长260 nm和280 nm处吸光度(A)值,计算各组OD260/OD280值,若样品纯度符合实验要求,则行基因检测。采用反转录试剂盒与miRNA-146a、U6、TLR4、β-actin反转录酶引物,以37 ℃、30 min,65 ℃、10 min,42 ℃、60 min,70 ℃、5 min进行孵育合成cRNA,-20 ℃保存。采用miRNA-146a、U6、TLR4 mRNA、β-actin的SYBR®Premix Ex Taq进行扩增,总体系30 μL,分三重复孔,95 ℃、30 s,95 ℃、5 s,60 ℃、30 s,共40个循环(荧光定量PCR)。采用2-ΔΔCt法,以第一个样为1,计算待测基因的相对定量(RQ)值。
3 统计学方法
4 结果
4.1 病毒毒力测定结果
根据Reed-Muench法计算得出TCID50=10-2.89/mL。
4.2 药物细胞毒性测定结果
通过回归曲线获得各实验用药90%细胞存活率浓度为甘全方0.003 7 g/mL、清残方0.002 0 g/mL、利残方0.008 1 g/mL和病毒唑0.64 mg/mL。
4.3 RNA电泳结果
6组28 s、18 s RNA的条带均比较清晰,且28 s RNA均比18 s RNA清晰,见图1。
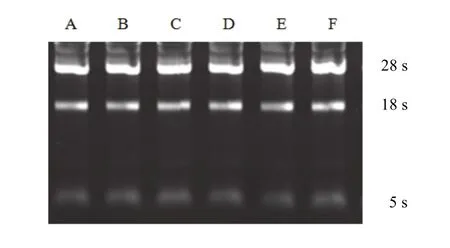
图1 各组RNA凝胶电泳图
4.4 RNA鉴定结果
各组OD260/OD280在1.8~2.0之间,见表1。表明提取的RNA污染较少,纯度较高。

表1 RNA鉴定结果
4.5 各组细胞miR-146a、Toll样受体 mRNA相对定量值
miR-146a、U6、TLR4、β-actin的扩增曲线、融解曲线见图2~图5。从各基因的扩增曲线和融解曲线可见,每个基因扩增用的引物特异性强,该基因扩增引物进行了特异性扩增,扩增结果可信。

图2 miR-146a扩增曲线和融解曲线
图3 U6扩增曲线和融解曲线

图4 TLR4扩增曲线和融解曲线
图5 β-actin扩增曲线和融解曲线
各组miR-146a mRNA RQ值比较:模型组、病毒唑组较正常组明显降低(P<0.05),甘全方组、清残方组、利残方组均较正常组明显升高(P<0.05,P<0.01);甘全方组、清残方组、利残方组均较模型组明显升高(P<0.01),病毒唑组与模型组差异不明显;清残方组较甘全方组明显降低(P<0.05),利残方组较甘全方组明显升高(P<0.01),利残方组较清残方组明显升高(P<0.01);病毒唑组较甘全方组、清残方组、利残方组明显降低(P<0.01)。各组TLR4 mRNA RQ值比较:模型组、甘全方组、清残方组、病毒唑组较正常组明显升高(P<0.05,P<0.01),利残方组与正常组比较无明显差异;甘全方组、清残方组、利残方组较模型组明显降低(P<0.01),病毒唑组与模型组比较差异不明显;清残方组、利残方组较甘全方组明显降低(P<0.01);清残方组与利残方组比较差异不明显;病毒唑组较甘全方组、清残方组、利残方组明显升高(P<0.01)。结果见表2。
表2 各组miR-146a、TLR4 mRNA表达比较(±s,RQ值)

表2 各组miR-146a、TLR4 mRNA表达比较(±s,RQ值)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,**P<0.01;与甘全方组比较,○P<0.05,○○P<0.01;与清残方组比较,※※P<0.01;与利残方组比较,&&P<0.01
组别 n miR-146a TLR4正常组 3 1.15±0.06 0.27±0.01模型组 3 1.00±0.03#1.00±0.06##甘全方组 3 1.33±0.11##**0.62±0.07##**清残方组 3 1.24±0.14#**○0.41±0.12#**○○利残方组 3 1.59±0.09##**○○※※0.34±0.10**○○病毒唑组 3 1.04±0.06#○○※※&&0.93±0.30##○○※※&&
5 讨论
手足口病患者存在明显的免疫功能调节障碍,T淋巴细胞、细胞因子、免疫球蛋白及补体水平均可能出现异常,同时患儿细胞免疫发育尚不成熟,感染EV71后则更容易进展为重症手足口病,也可能因为炎症因子分泌增多而激发全身炎症反应综合征和脓毒症,进而影响手足口病的转归,免疫调控成为治疗手足口病的新靶点。miRNA是一类长约为22个核苷酸的内源性非编码RNA,可以调节代谢、免疫、增殖、分化和癌变等多种生物学过程,是近年免疫研究的热点。miR-146是首个发现在免疫系统中有调节作用的miRNA,包括miR-146a、miR-146b两个成员,其中miR-146a在调节固有免疫、炎症反应中发挥重要作用,如髓系细胞中miR-146a能调节肿瘤坏死因子受体相关因子6和白细胞介素-1受体相关激酶介导的炎症信号通路[7-8],也可作用于相关靶基因进而调节可以抗病毒的干扰素通路[9]。另有研究发现,miR-146a调节炎症和免疫反应的途径之一是下调Toll样受体[10-11],后者能介导炎症因子的释放从而启动炎症应答。
我们前期的研究表明,甘露消毒丹及其拆方能直接对抗病毒[4-5],那么它们是否可通过microRNA调节机体免疫?有研究表明,甘露消毒丹具有免疫调节作用,能降低湿热证模型大鼠粒细胞集落刺激因子水平、增加体内一氧化氮的含量,影响血清酶活性等[12-15],但尚无其是否能调控microRNA的报道。我们的研究结果显示,RD细胞在感染EV71后miR-146a mRNA表达下降,TLR4 mRNA表达上升,提示EV71感染导致机体炎症与免疫反应的机制之一是抑制miR-146a、上调TLR4,从而促进炎症因子释放、启动炎症反应。同时研究还发现,甘露消毒丹及其拆方均能以不同程度上调miR-146a且下调TLR4 mRNA表达,推测它们可能通过调控microRNA而调控炎症信号,提示甘露消毒丹及其拆方既能直接抗EV71病毒,也能调节EV71感染后的机体免疫功能,所以甘露消毒丹治疗EV71感染的作用是多方面的,这也体现了中医复方多环节、多靶点的整体调节特点。而病毒唑对miR-146a、TLR4 mRNA未表现出明显的调节作用,表明病毒唑主要作用是抗病毒而不能调节免疫。
另一方面,拆方研究结果显示利残方的调节作用最明显。本课题前期研究发现,清残方抗EV71作用最强而利残方抗EV71作用最弱[4],但本研究中利残方表现出比清残方更强的免疫调节作用,可见二者侧重点不同,组合成方能使治疗更全面,生动地展示了中医复方“配伍”的奥妙所在,即在中医理论及方剂配伍原则指导下组方,方中每味药或者药物组(“功能团”)各有所长、各司其职,共同形成功能全面的整合体,从机体内在紊乱与失衡的多个“作用点”共同治疗疾病。
结合前期研究结果,我们还发现甘全方、清残方、利残方均有抗EV71及调节miR-146a、TLR4的作用,但甘全方抗EV71的作用较清残方弱,调节miR-146a及TLR4的效应又弱于利残方,这或许表明清残方及利残方之间可能存在相互拮抗,只是本实验尚未对具体的拮抗机制作出分析,在后续实验中将对这种关系进一步研究,可能有益于揭示中医复方配伍的奥秘。
[1] WU G Y, ZHU W B, GAO Y X, et al. The risk factors of hand-foot-mouth disease in Chinese mainland people[J]. The Indian Journal of Pediatrics,2014,81(12):1420-1429.
[2] 高育林.手足口病的中医药治疗[J].中国社区医师,2008,24(10):15-16.
[3] 尹周安,贺圆圆.手足口病的中医防治[J].中医药导报,2008,14(6):10-12.
[4] 艾碧琛,贺又舜,赵国荣,等.甘露消毒丹及其拆方体外抗肠道病毒71型作用[J].中医杂志,2014,55(8):695-698.
[5] 艾碧琛,贺又舜,赵国荣,等.甘露消毒丹抗肠道病毒71型作用的体外实验研究[J].中国中医药信息杂志,2014,21(11):62-65.
[6] 段富津.方剂学[M].上海:上海科学技术出版社,1995:245-246.
[7] 杨明兰,顾卫琼.MiR-146与免疫及自身免疫性疾病[J].国际病理科学与临床杂志,2012,32(2):165-168.
[8] HOU J, WANG P, LIN L. MicroRNA-146a feedback inhibits RIG-I-dependent type I IFN production in macrophages by targeting TRAF6, IRAK1, and IRAK2[J]. Journal of Immunol,2009,8,1(3):2150-2158.
[9] CAMERON J E, YIN Q Y, FEWELL C, et al. Epstein-Barr virus latent membrane protein 1 induces cellular MicroRNA miR-146a, a modulator of lymphocyte signaling pathways[J]. Journal of Virology,2008,82:1946-1958.
[10] WANG J F, YU M L, YU G, et al. Serum miR-146a and miR-223 as potential new biomarkers for sepsis[J]. Biochem Biophys Res Commun,2010,394(1):184-188.
[11] BHAUMIK D, SCOTT G K, SCHOKRPUR S, et al. Expression of microRNA-146 suppresses NF-kappaB activity with reduction of metastatic potential in breast cancer cells[J]. Oncogene,2008, 27(42):5643-5647.
[12] 徐建瑞,王红梅,曾琳.甘露消毒丹对温病湿热证模型大鼠血清G-CSF、NO的影响[J].贵阳中医学院学报,2009,31(4):76-77.
[13] 程方平,周洁,陈娟,等.甘露消毒丹对湿热证大鼠内毒素转导信号的动态干预[J].中医药学报,2008,36(4):43-45.
[14] 程方平,刘松林,杨红兵,等.甘露消毒丹对温病湿热证大鼠LBP mRNA、CD14 mRNA、NF-κB动态干预[J].中国实验方剂学杂志,2008,14(4):56-59.
[15] 曹蓉.甘露消毒丹对手足口病EV71感染小鼠血清酶活性的影响研究[D].长沙:湖南中医药大学,2015.
Effects of Ganlu Xiaodu Dan and Its Incomplete Prescription on Expressions of MiR-146a and TLR4 mRNA in Cells Infected by EV71
AI Bi-chen1, HE Yi-rong1, CAO Rong1, HE Dong2,ZHAO Guo-rong1, HE You-shun1
(1. TCM School of Hunan University of Chinese Medicine, Changsha 410208, China; 2. Graduate School of Hunan University of Chinese Medicine, Changsha 410208, China)
ObjectiveTo observe the effects of Ganlu Xiaodu Dan and its incomplete prescription on expressions of MiR-146a and TLR4 mRNA in RD cells infected by EV71.MethodsWith technique of cell culturing, Ganlu Xiaodu Dan therapy group, incomplete Qing prescription therapy group, incomplete Li prescription therapy group, normal cells control group, model control group and ribavirin control group were set, and tests for virus toxicity and medicine toxicity in cells were taken, then expressions of miRNA-146a and TLR4 mRNA in these RD cells 24 hours after intervention with medicine were detected.ResultsCompared with normal cells control group, miR-146a in mRNA model control group decreased and TLR4 mRNA increased. Compared with model control group, miR-146a mRNA in Ganlu Xiaodu Dan therapy group, incomplete Qing prescription therapy group and incomplete Li prescription therapy group all increased while TLR4 mRNA decreased, and differences between ribavirin control group and model control group were not significant. Compared with Ganlu Xiaodu Dan therapy group, both expressions of miR-146a and TLR4 mRNA in incomplete Qing prescription therapy group were lower; miR-146a increased and TLR4 mRNA decreased in incomplete Li prescription therapy group. Compared with incomplete Qing prescription therapy group, miR-146a mRNA in incomplete Li prescription therapy group increased, but expression of TLR4mRNA between them was not significant.ConclusionGanlu Xiaodu Dan can regulate the immune reactions caused by infection of EV71 by increasing expression of miR-146a mRNA and reducing expression of TLR4 mRNA. There may be antagonism effect between incomplete Qing prescription and incomplete Li prescription.
Ganlu Xiaodu Dan; incomplete prescription; EV71; miRNA-146a; TLR4
10.3969/j.issn.1005-5304.2017.03.015
R285.5
A
1005-5304(2017)03-0061-05
2016-07-26)
(
2016-09-18;编辑:华强)
国家自然科学基金(81173188);湖南中医药大学科技创新团队项目(2016年)
贺又舜,E-mail:youshunh@sina.com
