骨髓基质细胞移植对缺血性大鼠治疗效果及VEGF表达的影响
2017-02-27朱亚楠龙翠英郑春玲通讯作者
朱 磊 韩 丽 朱亚楠 龙翠英 郑春玲(通讯作者)
1)河南漯河市中心医院 漯河 462000 2)漯河医专二附院 漯河 462000
骨髓基质细胞移植对缺血性大鼠治疗效果及VEGF表达的影响
朱 磊1)韩 丽1)朱亚楠2)龙翠英1)郑春玲1)(通讯作者)
1)河南漯河市中心医院 漯河 462000 2)漯河医专二附院 漯河 462000
目的 研究骨髓基质细胞(BMSCs)对缺血性大鼠的治疗效果。方法 将30只成年雌性SD大鼠制备成大脑中动脉缺血2 h再灌注24 h动物模型,按随机原则分为对照组和实验组,对照组模型制备成功后,不给予任何干预,自由饮食。实验组于缺血再灌注24 h后经尾静脉给予BMSCs 3×106,所有大鼠于缺血再灌注1 d、3 d和7 d进行神经功能评分,免疫组化法测定VEGF表达水平。结果 神经功能评分:再灌注3 d、7 d后实验组神经功能评分明显低于梗死对照组(P<0.05)。VEGF免疫组织化学染色:再灌注后3 d、7 d实验组缺血区表达VEGF的细胞较梗死对照组明显增多(P<0.05)。结论 BMSCs可显著促进脑缺血大鼠的神经功能恢复,促进VEGF的表达,以减少神经细胞的凋亡。
脑梗死;大脑中动脉闭塞;骨髓基质细胞;血管内皮生长因子
近年来,脑卒中的发病率、致残率及病死率逐年增高。卫计委完成的《全国第三次死因回顾抽样调查报告》提示,脑血管病已上升为我国居民的首位死亡原因[1]。既往观点认为,神经细胞受损后不能再生,因此,目前缺血性脑卒中的溶栓、抗凝及营养神经等治疗手段不能有效修复损伤的神经细胞。而骨髓基质细胞(bone marrow stromal cells,BMSCs)是一类多能干细胞,具有多向分化的性质[2]。研究显示BMSCs能改善多种中枢神经系统疾病的神经功能[3],其在神经系统疾病中的应用前景越来越受到人们的关注。
1 材料与方法
1.1 材料 30只SD雌性大鼠,体质量(200±20)g,10%水合氯醛、4%多聚甲醛、PBS缓冲夜、2% TTC染液、3% H2O2溶液,碘伏、抗原修复液、VEGF一抗、兔二抗。
1.2 BMSCs制备 在无菌条件下取出SD大鼠双侧股骨,暴露骨髓腔。贴壁+胰酶消化法分离培养大鼠 BMSCs,取第4代细胞进行 Brdu标记,收集、调整浓度后备用。
1.3 动物分组、 造模、 移植 将 30只 SD大鼠均分为2组,各组动物均采用Zea-Longa线栓法制成右侧大脑中动脉梗死模型。实验组于建模成功后 24 h在严格无菌操作下进行 BMSCs移植,10%水合氯醛(3 mL/kg)腹腔注射麻醉大鼠,应用微量注射器将总体积1 mL的单细胞悬液(内含3×106个BMSCs)经大鼠尾静脉注入体内。对照组同法注入1 mL PBS。动物苏醒后送回笼内正常饲养。
1.4 神经功能评分 2组大鼠移植前及移植后1 d、3 d、7 d利用改良的神经严重程度记分(mNSS)评分法[3]进行神经功能评分,每次评分随机抽取6只大鼠,评分越高,神经功能损失越严重。
1.5 TTC染色 各组大鼠于移植后3 d、7 d,麻醉后取脑,置于-20 ℃冰箱15 min取出,做连续冠状切片,每片厚2 mm,给予TTC染色[4]。
1.6 HE染色 各组大鼠于移植后3 d、7 d,麻醉后灌注取脑,置于4%多聚甲醛固定,常规梯度酒精脱水,二甲苯透明,石蜡包埋,3 μm厚连续冠状切片。HE染色、拍照、观察。
1.7 VEGF免疫组织化学染色 石蜡切片,脱蜡、脱水,用3% H2O2溶液灭活内源性酶,热抗原修复,滴加兔血清封闭液,滴加VEGF一抗(1∶100)4 ℃过夜,滴加生物素化兔二抗IgG,DAB显色,苏木素复染,脱水、透明、封片,结果判定。
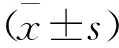
2 结果
2.1 MCAO大鼠脑梗死形态学观察及神经功能评分
2.1.1 大鼠脑梗死形态学观察:SD大鼠经过大脑中动脉结扎(MCAO)后运动功能缺损如图1A所示。同时,MCAO脑组织切片经过TTC染色,形态学观察如图1B所示,切片中红色区域代表正常脑组织,白色区域代表梗死区域。

图1 MCAO大鼠脑梗死形态学观察 A:SD大鼠经大脑中动脉结扎后运动功能缺损 B:制备成功的MCAO大鼠脑组织切片行TTC染色,切片中正常区域染为红色,缺血梗死区域染为白色
2.1.2 大鼠神经功能评分结果:所有大鼠都于模型制备前以及梗死后1 d,给药后3 d、7 d分别给予mNSS 评分,结果显示给药后3 d、7 d BMSCs组神经功能评分较梗死对照组明显下降,差异有统计学意义(P<0.05)。见图2。
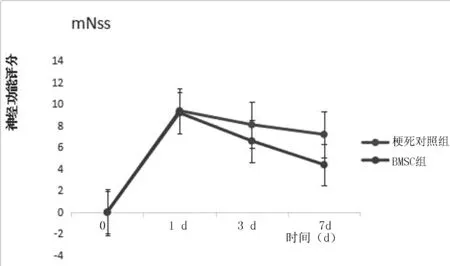
图2 BMSCs组和梗死对照组各时间段mNSS评分
2.2 HE染色结果 大鼠脑切片行HE染色显示,梗死灶大部分位于大脑皮质和基底节。BMSCs组与梗死对照组梗死区可见较多神经细胞的缺失,同时伴格子细胞及中性白细胞。见图3。
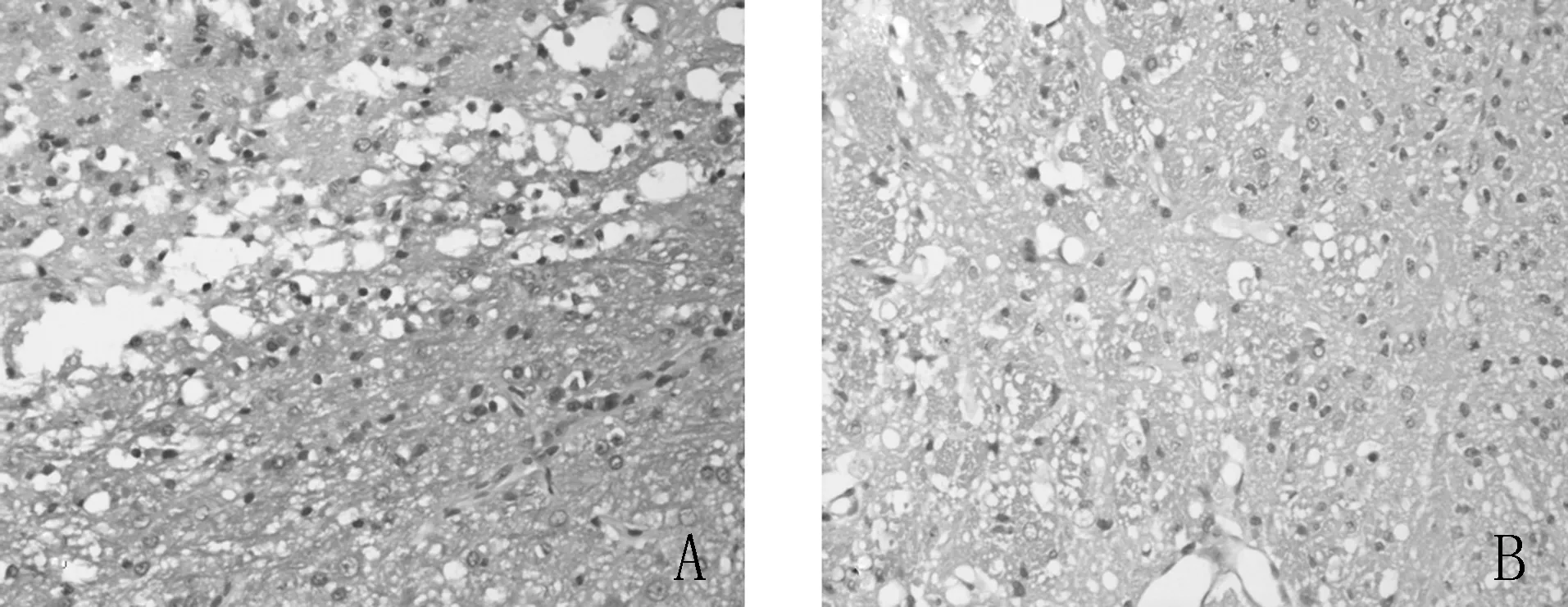
图3 A:梗死对照组 B:BMSCs组HE染色,×200
2.3 VEGF表达 梗死对照组及BMSCs组缺血区可见阳性标记细胞(如箭头所示),其中梗死对照组阳性细胞明显少于BMSCs组。见图4。BMSCs组在梗死3 d、7 d时的VEGF表达明显多于梗死对照组,差异有统计学意义(P<0.05)。见图5。
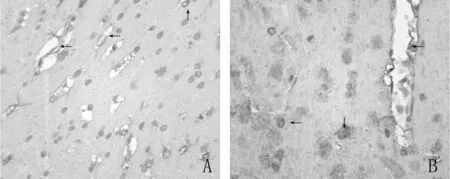
图4 BMSCs治疗组MCAO大鼠VEGF的表达明显较梗死对照组增加 A:梗死对照组 B:BMSCs组VEGF免疫组织化学染色,×400
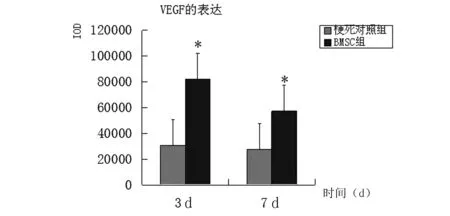
图5 BMSCs组VEGF表达较梗死对照组明显增加
3 讨论
脑梗死后局部脑动脉闭塞,脑组织灌流量降低,局部脑缺血、缺氧,脑组织功能的兴奋性降低,脑代谢率的下降,大脑皮质和皮质下神经细胞凋亡导致神经功能缺损。因此,改善脑代谢、增加脑血流量是治疗脑梗死后神经损伤的重要方法。研究已证实,及时恢复缺血区的血液供应,可减少脑细胞的损伤。同时实验室的研究结果提示,BMSCs移植对脑缺血动物模型具有明显的治疗效果。BMSCs移植能明显促进缺血区新生血管生成,减少梗死面积,促进神经功能的恢复,其主要是通过分泌多种营养因子,促进血管内皮细胞生成、血管形成等多种机制实现。同时,BMSC还能增强残留脑组织特别是缺血区周围的脑组织的功能和可塑性[5]。研究表明,提高脑组织的可塑性可促进卒中后神经功能的恢复[6]。血管发生的增多,可提高缺血半暗带区血液供应,从而挽救梗死周围区频死的神经细胞,促进神经功能的恢复。Zhang等[7-8]研究也显示,血管密度高的卒中患者比血管密度低的患者功能恢复快,同时存活时间也较长。新形成的血管可以提高缺血周围脑组织的血流灌注,改善微循环,从而促进神经功能的恢复。而VEGF具有促进内皮细胞增殖,诱导血管形成的特性[9]。在缺血缺氧状态下,VEGF 的表达可明显增加[10]。而VEGF可能是通过激活细胞上的磷脂酶C短暂地诱导Ca2+离子释放,从而促进内皮细胞的增殖进而促进新血管的形成[11-12]。因此,BMSCs可增加VEGF的表达,促进新生血管的形成,促进神经功能的恢复,为脑梗死的治疗和恢复提供可能。
[1] 陈竺.全国第三次死因回顾抽样调查报告[M].北京:中国协和医科大学出版社,2008:10-17.
[2] Li Y,Chen J,Lu M,et al.Treatment of stoke in rat with intracarotid administration of marrow stomal cells[J].Neurology,2001,56(12):1 666-1 672.
[3] Chen JR,Cheng GY,Sheu CC,et al.Transplanted bone marrow stromal cells migrate,differentiate and improve motor function in rats with experimentally induced cerebral stoke[J].J Ant,2008,213(3):249-258.
[4] 雷阳,牟文松,雄鹰,等.骨髓基质干细胞不同移植途径对脑缺血治疗的影响[J].大连医科大学学报,2009, 31(3):253-257.
[5] Chen J,Zhang ZG,Li Y,et al.Intravenous administra-tion of human bone marrow stromal cells induces angiogenesis in the ischemic boundary zone after stroke in rats[J].Circ Res,2003,92(6):692-699.
[6] Chen J,Li Y,Zhang R,et al.Combination therapy of stroke in rats with a nitric oxide donor and human bone marrow stromal cells enhances angiogenesis and neurogenesis[J].Brain Res,2004,1 005(1/2):21-28.
[7] Zhang ZG,Zhang L,Jiang Q,et al.VEGF enhances angiogenesis and promotes blood-brain barrier leakage in the ischemic brain[J].J Clin Invest,2000,106(7):829-838.
[8] Zhang ZG,Zhang L,Jiang Q,et al.Bone marrow-derived endothelial progenitor cells participate in cerebral neovascularization after focal cerebral ischemia in the adult mouse[J].Circ Res,2002,90(3):284-288.
[9] Kimura R,Nakase H,Tamaki R,et al.Vascular endothelial growth factor antagonist reduces brain edema formation and venous infarction[J].Stroke,2005,36(6): 1 259-1 263.
[10] Marti HH,Bernaudin M,Bellail A,et al.Hypoxia-induced vascular endothelial growth factor expression precedes neovascularization after cerebral ischemia[J].Am J Pathol,2000,156(3):965-976.
[11] Risau W.Mechanisms of angiogenesis[J].Nature,1997,386(6 626):671-674.
[12] Maeda K,Chung Y,Ogawa Y,et al.Prognostic value of vascular endothelial growth factor expression in gastric carcinoma[J].Cancer,1996,77(5):858-863.
(收稿2016-08-21)
R-322
A
1673-5110(2017)03-0052-03
