人釉原蛋白亮氨酸富集片段的冷冻电子显微镜观察及其引导矿化性能研究
2017-02-23田鲲冯小云杜芹廖楚航任小华
田鲲 冯小云 杜芹 廖楚航 任小华
电子科技大学附属医院·四川省人民医院口腔科,成都 610072
人釉原蛋白亮氨酸富集片段的冷冻电子显微镜观察及其引导矿化性能研究
田鲲 冯小云 杜芹 廖楚航 任小华
电子科技大学附属医院·四川省人民医院口腔科,成都 610072
目的 采用冷冻电子显微镜观察体外重组的人釉原蛋白富亮氨酸片段(LRAP),分析其细微结构和聚集状态,结合矿化实验评估LRAP体外引导羟磷灰石生长的定向成核能力。方法 人工合成LRAP基因,与原核表达载体pCold-SUMO行质粒构建,于宿主菌大肠杆菌BL21plys中诱导表达并纯化,在冷冻电子显微镜下观察LRAP在pH值从3.5到8.0的环境中聚合自组装的过程,并在人工唾液中通过透射电镜观察羟磷灰石晶体的生长规律。结果 通过原核表达成功得到纯度90%以上的LRAP蛋白提取物,当pH值为8.0时,LRAP能聚集成多聚体和纳米小球等功能结构,在人工唾液中能诱导羟磷灰石晶体生长成熟。结论 作为简化的釉原蛋白功能域,LRAP兼备了自组装为纳米小球和c轴诱导晶体矿化的特性,可作为运用釉基质蛋白多聚物行无细胞修复牙体硬组织缺损的备选材料之一。
冷冻电子显微镜; 釉原蛋白; 釉原蛋白亮氨酸富集片段; 羟磷灰石
近年来, 依据仿生矿化原理,体外搭建高度仿真的有机矿化模板,营造合适的钙、磷微环境逐步成为釉质晶体再生的可行方法。仿真矿化模板也经历了从最初简单的高分子到复杂多肽,再到直接提取体内釉质矿化模板的发展历程[1-3]。组成釉质的无机晶体组分是完全相同的,但它能达到普通磷酸钙硬度的5倍,唯一的差别就是晶体生长和组装的取向。釉柱和柱间质形成网球拍样结构,二者的差异是由矿化模板中纳米纤维长轴转角来架构的:其过程是成釉细胞的分泌单位Tomes突从两个位点分泌互成60°夹角的蛋白,在空间的排列走势分为辐射向和切线向,循着正弦曲线移动而形成网球拍样的人牙釉柱结构[4-5]。已有研究[4]佐证,矿化模板对釉基质的模仿程度越高,生成的羟磷灰石晶体就越接近牙齿釉柱的排列;相关基因敲除的小鼠,在釉质结构编排或羟磷灰石结晶相上均存在发育缺陷。近年来对釉基质蛋白特别是釉原蛋白的深入破解和探索成为研究釉质仿生合成的主流,故本实验拟对发育中的原位引导蛋白加以利用,体外再现牙体组织缺损处有机模板编织框架的过程,无缝延长这种编织模式,实现晶核的生长和发育。
造就釉质独特结构的主体是釉质发育期由成釉细胞分泌的釉基质蛋白, 釉原蛋白占全部釉基质蛋白的90%,是最主要的釉质形成蛋白。人釉原蛋白由175个氨基酸组成,其序列主要由疏水残基和亲水C-末端构成[4],分为3个区域:富含酪氨酸的N-末端序列,X-Y-脯氨酸重复序列构成的中央主段,以及11个亮氨酸残基架构的亲水性C-末端。釉原蛋白亮氨酸富集片段 (leucine-rich amelogenin peptide,LRAP)是经mRNA选择性剪切所形成的釉原蛋白的一个剪接变异体,富集了釉原蛋白的主要功能域。该片段由釉原蛋白的26个C-末端氨基酸和33个N-末端氨基酸构成,在1981年首次被发现[6]。在哺乳动物中,N-末端和C-末端的氨基酸序列是高度保守的[7],因此本实验拟对LRAP进行重组和纯化,并于冷冻电子显微镜(cryogenic transmission electron microscopy,cryoTEM)下观察其团聚、组装成纳米小球的生理过程,进一步检测其在矿化溶液中对钙磷离子的引导能力,为运用釉原蛋白体外实现釉质的生长提供基础数据。
获取正确的LRAP片段后,将首尾两段LRAP片段连接,设计引物(正向:5’-CGTAGGATCCGATGGGGACCTGGATTTTGTT-3’;反向:5’-GCAGCTCGAGTTAATCCACTTCCTCCTGCT-3’),参照Khan等[10]所述方法进行扩增、回收、克隆及筛选和鉴定。将LRAP片段与pCold-SUMO原核表达载体构建重组质粒,通过热激法将其转化入原核表达菌株的宿主菌大肠杆菌(Escherichia coli,E. coli)BL21plys,鉴定、培养,要求OD600达到0.6,以0.3 mmol·L-1异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)诱导,电泳检测。以高效液相色谱仪(AKTA Purifi er 900型,瑞典通用医疗公司)进行分离,收集含有小泛素相关修饰物(small ubiquitinrelated modifi er,SUMO)的重组蛋白,经rTEV蛋白酶切割融合蛋白得到LRAP蛋白,通过透析将蛋白溶液的pH值调整为7.0,冻干保存。
以pH值为3.5的双蒸水溶解LRAP蛋白,缓慢加入4 mmol·L-1pH=8.0的PBS,冰浴中调整蛋白的最终质量浓度为100 μg·mL-1。此时蛋白液的pH值由3.5跃升为8.0,单体蛋白开始自组装,分别在1、10、20 min时终止自组装反应。将20~50 μL的蛋白溶液滴至铜网多孔碳侧,冻干后将铜网置于cryoTEM(Tecnai F20 TEM型,FEI公司,美国)下观察。
部分质量浓度为10 g·L-1蛋白液置入 37 ℃人工唾液[11](MgCl20.2 mmol·L-1,CaCl2·H2O 1 mmol·L-1,HEPES buffer 20 mmol·L-1,KH2PO44 mmol·L-1,KCl 16 mmol·L-1,NH4Cl 4.5 mmol·L-1,NaF 7 mmol·L-1,用1 mmol·L-1NaOH 调整pH值为7.0)反应1~3 d,要求溶液中LRAP终质量浓度为10 g·L-1。3 d后将反应液滴于200目的碳膜铜网上,乙酯双氧铀染色,采用透射电子显微镜(Tecnai T12型,FEI公司,美国)观察,通过选区衍射确定晶体性质。
2 结果
1 材料和方法
根据GenBank公布的人釉原蛋白全长序列(Genebank M86932),参考文献[8-9]及蛋白质序列分析网络服务器对LRAP功能片段进行定义,确定剪切片段如下:ATGCCTCTACCACCTCATCCTGGGCACCCTGGTTATATCAACTTCAGCTATGAGGTGCTTACCCCTTTGAAGTGGTACCAGAGCATAAGGCCACCG—CCCCTGCCGCCACAGCCACCTCTGCCTCCGATGTTCCCCATGCAGCCCCTGCCTCCCATGCTTCCTGATCTGACTCTGGAAGCTTGGCCATCAACAGACAAGACCAAGCGGGAGGAAGTGGAT。
扩增的LRAP经1%琼脂糖凝胶电泳后,可见大小为220 bp左右的特异性条带,与预期一致,结果见图1,其中第二泳道为釉原蛋白N端酪氨酸富集片段(tyrosine-rich amelogenin peptide,TRAP)。DNA测序结果及配对结果显示,本研究扩增的LRAP与NCBI基因库中人LRAP序列的契合度达99%。转染原核表达载体后经培养、鉴定,纯化提取得到蛋白液体,明胶电泳结果显示其相对分子质量约6.03×103(图2),与计算所得LRAP的相对分子质量基本吻合。总体鉴定结果提示,重组纯化实验所得到的产物即为人LRAP。
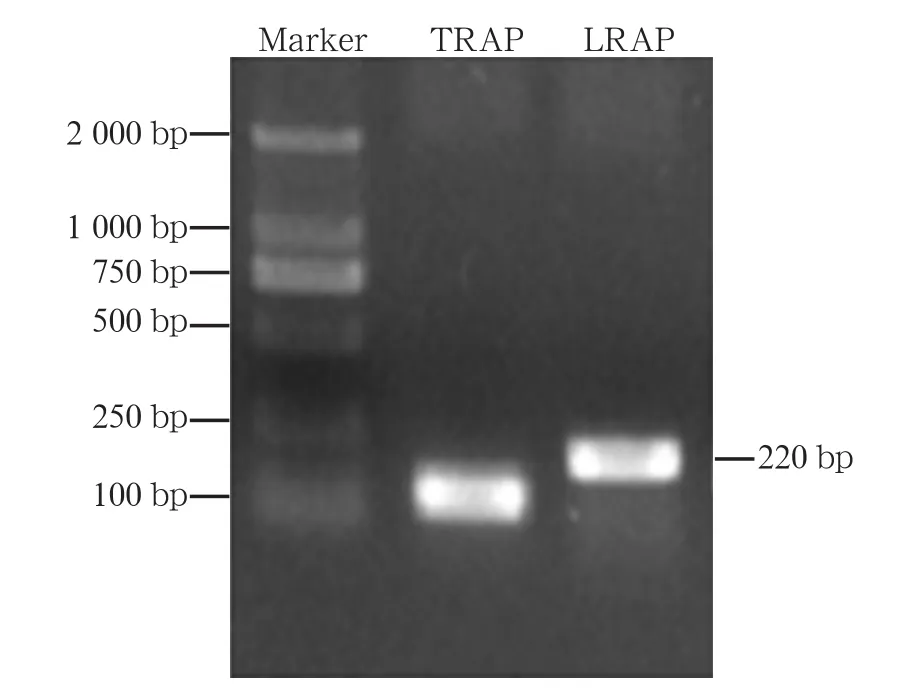
图 1 扩增的LRAP DNA凝胶电泳图Fig 1 DNA gel electrophoresis of LRAP

图 2 LRAP蛋白电泳图Fig 2 Protein electrophoresis of LRAP
cryoTEM下全视野图见图3。分析3个时间点(1、10、20 min)的全景图可以发现溶液中LRAP由散在单体团聚为纳米小球,再组装为串珠网的整体构建趋势。LRAP蛋白溶液的pH值由3.5迅速变为8.0,反应1 min时可见5~8 nm的LRAP单体以每6~8个为集落组装为10~30 nm的多聚体(图3左);反应10 min后,多聚体增多,集合为50~100 nm的纳米小球(图3中);反应20 min,纳米小球首尾相接自组装为链状长条,各长条结构相互平行或垂直堆积,构成羟磷灰石晶体平行排列的分子基础(图3右)。
当LRAP的pH值由3.5剧烈跃升至8.0时,LRAP的单体即开始聚合,图4是图3全景图中细节的等比例截取图:1 min时数量最多的是6~8个单体形成的环状多聚体(图4A),也有少量在此结构上的进一步构架,包括2个多聚体相邻结合(图4B)、3~4个多聚体以一定角度串起(图4C),或是5~8个多聚体在空间上三维重叠(图4D),形式多样。反应至10 min时,大体积结构增多(图3中),多聚体在某一个方向上开始延伸,形成4~8单位不等的直线串珠状多聚体(图4E),或是巨大的纳米小球(图4F),直径50~100 nm不等;纳米小球并不是孤立存在的,团聚仍在三维方向上继续,形成如图4G所示的延伸结构。反应20 min后(图3右),LRAP在溶液中的结构趋于稳定,纳米球和串珠状多聚体形成的三维网架成为镜下主体(图4H)。
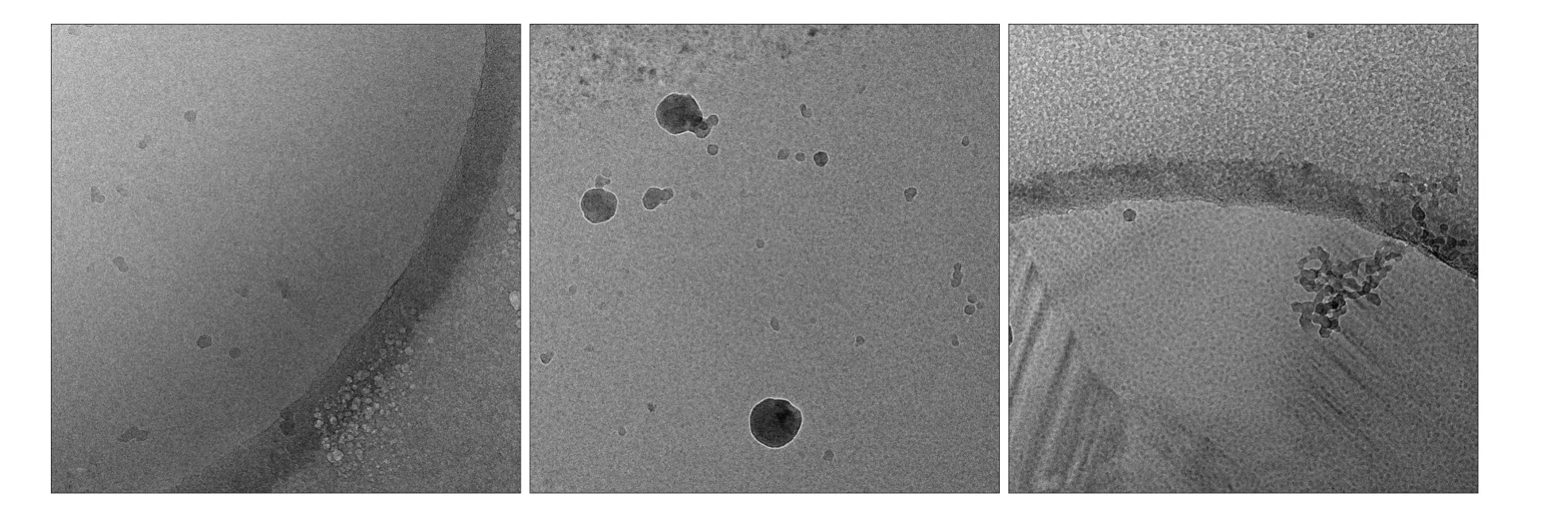
图 3 LRAP在1、10、20 min的自组装过程 cryoTEM × 50 000Fig 3 Micrographs of assembly of LRAP at 1, 10, and 20 min in the reaction cryoTEM × 50 000
将10 g·L-1的LRAP(pH值为3.5)置入37 ℃人工唾液(pH值为7.0)孵育后,可见蛋白溶液逐步自组装为多聚体及纳米小球,与图3所示聚合步骤一致。反应0.5 h后,透射电子显微镜下观察溶液可见LRAP团聚成20~50 nm的纳米小球(图5A中黑色框),背景可见10~30 nm的多聚体和大量5~8个LRAP单体首尾相接形成的环状初级结构,选区电子衍射未能检出晶体环。2 h后,纳米小球变大变厚,提示晶核开始各向生长,但未见明显的晶胞,仍无衍射环(图5B)。孵育24 h时,晶胞密度加大,但形态仍以纳米小球及其衍生物为主,此时可以检出稚嫩晶体环,选区电子衍射(图5C右下角)提示晶体主要为磷酸三钙[Ca3(PO4)2]。4 d后,可见大体积结晶,晶胞已趋成熟,融合为长度为2~4 μm的晶体,选区电子衍射(图5D右下角)可见晶体的成分包含磷酸八钙[Ca8H2(PO4)6·5H2O]和羟磷灰石[Ca10(PO4)6(OH)2]。

图 4 各种形态的多聚体和纳米小球 透射电子显微镜 × 50 000Fig 4 Various oligomers and nanospheres transmission electron microscopy × 50 000
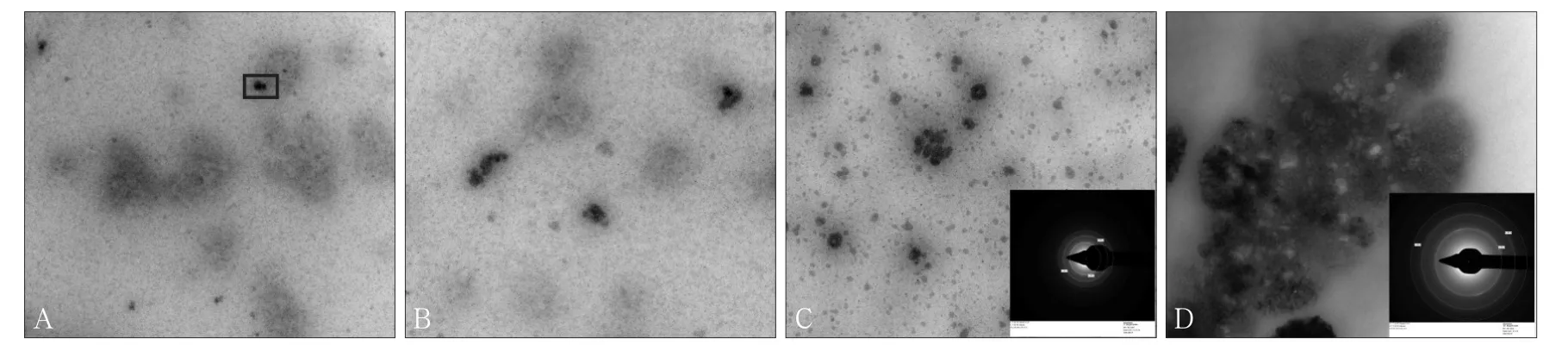
图 5 LRAP蛋白液与人工唾液孵育后的矿化产物 透射电子显微镜Fig 5 Mineralization products form reaction of LRAP and mimic saliva transmission electron microscopy
3 讨论
釉原蛋白归属于固有非结构化蛋白质,没有明确的二级或三级蛋白质三维结构却具有特定的生物学功能,能遵循其与靶标之间的作用而转化为折叠状态,在釉质晶体生长发育的动态运动中扮演多种职能[7]。釉原蛋白整个主链结构中亲水性的C端主要吸附无机晶体,同时抑制其沿a、b轴方向的生长,防止晶体间发生融合[5];中段X-Y-脯氨酸重复序列的作用目前尚未见明确报道;疏水的N端主要影响釉原蛋白的自组装和蛋白间的相互作用,TRAP中的三酪氨酸基序(PYPSYGYEPMGGW)能够糖基化,并与其他细胞外基质蛋白(如成釉蛋白或釉蛋白)结合[12]。已有研究[13]证实该片段能实现全蛋白初期阶段的串珠状聚集而诱导出不规则棒状晶体。
研究[4,14]表明,在中性pH和37 ℃环境中,釉原蛋白N端疏水的氨基酸富集区域相互聚拢,C端亲水的带电荷氨基酸尾巴TLAGGVA指向外部,形成直径约20 nm的球状自组装体(如图4),表面暴露多个可以与多种非釉原蛋白相结合的氨基酸序列(如氨基三甲叉磷酸:PYPSYGYEPMGGW),可以进一步自组装形成超分子集团[15]。本实验图3、4中的基本亚单位可聚合为20~40 nm的多聚体,进而组装为50~100 nm的纳米小球甚至超分子集团,但聚合单位尺寸较大,或许是LRAP较之全长蛋白缺少了中央X-Y-脯氨酸重复序列,在分子结构组装时对框架大小的掌控能力有所欠缺所致。Snead[5]提出,新分泌的釉原蛋白单体自组装的纳米球沉积于带状晶体之间或周围,封闭a、b轴方向的生长,只允许c轴的晶核延长发育,最终形成远大于骨组织羟磷灰石厚度(3~6 nm)的釉质羟磷灰石(20~30 nm)。本研究使用的LRAP因为中央重复序列的缺失,形成的矿化框架形态与全长蛋白有差异,当将LRAP单独提取出来并与矿化液共同孵育时,由于溶液中无附着相,因此没有形成针状晶体棒,而是从散在的纳米球状晶体颗粒直接融合为脉络花样结构,结晶型也相对稚嫩,从最初的磷酸三钙到矿化结束时以磷酸八钙为主,羟磷灰石含量相对较低。
体内矿化模板不只由釉原蛋白单一组装,还包含成釉蛋白、釉蛋白、釉成熟蛋白、激肽释放酶-4等在内的釉基质蛋白家族。本实验溶液中仅存在LRAP单一成分,虽然其全长釉原蛋白占釉基质蛋白的95%,但釉蛋白、釉质溶解素等物质的缺失还是导致了所形成的纳米小球在结构和功能上与体内矿化过程有所不同。
Fang等[14]证实,釉原蛋白分层逐步进行的自组装和形成的低聚物受多肽和亲水C端之间的相互作用所引导。自组装在成核前稳定集聚矿物质,使其排列成线性长链,然后组成平行阵列,未成核的矿物质长链形成针状的矿物质颗粒,最后构成成束的晶体。所有这些推论都是建立在单中心晶体生长的模式下,因为体内釉质在矿化时,模板没有预先成型,而是不断由成釉细胞分泌并适时实现自组装,自组装是依附于已有的蛋白框架进行的。换言之,最早的模板生发中心只有一个,在此中心的长轴模板不断编织伸长,矿物离子跟进矿化,模板再向空间生长,晶体继续沿c轴发育,如此循环往复数年之久,方可形成2~3 mm厚的羟磷灰石层。本实验的矿化观测于溶液中进行,意味着蛋白模板的编织是多中心的,只要蛋白浓度适宜(>10 g·L-1),纳米小球就在不断形成,网络样的超分子结构也在不同中心发育,没能统一形成单方向延长的长链结构,这或许是本研究未能得到针状羟磷灰石而只有花朵样散发晶体生成的原因。总而言之,LRAP的引导成核过程与釉原蛋白全长蛋白的成核虽有所差异,但它获取简单,提纯方便,若能与釉基质蛋白中其他调控晶体平行生长的蛋白配伍使用,可以使体外非细胞再造牙样羟磷灰石的设想离临床使用更近一步。
[1] Chen H, Clarkson BH, Sun K, et al. Self-assembly of synthetic hydroxyapatite nanorods into an enamel prismlike structure[J]. J Colloid Interf Sci, 2005, 288(1):97-103.
[2] 王志伟, 周长忍. 牙釉质表面的功能化及其仿生矿化的应用基础研究[D]. 广州: 暨南大学, 2008:11-29.
Wang ZW, Zhou CR. The applied basic research on functionalization and biomimetic mineralization of enamel surface[D]. Guangzhou: Jinan University, 2008:11-29.
[3] Zeitz C, Faidt T, Grandthyll S, et al. Synthesis of hydroxyapatite substrates: bridging the gap between model surfaces and enamel[J]. ACS Appl Mater Interfaces, 2016, 8(39): 25848-25855.
[4] Moradian-Oldak J. Protein-mediated enamel mineralization [J]. Front Biosci, 2012, 17:1996-2023.
[5] Snead ML. Biomineralization of a self-assembled-, softmatrix precursor: enamel[J]. JOM, 2015, 67(4):788-795.
[6] Fincham AG, Belcourt AB, Termine JD, et al. Dental enamel matrix: sequences of two amelogenin polypeptides[J]. Biosci Rep, 1981, 1(10):771-778.
[7] Ruan Q, Moradian-Oldak J. Amelogenin and enamel biomimetics[J]. J Mater Chem B Mater Biol Med, 2015, 3:3112-3129.
[8] Castiblanco GA, Rutishauser D, Ilag LL, et al. Identifi cation of proteins from human permanent erupted enamel[J]. Eur J Oral Sci, 2015, 123(6):390-395.
[9] Yadegari Z, Bandehpour M, Kazemi B, et al. Expression of recombinant human amelogenin in iranian lizard leishmania and its biological function assay[J]. Iran J Public Health, 2015, 44(7):987-996.
[10] Khan F, Li W, Habelitz S. Biophysical characterization of synthetic amelogenin C-terminal peptides[J]. Eur J Oral Sci, 2012, 120(2):113-122.
[11] Ruan Q, Zhang Y, Yang X, et al. An amelogenin-chitosan matrix promotes assembly of an enamel-like layer with a dense interface[J]. Acta Biomater, 2013, 9(7):7289-7297.
[12] Mazumder P, Prajapati S, Bapat R, et al. Amelogenin-ameloblastin spatial interaction around maturing enamel rods [J]. J Dent Res, 2016, 95(9):1042-1048.
[13] 田鲲, 杜芹, 廖楚航, 等. 人釉原蛋白功能片段LRAP的自组装行为与矿化能力[J]. 实用医院临床杂志, 2016, 13(4): 56-59.
Tian K, Du Q, Liao CH, et al. Assembly and mineralization of human tyrosine rich amelogenin peptide(TRAP)[J]. Pract J Clin Med, 2016, 13(4):56-59.
[14] Fang PA, Conway JF, Margolis HC, et al. Hierarchical selfassembly of amelogenin and the regulation of biomineralization at the nanoscale[J]. Proc Natl Acad Sci USA, 2011, 108(34):14097-14102.
[15] Tao J, Buchko GW, Shaw WJ, et al. Sequence-defi ned energetic shifts control the disassembly kinetics and microstructure of amelogenin adsorbed onto hydroxyapatite[J]. Langmuir, 2015, 31(38):10451-10460.
(本文编辑 吴爱华)
Study of human leucine-rich amelogenin peptide and its regulation of mineralization by cryogenic transmission electron microscopy
Tian Kun, Feng Xiaoyun, Du Qin, Liao Chuhang, Ren Xiaohua. (Dept. of Stomatology, Hospital of University of Electronic Science and Technology of China (UESTC) & Sichuan Provincial People’s Hosptial, Chengdu 610072, China)
Supported by: The National Natural Science Foundation of China (81100786).
Objective Recombinant human leucine-rich amelogenin peptide (LRAP) was studied by cryogenic transmission electron microscopy (TEM); evaluation focused on its self-assembly and crystal growth in vitro. Methods Human LRAP was recombined through prokaryotic expression vector pCold-SUMO and transformed into Escherichia coli BL21plys to acquire purifi ed proteins. Cryogen TEM recorded assembly and self-assembling of LRAP from pH 3.5 to pH 8.0, and the hydroxyapatite crystal growth in the mixture of LRAP protein solution and artifi cial saliva was observed using TEM and selected area electron diffraction. Results More than 90% purity LRAP was expressed, purifi ed and identifi ed as described in methods. LRAP linked into oligomers, nanospheres, nanochains, and microribbons, whereas pH value increased from 3.5 to 8.0. Mature hydroxyapatite crystal growth was guided in artifi cial saliva fi lled with calcium phosphate. Conclusion LRAP is simplifi ed amelogenin functional domain and conserved the basic characters of amelogenin such as self-assembling and inducing crystallization along c axis. In the area of acellular synthesis of hydroxyapatite using extracellular enamel matrix protein, LRAP is one of candidate repair materials for irregular hard tissue defection.
cryogenic transmission electron microscopy; amelogenin; leucine-rich amelogenin peptide; hydroxyapatite
R 783
A
10.7518/hxkq.2017.01.009
2016-07-30;
2016-10-20
国家自然科学基金(81100786)
田鲲,副主任医师,博士,E-mail:tiankun@med.uestc. edu.cn
任小华,副主任医师,硕士,E-mail:renxiaohua@med. uestc.edu.cn
Correspondence: Ren Xiaohua, E-mail: ren-xiaohua@med.uestc.edu.cn.
